

1. 中国农业科学院 特产研究所, 吉林 长春 130122;
2. 中国科学院 长春应用化学研究所 电分析国家重点实验室, 吉林 长春 130022
2018-11-27 收稿, 2018-12-03 录用
中国农业科学院基本科研业务费所级统筹优青专项(1610342018012)和吉林省科技厅项目(20170101011JC,20180520142JH)资助
*通讯作者: 王英平, E-mail: yingpingw@126.com
摘要: 荧光碳点探针是近几年来发展起来的一种新型荧光探针,具有传统有机染料、荧光染色蛋白及一般荧光纳米材料无法比拟的独特优势,如具有良好的水溶性、化学惰性、低毒性、易于功能化、抗光漂白性、可调谐和生物相容性等优异性能,因而引起研究者的广泛关注。目前已发展水热法等近十种较为经济便捷的方法,可进行大规模的荧光碳点制备,在细胞功能研究及细胞表面和内部功能分子的探测、组织的成像、病菌的定位等方面得到了较为广泛的应用。笔者对近年来荧光碳点的合成方法、依赖于碳点尺寸和波长等性质的发光性能,以及荧光碳点在生物成像等方面的应用作一简要综述,并对其在药用植物病理方面的应用提出展望,期望为丰富荧光碳点在生物成像领域的应用提供一定的借鉴和参考。
关键词: 荧光碳点荧光标记生物成像
Synthesis, Properties and Application of Fluorescence Carbon Quantum Dots in Bioimaging
LI Yali1, GUO Jing1, SONG Juan1, PIAO Xiangmin1, XU Xiaolong2, WANG Yingping1


1. Institute of Special Wild Economic Animals and Plants, Chinese Academy of Agriculture Sciences, Changchun 132122, Jilin, P. R. China;
2. State Key Laboratory of Electroanalytical Chemistry, Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130022, Jilin, P. R. China
*Corresponding author: WANG Yingping, E-mail: yingpingw@126.com
Abstract: The carbon dot (CD)-based fluorescent probe is a new type of fluorescent probe have been developed in recent years. Comparing with the traditional biological labels such as traditional organic dyes, fluorescent chromatin and usual fluorescent nanomaterial, the CDs have unique advantages (good water solubility, chemical inertia, low toxicity, easy function, anti-light bleaching, tunable and biocompatibility) have attracted considerable attentions. At present, more than ten kinds of inexpensive and convenient methods such as hydrothermal methods have been developed for large-scale preparation of fluorescent CDs. It has been widely used in cell function research, detection of cell surface and functional molecules, imaging of tissues, and positioning of pathogens. The synthesis method in recent years, the luminescence properties depending on the size and wavelength, and the application of fluorescent CDs in bioimaging are briefly reviewed, and their application in the pathology of medicinal plants is forecasted. It is expected to provide some reference for expending the application range of fluorescent CDs in the field of bioimaging.
Key words: fluorescence carbon quantum dotsfluorescence labelingbioimaging
荧光碳点(carbon dots, CDs)是碳家族继碳纳米管(carbon nanotubes, CNTs)、石墨烯(graphene)和富勒烯(fullerenes)之后的又一新成员,是粒径小于10 nm的近球形零维碳质骨架和表面基团构成的荧光纳米晶体,主要由C、H、O、N等元素组成[1]。荧光CDs不仅具有激发光谱宽且连续、耐光漂白、无光闪烁性等优越的荧光性能,而且具有生物相容性好、毒性低、价格低廉、制备简单、易于功能化等诸多优势,被广泛关注。CDs独有的量子尺寸效应使其荧光发射光谱在可见光到近红外光区范围内可调,是一种性能优良的荧光标记与生物成像材料,因此有望取代有机染料、荧光染色蛋白及传统半导体纳米材料应用于生物标记和生物成像领域。但是,CDs作为荧光标记材料应用于生物成像的研究较传统荧光标记材料而言尚处于起步阶段,许多基本问题尚待解决。本文对CDs的合成、性质及其在生物成像中的应用作一简要综述,并提出展望,期望为丰富荧光CDs在生物成像领域应用提供一定的借鉴和参考。
1 荧光碳量子点的合成CDs最早是由Xu等[2]在2004年用电弧放电的方法处理烟灰制备碳纳米管(carbon nanotubes, CNTs)时偶然发现的。2006年,Sun等[3]将粘土与石墨粉的混合物在氮气保护下经加热和退火等处理得到C靶物,进行激光烧蚀及表面钝化得到的荧光性质优越的碳纳米粒子,首次命名为CDs。近年来,CDs的制备已得到极大地丰富和发展,逐渐朝着安全高效、操作简单和绿色环保等方向发展,这些制备方法总体可分为两大类:即自上而下(top-down)和自下而上(bottom-up)[4],如图 1所示。
图 1
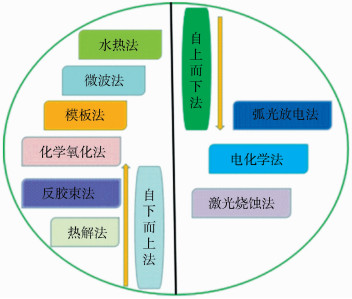 | 图 1 碳点的不同制备方法 Schematic illustration of CDs preparation approaches |
自上而下法系采用物理或化学的方法将宏观尺度的碳结构材料经过裂解、切割、烧蚀等手段进行剥离变为纳米级粒子,如:电化学法[5]、激光烧蚀法[3]、弧光放电法等[2]。自下而上法是采用有机碳分子作为原料,通过体系中的小分子碳前驱体间聚集发生诸如碳化、缩合等反应而相互结合形成CDs,包括水热法[6]、化学氧化法[7]、微波法[8]、模板法[9, 10]、热解法[11, 12]、反胶束法[13]等。当然,有些CDs的合成同时运用自上而下法和自下而上法。表 1对CDs几种常用的制备方法进行简要介绍。
表1
| 表 1 不同碳点的合成方法比较 Comparison of different synthetic methods for CDs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1.1 自上而下法1.1.1 电弧放电法电弧放电法是采用实心石墨棒作阴极进行电弧放电时被高温气化,进而生成CDs的方法,是最早发现的合成CDs的方法[2],此方法得到的CDs具有优良的性质,但是荧光量子产率(fluorescence quantum yields, QYs)极低。
1.1.2 电化学法电化学法亦称电化学氧化法,是一种利用各种大体积的碳结构材料(多壁碳纳米管、石墨棒、碳糊电极碳等)为工作电极,借助电化学装置应用循环伏安法(cyclic voltammetry, CV)等将工作电极在电解质中进行连续电压扫描,通过调节电压和电流密度精确地控制制备CDs的方法。2007年,Zhou等[5]以多壁碳纳米管为原料,第一次利用电化学法制备得到CDs。电化学法制备CDs方法简单、温和、方便,用一个普通的电化学池就可以制备。然而,只有少数文献介绍过电化学法将小分子碳转化为CDs。
1.1.3 激光烧蚀法激光烧蚀法是利用高能激光束,在特定的气氛下照射靶材表面迅速加热融化蒸发而制备CDs的方法。Sun等[3]首次报道利用激光烧蚀法制备并命名为CDs。激光烧蚀法制备过程复杂且耗时,通常需要有机试剂进行钝化以及昂贵的仪器设备,不适用于大规模制备。
1.2 自上而下法1.2.1 水热法水热法或水热碳化(hydrothermal carbonization, HTC)或者容积热碳化法是指在特制的密闭反应器(高压釜)中,采用水溶液作为反应介质在高温高压条件下进行化学反应而合成CDs的方法。HTC合成CDs的典型路线是把碳源混合液放进聚四氟乙烯水热釜中,在温度180~240 ℃下反应数小时即可完成。HTC法制备CDs最早是由Zhang等[6]以乙醇为溶剂碳化抗坏血酸时发展的,所得CDs的平均粒径为2 nm,能发射蓝色的荧光,荧光信号稳定且几乎不受环境pH等因素的影响。HTC法合成过程不需要昂贵的试剂, 也不需多步钝化和精密仪器,反应前体可以是各种含碳材料,原料成本低、环境友好且无毒性。其反应设备简单且反应过程密闭,可以有效防止反应物质挥发,保护原材料,能有效避免合成过程对操作人员的伤害和环境的污染,是目前应用中最受追捧的CDs合成方法,最重要的是它还可以将制备与掺杂功能合二为一,将繁琐的步骤简单化。但是,一般水热反应需要高温高压,亦需要注意实验安全。
1.2.2 微波法微波法是利用微波辐射进行CDs合成的一种方法[11]。Li等[8]首次报道利用微波法处理葡萄糖和PEG-200的混合水溶液制备出性能优越的CDs,该报道中PEG-200既是溶剂又是钝化剂,一步操作可同时完成反应和修饰两个过程,并且发现微波时长在一定程度上能够影响所得CDs的尺寸。通过微波辐射法,以有机化合物合成CDs是一种经济高效的合成方法。微波能集中高效的能量并节约反应时间,具有耗时短、操作简便和成本低等优点,因而吸引了研究者的广泛兴趣。但是,用该法制得的CDs的粒径不够均一。
1.2.3 模板法模板法系先在合适的模板上合成CDs,然后用酸刻蚀等手段除去模板的CDs合成方法。Bourlinos等[9]初次利用模板法成功制备CDs,该实验选用NaY沸石作为模板,与2, 4-二氨基苯酚二盐酸盐进行离子交换,在高温条件下沸石表面发生热解氧化形成CDs,最后用氢氟酸除去沸石模板便得到分散的荧光CDs。随后,Guo等[10]以含碳复合光子晶体为模板,在惰性气体的保护下经过高温热解制得CDs,实验发现通过控制反应温度可以调控CDs的荧光颜色。模板法可以合成粒径足够均一的CDs,分散性好且可较长时间放置。不足之处是适宜模板的合成/选择以及去模板的方法有待改进。
1.2.4 化学氧化法化学氧化法是用强氧化性酸将有机小分子碳化,并通过氧化作用使其进一步被分解形成CDs的方法。Fang等[7]将冰醋酸和水按25:2的比例混合均匀后,快速加入五氧化二磷,即制得交联的、具有中空结构的荧光CDs。化学氧化法的碳源来源广泛,可灵活选择不同的碳源和氧化剂,从而制备出不同的CDs。但该法所得的CDs荧光量子产率较低。
1.2.5 热解法热解法是通过高温分解有机碳源制备CDs[11]。Jia等[12]直接对抗坏血酸的水溶液加热到90 ℃,合成了重量超过6.0 g的CDs,且具有很好的分散性。热解法制备的CDs具有激发波长可调、pH可调和上转换荧光性能等优点。此外,CDs表面存在的羟基和羧基基团,使其具有较好的水溶性。
1.2.6 反胶束法反胶束法是通过表面活性剂作用,使含碳前驱体的水溶液与有机溶剂形成反胶束,加热碳化、修饰后制得CDs的方法。Kwon等[13]用反胶束法,将葡萄糖水溶液加入癸烷中,在表面活性剂磺基琥珀酸二乙基己酯钠(AOT)作用下形成油包水反胶束,之后加入钝化剂十六烷基胺,在160 ℃氩气氛围中回流制得CDs。用反胶束法制备的CDs粒径均匀,但该法反应条件比较苛刻,成本较高,目前无法广泛应用。
1.3 合成CDs的原材料CDs被发现的初期,其合成原料仅局限于单一元素组成,即尺寸较大的碳骨架材料,如碳粉[3]、石墨[8]、纳米金刚石[14]、活性炭[15]、煤灰[16]、炭黑[17]、氧化石墨烯[18]、碳化纤维和碳纳米管[19]等,用它们为原料合成出的CDs的QYs大多低于10%。
随着CDT合成的深入研究,部分研究者尝试直接用单一的小分子、生物大分子(聚合物)、天然物质甚至废弃物等作为原料合成CDs,如苯胺、苯酚、氨基酸、糖类、咪唑类有机物、壳聚糖以及聚乙烯亚胺等。2006年,有用含有端基氨的有机聚合物PEI-EI和PEG1500N来修饰CDs,使其QYs得到了极大提高,并且阐明其发光增强是由于端基氨的钝化作用而有效地修复了CDs表面的缺陷,在CDs表面产生能量势阱而导致CDs的发光增强。于是,氮元素便被引入CDs合成中用以提高期发光性质。2012年,掀起了一股以自然界天然物质为原料合成CDs的热潮。近年来,大量的廉价原料被用于CDs制备。合成原料向着安全、绿色、环保的方向发展;制备方法朝着设备便捷,条件易操作可控,步骤少的方向发展。例如报道了用鸡蛋膜[20]、蚕丝、草、豆浆、柚子皮、红辣椒、草、橘子汁[21]、蘑菇[22]、棉花[23]、花瓣[24]、牛奶[25]、蜂蜜[26]、柚子皮[27]、甘蔗渣[28]甚至虾壳[29]等作为原料合成CDs。这些研究工作主要将目标集中在碳源的筛选,而且QYs均有所提升。2013年,发展了用柠檬酸和L-半胱氨酸合成氮、硫共掺杂的CDs的方法,此方法在一定程度上了提高了量子效率,并解释了氮硫掺杂提高量子产率的机理。至此,硫掺杂便成为一种提升CDs发光性质的新手段。
除此之外,亦可以用含硼元素的化合物合成硼掺杂的CDs,丰富了制备CDs的原材料。元素掺杂避免了繁琐的修饰过程,并且能得到具有很好荧光发射及特殊性能的CDs,在CDs掺杂的所有元素中,氮源易获得,作用机理最清楚。因此,目前氮元素掺杂法得到了广泛应用。
碳元素是自然界中存在的最重要的元素之一,由碳元素构成的碳纳米材料种类繁多,通过合成方法的探索和原料的筛选,以及对CDs进行表面修饰和掺杂等手段,使CDs的发光效率大幅度提升,目前己达到80%以上。Wang等[30]利用微波-水热法处理氧化石墨烯制备了具有长荧光寿命的CDs。另一类非常经典的路线是以柠檬酸作为碳源,短链的脂肪胺或芳香胺做为氮源,通过某种方法反应碳化后制得氮掺杂的CDs,该方法制得的CDs往往含氮量高,QYs较高,发射波长多位于蓝色光区,某些由具有多共轭结构的小分子为原料制得的CDs发射波长还可能发生红移,产生绿色、黄绿色甚至红色的荧光。
2 荧光CDs的性质2.1 粒径及分子量小由CDs的定义可知CDs的粒径一般小于10 nm,因此赋予CDs优良的边缘效应及量子限域,进而使其具有独特的光电性质。此外,CDs的分子量通常只有几千到几万之间,所以可以很容易进入到细胞内部,因而在体外细胞成像、活体光学成像和生物成像检测方面具有广泛的应用前景。
2.2 紫外吸收特性CDs通常在紫外光区(260~320 nm)具有吸收特性,且吸收范围可一直延伸到可见光区。大量研究表明,裸露碳纳米粒子在280 nm产生自吸收的原因常被认为是CDs的CC双键发生的π-π*跃迁[31]。CDs的这一性质与间带半导体材料类似,所以从这方面看CDs也属于半导体材料[32]。而经过功能化或者表面修饰的CDs, 其吸收峰位置均可能发生改变,例如多巴胺修饰的CDs在360 nm处存在一个强的吸收峰,该吸收被解释为碳点的n-π*跃迁[33]
2.3 荧光发射特性(光致发光)2.3.1 荧光发射类型依据发射波长是否随激发波长的改变而改变,可将CDs分为激发依赖型(即发射波长和强度随激发波长的改变而改变)和激发不依赖型(即发射波长不随激发波长改变)两种。如图 2a所示,发射波长会随着激发波长的增加产生逐渐红移的现象,发生这种变化的原因可能归结于粒径不均匀(量子效应)或碳点表面的发光位点的多样性[34],但也有研究者发现,有些CDs发射与激发波长无关,如图 2b所示[35],这可能归因于它们的均匀的粒径或是其表面化学的差异。CDs的荧光特性同时可以通过修饰或者能量转移进行调节。
图 2
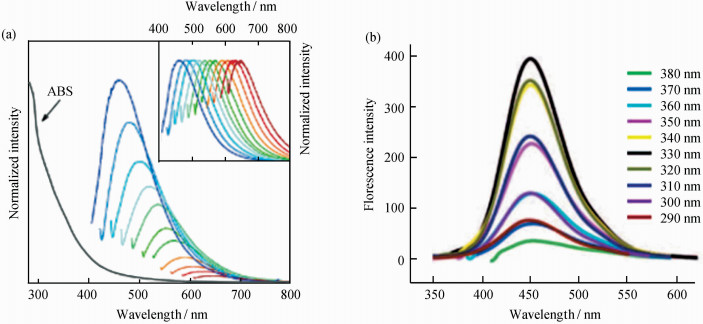 | 图 2 (a) 激发依赖型荧光光谱[34];(b)激发不依赖型荧光光谱[35] (a) PL emission of excitation-dependent[34]; (b) PL emission of excitation-independent[35] |
2.3.2 与传统荧光探针相比与传统荧光探针试剂相比,CDs具有宽且连续的激发波长范围,其发射波长能够涵盖可见光区甚至延伸到近红外光区,部分CDs还具有“一元激发多元发射”的特点。目前发展的CDs的发光机理主要包括:表面态和边缘态、碳核态和分子态、本征态和缺陷态、sp2局域化的电子空穴对、激子辐射复合和杂原子到碳的电荷转移等。
2.3.3 钝化修饰和掺杂提高QYsQYs是评价荧光性能的一个重要的参数。与传统的量子点相比,碳点的QYs相对较低,限制了其作为荧光探针在生物成像等领域的应用。由于CDs表面存在发射缺陷,裸露QYs的量子产率往往偏低(<10%)。通过对合成步骤的不断改进以及对CDs表面进行钝化修饰等方法,CDs的QYs得到了大幅度的提高。由于单个CDs之间的荧光性质存在较大的差异,同时,CDs的荧光性能还受粒径大小、掺杂元素、表面氧化程度等多种因素的影响。因此,现阶段荧光CDs的可控合成仍存在一定难度,荧光CDs的发光机理也正被深入研究。
元素掺杂是调节CDs内在结构性能、优化CDs性质的重要手段。这是因为异原子的引入能改变CDs的电子分布,这与最高已占轨道HOMO和最低未占轨道LUMO能隙相关,从而影响其光学性质。通过调整掺杂原子的种类和数量可以提高CDs的QYs,改变其荧光发射峰位。因此,近10年来,研究人员用各掺杂试剂或多元素共掺杂制备具有良好光学性能的CDs。目前,已经发展了CDs的多种掺杂方法,总体分为非金属元素掺杂、金属元素掺杂和非金属-金属共掺杂3大类。非金属元素掺杂碳点一般指的是B、P、Cl、N[36]、S[37]和Si[38]等元素掺杂的CDs,这些元素的电负性均与碳不同,无论是掺入电负性比碳高还是电负性比碳低的异原子,都会引起CDs电子重新分布。N是掺杂CDs中研究最早也是研究最多的元素,最早提出N掺杂概念的文献是以草水热合成制备的N掺杂富碳荧光纳米点的研究,经过N掺杂后QYs显著提高。金属元素的掺杂不仅改变CDs的电子分布,还能赋予CDs一些新的功能,迄今发展了包括Cu[39]、Mg、Fe、Ge、Gd[40]等掺杂的CDs。Wu等[41]金属掺杂的CDs,以Na2[Cu(EDTA)]为前体一步热解法合成N-Cu共掺杂CDs,所合成的共掺杂CDs可有效提升CDs的电子传输和光氧化反应。掺杂型量子点除具有本征量子点所具备的极佳的光学性能外,还可以对其性能进行有效的控制和强化,如Stokes位移更大,能够避免因自吸收而导致的猝灭现象发生等。
2.3.4 荧光稳定性高、抗光漂白性强CDs通常具有荧光稳定性高、抗光漂白性强、无闪烁现象等优势,如采用激光烧蚀法制备的CDs在被激发光照射4 h后,荧光强度几乎不变,而有机染料在被照射几分钟后就已经被光漂白。CDs的这些优势极大地拓展了其在生物标记和生物成像等领域的应用。
2.4 CDs的电化学发光(electrochemi-luminescence, ECL)性质随着研究的不断深入,CDs已被证明具有优异的ECL性质。Zhu等[8]报道利用微波法制备出的CDs具有良好ECL性能,可被用于ECL传感器。
2.5 CDs的上转换荧光性质CDs另一个重要的性质就是上转换荧光性质。上转换发光是指在长波长激发光的激发下体系发出短波长光子的现象,即辐射光子能量大于所吸收的光子能量,这属于反Stokes现象。下转换发光或Stokes现象,是指传统的光致发光现象,在短波长激发源的激发下,体系发射出较长波长光子的现象,所有的发光材料均遵从Stokes定律。
2.6 生物相容性和低生物毒性碳元素是构成生物体所需的重要元素之一,具有化学惰性、良好的环境友好性和生物相容性。此外,制备CDs的反应条件温和、步骤简单、原料丰富且廉价。因此,CDs有望代替传统的荧光量子点用于生物标记和生物成像。
为了考察CDs的生物毒性,很多课题组将其与癌细胞,如Hela、Hep-2等孵育。实验结果表明,在较高的CDs浓度、较长的孵育时间下,细胞仍具有较高的存活率(大于80%)。Ray等[42]通过MTT实验研究了碳点对肝癌细胞存活率的影响,证明一定剂量的CDs对细胞活性几乎没有影响。Yang等[43]考察CDs对小鼠的毒性,结果证明CDs对小鼠身体器官几乎不产生影响。
3 生物成像研究进展生物成像包含细胞成像和活体成像两个方面,CDs在这两方面均已被成功应用[44]。2007年,Cao等[45]初次尝试用CDs标记乳腺癌细胞(MCF-7),然后用双光子荧光显微镜进行观察,发现细胞质表现出明亮的荧光,说明CDs能够成功进入细胞。Chen等[46]用2-叠氮咪唑为原料,在低温条件下合成了多色荧光CDs,在不同的激发波长下可发射蓝色、蓝绿色和青绿色的荧光,该CDs的氮含量达到34.48%,并且具有生物相容性好等优点,被成功应用于多色细胞成像。Wen等[47]以猪皮为原料制备了量子产率为24.1%的多色荧光CDs,并成功用于钴离子检测和多色细胞成像。Rong等[48]将制备的N, S-CDs与乳腺癌细胞共同培养,成功观察到碳点内吞进入细胞。安佰超课题组[49]合成了荧光CDs并将其应用于标记芥子碱硫氰酸盐,有助于揭示芥子碱硫氰酸盐的分子作用机制。刘武等[50]合成了一种具有室温磷光的碳量子点基复合材料,期望在磷光防伪上能有很好的应用。李迎运等[51]制备了最大发射峰位于近红外区域的CDs探针,对生物组织具有较小的光损伤和更深的穿透性;同时,其细胞毒性较低,适用于细胞成像。
在活体成像方面,Michalet等[52]将碳量子点注入小鼠体内,在不同波长激发光下均可进行活体成像(图 3)。到目前为止,在活体成像方面的工作尚未全面展开,主要原因在于CDs引入活体细胞机制、结合部位及其与活体细胞间的相互作用规律等问题尚不明确;再者,现阶段,CDs用于生物在体成像的研究成果还很少,迟迟得不到突破的关键在于CDs的量子产率偏低、生物体内源性背景噪音大等问题。然而,总体来看,CDs通常具有较好的水溶性、较低的细胞毒性、优异的生物相容性,以及可调的发光性质,这些优异的特质表明CDs在细胞成像领域具有巨大应用前景。
图 3
 | 图 3 (a) 不同激发波长下CDs的小鼠体内成像图和(b)不同pH条件下CDs传感器传感HeLa细胞的荧光成像图[52] (a) In vivo fluorescence images at various excitation wavelengths of a CDs-injected mice, and (b) fluorescent images of HeLa cells clamped at pH 6.0, 6.5, 6.8, 7.2, 7.5, and 8.0, respectively[52] |
4 展望目前,随着对CDs研究的不断深入,CDs的制备方法、修饰手段和机理研究等得到了极大的发展。CDs的制备方法完成了由复杂到简单,并向绿色安全方向转变,QYs亦得到大幅度提升,但是仍有以下问题亟待解决:(1)大多数方法制备的CDs,其发射波长通常在与生物体自身背景荧光十分相近的蓝光区,并且颜色呈现为蓝色或绿色,不利于其在细胞成像中的应用。发射波长在近红外的碳点也有相关报道,但QYs却非常低,这使得CDs在生物成像分析中的应用受到了很大的限制;(2)CDs粒径极小,经过化学修饰后对其分离十分困难,因此难于将CDs进行功能化,这对CDs在某些领域的应用造成一定的阻碍;(3)CDs存在荧光颜色难以灵活调控、发光机理尚不明确等问题;(4)CDs在植物病害病理方面的研究和探索为生命科学注入了新思想,已成为当下研究的热点,但现阶段的认识只是冰山一角,亟待投入更多的研究,且大有可为。科研工作者们仍要经过不断的探索和不懈的努力才能全面了解CDs。此外,CDs生物成像研究对药用植物病害病理研究的进步具有重大意义,将是未来药用植物病害研究的重点领域。
参考文献
| [1] | Tang L, Ji R, Cao X, Lin J, Jiang H, Li X, Teng K S, Luk C M, Zeng S, Hao J, Lau S P. Deep ultraviolet photoluminescence of water-soluble self-passivated graphene quantum dots[J]. ACS Nano, 2012, 6(6): 5102–5110.DOI:10.1021/nn300760g |
| [2] | Xu X Y, Ray R, Gu Y L, Ploehn Harry J, Gearheart L, Raker K, Scrivens Walter A. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. Journal of the American Chemical Society, 2015, 126(40): 12736–12737. |
| [3] | Sun Y P, Zhou B, Lin Y, Wang W, Fernando K A Shiral, Pathak P, Meziani M J, Harruff Barbara A, Wang X, Wang H F, Luo Pengju G, Yang H, Kose M E, Chen B, Veca L M, Xie S Y. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. Journal of the American Chemical Society, 2006, 128(24): 7756–7757.DOI:10.1021/ja062677d |
| [4] | 霍绍森, 陈志远, 黄丽, 吕亚非, 刘勇. 碳纳米点的制备及应用研究进展[J]. 材料导报, 2015, 29(12): 18–23. Huo S S, Chen Z Y, Huang L, Lü Y F, Liu Y. Development of preparation and application of carbon nanodots[J]. Materials Review, 2015, 29(12): 18–23. |
| [5] | Zhou J G, Booker C, Li R Y, Zhou X T, Sham T K, Sun X L, Ding Z F. An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs)[J]. Journal of the American Chemical Society, 2007, 129(4): 744–745.DOI:10.1021/ja0669070 |
| [6] | Zhang B, Liu C Y, Liu Y. A novel one-step approach to synthesize fluorescent carbon nanoparticles[J]. European Journal of Inorganic Chemistry, 2010(28): 4411–4414. |
| [7] | Fang Y X, Guo S J, Li D, Zhu C Z, Ren W, Dong S J, Wang E K. Easy synthesis and imaging applications of cross-linked green fluorescent hollow carbon nanoparticles[J]. ACS Nano, 2012, 6(1): 400–409.DOI:10.1021/nn2046373 |
| [8] | Li H, Shao F Q, Zou S Y, Yang Q J, Huang H, Feng J J, Wang A J. Microwave-assisted synthesis of N, P-doped carbon dots for fluorescent cell imaging[J]. Microchimica Acta, 2016, 183(2): 821–826.DOI:10.1007/s00604-015-1714-2 |
| [9] | Bourlinos A B, Stassinopoulos A, Anglos D, Zboril R, Georgakilas V, Giannelis Emmanuel P. Photoluminescent Carbogenic dots[J]. Chemistry of Materials, 2008, 20(14): 4539–4541.DOI:10.1021/cm800506r |
| [10] | Guo X, Wang C F, Yu Z Y, Chen L, Chen S. Facile access to versatile fluorescent carbon dots toward light-emitting diodes[J]. Chemical Communications, 2012, 48(21): 2692–2694.DOI:10.1039/c2cc17769b |
| [11] | Zhang R, Liu Y B, Yu L B, Li Z, Sun S Q. Preparation of high-quality biocompatible carbon dots by extraction, with new thoughts on the luminescence mechanisms[J]. Nanotechnology, 2013, 24(22): 225601–225605.DOI:10.1088/0957-4484/24/22/225601 |
| [12] | Jia X, Li J, Wang E. One-pot green synthesis of optically pH-sensitive carbon dots with upconversion luminescence[J]. Nanoscale, 2012, 4(18): 5572–5575.DOI:10.1039/c2nr31319g |
| [13] | Kwon W, Rhee S W. Facile synthesis of graphitic carbon quantum dots with size tunability and uniformity using reverse micelles[J]. Chemical Communications, 2012, 48(43): 5256–5258.DOI:10.1039/c2cc31687k |
| [14] | Dong Y, Zhou N, Lin X, Lin J P. Extraction of electrochemiluminescent oxidized carbon quantum dots from activated carbon[J]. Chemistry of Materials, 2010, 22(21): 5895–5899.DOI:10.1021/cm1018844 |
| [15] | Yu S J, Kang M W, Chang H C, Chen K M, Yu Y C. Bright fluorescent nanodiamonds:no photobleaching and low cytotoxicity[J]. Journal of the American Chemical Society, 2005, 127(50): 17604–17605.DOI:10.1021/ja0567081 |
| [16] | Liu H, Ye T, Mao C. Fluorescent carbon nanoparticles derived from candle soot[J]. Angewandte Chemie International Edition, 2007, 46(34): 6473–6475.DOI:10.1002/(ISSN)1521-3773 |
| [17] | Xia X, Zheng Y. Comment on "one-step and high yield simultaneous preparation of single-and multi-layer graphene quantum dots from CX-72 carbon black"[J]. Journal of Materials Chemistry, 2012, 22(18): 8764–8766.DOI:10.1039/c2jm30658a |
| [18] | Zhu S, Zhang J, Qiao C, Tang S, Li Y, Yuan W, Li B, Tian L, Liu F, Hu R, Gao H, Wei H, Zhang H, Sun H, Yang B. Strongly green-photoluminescent graphene quantum dots for bioimaging applications[J]. Chemical Communications, 2011, 47(24): 6858–6860.DOI:10.1039/c1cc11122a |
| [19] | Zhou J G, Booker C, Li R Y, Zhou X T, Sham T K, Sun X L, Ding Z F. An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs)[J]. Journal of the American Chemical Society, 2007, 129(4): 744–745.DOI:10.1021/ja0669070 |
| [20] | Li H T, He X D, Kang Z H, Huang H, Liu Y, Liu J L, Lian S Y, Tsang Chi Him A, Yang X B, Lee S T. Water-soluble fluorescent carbon quantum dots and photocatalyst design[J]. Angewandte Chemie International Edition, 2010, 49(1): 4430–4434. |
| [21] | Sahu S, Behera B, Maiti T K, Mohapatra S. Simple one-step synthesis of highly luminescent carbon dots from orange juice:application as excellent bio-imaging agents[J]. Chemical Communications, 2012, 48(70): 8835–8837.DOI:10.1039/c2cc33796g |
| [22] | Wang W J, Xia J M, Feng J, He M Q, Chen M L, Wang J H. Green preparation of carbon dots for intracellular pH sensing and multicolor live cell imaging[J]. Journal of Materials Chemistry B, 2016, 4(1): 7130–7137. |
| [23] | Wen X, Shi L, Wen G, Wen X P, Shi L H, Wen G M, Li Y Y, Dong C, Yang J, Shuang S M. Green synthesis of carbon nanodots from cotton for multicolor imaging, patterning, and sensing[J]. Sensors & Actuators B Chemical, 2015, 221(1): 769–776. |
| [24] | Shi L, Li Y, Li X, Wen X P, Shi L H, Wen G M, Li Y Y, Dong C, Yang J, Shuang S M. Facile and eco-friendly synthesis of green fluorescent carbon nanodots for applications in bioimaging, patterning and staining[J]. Nanoscale, 2015, 7(16): 7394–7401.DOI:10.1039/C5NR00783F |
| [25] | Wang L, Zhou H S. Green synthesis of luminescent nitrogen-doped carbon dots from milk and its imaging application[J]. Analytical Chemistry, 2014, 86(18): 8902–8905.DOI:10.1021/ac502646x |
| [26] | Yang X M, Zhuo Y, Zhu S S, Luo Y W, Feng Y J. Novel and green synthesis of high-fluorescent carbon dots originated from honey for sensing and imaging[J]. Biosensors & Bioelectronics, 2014, 60(60): 292–298. |
| [27] | Lu W B, Qin X Y, Liu S, Chang G H, Zhang Y W, Luo Y L, Asiri Abdullad M, Al-Youbi A O, Sun X P. Economical, green synthesis of fluorescent carbon nanoparticles and their use as probes for sensitive and selective detection of mercury (Ⅱ) ions[J]. Analytical Chemistry, 2012, 84(12): 5351–5357.DOI:10.1021/ac3007939 |
| [28] | Thambiraj S, Ravi S D. Green synthesis of highly fluorescent carbon quantum dots from sugarcane bagasse pulp[J]. Applied Surface Science, 2016, 390(1): 435–443. |
| [29] | Gedda G, Lee C Y, Lin Y C, Wu H F. Green synthesis of carbon dots from prawn shells for highly selective and sensitive detection of copper ions[J]. Sensors & Actuators B Chemical, 2016, 224(1): 396–403. |
| [30] | Wang Q, Zheng H, Long Y, Wu H F. Microwave-hydrothermal synthesis of fluorescent carbon dots from graphite oxide[J]. Carbon, 2011, 49(9): 3134–3140.DOI:10.1016/j.carbon.2011.03.041 |
| [31] | Baker S N, Baker G A. Luminescent carbon nanodots:emergent nanolights[J]. Angewandte Chemie International Edition, 2010, 49(38): 6726–6744.DOI:10.1002/anie.200906623 |
| [32] | Bourlinos A B, Zboril R, Petr J, Bakandritsos A, Krysmann M, Giannelis Emmanuel P. Luminescent surface quaternized carbon dots[J]. Chemistry of Materials, 2012, 24(1): 6–8.DOI:10.1021/cm2026637 |
| [33] | Dutta C A, Doong R A. Highly sensitive and selective detection of nanomolar ferric ions using dopamine functionalized graphene quantum dots[J]. ACS Applied Materials & Interfaces, 2016, 8(32): 21002–21010. |
| [34] | Fernando K A Shiral, Pathak P, Meziani M J, Harruff B A, Wang X, Wang H F, Luo Pengju G, Yang H, Kose M E, Chen B L, Veca L Monica, Xie S Y. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. Journal of the American Chemical Society, 2006, 128(24): 7756–7757.DOI:10.1021/ja062677d |
| [35] | Tang L B, Ji R B, Li X M, Teng K T, Lau S P. Energy-level structure of nitrogen-doped graphene quantum dots[J]. Journal of Materials Chemistry C, 2013, 1(32): 4908–4915.DOI:10.1039/c3tc30877d |
| [36] | Parvin N, Mandal T K. Synthesis of a highly fluorescence nitrogen-doped carbon quantum dots bioimaging probe and its in vivo clearance and printing applications[J]. RSC Advances, 2016, 6(22): 18134–18140.DOI:10.1039/C5RA25402G |
| [37] | Sangam S, Gupta A, Shakeel A, Bhattacharya R, Sharma A K, Suhag D, Chakrabarti S, Garg S K, Chattopadhyay S, Basu B, Kumar V, Rajput S K, Duttah M K, Mukherjee M. Sustainable synthesis of single crystalline sulphur-doped graphene quantum dots for bioimaging and beyond[J]. Green Chemistry, 2018, 20(1): 4245–4259. |
| [38] | Qian Z S, Shan X Y, Chai L J, Ma J J, Chen J R, Feng H. Si-doped carbon quantum dots:a facile and general preparation strategy, bioimaging application, and multifunctional sensor[J]. ACS Applied Material & Interfaces, 2014, 6(9): 6797–6805. |
| [39] | Skaltsas T, Goulielmaki M, Pintzas A, Pispas S, Tagmatarchis N. Carbon quantum dotsblock copolymer ensembles for metal-ion sensing and bioimaging[J]. Journal of Mater-ials Chemistry B, 2017, 5(27): 5397–5402.DOI:10.1039/C7TB01352C |
| [40] | Pan Y, Yang J, Fang Y, Zheng J H, Song R, Yi C Q. One-pot synthesis of gadolinium-doped carbon quantum dots for high-performance multimodal bioimaging[J]. Journal of Materials Chemistry B, 2017, 5(1): 92–101.DOI:10.1039/C6TB02115H |
| [41] | Wu W T, Zhan L Y, Fan W Y, Song J Z, Li X M, Li Z T, Wang R Q, Zhang J Q, Zheng J T, Wu M B, Zeng H B. Cu-N dopants boost electron transfer and photooxidation reactions of carbon dots[J]. Angewandte Chemie, 2015, 127(22): 6640–6644.DOI:10.1002/ange.201501912 |
| [42] | Ray S C, Saha A, Jana N R, Sarkar R. Fluorescent carbon nanoparticles:Synthesis, characterization, and bioimaging application[J]. Journal of Physical Chemistry C, 2009, 113(43): 18546–18551.DOI:10.1021/jp905912n |
| [43] | Yang S T, Wang X, Wang H, Lu F, Luo P G, Cao L, Meziani M J, Liu J H, Liu Y, Chen M, Huang Y, Sun Y P. Carbon dots as nontoxic and high-performance fluorescence imaging agents[J]. Journal of Physical Chemistry C Nanomaterials & Interfaces, 2009, 113(42): 18110–18114. |
| [44] | Li J J, Jiao Y Z, Feng L D, Zhong Y, Zuo G C, Xie A M, Dong W. Highly N, P -doped carbon dots:rational design, photoluminescence and cellular imaging[J]. Microchimica Acta, 2017, 184(8): 2933–2940.DOI:10.1007/s00604-017-2314-0 |
| [45] | Cao L, Wang X, Meziani M J, Lu F S, Wang H F, Luo P G, Lin Y, Harruff B A, Veca M, Murray D, Xie S Y, Sun Y P. Carbon dots for multiphoton bioimaging[J]. Journal of the American Chemical Society, 2007, 129(37): 11318–11319.DOI:10.1021/ja073527l |
| [46] | Chen X X, Jin Q Q, Wu L Z, Tung C H, Tang X J. Synthesis and unique photoluminescence properties of nitrogen-rich quantum dots and their applications[J]. Angewandte Chemie, 2014, 53(1): 12542–12547. |
| [47] | Wen X P, Shi L H, Wen G M, Li Y Y, Dong C, Yang J, Shuang S M. Green and facile synthesis of nitrogen-doped carbon nanodots for multicolor cellular imaging and Co2+, sensing in living cells[J]. Sensors & Actuators B Chemical, 2016, 235(1): 179–187. |
| [48] | Rong M C, Feng Y F, Wang Y R, Chen X. One-pot solid phase pyrolysis synthesis of nitrogen-doped carbon dots for Fe3+, sensing and bioimaging[J]. Sensors & Actuators B Chemical, 2017, 245(1): 868–874. |
| [49] | 安佰超, 乡世健, 曹思玮, 阮世发, 王著显, 翁立冬. 碳点在中药活性组分标记领域的应用[J]. 广东医学, 2018, 39(4): 492–496. An B C, Xiang S J, Cao S W, Ruan S F, Wang Z X, Weng L D. Application of carbon dots in the labeling of active components of Chinese traditional medicine[J]. Guangdong Medical Journal, 2018, 39(4): 492–496.DOI:10.3969/j.issn.1001-9448.2018.04.002 |
| [50] | 刘武, 解荣军. 一种具有室温磷光的碳量子点基复合材料[J]. 功能材料, 2018, 49(8): 492–496. Liu W, Xie R J. A carbon quantum dots matrix composite with room temperature phosphorescence[J]. Functional Materials, 2018, 49(8): 492–496. |
| [51] | 李迎运.新型近红外荧光分子探针的设计合成及其在细胞成像中的应用[D].合肥: 中国科学技术大学, 2017. Li Y Y. Design and synthesis of a novel near infared fluorescent molecular probe and its application in cell imaging[D]. Hefei: China University of Science and Technology, 2017.http://cdmd.cnki.com.cn/Article/CDMD-10358-1017073406.htm |
| [52] | Michalet X, Pinaud F F, Bentolila L A, Tsay J M, Doose S, Li J J, Sundaresan G, Wu A M, GambhirS S, Weiss S. Quantum dots for live cells, in vivo imaging, and diagnostics[J]. Science, 2005, 307(5709): 538–544.DOI:10.1126/science.1104274 |
