
 , 孟铁宏1, 王传明1, 张汝国1, 李炜4, 吕廷勇4, 江家志1, 莫兴泽1, 龙友国1, 余跃生1, 潘卫东2,3
, 孟铁宏1, 王传明1, 张汝国1, 李炜4, 吕廷勇4, 江家志1, 莫兴泽1, 龙友国1, 余跃生1, 潘卫东2,31. 黔南民族医学高等专科学校, 贵州 都匀 558000;
2. 贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550002;
3. 贵州医科大学 天然产物化学重点实验室, 贵州 贵阳 550002;
4. 黔南民族医学高等专科学校附属医院, 贵州 都匀 558000
2018-01-11 收稿, 2018-04-23 录用
国家自然科学基金项目(21545006)、贵州省自然科学基金(黔科合基础[2016]1136号,黔科合J字[2015]2138号)、黔南州优青项目、黔南科技计划项目(黔南科合工字[2016]12号,黔南科合社字[2016]1号)和黔南民族医专科研基金(QNYZ201601,QNYZ201605,QNYZ201801,QNYZ201807)资助
*通讯作者: 胡先运, E-mail: huxianyun2004@163.com
摘要: 通过生物偶联方式,将无毒的碳点(Carbon Dots,CD)表面功能化上核酸,以核酸功能化的碳点(CD-DNA)为荧光团,氧化石墨烯(GO)为猝灭剂,二者组装成CD-DNA/GO纳米荧光探针,CD与GO之间产生长程共振能量转移(long-range resonance energy transfer,LrRET),CD荧光猝灭。当miRNA-21存在时,DNA与其杂交,CD从GO表面分离,二者之间的荧光共振能量转移被打断,碳点荧光恢复,通过荧光"开"方式检测miRNA-21,检测限为0.2 nmol/L,线性范围为1~500 nmol/L。该探针成功应用于血癌K562细胞中miRNA-21的原位成像,为血癌的原位诊断和治疗提供了研究依据。
关键词: 碳点氧化石墨烯荧光成像DNAmiRNA检测
CD-DNA/GO Fluorescent Nanoprobe for Detection of miRNA-21 in situ Live Cell
HU Xianyun1,2,3

 , MENG Tiehong1, WANG Chuanming1, ZHANG Ruguo1, LI Wei4, Lü Tingyong4, JIANG Jiazhi1, MO Xingze1, LONG Youguo1, YU Yuesheng1, PAN Weidong2,3
, MENG Tiehong1, WANG Chuanming1, ZHANG Ruguo1, LI Wei4, Lü Tingyong4, JIANG Jiazhi1, MO Xingze1, LONG Youguo1, YU Yuesheng1, PAN Weidong2,31. Qiannan Medical College for Nationalities, Duyun 558000, Guizhou, P. R. China;
2. The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang 550002, Guizhou, P. R. China;
3. The Key Laboratory of Chemistry for Natural Products of Guizhou Medical university, Guiyang 550002, Guizhou, P. R. China;
4. Affiliated Hospital of Qiannan Medical College for Nationality, Duyun 558000, Guizhou, P. R. China
*Corresponding author: HU Xianyun, E-mail: huxianyun2004@163.com
Abstract: By using carbon dots (CD) to label DNA as fluorophore by biological coupling method, combining with graphene oxide (GO) as quencher, CD-DNA/GO fluorescent nanoprobe was constructed, and developed for miRNA-21 detection. In CD-DNA/GO, the fluorescence of CD was quenched by GO through long-range resonance energy transfer (LrRET). In present of miRNA-21, the DNA bind with miRNA-21 to form duplex, releasing CD-DNA from GO and interrupting the LrRET, and the fluorescence of CD was recovery to achieve miRNA-21 detection by fluorescence "turn on" mode. The obtained the linear range for miRNA-21 was from 1 nmol/L to 500 nmol/L; the detection of limit was estimated to be 0.2 nmol/L by the miRNA-21 fluorescent nanoprobe. The nanoprobe was achieved for detection of miRNA-21 in situ live cell imaging, which provide the basic research for in situ diagnosis and treatment of leukemia.
Key words: carbon dotsgraphene oxidefluorescent imagingDNAmiRNA detection
MicroRNA(miRNA)是近年来发现的一类长度为18~24个核苷酸的一类小的内源性功能非编码RNA。参与调控不同肿瘤细胞增殖、分化和凋亡等生命活动过程[1-3]。miRNA-21已经被认定为在多种癌症中过表达的miRNA,能够增加K562细胞迁移和减少细胞凋亡,而miRNA-21的反义寡核苷酸链能够抑制K562细胞迁移,促进K562细胞凋亡,抑制细胞生长[4]。因此,miRNA-21在白血病的发生发展过程中起着重要作用,可作为该疾病潜在的检测标志物[5],早期检测白血病细胞内miRNA-21的含量对癌症的诊断具有重大理论和临床应用价值。尽管Northern Blot法、qRT-PCR技术、微阵列芯片技术等方法已用于miRNA的检测[6],然而由于miRNA在肿瘤细胞内含量低、种类多样,以及这些检测方法在操作过程的复杂性、灵敏度、特异性等方面的限制,还远远不能满足miRNA生物功能研究的需要,特别是在不同肿瘤细胞的原位检测中受到限制[7, 8]。
氧化石墨烯(Graphene Oxide,GO)因具有独特的核酸吸附性能、高效且通用的荧光猝灭性质,以及较低的生物毒性,能改进检测灵敏度、降低检测成本、增大信噪比、进行原位miRNA检测等[9]。碳点(Carbon Dots, CD)作为环境友好、无毒的纳米荧光团之一,具有如下显著特点:发光性能稳定、发光范围可调、易表面修饰、生物毒性低、制备成本低、水溶性好以及生物相容性好等优势,目前已用于生物传感、细胞成像、诊疗等领域[10-21]。本文以碳点为荧光团,将单链DNA连接到碳点表面,制备出核酸功能化的碳点(CD-DNA),并与GO组装成CD-DNA/GO荧光探针用于miRNA-21检测(图 1),CD与GO之间产生长程荧光共振能量转移(long-range resonance energy transfer, LrRET)过程[22],碳点荧光猝灭。当靶标分子miRNA-21存在时,miRNA-21与单链DNA杂交,CD从GO表面分离,荧光共振能量转移被打断,碳点荧光恢复,通过荧光“开”方式检测miRNA-21,该探针并成功应用于血癌K562细胞中原位成像。
图 1
Fig. 1
 | 图 1 CD-DNA/GO探针检测miRNA-21原理示意图Fig.1 Scheme of CD-DNA/GO probe to detection miRNA-21 |
1 实验部分1.1 试剂及设备柠檬酸(CA,99.99%,百灵威科技公司),尿素(urea,99.99%,南京化学试剂有限公司),氯乙酸钠(分析纯,Alfa公司),氧化石墨烯(GO,4 mg/mL,Sigma-Aldrich),小牛胸腺DNA(ctDNA,生物级,Sigma-Aldrich),牛血清白蛋白(BSA,98%,Sigma-Aldrich),其他试剂均为分析纯。
本实验中核酸序列由上海Invitrogen生物公司合成提供,氨基修饰的核酸(DNA)序列为:5’-NH2-C12-TTTCAACATCAGTCTGATAAGCTAT-3’,氨基修饰的任意核酸序(DNA0)列为:5’-NH2-C12-TTCTAAATCGCTATGGTCGC-3’,miRNA-21序列为:5’-UAGCUUAUCAGACUGAUGUUGA-3’,miRNA-155序列为:5’-UUAAUGCUAAUCGUGAUAGGGGU-3’,miRNA-10b序列为:5’-UACCCUGUAGAACCGAAUUUGUG-3’,miRNA-373序列为:5’-ACUCAAAAUGGGGGCGCUUUCC-3’。
PHI 5000型X射线光电子能谱(XPS), 日本ULVAC-PHI公司;Hitachi F-7000荧光光谱仪, 日本日立公司;Hitachi U-4100紫外-可见光谱仪, 日本日立公司;JEM-2100透射电子显微镜, 日本电子株式会社;Nicolet 5700型傅立叶红外光谱仪, 德国Thermo公司;细胞荧光成像采用激光共聚焦显微镜(Leica TCS SP8)成像系统。
1.2 核酸功能化碳点的制备将0.26 g柠檬酸和0.57 g尿素溶于10 mL的超纯水中,在700 W的微波炉中反应3 min,得到黑色固体的粗碳点,按照文献[23]方法制备出富含羧基的碳点并连接核酸,取40 mg再溶解于20 mL的NaOH和氯乙酸钠的溶液中, 水浴3 h,用HCl中和,并用3.5 kDa透析膜透析,制备出富含羧基碳点,用红外和TEM表征。对于核酸功能化碳点,5 mg羧基化的碳点溶于7.5 mL的Tris-HCl缓冲液(0.1 mol·L-1,pH 7.2)中,加入3 mg EDC和4.5 mg NHS反应30 min。再分别加入50 μL核酸(DNA)和任意核酸(DNA0),反应12 h。用透析膜透析纯化,分别制备出核酸功能化的碳点(CD-DNA以及CD-DNA0)备用。
1.3 CD-DNA/GO探针对miRNA-21检测将CD-DNA分散在Tris-HCl缓冲液(10 mmol/L Tris-HCl, 100 mmol/L NaCl, 2 mmol/L KCl, pH 8.0)中,将1 μg/mL的CD-DNA溶液与不同浓度GO溶液混合,构建CD-DNA/GO探针,测量体系的荧光猝灭实验;在荧光恢复实验中,将不同浓度的miRNA-21加入CD-DNA/GO体系中,检测荧光强度变化,计算出miRNA-21浓度与荧光变化的线性范围和检测限。所有荧光测量均室温下进行,激发光波长为330 nm,光电倍增管(PMT)电压为400 V,狭缝宽度为5 nm。
1.4 CD-DNA/GO探针选择性分析在制备的CD-DNA/GO中分别加入常用的miRNA(miRNA-155、miRNA-10b、miRNA-373等)、BSA蛋白、ctDNA,浓度均为1 μmol/L。测量各自的荧光强度。
1.5 CD-DNA/GO探针对细胞内miRNA-21成像将血癌K562细胞培养在24孔板中,细胞浓度为1×104个/mL,加入100 μL 1 mg/mL的CD-DNA/GO探针,培养2 h、8 h后,吸去培养液,用PBS洗去3次,固定,封片,采用共聚焦荧光显微镜成像,激发波长为330 nm。
2 结果与讨论2.1 核酸功能化碳点的制备柠檬酸和尿素为原料,通过微波法一步合成了碳点,并在其表面进行了羧基化,将制备好的碳点进行XPS表征,如图 2(a)所示,为高分辨率C1s谱,在287.8、286.9、286.0、283.1 eV处有3个峰,分别对应于C=N/C=O、C—O、C—N以及C—C的发射峰,说明碳点表面含有丰富的羧基[24-26]。此外,对碳点的拉曼也进行了表征,如图 2(b)所示,在1580 cm-1处出现最大峰,说明是碳点荧光团的—C=C—伸缩振动,与文献一致[27]。
图 2
Fig. 2
 | 图 2 (a) 碳点的XPS图;(b)碳点的拉曼光谱Fig.2 (a) The XPS spectra of CDs; (b) Raman spectrum of CDs |
通过NHS/EDC活化反应,将氨基修饰的miRNA-21互补核酸连接到CD上,制备核酸功能化的CD,对其光谱性质和TEM进行了表征。
如图 3(a)所示,随着激发波长增加,荧光发射光谱也会发生红移,在330 nm激发时,发射峰波长为411 nm;350 nm激发时,发射峰波长为423 nm;380 nm激发时,发射峰波长为444 nm。吸收峰为410 nm。随着激发波长增加,荧光强度下降,因此,我们选用330 nm激发出高的荧光强度,用于miRNA-21的检测。
图 3
Fig. 3
 | 图 3 (a)核酸功能化碳点在不同激发波长下的荧光发射光谱以及紫外-吸收光谱;(b)CD-DNA的TEM图,插图为高分辨透射电镜图;(c)CD、CD-DNA、GO、CD-DNA/GO的红外光谱图Fig.3 (a) The excitation-dependent emission spectra and UV-Vis of CD-DNA, Inset: the CD-DNA photograph under 365 nm UV lamp; (b) The TEM image of CD-DNA, inset: HRTEM image; (c) The FT-IR spectra of CD, CD-DNA, GO and CD-DNA/GO |
由图 3(b)所示的TEM图可知,核酸功能化的碳点具有很好的单分散性,从高分辨电镜可以看出,其粒径约为2.4±0.58 nm,并明显显示出碳晶格结构,晶格条纹间距分别为0.24 nm和0.34 nm两种,与文献相符[28]。
核酸功能化碳点的红外光谱(FTIR)如图 3(c)所示,与单纯的碳点相比,在1054 cm-1处出现了明显的磷酸特征振动峰,说明CD与核酸成功连接。使用硫酸奎宁作为参考标准[29],计算出碳点的荧光量子产率为18.5%,具有较高的量子产率。
2.2 CD-DNA/GO荧光探针构建向所制备的1 μg/mL CD-DNA溶液中加入不同浓度的GO,由于DNA为单链,CD-DNA与GO烯通过“π-π”堆积作用相互吸引,组装形成CD-DNA/GO纳米荧光探针,如图 4(a)所示,由于CD-DNA与GO之间发生长程共振能量转移过程,随着GO浓度的增加,CD-DNA荧光被逐渐猝灭。对GO的浓度与CD-DNA荧光强度作点线图,如图 4(b),当GO的浓度小于40 μg/mL时,CD-DNA的荧光强度呈现强的线性猝灭,R2=0.997;当GO的浓度大于40 μg/mL时,猝灭效率降低;当GO浓度为40 μg/mL时,CD-DNA的荧光强度猝灭到原来的27%。因此,在CD-DNA浓度为1 μg/mL,GO浓度为40 μg/mL时,构建CD-DNA/GO荧光探针,荧光处于“关”状态,为下一步通过荧光“开”方式检测miRNA-21奠定基础。
图 4
Fig. 4
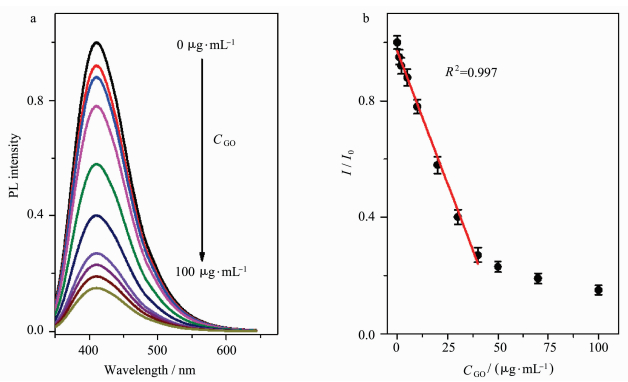 | 图 4 不同浓度的GO猝灭CD-DNA荧光光谱(a)和点线图(b)Fig.4 (a) Evolution of PL spectra of CD-DNA with the GO concentration; (b) relationship between the relative PL intensity (I/I0) and the GO concentration |
我们对所构建的CD-DNA/GO荧光探针进行了红外光谱表征,如图 3(c)所示,CD-DNA与GO组装后,其离心沉淀物在1054 cm-1处也出现了DNA的磷酸的特征振动峰,说明CD-DNA/GO荧光探针构建成功。
2.3 CD-DNA/GO荧光探针用于miRNA-21检测将CD-DNA/GO荧光探针与靶标miRNA-21进行简单共混,实现对miRNA-21的检测。如图 5(a)所示,随着miRNA-21浓度的增加,该荧光探针的荧光强度逐渐增加,这主要是由于miRNA-21存在时,DNA与靶标分子miRNA-21通过碱基配对杂交,形成DNA-RNA双链,打断DNA与GO的“π-π”堆积作用,从GO表面分离,CD与GO之间的长程共振能量转移过程被打断,CD荧光恢复,实现对miRNA-21的检测。
图 5
Fig. 5
 | 图 5 不同浓度的miRNA-21恢复CD-DNA/GO荧光光谱(a)和点线图(b)Fig.5 (a) Evolution of PL spectra of CD-DNA/GO with the miRNA-21 concentration; (b) Relationship between the relative PL intensity (I/I0) and the miRNA-21 concentration |
通过计算相对荧光强度(I/I0)与miRNA-21浓度的变化关系曲线,如图 5(b)所示,计算出CD-DNA/GO纳米荧光探针对miRNA-21的检测限为0.2 nmol/L (3σ),并与miRNA-21浓度在1~500 nmol/L范围有良好的线性关系,R2=0.998,通过荧光“开”方式实现对miRNA-21的检测。
2.4 CD-DNA/GO纳米荧光探针检测miRNA-21的原理证明通过TEM以较直观的方式对CD-DNA/GO纳米荧光探针的miRNA-21检测过程进行了验证。如图 6(a)所示,GO呈现出单层薄片状;而在CD-DNA/GO荧光探针中,图 6(b)所示,GO表面呈现密集的点状,说明CD-DNA都吸附在GO表面,DNA单链与GO通过的“π-π”堆积作用,将CD吸附在GO表面。当miRNA-21存在时,如图 6(c)所示,CD均匀分布在整个视野中,说明CD脱附GO表面,DNA与miRNA-21杂交结合,打断了DNA与GO的“π-π”堆积作用,从而使CD脱附GO表面。
图 6
Fig. 6
 | 图 6 (a) GO、(b)不存在miRNA-21、(c)存在miRNA-21时的CD-DNA/GO体系的TEM图,白色虚线为GO的边缘Fig.6 The TEM images of (a) GO, (b) CD-DNA/GO and (c) CD-DNA/GO in present of miRNA-21 |
2.5 CD-DNA/GO纳米荧光探针特异性分析荧光探针的特异性是分析性能的主要指标之一,图 7为对CD-DNA/GO纳米荧光探针的选择性分析,在该探针中加入其它miRNA(如:mi-RNA-155、miRNA-10b、miRNA-373等)、常用蛋白(如BSA)、双链ctDNA。发现只有加入miRNA-21存在时,CD荧光增强,而其他miRNA、蛋白以及双链DNA等生物分子对该荧光探针没有明显响应,说明该探针对miRNA-21具有较好的特异性。
图 7
Fig. 7
 | 图 7 CD-DNA/GO纳米荧光探针选择性分析Fig.7 Selectivity analysis of CD-DNA/GO fluorescent probe |
2.6 CD-DNA/GO纳米荧光探针的细胞成像白血病是人类癌症发生之一,其癌细胞K562中的miRNA-21含量对癌症的发生起着重要作用,以白血病K562细胞中的miRNA-21进行细胞成像,如图 8(a)所示,CD-DNA0/GO与K562细胞培养8 h作为对照(CD-DNA0为任意核酸序列功能化的碳点),发现K562细胞无荧光。当CD-DNA/GO荧光探针与K562细胞共培养2 h后,K562细胞的荧光出现,且荧光较弱,主要分布在细胞质中,如图 8(b)所示,说明CD-DNA/GO荧光探针进入细胞,对细胞内miRNA-21成像;随着CD-DNA/GO荧光探针与K562细胞共培养时间延长至8 h时,细胞内呈现出较强的荧光,如图 8(c)所示,说明利用该荧光探针可以实现对肿瘤K562细胞成像。
图 8
Fig. 8
 | 图 8 CD-DNA/GO和CD-DNA0/GO纳米荧光探针对K562细胞共聚焦成像,(a) CD-DNA0/GO与K562细胞共培养8 h;CD-DNA/GO纳米荧光探针与K562细胞共培养2 h(b)和8 h(c)Fig.8 Confocal images of K562 cancer cells after incubation with CD-DNA0/GO for 8 h (a), with CD-DNA/GO for 2 h (b) and 8 h (c) |
3 结论本研究中成功制备出核酸功能化的碳点(CD-DNA),并与GO组装成CD-DNA/GO荧光探针,实现了对miRNA-21的检测,利用CD与GO之间产生长程荧光共振能量转移机制,碳点荧光猝灭。当靶标分子miRNA-21存在时,miRNA-21与单链DNA杂交,CDs从GO表面分离,荧光共振能量转移被打断,碳点荧光恢复,通过荧光“开”方式特异性检测miRNA-21。该探针成功应用于血癌K562细胞中miRNA-21的原位成像,为血癌的原位诊断和治疗提供了研究依据。
参考文献
| [1] | Ventura A, Jacks T. MicroRNAs and cancer:short RNAs go a long way[J]. Cell, 2009, 136(4): 586–591.DOI:10.1016/j.cell.2009.02.005 |
| [2] | Kundu S T, Byers L A, Peng D H, Roybal J D, Diao L, Wang J, Gibbons D L. The miR-200 family and the miR-183 similar to 96 similar to 182 cluster target Foxf2 to inhibit invasion and metastasis in lung cancers[J]. Oncogene, 2016, 35(2): 173–186.DOI:10.1038/onc.2015.71 |
| [3] | Telonis A G, Loher P, Yi J. Beyond the one-locus-one-miRNA paradigm:microRNA isoforms enable deeper insights into breast cancer heterogeneity[J]. Nucleic Acids Research, 2015, 43(19): 9158–9175.DOI:10.1093/nar/gkv922 |
| [4] | Hu H, Li Y, Gu J. Antisense oligonucleotide against miR-21 inhibits migration and induces apoptosis in leukemic K562 cells[J]. Leukemia and Lymphoma, 2010, 51(4): 694.DOI:10.3109/10428191003596835 |
| [5] | Li M, Li J, Ding X, He M, Cheng S Y. MicroRNA and Cancer[J]. The AAPS Journal, 2010, 12(3): 309–317.DOI:10.1208/s12248-010-9194-0 |
| [6] | Shen Y, Tian F, Chen Z. Amplification-based method for microRNA detection[J]. Biosensors Bioelectronics, 2015, 71: 322–331.DOI:10.1016/j.bios.2015.04.057 |
| [7] | Choi C K, Li J, Wei K, Xu Y J, Ho L W, Zhu M, To K K, Choi C H, Bian L. A gold@polydopamine core-shell nanoprobe for long-term intracellular detection of microRNAs in differentiating stem cells[J]. Journal American Chemical Society, 2015, 137(23): 7337–7346.DOI:10.1021/jacs.5b01457 |
| [8] | 成永强, 李正平, 王愈聪, 范永山. MicroRNA分析方法进展[J]. 化学进展, 2010, 22(8): 1509–1517. Chen Y Q, Li Z P, Wang Y C, Fan Y S. MicroRNA detection[J]. Progress in Chemistry, 2010, 22(8): 1509–1517. |
| [9] | Ryoo S, Lee J, Yeo J. Quantitative and multiplexed microRNA sensing in living cells based on peptide nucleic acid and nano graphene oxide (PANGO)[J]. ACS Nano, 2013, 7(7): 5882–5891.DOI:10.1021/nn401183s |
| [10] | Ding C, Zhu A, Tian Y. Functional surface engineering of C-dots for fluorescent biosensing and in vivo bioimaging[J]. Accounts of Chemical Research, 2014, 47(1): 20–30.DOI:10.1021/ar400023s |
| [11] | 侯昌顺, 葛介超. 多色荧光碳点的制备新进展[J]. 影像科学与光化学, 2017, 35(1): 1–14. Hou C S, Ge J C. New progress in preparation of multicolor carbon dots[J]. Imaging Science and Photochemistry, 2017, 35(1): 1–14.DOI:10.7517/j.issn.1674-0475.2017.01.001 |
| [12] | 唐志姣, 李攻科, 胡玉玲. 氮掺杂碳点的制备及在定量分析中的应用[J]. 化学进展, 2016, 28(10): 1455–1461. Tang Z J, Li G K, Hu Y L. Advances in preparation and applications in quantitative analysis of nitrogen-doped carbon dots[J]. Progress in Chemistry, 2016, 28(10): 1455–1461. |
| [13] | 王胜达, 袁楠, 朱志峰, 蒋阳. 荧光碳点的合成、性质和应用[J]. 影像科学与光化学, 2016, 34(3): 203–218. Wang S D, Yuan N, Zhu Z F, Jiang Y. Synthesis, properties and applications of the fluorescent carbon dots[J]. Imaging Science and Photochemistry, 2016, 34(3): 203–218.DOI:10.7517/j.issn.1674-0475.2016.03.203 |
| [14] | 邓亚峰, 周奕华, 钱俊, 罗妍, 吴丽辉. 基于上转换发光的碳量子点制备及应用研究[J]. 影像科学与光化学, 2017, 35(6): 884–893. Deng Y F, Zhou Y H, Qian J, Luo Y, Wu L H. Preparation and application of carbon quantum dots based on up conversion photoluminescence[J]. Imaging Science and Photochemistry, 2017, 35(6): 884–893.DOI:10.7517/j.issn.1674-0475.2017.05.010 |
| [15] | 李欣彤, 吴晶, 张德蒙, 谭明乾, 马小军. 新型水溶性多色荧光碳点的制备及细胞成像研究[J]. 分析测试学报, 2014, 33(4): 380–386. Li X T, Wu J, Zhang D M, Tan M Q, Ma X J. Preparation of novel water soluble multicolor carbon dots for cell imaging[J]. Journal of Instrumental Analysis, 2014, 33(4): 380–386. |
| [16] | 木合塔尔·吐尔洪, 徐阳, 尹学博. 碳点的研究进展[J]. 分析化学, 2017, 45(1): 139–150. Mhetaer T, Xu Y, Yin X B. Review on carbon dots and their applications[J]. Chinses Journal of Analytical Chemistry, 2017, 45(1): 139–150.DOI:10.11895/j.issn.0253-3820.160295 |
| [17] | Qu D, Miao X, Wang X T, Nie C, Li Y X, Luo L, Sun Z C. Se & N co-doped carbon dots for high-performance fluorescence imaging agent of angiography[J]. Journal of Materials Chemistry B, 2017, 5(25): 4988–4992.DOI:10.1039/C7TB00875A |
| [18] | Miao X, Yan X L, Du D, Li D B, Tao F F, Su Z C. Red emissive sulfur, nitrogen codoped carbon dots and their application in ion detection and theraonostics[J]. ACS Applied Material & Interfaces, 2017, 9(22): 18549–18556. |
| [19] | Zheng M, Xie Z G, Qu D, Li D, Du P, Jing X B, Sun Z C. On-off-on fluorescent carbon dot nanosensor for recognition of chromium(Ⅵ) and ascorbic acid based on the inner filter effect[J]. ACS Applied Materials & Interfaces, 2013, 5(24): 13242–1324. |
| [20] | 颜范勇, 邹宇, 王猛, 代林枫, 周旭光, 陈莉. 荧光碳点的制备及应用[J]. 化学进展, 2014, 26(1): 61–74. Yan F Y, Zhou Y, Wang M, Dai L F, Zhou X G, Chen L. Synthesis and application of the fluorescent carbon dots[J]. Progress in Chemistry, 2014, 26(1): 61–74. |
| [21] | 赵薇, 张志凌, 庞代文. 量子点荧光标记技术在生物医学领域的应用[J]. 化学传感器, 2008, 28(1): 8–14. Zhao W, Zhang Z L, Pang D W. Application of quantum dots as fluorescent labels in medicine and biology[J]. Chemical Sensors, 2008, 28(1): 8–14. |
| [22] | Hu X Y, Liu Y Q, Qu X J, Sun Q J. A quantum dot-labelled aptamer/graphene oxide system for the construction of a half-adder and half-subtractor with high resettability[J]. Chemical Communications, 2017, 53(81): 11181–11184.DOI:10.1039/C7CC05279K |
| [23] | Gui R J, Jin H, Wang Z H, Zhang F F, Xia J F, Yang M, Bi S, Xia Y Z. Room-temperature phosphorescence logic gates developed from nucleic acid functionalized carbon dots and graphene oxide[J]. Nanoscale, 2015, 7(18): 8289–8293.DOI:10.1039/C4NR07620F |
| [24] | Schneider J, RecKmeier C J, Xiong Y, Seckendorff M, Susha A S, Kasak P, Rogach A L. Molecular fluorescence in citric acid-based carbon dots[J]. The Journal of Physical Chemistry C, 2017, 121(3): 2014–2022.DOI:10.1021/acs.jpcc.6b12519 |
| [25] | Bankoti K, Rameshbabu A P, Datta S, Das B, Mitra A, Dhara S. Onion derived carbon nanodots for live cell imaging and accelerated skin wound healing[J]. Journal of Materials Chemistry B, 2017, 5(32): 6579–6592.DOI:10.1039/C7TB00869D |
| [26] | Sharma V, Tiwari P, Mobin S M. Sustainable carbon-dots:recent advances in green carbon dots for sensing and bioimaging[J]. Journal of Materials Chemistry B, 2017, 5(45): 8904–8924.DOI:10.1039/C7TB02484C |
| [27] | Das A, Gude V, Roy D, Chatterjee T, De C K, Mandal P K. On the molecular origin of photoluminescence of nonblinking carbon dot[J]. The Journal of Physical Chemistry C, 2017, 121(17): 9634–9641.DOI:10.1021/acs.jpcc.7b02433 |
| [28] | Miao X, Qu D, Yang D X, Nie B, Zhao Y K, Fan H Y, Sun Z C. Synthesis of carbon dots with multiple color emission by controlled graphitization and surface functionalization[J]. Advanced Materials, 2018, 30(1): 1704740.DOI:10.1002/adma.201704740 |
| [29] | Ma J, Guo B L, Cao X T, Lin Y P, Yao B X, Li F M, Weng W, Huang L Z. One-pot fabrication of hollow cross-linked fluorescent carbon nitride nanoparticles and their application in the detection of mercuric ions[J]. Talanta, 2015, 143: 205–211.DOI:10.1016/j.talanta.2015.05.063 |
