

1. 江南大学 化学与材料工程学院, 江苏 无锡 214122;
2. 安庆师范大学 化学化工学院 光电磁功能材料安徽省重点实验室, 安徽 安庆 246011
2017-09-29 收稿, 2017-11-08 录用
国家自然科学基金项目(21404048)资助
*通讯作者: 刘晓亚, E-mail: lxy@jiangnan.edu.cn
摘要: 单组分可见光引发剂是光固化材料研发中的重要内容。本文设计并合成了一种新型的单组分可见光引发剂——2-硫杂蒽酮乙酸四苯基磷酸盐(TXP),该引发剂以硫杂蒽酮为生色团,通过光致脱羧反应产生活性自由基,进而引发聚合反应。利用核磁和高分辨率质谱对TXP的结构进行了表征;通过光解及电子自旋共振捕获等方法研究了其光致脱羧反应。光聚合动力学研究表明:在可见光源照射下,这种单组分光引发剂能高效引发巯基-烯类单体的聚合反应,具有一定的应用的前景。
关键词: 光引发剂单组分光致脱羧光聚合2-硫杂蒽酮乙酸四苯基磷酸盐(TXP)
Synthesis and Photochemical Properties of One-component Visible-light Photoinitiator Based on Photodecarboxylation
DONG Xiaoqing1,2, LI Zhiquan1, LIU Ren1, LIU Xiaoya1


1. School of Chemical and Material Engineering, Jiangnan University, Wuxi 214122, Jiangsu, P. R. China;
2. Anhui Province Key Laboratory of Optoelectronic and Magnetism Functional Materials, School of Chemistry and Chemical Engineering, Anqing Normal University, Anqing 246011, Anhui, P. R. China
*Corresponding author: LIU Xiaoya, E-mail: lxy@jiangnan.edu.cn
Abstract: One-component visible-light photoinitiators receive more attention recently. A novel photoinitiator-tetraphenylphosphonium 2-(9-oxo-9H-thioxanthen-2-yl)acetate(TXP) was synthesized and contained thioxanthone as the chromophore, which generate radicals via photodecarboxylation reaction. The structure was characterized by 1HNMR, 13CNMR and HR-MS. The study on photolysis confirmed the photoinduced decarboxylation mechanism. The novel photoinitiator showed high activity in initiating thiol-ene click polymerization under visible-light LED sources, which makes the photoinitiator promising candidates for one-component visible-light photoinitiator.
Key words: photoinitiatorone-componentphotodecarboxylationphotopolymerizationtetraphenylphosphonium 2-(9-oxo-9H-thioxanthen-2-yl)acetate(TXP)
近年来,随着人们安全意识的提高和环保政策的日益严格,具有环保、节能、高效、经济、适应性广等“5E”特点的光固化技术得到迅速发展,在涂料、油墨、微电子、医疗、3D打印等领域得到了广泛的应用[1, 2]。目前,光固化技术主要使用高压、中压汞灯作为辐射光源,这类光源具有价格便宜和技术成熟等优势,但缺点是寿命较短、主要发射低于280 nm的紫外光、易产生对人体有害的臭氧、热量大、效率低等[3]。因此,寿命长、效率高、安全性好、发射波长较高的LED光源受到研究人员的重点关注。但是,LED光源发射光谱带较窄,要求光引发剂的吸收光谱要与其相匹配才能利用光能。光引发剂是光固化材料的重要组成部分,对材料的固化速率、固化程度以及产品性能有很大的影响,因此,LED光源的应用受到光引发剂种类和数量的限制[4]。开发与LED光源匹配的可见光引发剂是光固化材料研发的重点。
硫杂蒽酮衍生物具有优秀的光物理、光化学性质,是常用的夺氢型光引发剂。它们的主吸收峰位于UV-A区域,吸收谱带可延伸到可见光区(~450 nm)[5],有作为可见光引发剂应用的潜力。夺氢型光引发剂硫杂蒽酮需要与胺类等供氢体复配成双组分引发体系,但是胺类等供氢体常给光固化材料带来气味、毒性、黄变等一系列问题,且双组分引发体系又受到结构是否匹配、逆电子转移等问题的困扰,使引发效率受到影响。常见的解决办法是将供氢体与硫杂蒽酮骨架通过共价键连接起来[6-8],例如,杨建文等[9]将小分子胺类引入到生色团骨架,尝试解决气味、迁移性等问题。然而,方维海等[10]发现,在不需要引入胺类供氢体的前提下,二苯甲酮衍生物可以经光致脱羧反应生成一种活性自由基,该自由基可以用于引发丙烯酸酯类单体的聚合反应[11]。由于光致脱羧反应具有不可逆、高量子产率的特点[12],Yagci等[13, 14]制备了一系列基于光致脱羧的硫杂蒽酮类单组分光引发剂。作者经过进一步研究发现,通过促进光致脱羧反应可以促进自由基的生成[15],可以为引发剂的分子设计提供一个新的思路。
本文设计并合成了一种新型的单组分可见光引发剂2-硫杂蒽酮乙酸四苯基磷酸盐(TXP),该引发剂以硫杂蒽酮为生色团,以四苯基膦阳离子为配对阳离子。TXP可以作为单组分光引发剂,不需要与供氢体复配,并且,借助四苯基膦阳离子对光致脱羧反应的促进作用和光致脱羧反应不可逆的特点(抑制了逆电子转移),最终获得较高的引发活性。利用紫外-可见光光谱、荧光光谱研究了该光引发剂的光物理性质;通过光解、电子自旋共振捕获等方法研究其光化学性质;通过实时红外研究了光引发剂引发巯基(PETMP)/烯(APE)类单体进行点击化学反应的光聚合动力学,并在此基础上提出TXP可能的引发机理。
本文所涉及的光引发剂和单体的结构式如图 1所示。
图 1
Fig. 1
 | 图 1 本文所涉及的光引发剂和单体的结构式Fig.1 Structures of the photointitators and the monomers |
1 实验部分1.1 材料与仪器硫代水杨酸(分析纯,萨恩化学技术有限公司)、苯乙酸(分析纯,国药集团化学试剂有限公司)、N-叔丁基苯硝酮(PBN,分析纯,梯希爱化成工业发展有限公司)、硫酸(分析纯,国药集团化学试剂有限公司)、1, 4-二氧六环(分析纯,国药集团化学试剂有限公司)、异丙基硫杂蒽酮(ITX,分析纯,广信感光新材料股份有限公司)、四(3-巯基丙酸)季戊四醇酯(分析纯,梯希爱化成工业有限公司)、季戊四醇三烯丙基醚(分析纯,梯希爱化成工业发展有限公司)、无水甲醇(分析纯,国药集团化学试剂有限公司)、甲苯(分析纯,国药集团化学试剂有限公司)、苯(分析纯,国药集团化学试剂有限公司)。以上试剂在使用前未经进一步处理。
Nicolet 6700型傅立叶变换红外光谱仪,美国赛默飞世尔科技有限公司;AVANCE Ⅲ HD 400 MHz型核磁共振仪,德国布鲁克公司;UPLC-TQD型超高效液相色谱串联四级杆质谱联用仪,美国沃特世公司;TU-1901型紫外可见分光光度计,北京普析通用公司;CARY Eclipse型荧光分光光度计,美国瓦里安有限公司;EMXplus-10/12型电子自旋共振波谱仪,德国布鲁克科技有限公司;OmniCure S1000 UV/可见光点光源(滤波器:320~500 nm),加拿大EXFO公司;UV Power Puck Ⅱ紫外能量计,美国EIT公司;LED光固化仪YW-51220(365 nm,405 nm),上海悦威电子有限公司。
1.2 合成TXP的合成路线如图 2所示。2-硫杂蒽酮乙酸(TX)依照文献方法合成[16],本研究所有的合成实验均在暗室中或避光棕色容器中完成。
图 2
Fig. 2
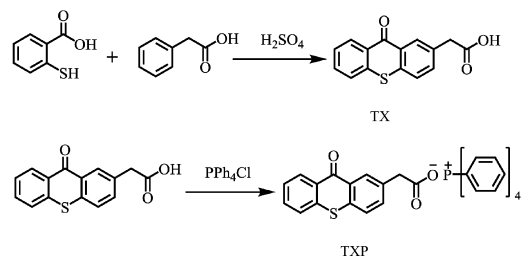 | 图 2 光引发剂TXP的合成路线Fig.2 Synthetic route of TXP |
1.2.1 TX的合成将1.54 g硫代水杨酸(10 mmol)加入20 mL浓硫酸中并充分溶解,然后缓慢加入4.05 g苯乙酸(30 mmol),室温搅拌2 h。升温至75 ℃反应4 h后,将反应溶液冷却至室温并搅拌过夜。将反应溶液倒入200 mL沸水中析出沉淀,收集该沉淀并在二氧六环/水溶液中重结晶,得到蓝色固体1.68 g,收率68%。1HNMR (400 MHz, d6-DMSO): 12.54 (s, 1H, COOH), 8.52~7.45 (m, 7H, Ar-H), 3.79 (s, 2H, CH2)[5, 11]。
1.2.2 TXP的合成分别称取0.27 g TX(1 mmol)、0.49 g四苯基氯化膦(1.3 mmol)、0.5 g碳酸钾,加入10 mL水,室温搅拌过夜。反应结束后静置0.5 h,取下层无色油状液体,用0.22 μm滤膜过滤后水洗3次,甲苯洗涤两次,离心得到下层无色油状液体,真空干燥,得目标产物0.34 g,产率55.9%。1HNMR (400 MHz, d6-DMSO): 8.5~7.48 (m, 27H, Ar-H), 3.43 (s, 2H, CH2)。13CNMR (101 MHz, d6-DMSO):180.45 (C=O), 175.40 (O—C=O), 137.24~117.95(137.24, 136.10, 133.9, 133.80, 133.60, 133.05, 131.70, 129.85, 126.92, 126.55, 117.95, Ar-C), 41.50 (—CH2)。高分辨质谱Q-Tof-MS (m/z): C15H9O3S-, 理论值:269.0278,实测值: 269.0155 [M]-。
1.3 结构表征核磁测试使用AVANCE Ⅲ HD 400 MHz核磁共振仪,测试溶剂为氘代二甲基亚砜;高分辨率质谱测试采用MALDI SYNAPT MS质谱联用仪,溶剂为无水甲醇。
1.4 光物理性质测试紫外-可见吸收光谱测试采用TU-1901型紫外-可见光分光光度计,测试溶剂为无水甲醇;荧光发射光谱测试采用CARY Eclipse型荧光分光光度计,测试溶剂为无水甲醇。
使用同一设备,在相同激发波长下,采用参比法计算荧光量子产率:
 |
1.5 稳态光解测试配制浓度为2.05×10-5 mol/L的TXP无水甲醇溶液,用OmniCure S1000 UV/可见光点光源辐照并搅拌,辐射光强为100%,用TU-1901型紫外可见分光光度计测试不同辐照剂量下的紫外-可见光吸收光谱。
1.6 电子自旋共振波谱(ESR)测试向核磁管中依次加入2 mg TXP(0.003 mmol)、2 mg N-叔丁基苯硝酮(PBN,0.01 mmol)、1 mL苯,超声10 min充分溶解,随后在通风橱中通氮气排氧10 min,测试前用365 nm LED光源光照30 s,光源强度100%,光强26.2 J/cm2,采用电子自旋共振波谱仪测得电子自旋共振图谱。
1.7 光聚合动力学测试本研究使用实时红外(Real-time IR)进行光引发剂的光聚合动力学研究。称取约0.01 mmol光引发剂ITX、TX、TXP溶解于一滴DMF,加入PETMP/APE单体混合物(PETMP/APE=3:4,摩尔比),混合均匀得到实时红外测试样品(Blank为不含光引发剂的空白样),其中光引发剂含量为1%(摩尔分数)。样品涂抹于KBr盐片上,用LED光源(365 nm,405 nm)辐照,通过紫外能量计调整每10 s光照剂量为8.5 J/cm2,辐照时间为300 s,采用傅立叶变换红外光谱仪实时监测巯基、双键官能团的转化率:位于2580 cm-1处的巯基吸收峰和1636 cm-1的双键特征吸收峰[18]。
2 结果与讨论2.1 光引发剂的合成硫杂蒽酮衍生物具有优秀的光物理和光化学性质:较高的摩尔消光系数、较低的三重态能量、较高的量子产率。通过前期的研究证实,TX可以通过高效的光致脱羧反应产生活性自由基[15],从而引发聚合反应。由于光致脱羧反应是不可逆的化学反应过程,基于光致脱羧反应的单组分光引发剂能有效抑制逆电子转移,进而提高光引发剂的量子产率[5]。促进脱羧的反应速率是光引发剂分子设计的重点。脱羧反应的本质是羧基质子首先离去,随后进行C—C共价键的异裂生成CO2离去,并产生亚甲基自由基。Phillips等[19]系统地研究了酮基布洛芬的光致脱羧反应机理,结果表明, 激发三重态分子内质子转移是脱羧反应的难点,也是反应进行的先决条件。因此,本研究采用四苯基膦阳离子作为配对离子,使光致脱羧反应不再需要经历分子内质子转移而直接进行C—C共价键的异裂步骤,且膦阳离子的引入能有效避免铵阳离子引入时给固化体系带来的黄变等问题。
2.2 光物理性质图 3是两种光引发剂TX和TXP在甲醇溶液中的紫外-可见光吸收光谱。两种光引发剂在270和385 nm附近均有较强吸收。在270 nm附近的吸收峰归属于硫杂蒽酮的π-π*跃迁,而385 nm附近的吸收峰归属于羰基的n-π*跃迁,TXP在230 nm的吸收峰归属于四苯基膦阳离子上苯环的吸收峰。由于膦阳离子的引入对TX共轭结构没有较大的影响,因此,TXP与TX的最大吸收峰位置几乎相同(表 1)。而TXP的紫外吸收谱带也延伸到440 nm处,因此,可以作为可见光引发剂与405 nm LED光源相匹配。
图 3
Fig. 3
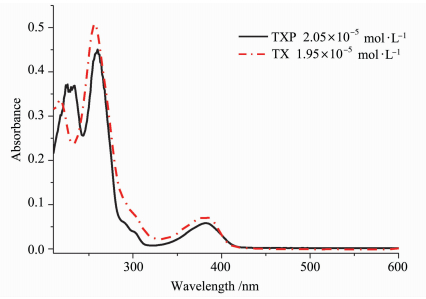 | 图 3 TX和TXP在甲醇溶液中的紫外吸收光谱Fig.3 UV-Vis absorption spectra of TX and TXP in methanol solution |
表1
Table 1
| 表 1 光引发剂的光物理性质数据 Table 1 Photophysical properties of the photoinitiators | ||||||||||||||||||||||||||||||||
TX与TXP的荧光光谱如图 4所示。四苯基膦阳离子的引入对光引发剂的荧光发射光谱影响不大,两个化合物的荧光发射都在440 nm附近。但是TXP的荧光发射峰明显增强,以硫酸奎宁为参比测试的荧光量子产率为17%(表 1)。在TXP的摩尔消光系数没有增加的情况下,荧光量子产率的升高通常意味着三重态量子产率的降低。
图 4
Fig. 4
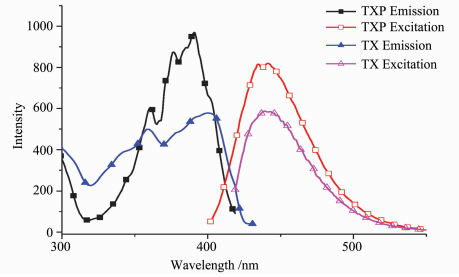 | 图 4 TXP和TX在甲醇溶液中的荧光光谱Fig.4 Fluorescence excitation and emission spectra of TXP and TX in methanol |
TX与TXP的光物理性质数据详见表 1。
2.3 光解行为研究光引发剂TXP的在光源照射下光解过程的紫外吸收变化如图 5所示,随着光照剂量的增加,吸收图谱没有发生明显的变化,说明硫杂蒽酮生色团本身没有发生分解。
图 5
Fig. 5
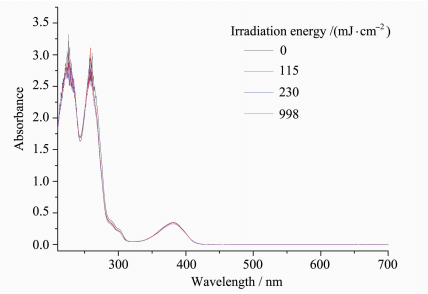 | 图 5 TXP光解紫外吸收图谱Fig.5 UV-Vis absorption spectra of TX-S-TBD in acetonitrile upon irradiation |
Yagci等[13]报道TX在光致脱羧后会产生活性自由基,这些自由基具有引发丙烯酸酯类单体聚合的能力。Arimitsu等[12]开发了一系列氧杂蒽酮类的光产碱剂,这些光产碱剂基于高效的光致脱羧反应释放出超强碱,具有很高的量子产率。为了研究TXP光解过程中产生的自由基,本研究以PBN为自由基捕捉剂,通过电子自旋共振研究捕获的自由基特征参数。电子自旋共振监测的自由基谱图如图 6所示,该自由基信号的超精细裂分常数为aN =14.7 G, aH =2.5 G。作为对比,采用相同的条件测试了TX光致脱羧自由基信号,相同的超精细裂分常数可证实光解过程产生了亚甲基自由基[15]。
图 6
Fig. 6
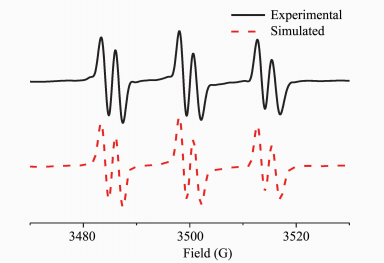 | 图 6 苯溶液中TXP光照后的ESR模拟和实测图谱Fig.6 Simulated ESR spectra and experimental ESR spectra of TXP with PBN in benzene |
2.4 光聚合动力学研究通过实时红外研究了TXP光引发剂的光聚合动力学,并在相同条件下对比测试了TXP的前体结构TX。如图 7所示,两种单组分可见光引发剂均能在LED光源照射下高效引发巯基-烯类树脂进行聚合反应。在300 s光照结束后,最终的双键转化率达到或接近90%。其中TXP的双键转化率稍高于TX(图 7a),这可能是由于TXP光解速率快,与树脂体系相容性更好,导致引发活稍高。单组分引发剂TXP的巯基转化率明显高于TX的巯基转化率(图 7b),这可能是由于TXP具有更快的光致脱羧反应速率,在聚合反应初始阶段,光解时在短时间内产生了更多的活性自由基,进而形成大量的硫自由基,过量的硫自由基增加二硫键化合物的形成,从而使TXP具有较高的巯基转化率[1]。
图 7
Fig. 7
 | 图 7 含不同光引发剂的树脂的实时红外双键(a)和巯基(b)转化率曲线Fig.7 Epoxy conversion (a) and thiol conversion (b) curves of resin contained different photoinitiators |
由于不含光引发剂的巯基/烯类单体也可以在光源照射下进行聚合反应[20],因此不含光引发剂的巯基/烯混合物(Blank)也在相同的条件下进行了光聚合动力学测试。如图 7所示,不含光引发剂和阻聚剂的巯基/烯树脂虽然可以进行聚合反应,但聚合速率明显慢于含TX及TXP的树脂样品。在避光、60 ℃条件下,Blank树脂在3~4 h左右即发生凝胶化,TX树脂的凝胶化时间稍长为5 h左右。TXP树脂的储存稳定稍好于前两者,为9~10 h,这可能是由于TXP在极性溶剂(DMF)中的弱电离作用产生的阻聚效果。
如图 8所示,在405 nm LED光源照射下,树脂的双键和巯基的基团转化率均比使用365 nm LED光源高,这主要是因为TX及TXP的主吸收波长在385 nm附近。与TX相比,TXP在405 nm具有更高的摩尔消光系数(表 1),与可见光光源匹配性更好,说明TXP具有作为可见光引发剂应用的潜力。
图 8
Fig. 8
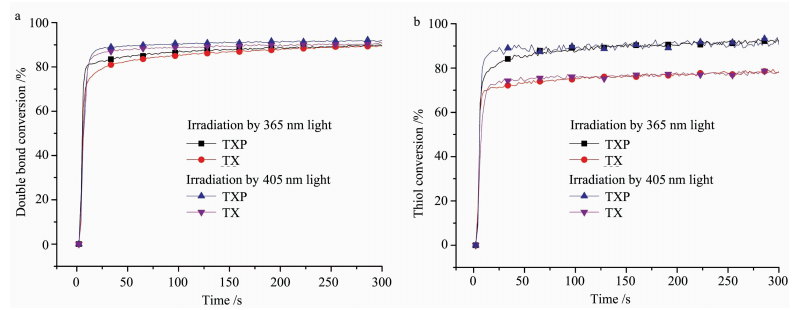 | 图 8 含单组分光引发剂的树脂在可见光源照射下的实时红外双键(a)和巯基(b)转化率Fig.8 Epoxy conversion (a) and thiol conversion (b) curves of one-component photoinitiators containing resin under visible light |
光引发剂的浓度也是光聚合速率的重要影响因素。如图 9所示,随着TXP浓度的提高,最终的双键转化率也不断提高。当引发剂浓度为0.5%(摩尔分数)时,最终的双键转化率仅达到70%,这说明引发剂浓度过低,产生的自由基量不足。而当引发剂浓度达到2%时,其双键转化率相比1%时没有明显的提升。这可能是由于TXP含有较大的四苯基膦基团,当聚合物链增长到一定程度,链的活动能力和引发剂的活动能力都受到限制,使基团转化率不能进一步提高。
图 9
Fig. 9
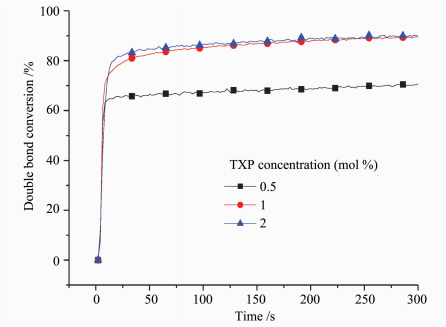 | 图 9 含不同浓度TXP的树脂聚合时的双键转化率Fig.9 Epoxy conversion curves of resin contained different concentration TXP |
由于巯基化合物可以作为夺氢型光引发剂的供氢体,不能脱羧的ITX与巯基单体间的夺氢反应产生硫自由基,进而引发聚合反应。同时由于ITX具有更强的夺氢能力,可直接通过双分子夺氢反应产生硫自由基,比先通过脱羧反应产生亚甲基自由基再产生硫自由基效率更高。另一方面,前期的研究表明配对阳离子的引入使引发剂更容易进行分子内光致脱羧产生亚甲基自由基,不容易通过分子间的电子/质子转移作用产生羰自由基(图 5),从而降低了供氢体自由基的量子产率[15],因此,ITX表现出比TXP更高的引发速率和基团转化率(图 7)。
综上所述,基于巯基/烯点击化学的TXP引发机理包括双分子夺氢和单分子光致脱羧两种机理。TXP基于单分子光致脱羧反应的引发机理为:TXP分子吸收光子能量跃迁激发单重态,经过快速的系间窜越到达激发三重态,进而发生脱羧反应,离去CO2,产生硫杂蒽酮亚甲基自由基。随后,该自由基进攻巯基产生硫自由基,硫自由基与烯类单体的双键发生点击化学反应,从而引发巯基-烯类单体的聚合反应,其反应机理如图 10所示。
图 10
Fig. 10
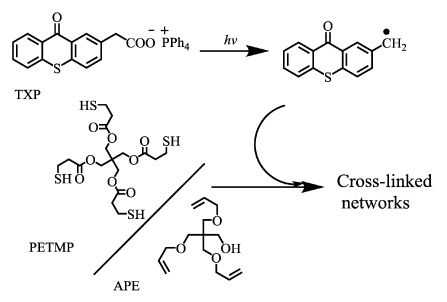 | 图 10 TXP基于光致脱羧反应的引发机理Fig.10 Proposed photodecarboxylation-initiated mechanism of TXP |
3 结论本文设计并合成了一种新型的单组分可见光引发剂TXP,该光引发剂在UV-A和可见光区域有较强吸收,具有作为可见光引发剂应用的潜力。TXP在可见光照射下,能发生高效的光致脱羧反应,进而产生活性亚甲基自由基并引发巯基-烯的点击化学反应。光聚合动力学研究表明TXP能有效引发PETMP/APE树脂进行光固化,在405 nm的LED光源照射下能获得更高的基团转化率。
参考文献
| [1] | 沈为真, 刘晓亚, 刘仁, 李治全. 硫杂蒽酮类光产碱剂的合成及其光化学性能研究[J]. 影像科学与光化学, 2017, 35(1): 70–79. Shen W Z, Liu X Y, Liu R, Li Z Q. Synthesis and photochemical properties of photobase generators containing thioxanthone[J]. Imaging Science and Photochemistry, 2017, 35(1): 70–79.DOI:10.7517/j.issn.1674-0475.2017.01.070 |
| [2] | 王德海, 江棂. 紫外光固化材料:理论与应用[M].北京: 科学出版社, 2001: 7-11. Wang D H, Jiang L. Theory and Application of UV-curing Material[M]. Beijing: Science Press, 2001: 7-11. |
| [3] | Pan X, Tasdelen M A, Laun J, Junkers T, Yagci Y, Matyjaszewski K. Photomediated controlled radical polymerization[J]. Progress in Polymer Science, 2016, 62: 73–125.DOI:10.1016/j.progpolymsci.2016.06.005 |
| [4] | Karasu F, Croutxe-Barghorn C, Allonas X, Van Der Ven L G J. Free radical photopolymerization initiated by UV and LED:towards UV stabilized, tack free coatings[J]. Journal of Polymer Science Part A-Polymer Chemistry, 2014, 52(24): 3597–3607. |
| [5] | Dong X Q, Hu P, Zhu G G, Li Z Q, Liu R, Liu X Y. Thioxanthone acetic acid ammonium salts:highly efficient photobase generators based on photodecarboxylation[J]. RSC Advances, 2015, 5(66): 53342–53348.DOI:10.1039/C5RA09314G |
| [6] | Qiu J, Wei J. Water-soluble and polymerizable thioxanthone photoinitiator containing imidazole[J]. Journal of Applied Polymer Science, 2014, 131: 40659. |
| [7] | Aydin M, Arsu N, Yagci Y, Jockusch S, Turro N J. Mechanistic study of photoinitiated free radical polymerization using thioxanthone thioacetic acid as one-component type Ⅱ photoinitiator[J]. Macromolecules, 2005, 38(10): 4133–4138.DOI:10.1021/ma047560t |
| [8] | Karaca N, Balta D K, Ocal N, Arsu N. Mechanistic studies of thioxanthone-carbazole as a one-component type Ⅱ photoinitiator[J]. Journal of Luminescence, 2014, 146: 424–429.DOI:10.1016/j.jlumin.2013.10.011 |
| [9] | He M, Chen G, Huang X, Xu R, Zeng Z, Yang J. N-phthaloyltranexamic acid ammonium salt derivatives as photocaged superbase for redox free radical photopolymerization[J]. Polymer Chemistry, 2014, 5(8): 2951–2960.DOI:10.1039/c3py01448g |
| [10] | Xu Y, Chen X, Fang W H, Phillips D L. Ph-and wavelength-dependent photodecarboxylation of ketoprofen[J]. Organic Letters, 2011, 13(20): 5472–5475.DOI:10.1021/ol202182k |
| [11] | Esen D S, Temel G, Balta D K, Allonas X, Arsu N. One-component thioxanthone acetic acid derivative photoinitiator for free radical polymerization[J]. Photochemistry and Photobiology, 2014, 90(2): 463–469.DOI:10.1111/php.2014.90.issue-2 |
| [12] | Arimitsu K, Endo R. Application to photoreactive materials of photochemical generation of superbases with high efficiency based on photodecarboxylation reactions[J]. Chemistry of Materials, 2013, 25(22): 4461–4463.DOI:10.1021/cm4022485 |
| [13] | Aydin M, Arsu N, Yagci Y. One-component bimolecular photoinitiating systems, 2[J]. Macromolecular Rapid Communications, 2003, 24(12): 718–723.DOI:10.1002/(ISSN)1521-3927 |
| [14] | Chen G X, Guan X Y, Xu R X, Tian J F, Lu F C, He M H, Yang J W. Thioxanthone dicarboxamide derivatives as one-component photoinitiators for near-UV and visible LED(365-405 nm) induced photopolymerizations[J]. RSC Advances, 2016, 6(80): 77093–77099.DOI:10.1039/C6RA13512A |
| [15] | Dong X Q, Hu P, Shen W Z, Li Z Q, Liu R, Liu X Y. Carbanion as a superbase for catalyzing thiol-epoxy photopolymerization[J]. Polymers, 2017, 9(9): 400. |
| [16] | Yilmaz G, Acik G, Yagci Y. Counteranion sensitization approach to photoinitiated free radical polymerization[J]. Macromolecules, 2012, 45(5): 2219–2224.DOI:10.1021/ma3000169 |
| [17] | Cameron J F, Frechet J. Photogeneration of organic-bases from ortho-nitrobenzyl-derived carbamates[J]. Journal of the American Chemical Society, 1991, 113(11): 4303–4313.DOI:10.1021/ja00011a038 |
| [18] | Ortiz R A, Urbina B A P, Valdez L V C, Duarte L B, Santos R G, Valdez A E G, Soucek M D. Effect of introducing a cationic system into a thiol-ene photopolymerizable formulation[J]. Journal of Polymer Science Part A:Polymer Chemistry, 2007, 45(21): 4829–4843.DOI:10.1002/(ISSN)1099-0518 |
| [19] | Li M D, Su T, Ma J, Liu M, Liu H, Li X, Phillips D L. Phototriggered release of a leaving group in ketoprofen derivatives via a benzylic carbanion pathway, but not via a biradical pathway[J]. Chemistry-A European Journal, 2013, 19(34): 11241–11250.DOI:10.1002/chem.201300285 |
| [20] | Cramer N B, Scott J P, Bowman C N. Photopolymerizations of thiol-ene polymers without photoinitiators[J]. Macromolecules, 2002, 35(14): 5361–5365.DOI:10.1021/ma0200672 |
