

中国科学院大学材料科学与光电技术学院, 北京 100049
2018年4月10日 收稿; 2018年5月8日 收修改稿
基金项目: 国家自然科学基金(21101169)资助
通信作者: 张静,E-mail:zhangj271@ucas.edu.cn
摘要: 环硫脲为配体和亚铜盐在溶剂热条件下进行反应,通过调整配体与亚铜盐的摩尔比以及亚铜盐中的阴离子,得到4种环硫脲亚铜配合物:1-Cu(TU)I、2-Cu(TU)2I、3-[Cu(TU)2](BF4)和4-[Cu(TU)2](PF6)。对这4个配合物的光物理性质进行测定。通过激光倍频效应发现化合物1的SHG效应的响应活性是KDP的1.1倍。在392或335 nm下激发,化合物3和4在室温下分别在517和520 nm处产生具有较高量子产率的固体磷光发射。
关键词: 环硫脲亚铜配合物固体发光二阶非线性光学性质
Structures and photophysical properties of four copper(I) complexes based on cyclic thiourea
CHAI Ke, GAO Yueze, ZHANG Jing


College of Materials Science and Opto-Electronics Technology, University of Chinese Academy of Sciences, Beijing 100049, China
Abstract: Cyclic thiourea copper(I) complexes, 1-Cu(TU)I, 2-Cu(TU)2I, 3-[Cu(TU)2](BF4), and 4-[Cu(TU)2](PF6), were successfully prepared by solvothermal method. By adjusting the molar ratio of the ligand to the cuprous salt and the anion in the cuprous salt, we got four coordination complexes and characterized their structures by X-ray single crystallography. The photophysical properties of these four complexes were measured. Complex 1 exhibited modest SHG response of 1.1 times response of potassium dihydrogen phosphate(KDP). Under excitation at either 392 or 335 nm, complexes 3 and 4 showed the phosphorescence at 517 and 520 nm, respectively, and high quantum yields in solid state at room temperature.
Keywords: cyclic thioureacopper(I) complexessolid state phosphorescencesecond-order nonlinear optical properties
N-杂环卡宾(NHC)[1]及其衍生物作为一类新型有机化合物一直是金属有机化学研究中的前沿领域[2-3]。其不仅可以与金属元素形成配合物,还能够与非金属和半金属的元素形成相应的衍生物[4]。其中,氮杂环卡宾与硫元素形成的环硫脲(TU)[5]可作为配体,与Cu-,Ag-,Au-,Pd-,Ru-和Rh-等过渡金属原子形成配合物,从而在生物医药,催化等领域有广泛的应用[6-7]。例如,香港大学支志明课题组[8-9]研究表明,环硫脲的铜,银和金配合物对癌细胞具有效果显著的细胞毒性,其中金的环硫脲配合物可以与靶向硫氧还蛋白还原酶的抗癌药物紧密结合,而银的环硫脲配合物可以通过对IκB激酶的失活作用来抑制细胞因子刺激的NF-κB的活性。又如,Yang等[10]制备的大位阻环硫脲钯配合物对Heck反应类型有非常高的催化反应活性。
硫脲配体[11-12]具有很好的性能,如Circu等[11]制备的N-苯甲酰基硫脲的Pt配合物在室温下固体可发荧光。而d10亚铜配合物作为磷光材料,是OLED最理想的发光材料之一[13]。因此,我们通过溶剂热法制备一系列环硫脲亚铜配合物(图 1),并通过X射线单晶衍射解析其晶体结构,研究它们的光物理性质。
Fig. 1
 | Download: JPG larger image |
| 图 1 配合物1-4的结构图 Fig. 1 Structures of complexes 1-4 图 1 配合物1-4的结构图 Fig. 1 Structures of complexes 1-4 --> | |
1 实验部分1.1 仪器与试剂Agilent 8453紫外可见光谱仪;Bruker ARX(400 MHz)核磁共振波谱仪; Bruker APEX IV FT-ICR质谱仪;Edinburgh FLS980稳态顺态荧光光谱仪;PerkinElmer Lambda35紫外可见分光光度计。所有试剂均为市售分析纯。环硫脲配体按照文献[8]中所示方法合成。
1.2 环硫脲亚铜配合物的合成[Cu(TU)I] (1):在10 mL的聚四氟乙烯水热釜内胆中,将配体TU(120.6 mg,0.38 mmol),CuI (73.2 mg,0.38 mmol)和5 mL的无水MeCN以1:1:250的摩尔比例充分混合。将水热反应釜加热到100 ℃,保持20 h。反应完成后降至室温,过滤得到无色块状晶体,产率达83%。ESI-MS: m/z 377.0 [M]+. 1H NMR (400 MHz, DMSO-d6): δ 7.46 (d, J=8.8 Hz, 4H), 6.98 (d, J=8.8 Hz, 4H), 4.13 (s, 4H), 3.78 (s, 6H). IR (KBr, cm-1): 2959 (w), 2932 (w), 2835 (w), 1609 (m), 1513 (s), 1288 (s), 1253 (s), 1167 (m), 1027 (m), 833 (m), 553 (m). UV-visible (MeCN) λmax (logε) 208(4.77), 245 (4.52), 272 (4.29)。
[Cu(TU)2I] (2):在10 mL的聚四氟乙烯水热釜内胆中,将配体TU(120.6 mg,0.38 mmol),CuI (36.6 mg,0.19 mmol)和5 mL的无水MeCN以2:1:1 000的摩尔比例充分混合。将水热反应釜加热到100 ℃,保持20 h。反应完成后降至室温,过滤得到无色块状晶体,产率为73%。ESI-MS: m/z 691.1 [M]+. 1H NMR (400 MHz, DMSO-d6): δ7.47 (d, J=8.9 Hz, 4H), 6.97 (d, J=8.9 Hz, 4H), 4.11 (s, 4H), 3.77 (s, 6H). IR (KBr, cm-1): 2958 (w), 2931 (w), 2835 (w), 1609 (m), 1512 (s), 1286 (s), 1248 (s), 1169 (m), 1026 (m), 833 (m), 556 (m). UV-visible (MeCN) λmax (log ε) 208(4.94), 245 (4.73), 272 (4.29)。
[Cu(TU)2](BF4)(3):在10 mL的聚四氟乙烯水热釜内胆中,将配体TU(150.75 mg,0.48 mmol),[Cu(CH3CN)4](BF4) (75.4 mg,0.24 mmol)和5 mL的无水MeCN以2:1:400的摩尔比例混合。将水热反应釜加热到100 ℃,保持20 h。反应完成后降至室温,过滤得到无色块状晶体,产率为62%。ESI-MS: m/z 691.1 [M]+. 1H NMR (400 MHz, DMSO-d6): δ7.54~7.29 (m, 4H), 7.01 (d, J=8.9 Hz, 4H), 4.13 (s, 4H), 3.76 (s, 6H). IR (KBr, cm-1): 2960 (w), 2937 (w), 2836 (w), 1607 (m), 1513 (s), 1288 (m), 1251 (s), 1168 (m), 1060 (m), 834 (m), 556 (m). UV-visible (MeCN) λmax (log ε) 219 (4.72), 272 (4.57)。
[Cu(TU)2](PF6)(4):在10 mL的聚四氟乙烯水热釜内胆中,将配体TU(150.75 mg,0.48 mmol),[Cu(CH3CN)4](PF6) (90 mg,0.24 mmol)和2.5 mL的无水MeCN以2:1:200的摩尔比例混合。将水热反应釜加热到100 ℃,保持20 h。反应完成后降至室温,过滤得到无色块状晶体,产率为54%。ESI-MS: m/z 691.1 [M]+. 1H NMR (400 MHz, DMSO-d6): δ7.44 (d, J=8.8 Hz, 4H), 6.98 (d, J=8.8 Hz, 4H), 4.11 (s, 4H), 3.77 (s, 6H).IR (KBr, cm-1): 2960 (w), 2933 (w), 2837 (w), 1608 (m), 1514 (s), 1288 (m), 1251 (s), 1166 (m), 1029 (m), 843 (s), 556 (m). UV-visible (MeCN) λmax (log ε) 219 (4.68), 272 (4.53)。
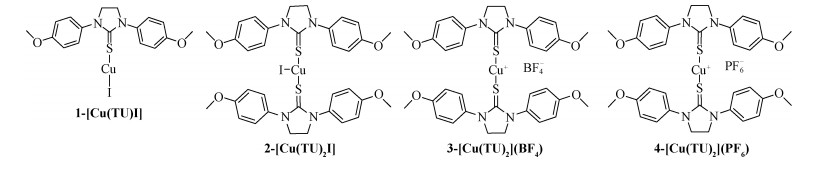
2 结果与讨论2.1 晶体结构分析我们通过X射线单晶衍射解析这4个化合物的单晶结构,并将数据存入剑桥晶体数据库(配合物1-CCDC 1840245,配合物2-CCDC 1840244,配合物3-CCDC 1840243,配合物4-CCDC 1840246)。配合物1-4的晶体结构如图 2所示,结构数据见表 1。配合物1的结构为正交晶系,Cmc21空间群,非中心对称。在其不对称单元中包含半个环硫脲配体,半个亚铜离子和半个碘离子。铜离子与2个硫原子和1个碘离子形成平面三角形配位环境。碘离子既作为阴离子起到平衡电荷的作用,又与铜离子形成配位键(图 2(a))。环硫脲配体的硫原子作为桥联配体链接2个铜离子,沿着c轴方向形成链状配位高分子。链与链通过苯环之间的π-π堆积作用形成三维结构(图 3)。Cu—S键长为2.203 ?,Cu—I键长为2.475 ?。通过调节反应物比例,可以得到单核配合物2,其不对称单元中含由两个环硫脲配体和一个铜离子以及一个碘离子。铜离子仍具有由两个硫原子和一个碘原子形成的平面三角形的配位环境,环硫脲配体没有作为桥联配体,从而形成的为单核化合物(图 2(b))。Cu-S键长分别为2.248和2.263 ?,Cu-I平均键长为2.491 ?,比配合物1相应键长略长。
Fig. 2
 | Download: JPG larger image |
| 图 2 配合物1-4的晶体结构图 Fig. 2 Crystal diagram of complexes 1-4 图 2 配合物1-4的晶体结构图 Fig. 2 Crystal diagram of complexes 1-4 --> | |
Fig. 3
 | Download: JPG larger image |
| 图 3 配合物1的链状结构三维图 Fig. 3 3D chain structure of complex 1 图 3 配合物1的链状结构三维图 Fig. 3 3D chain structure of complex 1 --> | |
Table 1
| 表 1 配合物1-4的晶体数据总结Table 1 Crystalline data of complexes 1-4 |
在配合物1, 2中碘离子均参与配位,如果采用含有配位能力弱的阴离子的亚铜盐与环硫脲进行反应,可以得到不同的结构。首先利用亚铜四氟磷酸根化合物进行反应,得到单核的亚铜配合物,不对称单元中含有1个亚铜离子与2个环硫脲配体,四氟硼酸根离子作为抗衡离子没有参与配位。与配合物1, 2不同的是,铜离子为二配位,与2个环硫脲配体的硫原子形成直线型的配位结构(图 2(c))。Cu—S键长为2.164 ?,比配合物1, 2中铜硫键键长略短。采用亚铜的六氟磷酸根化合物作为反应物在溶剂热条件下与环硫脲配体进行反应,得到配合物4。配合物4的不对称单元中含有半个铜离子和1个环硫脲配体,以及半个六氟磷酸跟离子(图 2(d))。铜离子的配位环境与配合物3相同,均为直线型二配位环境,Cu—S平均键长为2.169 ?。
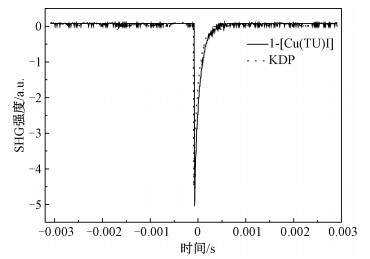
2.2 激光倍频效应由配合物1-4的晶体结构分析的结果可知,配合物2-4是中心对称结构,由于Kleinman的近似对称和晶体的中心对称性,其独立不可约的分张量为零,不具有二次谐波(SHG)效应。而配合物1作为非中心对称结构,通过中心金属铜与硫原子间的配位作用沿着c轴方向形成长链,且其配体是两端带有强推电子的共轭体系。这些因素促使化合物1可能具有较大的非线性效应。使用波长为1 064 nm的Nd:YAG激光光源对配合物1进行激光倍频效应(SHG)的测试。结果表明,配合物1具有SHG活性,使输出的光波长变为532 nm的绿色激光。使用KDP(磷酸二氢钾)作为基准物质进行对比,利用Kurtz-Perry方法[14]衡量配合物1的粉末样品的二阶非线性光学(NLO)性质(图 4)。结果表明,配合物1的SHG效应的响应活性是KDP的1.1倍,其可以用作二阶非线性材料,并通过改进溶剂热合成的方法高效地制备厘米级高质量的晶体。
Fig. 4
 | Download: JPG larger image |
| 图 4 [Cu(TU)I]与磷酸二氢钾的激光倍频效应比较 Fig. 4 Comparison of SHG effect between [Cu(TU)I] and potassium dihydrogen phosphate 图 4 [Cu(TU)I]与磷酸二氢钾的激光倍频效应比较 Fig. 4 Comparison of SHG effect between [Cu(TU)I] and potassium dihydrogen phosphate --> | |
2.3 光物理性质图 5为配合物3和4在室温下的固体的激发和发射光谱。分别在392或335 nm下激发,配合物3和4在517或520 nm处分别产生半峰宽较大的最大发射峰,其斯托克斯位移分别为125或185 nm。它们的发光衰减寿命按二次指数进行拟合,分别达到1.06, 32.58 μs和44.09, 95.95 μs,表明配合物3和4的发光性质为固体磷光。其中,配合物3和4的绝对量子产率较高,分别达到5.62%和1.57%。而配合物1和2在室温下,并没有检测到它们的发光信号。
Fig. 5
 | Download: JPG larger image |
| 图 5 室温下配合物3和4的固态激发和发射光谱 Fig. 5 Solid excitation and emission spectra of complexes 3 and 4 at room temperature 图 5 室温下配合物3和4的固态激发和发射光谱 Fig. 5 Solid excitation and emission spectra of complexes 3 and 4 at room temperature --> | |
3 总结基于环硫脲配体,通过调节反应物中亚铜化合物与配体的比例以及改变反应物中亚铜化合物的类型,我们设计并通过溶剂热方法合成4种基于环硫脲为配体的亚铜配合物,并通过X-射线单晶衍射分析得到它们的晶体结构。配合物1-2均为采用碘化亚铜作为反应物,当反应物中碘化亚酮与环硫脲配体的摩尔比为1:1时得到配合物1,环硫脲配体中的硫原子作为桥联配体链接相邻的两个亚铜离子形成具有一维链状结构的配位高分子;当反应物中碘化亚酮与环硫脲配体的摩尔比为1:2时得到配合物2,亚铜离子与2个环硫脲配体中的硫原子以及一个碘离子进行配位形成单核化合物。采用亚铜的四氟硼酸盐和六氟磷酸盐作为起始物与环硫脲配体进行反应时,得到配合物3-4。由于配合物3-4中阴离子的配位能力弱,只能作为抗衡离子,配合物3-4中铜离子的配位环境为二配位直线型。对具有非中心对称晶体结构配合物1的二阶非线性光学性质进行研究,发现其具有SHG活性,且其效应的响应活性是标准物质磷酸二氢钾的1.1倍,可用作非线性光学材料。在室温下,配合物3和4分别在517和520 nm处发固体磷光,具有作为磷光器件的潜质。
参考文献
| [1] | Arduengo A J, Harlow R L, Kline M A. A stable crystalline carbene[J]. J Am Chem Soc, 1991, 113(1): 361-363. Doi:10.1021/ja00001a054 |
| [2] | Wang M H, Scheidt K A. Cooperative catalysis and activation with N-heterocyclic carbenes[J]. Angew Chem Int Ed, 2016, 55(48): 14 912-14 922. Doi:10.1002/anie.201605319 |
| [3] | Wang F J, Liu L J, Shi M, et al. Chiral NHC-metal-based asymmetric catalysis[J]. Coord Chem Rev, 2012, 256(9/10): 804-853. |
| [4] | Hopkinson M N, Richter C, Schedler M, et al. An overview of N-heterocyclic carbenes[J]. Nature, 2014, 510(7506): 485-496. Doi:10.1038/nature13384 |
| [5] | Denk M K, Gupta S, Brownie J, et al. C-H activation with elemental sulfur:synthesis of cyclic thioureas from formaldehyde aminals and S-8[J]. Chem-Eur J, 2001, 7(20): 4 477-4 486. Doi:10.1002/1521-3765(20011015)7:20<4477::AID-CHEM4477>3.0.CO;2-I |
| [6] | Lobana T S, Sultana R, Butcher R J, et al. Chemistry of heterocyclic 2-thiones:in situ generation of 3-(2-thiazolin-2-yl)thiazolidine-2-thione and 1, 1'-dimethyl-2, 2'-diimidazolyl sulfide and their coordination to Cu-I and Cu-Ⅱ[J]. Eur J Inorg Chem, 2013, 29: 5 161-5 170. |
| [7] | Slivarichova M, Nunn J, Owen G R, et al. Two synthetic routes to Bis (1 methyl-imidazole-2-thione) methane and Bis (1-benzyl-imidazole-2-thione) methane complexes including sulfur atom insertion into copper-NHC bonds[J]. J Org Chem, 2017, 847: 224-233. Doi:10.1016/j.jorganchem.2017.05.015 |
| [8] | Yan K, Lok C N, Che C M, et al. Gold (I) Complex of N, N'-disubstituted cyclic thiourea with in vitro and in vivo anticancer properties-potent tight-binding inhibition of thioredoxin reductase[J]. Chem Commun, 2010, 46(41): 7 691-7 693. Doi:10.1039/c0cc01058h |
| [9] | Lin I W S, Lok C N, Che C M, et al. A silver complex of N, N'-disubstituted cyclic thiourea as an anti-inflammatory inhibitor of I kappa B kinase[J]. Chem Commun, 2013, 49(32): 3 297-3 299. Doi:10.1039/c3cc00063j |
| [10] | Yang D, Chen Y C, Zhu N Y. Sterically bulky thioureas as air- and moisture-stable ligands for Pd-catalyzed heck reactions of aryl halides[J]. Org Lett, 2004, 6(10): 1 577-1 580. Doi:10.1021/ol049697+ |
| [11] | Circu V, Ilie M, Neagoe I, et al. Luminescent cyclometallated platinum (Ⅱ) complexes with N-benzoyl thiourea derivatives as ancillary ligands[J]. Polyhedron, 2009, 28(17): 3 739-3 746. Doi:10.1016/j.poly.2009.08.015 |
| [12] | Giacco T D, Carlotti B, Elisei F, et al. Photophysics of aromatic thiourea derivatives and their complexes with anions. Fast and ultrafast spectroscopic investigations[J]. Phys Chem Chem Phys, 2010, 12(28): 8 062-8 070. Doi:10.1039/b927442a |
| [13] | 刘小琛, 卞祖强, 黄春辉, 等. 亚铜配合物的光致发光与电致发光研究[J]. 中国科学:化学, 2013, 43(4): 427-436. |
| [14] | Kurtz S K, Perry T T. A powder technique for the evaluation of nonlinear optical materials[J]. J Appl Phys, 1968, 39(8): 3 798-3 813. Doi:10.1063/1.1656857 |
