
I/R损伤是肝移植过程中常见的病理过程,与肝移植后早期的排斥反应以及肝功能障碍密切相关,经典的I/R损伤机制包括氧化应激、钙超载、微循环障碍和炎症。最新研究发现,线粒体功能障碍有可能是I/R发生的另一重要病理生理学机制。线粒体异常分裂(fission)可导致线粒体功能障碍,参与肝脏I/R损伤。Drp1是线粒体分裂的核心蛋白,磷酸化修饰和SUMO化修饰决定了其由胞浆向线粒体转位并促进线粒体分裂的重要作用,但在I/R过程中这两种修饰如何被精密调控尚不清楚。
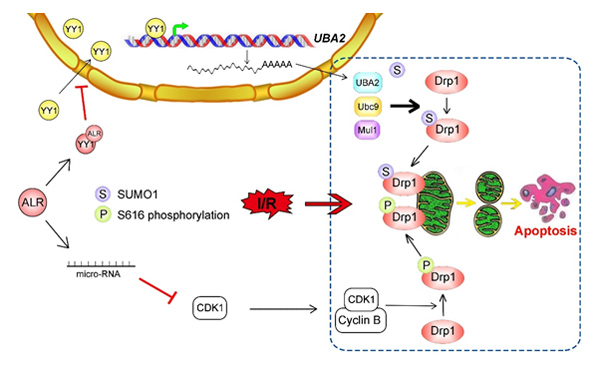
安威教授团队长期致力于肝脏损伤与修复研究,尤其关注ALR(亦称肝刺激因子Hepatic stimulator substance, HSS)抑制肝脏损伤的分子机制。课题组发现,在肝脏I/R过程中,Drp1的S616位磷酸化修饰和SUMO化修饰之间存在此消彼长,互为补偿的关系,交互性地(reciprocally)促使Drp1向线粒体的转移;利用Alr基因敲除小鼠模型,课题组通过体内外实验证实,在I/R过程中,ALR除了阻止Drp1的S616位磷酸化修饰外,ALR还能抑制Drp1的SUMO化修饰,减少Drp1向线粒体的转位,维持线粒体结构与功能的完整性。进一步的机制研究显示,ALR可与转录因子YY1结合,阻碍YY1的核转位,降低靶基因UBA2(编码SUMO激活酶-E1)的转录,进而抑制Drp1的SUMO化修饰。
上述结果是该课题组2017年底首次报道ALR通过CDK1抑制Drp1磷酸化、减轻肝细胞线粒体损伤及I/R进程(见Hepatology, 2017)之后的又一重大进展。该研究进一步明确了线粒体动态紊乱与I/R发生的关系,以及ALR作为肝脏特异性的保护因子,在维持线粒体稳态及对抗肝脏I/R损伤中的关键作用,为该类疾病的防治提供了可能新途径。
本研究得到国家自然科学基金(31771279)的资助。

安威,教授、博士生导师,首都医科大学基础医学院细胞生物学系主任,肝脏保护与再生调节北京市重点实验室主任。北京市优秀教学名师。长期从事肝脏保护与再生调节的细胞分子生物学机制。先后承担10项国家自然科学基金面上课题以及“863”和“973”课题各1项,在国际杂志发表论文70余篇。主编本科生教材《医学细胞生物学》(第1-4版,北京大学医学部出版社)和研究生教材《医学细胞生物学》(第3版,人民卫生出版社),参编教材多部。指导本科生参加全国基础医学创新大赛并多次获一等奖。获北京市科技进步奖2项。
