0 引言
【研究意义】大豆(Glycine max [L.] Merrill)是世界上重要的经济和粮食作物之一,也是中国的战略性物资。高温高湿、重金属等非生物胁迫是制约大豆生产,影响种子发育及品质的重要因子。中国南方春大豆在种子生理成熟期(R6期—R7期),常处于高温、多雨的季节,极易发生田间劣变,导致种子活力下降,严重制约了春大豆的生产[1,2]。另外,重金属污染也是当前不容忽视的污染问题之一,中国受重金属污染的耕地面积达2.0×107 hm2,约占全国耕地总面积的20%,造成粮食减产1.0×107 t[3]。重金属污染不仅严重影响作物生长发育,而且能够通过食物链危害人体健康[4]。Cu、Cd是当今污染较为严重与普遍的重金属,其对作物产生伤害的临界浓度普遍较低,即使较低浓度的胁迫也会影响作物生长发育,进而降低产量、影响品质[5]。而大豆是对Cu、Cd较为敏感的作物,Cu、Cd胁迫会影响大豆根系活力和植株形态,最终造成大豆减产[3,6]。因此,选育高活力的逆境耐受性大豆新品种尤为迫切。【前人研究进展】种子活力是衡量种子质量的一个综合指标,其与田间出苗率关系紧密,直接影响作物的产量和品质。一般情况下,当种子处于生理成熟期时,种子活力达到最大,随后由于老化或者受到环境因素等的影响,会出现不可逆转的质量下降变化,即种子劣变[7]。种子劣变后会导致种子贮藏力和种子质量下降,萌发及生长缓慢,发芽率、发芽指数和整齐率降低,严重时会导致生活力丧失,进而对生产造成严重损失[8,9]。高温高湿胁迫是导致春大豆种子田间劣变发生的重要因素之一[10]。然而,目前有关种子田间劣变的分子机制研究尚不够深入。本研究团队在大豆种子田间劣变抗性的机制研究方面取得了一定进展,WANG等[11]从92份春大豆地方品种和推广品种中筛选到了种子田间劣变抗性品种湘豆3号和不抗品种宁镇1号,并通过差异蛋白质组学技术发现GmSBH1经高温高湿胁迫后,在宁镇1号中显著上调表达;SHU等[12]研究表明,GmSBH1能够响应高温高湿胁迫,并参与种子活力形成;陶源[13]进一步以GmSBH1为诱饵蛋白,通过对大豆高温高湿酵母双杂交cDNA文库进行筛选,得到一个可能与之互作的大豆重金属相关域包含蛋白(Glycine max heavy-metal- associated domain-containing protein,GmHMADP)。目前,重金属域包含蛋白研究较多的主要是重金属ATP酶(heavy metal transporting ATPases,HMAs)与重金属相关异戊二烯植物蛋白(heavy metal- associated isoprenylated plant proteins,HIPPs)。研究表明,HMAs不仅能够转运一些必需金属离子(Cu+、Zn2+和Co2+),而且能够运输重金属离子(Cu2+、Cd2+和Pb2+)[14,15,16,17,18,19,20]。HIPPs是含有金属结合结构域(HMA)和C-端异戊二烯基序(CaaX)的金属伴侣。大量研究表明,HIPPs能够参与重金属的代谢和解毒、生物和非生物胁迫以及花和种子的发育[21,22,23]。【本研究切入点】目前,有关重金属域包含蛋白的研究主要集中在拟南芥和水稻等模式作物,在大豆中的研究较少。【拟解决的关键问题】本研究克隆大豆GmHMADP,对其编码的蛋白进行亚细胞定位,研究其在重金属Cu、Cd以及高温高湿胁迫下的表达水平及功能,以期为利用基因工程手段培育新的高活力的大豆抗性品种提供理论依据和实践基础。1 材料与方法
1.1 试验材料
试验于2015年9月至2017年12月进行。供试大豆材料为南京农业大学作物遗传与种植创新国家重点实验室麻浩教授课题组通过温箱蚀化法对92份南方春大豆地方品种和推广品种筛选得到的种子田间劣变抗性品种湘豆3号与不抗品种宁镇1号。试验所需大肠杆菌DH5α感受态细胞购自南京博尔迪生物技术公司;EHA105拟南芥遗传转化菌株由南京农业大学作物遗传与种质创新国家重点实验室保存;pMD19-T载体购自TaKaRa公司;植物瞬时表达载体pA7-GFP以及植物表达载体pBI121-GUS由南京农业大学作物遗传与种质创新国家重点实验室保存。1.2 总DNA和RNA的提取及cDNA的合成
以2周苗龄的大豆幼叶为材料,采用CTAB法提取基因组总DNA;参照新型植物总RNA提取试剂盒说明书提取大豆材料的RNA,并采用TaKaRa公司RTase M-MLV试剂盒合成第一链cDNA,保存备用。1.3 大豆GmHMADP的分离与氨基酸序列分析
根据NCBI公布的GmHMADP序列(GenBank登录号XM_006580986.1),利用Primer Premier 5.0软件设计引物(表1),分别以宁镇1号和湘豆3号幼叶的DNA和cDNA为模板,对应引物进行扩增。PCR体系及反应程序参照LIU等[24]方法进行。PCR产物经1.5%的琼脂糖电泳凝胶检测后回收,并与pMD19-T simple vector载体连接,转化大肠杆菌DH5α,挑取阳性克隆送至南京铂尚生物技术公司测序,并将正确的克隆命名为T-GmHMAD。并通过NCBI网站BLAST对同源性氨基酸序列进行搜索,并用DNAMAN软件分析不同来源氨基酸序列的相似性。Table 1
表1
表1本研究所用引物序列
Table 1Sequences of primers used in this study
| 引物名称 Primers name | 引物序列 Primers sequences (5'-3') | 用途 Function |
|---|---|---|
| GmHMADP-F | AGAAGTGAAAATAACAGCAAAAAGT | ORF分离 ORF isolated |
| GmHMADP-R | CACAGTACAGGTAACACAGGAAAGG | ORF分离 ORF isolated |
| qRT-GmHMADP-F | AAACAAGGTAAGGCAGCAA | 实时荧光定量PCR qRT-PCR |
| qRT-GmHMADP-R | AGTTTGGTTCTTAGACCGTTTA | 实时荧光定量PCR qRT-PCR |
| Actin-F | CCTCAACCCAAAGGTCAACAG | 大豆内参基因 Soybean endogenous control |
| Actin-R | GACCAGCGAGATCCAAACGAA | 大豆内参基因 Soybean endogenous control |
| PA7-GmHMADP-F | CATTTACGAACGATACTCGAGATGGGAGAGGAGGAAAAGA | 亚细胞定位 Subcellular localization |
| PA7-GmHMADP-R | CACCATCACTAGTACGTCGACCATGACAGTGCAGGCATTT | 亚细胞定位 Subcellular localization |
| PBI121- GmHMADP-F | GAGAACACGGGGGACTCTAGAATGGGAGAGGAGGAAAAGA | 转基因表达载体 Transgenic expression vector |
| PBI121 -GmHMADP-R | GGACTGACCACCCGGGGATCCCATGACAGTGCAGGCATTT | 转基因表达载体 Transgenic expression vector |
新窗口打开
1.4 GmHMADP的表达分析
大豆种子用次氯酸钠进行消毒,置于培养皿,25℃催芽2—3 d,随后将萌动的种子播种于装有营养土的花盆,置于室外自然条件下生长。生长至一节期(V1)时采集大豆植株的子叶、根、茎及叶;盛花期(R2)取花;盛荚期(R4)取幼荚和幼嫩的豆粒;完熟期(R8)取成熟的荚和成熟的豆粒,用于组织特异性表达分析。植株生长至种子生理成熟期(R7期)时,将植株转移至光照培养箱中进行高温高湿处理。处理:白天40℃、RH 100%、10 h/黑夜30℃、RH 70 %、14 h;对照:白天30℃、RH 75 %、10 h/黑夜20℃、RH 70 %、14 h。分别收获处理及对照组0、6、12、24、48、96和168 h的种子,用于高温高湿胁迫下的表达模式分析。大豆种子消毒后,播种于1/2 MS固体培养基于光照培养箱中培养7 d,将发芽的种子转移至水培营养液中固定生长,培养7 d后,将长势一致的幼苗分别移至含有0(空白对照)、50、100和200 μmol·L-1的CuSO4与CdCl2的水培营养液中,培养处理24 h。每个处理各选取10棵大豆幼苗的根系用于Cu、Cd胁迫下的表达模式分析。所有样品迅速用液氮冷冻5 min,于-80℃冰箱保存备用。qRT-PCR参照WANG等[10]方法进行,所有试验均设置3次独立的生物学重复。
1.5 GmHMADP蛋白的亚细胞定位
以T-GmHMAD为模板扩增回收目的片段,用限制性内切酶XhoⅠ和SalⅠ酶切载体pA7-GFP,采用同源重组法将目的基因构建到pA7-GFP表达载体上,获得35S::GmHMAD-GFP融合蛋白表达载体。取新鲜幼嫩的烟草叶片平铺在MS培养基上,22℃培养3—4 h。采用PDS-1000/He基因枪(Bio-Rad)转化烟草叶片的叶肉细胞,黑暗条件下23℃培养12—16 h,于激光共聚焦显微镜下观察GFP蛋白表达信号。1.6 拟南芥转化及转基因纯合植株的获得
用限制性内切酶XbaⅠ和BamHⅠ酶切植物表达载体pBI121-GUS,通过同源重组法获得pBI121- GmHMADP::GUS重组质粒,并采用农杆菌介导法转化野生型拟南芥(WT)。经筛选鉴定得到3个GmHMADP过表达阳性株系HMADP-1、HMADP-3和HMADP-6,分别收获纯合的T3代转基因种子进行功能分析试验。1.7 GmHMADP转基因纯合T3拟南芥的胁迫处理及表型分析
将纯合的GmHMADP过表达株系HMADP-1、HMADP-3和HMADP-6以及野生型拟南芥种子播种于MS培养基,生长14 d后移至含有营养土和蛭石的花盆中,待黄熟期置于高温高湿下处理2 d,以正常生长条件下的植株作对照。待种子收获后,处理组和对照组的拟南芥种子分别取100粒点播于MS培养基上,播种后第1天至第7天,每天记录种子的发芽数,统计种子发芽率、发芽势、发芽指数、活力指数及平均发芽天数。此外,将野生型拟南芥种子和GmHMADP过表达株系T3代种子分别播种于含有1 μmol·L-1 CuSO4、CdCl2的MS培养基上,生长6 d后,将部分幼苗分别转移至含有50 μmol·L-1 CuSO4、CdCl2的MS培养基上,继续培养生长10 d,观察植株的表型,并统计分析幼苗的主根长以及干重,根长与干重均以30株计算。所有试验均设置3次重复。1.8 数据处理
利用软件DPS进行方差(ANOVA)分析,检测差异显著性。2 结果
2.1 GmHMADP的分离与氨基酸序列分析
分别以湘豆3号和宁镇1号的cDNA为模板,利用特异性引物(表1)进行PCR扩增,得到1条996 bp的条带,经测序发现该基因的cDNA序列在2个品种间没有差异。进一步分别以湘豆3号和不抗品种宁镇1号叶片DNA为模板进行PCR扩增,得到1814 bp的GmHMADP的DNA序列,将测序得到的cDNA与DNA序列进行比对,发现GmHMADP由4个外显子和3个内含子组成(图1-A)。通过NCBI网站对GmHMADP进行BLASTP搜索,并将与其相似性高的大豆(Glycine max,KRH54159.1)、赤豆(Vigna angularis,XP_017420608.1)、绿豆(Vigna radiata,XP_014500166.1)和狭叶羽扇豆(Lupinus angustifolius,XP_019464718.1)进行比对,发现仅有大豆(Glycine max,KRH54159.1)的氨基酸序列相似性最高,达99%。同时,这些蛋白均含有HMA结构域,并且具有2个金属离子结合位点特征序列CXXC(图1-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1GmHMADP结构示意图及GmHMADP与其他物种氨基酸序列多重比对
A:GmHMADP结构示意图,黑色方框为外显子,线条代表内含子;B:GmHMADP与其他物种氨基酸序列多重比对,Ⅰ、Ⅱ代表CXXC motif(金属离子结合位点特征序列)
-->Fig. 1Schematic representation of the gene structures GmHMADP and multiple alignment of the GmHMADP amino acid sequences and other plants
A: Schematic representation of the gene structures GmHMADP,The black box indicates the extron, line indicates the intron; B: multiple alignment of the GmHMADP amino acid sequences and other plants,Ⅰ,Ⅱ indicates theCXXC motif (heavy metal binding core motif)
-->
2.2 GmHMADP的亚细胞定位
利用基因枪介导法将构建的融合表达载体35S:: GmHMADP-GFP和35S::GFP分别转入烟草叶肉细胞,并对烟草叶肉细胞中的GFP蛋白信号进行观察,发现35S::GmHMADP-GFP融合蛋白信号分布在细胞核与细胞膜上,且分别与核Marker蛋白mCherry和膜Marker蛋白pm-ck CD3-1001信号重合(图2)。结果表明,GmHMADP编码的产物定位于细胞核与细胞膜上。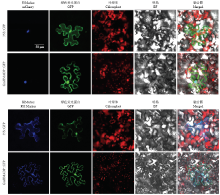 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2GmHMADP在烟草叶肉细胞中的亚细胞定位
-->Fig. 2Subcellular localization of GmHMADP protein in N.benthamiana mesophyll cells
-->
2.3 GmHMADP的组织表达分析
为了解GmHMADP在大豆不同组织器官中的表达特性,分别调查GmHMADP在湘豆3号和宁镇1号2个品种中根、茎、叶、花、子叶、发育中的荚、成熟的荚、发育中的种子以及成熟的种子中的表达情况。qRT-PCR结果表明,GmHMADP在2个品种的各组织器官中均有表达,且在发育中的种子和成熟的种子中表达量较高(图3)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3大豆不同组织器官中GmHMADP的相对表达量
-->Fig. 3The relative expression of GmHMADP gene in different soybean organs
-->
2.4 大豆种子发育过程中GmHMADP的表达特性
组织表达研究表明,GmHMADP在种子中表达量较高,因此进一步对GmHMADP在湘豆3号和宁镇1号的种子发育过程中的表达水平进行了检测。结果表明,在2个品种的种子发育过程中,GmHMADP总体呈先上升后下降的表达趋势,且在花后40 d表达量达到最高(图4)。以上结果表明,GmHMADP可能参与了种子发育过程。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4大豆种子发育过程中GmHMADP的相对表达量
-->Fig. 4The relative expression of GmHMADP gene in developing soybean seed
-->
2.5 高温高湿胁迫下GmHMADP的表达特性
大豆植株在种子生理成熟期经高温高湿胁迫处理后,在不抗品种宁镇1号种子中,GmHMADP在胁迫处理48、96和168 h时表达量显著(P<0.01)上升(图5-A),而在抗性品种湘豆3号中,该基因在处理24、48、96和168 h时表达量显著(P<0.01)上升(图5-B)。以上结果表明,GmHMADP响应了高温高湿胁迫,并推测其可能参与了春大豆种子田间劣变抗性过程。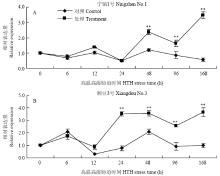 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5高温高湿胁迫下的大豆种子中的GmHMADP的相对表达量
A:宁镇1号;B:湘豆3号。**代表极显著水平差异(P< 0.01)。下同
-->Fig. 5The relative expression of GmHMADP gene in soybean seeds under HTH stress
A: Ningzhen No.1; B: Xiangdou No.3. ** indicate that the differences are significant at 0.01 level. The same as below
-->
2.6 Cu、Cd胁迫下GmHMADP的表达特性
为了进一步研究GmHMADP对重金属胁迫的响应特征,通过qRT-PCR技术对不同浓度CuSO4、CdCl2处理24 h的大豆幼苗中的GmHMADP进行表达模式分析。在宁镇1号幼苗的根中,50 μmol·L-1 CuSO4和200 μmol·L-1 CdCl2胁迫下GmHMADP表达量显著(P<0.01)高于对照;在抗性品种湘豆3号中,不同浓度CuSO4、CdCl2胁迫处理后,GmHMADP表达量均显著(P<0.01)上调(图6-A与图6-B)。表明GmHMADP受Cu2+和Cd2+的诱导表达,推测其可能参与重金属Cu和Cd的胁迫。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6不同浓度CuSO4和CdCl2处理下的大豆幼苗根中的GmHMADP的相对表达量
-->Fig. 6The relative expression of GmHMADP gene under different concentration of CuSO4 and CdCl2 stress in soybean seedling roots
A:CuSO4;B:CdCl2
-->
2.7 高温高湿胁迫下GmHMADP过表达拟南芥种子的活力分析
研究表明,正常生长条件下收获的WT和GmHMADP过表达植株的种子在第7天的发芽率均能达到90%以上,且均能正常生长成为幼苗,而在高温高湿环境下收获的各个株系种子的发芽率均有所下降,但GmHMADP过表达拟南芥株系的下降幅度最小,情况优于WT(图7-A);表2显示,在高温高湿环境中收获的WT和GmHMADP过表达植株种子发芽势、发芽指数以及活力指数均明显低于在正常生长环境中收获的种子,但GmHMADP过表达株系种子的发芽势、发芽指数和活力指数均显著(P<0.01)优于WT;而且胁迫后GmHMADP过表达植株种子的平均发芽天数明显(P<0.01)较WT种子短。结果表明,GmHMADP过表达株系的种子活力显著高于野生型。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7高温高湿胁迫对拟南芥种子发芽率的影响
A和B:对照条件下与经高温高湿处理条件下的种子发芽率
-->Fig. 7Effect on germination percentage of Arabidopsis seeds under HTH stress
A, B: Germination percentage of the developing seeds harvested from the wild type and transgenic line plants under the control (A) and HTH stress (B)
-->
Table 2
表2
表2高温高湿处理对拟南芥种子萌发特性的影响
Table 2The Effect of HTH stress on germination of Arabidopsis seeds
| 处理类型 Treatment type | 株系 Lines | 发芽势 Germination potential (%) | 发芽指数 Germination index | 活力指数 Vitality index | 平均发芽天数 Average germination days (d) |
|---|---|---|---|---|---|
| 对照Control | WT | 99±1A | 124.20±1.49AB | 106.53±0.88B | 4.79±0.01C |
| HMADP-1 | 97±1A | 120.61±0.85B | 107.27±2.98B | 4.82±0.01C | |
| HMADP-3 | 99±1A | 125.44±2.46A | 112.41±1.66A | 4.78±0.02C | |
| HMADP-6 | 99±1A | 125.38±1.32A | 109.23±0.64AB | 4.77±0.02C | |
| 处理Treatment | WT | 29±2D | 21.12±1.72E | 13.30±1.15E | 5.44±0.05A |
| HMADP-1 | 49±2C | 38.59±2.01D | 23.38±1.05D | 5.34±0.03B | |
| HMADP-3 | 58±1B | 46.24±0.69C | 27.99±0.63C | 5.34±0.02B | |
| HMADP-6 | 56±2B | 42.24±1.11D | 26.04±0.78CD | 5.35±0.01B |
新窗口打开
2.8 Cu、Cd胁迫下GmHMADP过表达拟南芥的耐性分析
研究表明,经过1 μmol·L-1 CuSO4处理后,GmHMADP过表达拟南芥株系幼苗的根长均长于WT,且过表达株系HMADP-2和HMADP-3达到显著水平(P<0.05);50 μmol·L-1 CuSO4处理下GmHMADP过表达拟南芥株系的根长均显著(P<0.01)长于WT(图8-A、图8-C和图8-E);经过1和50 μmol·L-1 CdCl2处理后,GmHMADP过表达株系的根长均显著(P<0.01)长于WT(图8-B、图8-D和图8-F)。通过对GmHMADP过表达拟南芥株系以及WT植株幼苗的干重进行测定,结果表明,低浓度与高浓度的CuSO4和CdCl2胁迫下,GmHMADP过表达拟南芥株系的干重均显著(P<0.05)高于WT(图8-G和图8-H)。以上结果表明,GmHMADP在拟南芥中过表达能够提高对Cu、Cd胁迫的抗性。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8不同浓度CuSO4、CdCl2对拟南芥幼苗的根长与干重的影响
A、C和E:不同浓度CuSO4对拟南芥幼苗的根长的影响;B、D和F:不同浓度CdCl2对拟南芥幼苗的根长的影响;G和H:不同浓度CuSO4和CdCl2对拟南芥幼苗的干重的影响;拟南芥植株于1 μmol·L-1 CuSO4或CdCl2生长6 d后移至50 μmol·L-1 CuSO4或CdCl2继续培养10 d。Bar=1 cm;*代表显著水平差异(P< 0.05)
-->Fig. 8Effect on root length and dry weight(DW) of Arabidopsis seedlings under different concentration of CuSO4 and CdCl2
A, C and E: Effect on root length of Arabidopsis seedlings under different concentration ofCuSO4 stress; B, D and F: Effect on root length of Arabidopsis seedlings under different concentration of CdCl2; G, H: Effect on dry weight of Arabidopsis seedlings under different concentration of CuSO4(G) and CdCl2 (H); Plants were grown on MS media with 1 μmol·L-1 CuSO4 or CdCl2 for 6 days and then transferred to the media containing 1 or 50 μmol·L-1 CuSO4 or CdCl2 for 10 days, respectively. Bar=1 cm. * indicate that the differences are significant at 0.05 level
-->
3 讨论
本研究分离了大豆重金属相关域包含蛋白基因GmHMADP,并通过氨基酸多重序列比对发现其含有HMA保守结构域,而且具有2个金属离子结合位点特征序列CXXC。含有重金属相关结构域(heavy- metal-associated domain,HMA)的蛋白能够通过与细胞内各种酶和辅因子结合完成金属离子的时空运输,从而对重金属转运、解毒起重要作用[25]。表明GmHMADP可能与含有HMA结构域的基因在植物生命活动中发挥相似的功能。已有研究表明,含有HMA结构域的HMAs家族蛋白多定位于细胞膜与液泡膜,参与重金属的转运[26,27,28];HIPPs家族蛋白多定位于细胞核,参与冷害、盐害和干旱等非生物胁迫[21-23,29]。此外,南京农业大学作物遗传与种质创新国家重点实验室前期研究表明,可能与GmHMADP发生互作的GmSBH1蛋白定位于细胞核[12,13]。本研究亚细胞定位结果显示GmHMADP编码的蛋白定位于细胞核与细胞膜上,由此推测,GmHMADP与GmSBH1可能在细胞核上发生互作,并在重金属转运及非生物胁迫响应等方面发挥着作用,但需进一步研究验证。目前,关于含有HMA结构域基因的组织特异性表达分析表明,大麦HvHMA1在籽粒中的表达量较高,其参与谷物萌发期和灌浆期糊粉层细胞中Cu2+和Zn2+的运输[15]。水稻OsHMA2不仅在根尖成熟区表达[30,31],同时也在花序、花药、雌蕊、子房和胚芽中表达,能够参与花序形成过程中及种子成熟阶段Zn2+的运输[32]。也有研究发现拟南芥AtHIPP3参与生物胁迫以及花和种子的发育[23]。本研究基因组织特异性表达结果显示GmHMADP在种子中大量表达,表明GmHMADP可能参与种子发育。此外,本研究通过对高温高湿胁迫下该基因在大豆种子中的表达模式进行分析,发现GmHMADP在转录水平上响应高温高湿胁迫,与SHU等[12]研究中的可能与GmHMADP互作的GmSBH1蛋白在高温高湿胁迫下的表达趋势基本一致,由此推测GmHMADP可能通过与GmSBH1的互作协同响应高温高湿胁迫。另外,本研究中高温高湿胁迫处理后收获的GmHMADP过表达拟南芥植株种子的发芽率、发芽势、发芽指数以及活力指数均明显优于野生型拟南芥,且过表达株系种子的平均发芽天数明显缩短,表明GmHMADP过表达可提高拟南芥的种子活力。
镉的移动性强、毒性高,其位居“五毒重金属”(汞、镉、铅、铬、砷)第二位[33]。植物受到镉胁迫,呼吸和光合作用受到影响,植株生长发育受到抑制,导致植株生物量下降,干质量减轻[34]。研究发现,镉胁迫能够抑制大豆、绿豆等豆科作物种子的萌发[35,36]。而铜是中国第四大农田重金属污染源[37],过量时能够增强活性氧的产生,造成细胞损伤,影响植株生长,尤其是对根的生长有明显的抑制作用,最终造成产量下降[6,38]。KULIKOVA等[6]研究表明,随着铜浓度的增高,铜对大豆根生长的抑制率逐渐升高,当铜含量达到50 μmol·L-1时,根部生长完全停止。因此,对大豆抗铜、镉胁迫分子机制的研究尤为重要。由于土壤中的Cu和Cd通常以离子态或络合态进入植物体内,从而对植物产生毒害[3],因此本研究以含有CuSO4和CdCl2的水培营养液对大豆幼苗处理24 h,qRT-PCR结果表明,在不同浓度的Cu2+、Cd2+处理下,湘豆3号幼苗根中GmHMADP的表达量均显著增加;而宁镇1号品种中,仅在50 μmol·L-1 CuSO4和200 μmol·L-1 CdCl2处理下GmHMADP表达量显著增加。以上试验结果表明GmHMADP在转录水平上能够响应Cu和Cd胁迫。同时,本研究发现GmHMADP的cDNA序列在2个品种间并没有差异,但经Cu、Cd处理后在宁镇1号和湘豆3号2个品种中该基因表达存在明显差异,那么这种现象究竟是由什么原因造成的呢?前人研究表明,启动子序列差异影响下游基因表达[39,40]。因此,推测该结果可能是由于该基因上游启动子序列在2个品种间存在一定差异,这仍需进一步研究验证。另外,VERRET等[33]研究发现,在Zn、Cd和Co的毒害下,AtHMA4过表达促进了拟南芥根系的生长,增强了植株对重金属胁迫的抗性。本研究通过对CuSO4、CdCl2处理下GmHMADP过表达拟南芥植株的根长以及干重的研究,发现CuSO4、CdCl2处理下转基因拟南芥植株的根长以及干重均显著高于野生型,表明GmHMADP可提高植株对Cu、Cd胁迫的耐受性。
4 结论
克隆获得GmHMADP,其cDNA全长996 bp,由4个外显子和3个内含子组成。GmHMADP蛋白定位于细胞核与细胞膜。GmHMADP的表达具有较高的组织特异性,在种子中表达量最高;同时,该基因的表达受高温高湿和Cu、Cd胁迫的影响。GmHMADP能够提高拟南芥的种子活力以及对Cu、Cd胁迫的耐性。The authors have declared that no competing interests exist.
