0 引言
【研究意义】果蔬贮藏保鲜不仅能够满足人们日益增长的消费需求,而且可显著降低因腐败变质造成的资源浪费,对提高经济效益和缓解环境压力具有重大意义。涂膜材料来源广泛、成本低,且对呼吸跃变型果实有良好的贮藏效果,具有一定应用前景。随着人们安全环保意识的增强,对涂膜材料的安全性提出了更高层次的要求[1,2]。壳聚糖广泛存在于虾、蟹等甲壳类动物的甲壳质中,是一种通过β-D-(1-4)糖苷键连接而成的2-乙酰胺基-2-脱氧-D-吡喃葡萄糖链节的线型聚合物[3],具有良好的生物相容性、可降解性、再生性、抗菌防腐性及成膜性等优点[4],可作为涂膜制备的一种优质材料。此外,苹果多酚是一种安全的食源性添加剂,具有很强的氢离子供给能力,对活性氧自由基具有较好的清除作用,有提高涂膜溶液抗氧化能力的潜在价值[5,6]。【前人研究进展】目前国内外关于壳聚糖及其衍生物对水果的涂膜保鲜作用已有少量报道。例如,洪克前等[7]和王香爱等[8]用壳聚糖溶液对采摘后的芒果进行涂膜处理,结果表明,该涂膜剂可显著减少果实水分散失,能够较好地保持果实硬度,且显著降低病果率。国外方面,GAY2A等[9]分别以果胶和壳聚糖为原料制备液体涂膜剂,并对草莓进行涂膜保鲜处理,结果发现,该涂膜溶液可有效延缓草莓果实软化,防止水分流失,使草莓货架期从6 d延长至15 d。REN等[10]将玉米淀粉和壳聚糖混合制备出一种活性包装膜,这种包装薄膜具有良好的溶解性、总色差和拉伸强度,而且加入玉米淀粉后能够显著降低壳聚糖薄膜的水蒸气透过率。ROBLEDO等[11]将10%麝香草酚纳米乳与壳聚糖混合,对圣女果进行涂膜保鲜试验,结果表明,该涂膜剂对接种在圣女果表面的霉菌有显著的抑制效果。ASHRFI等[12]研究表明,加入普洱茶可以明显提高壳聚糖可食膜抗菌能力,延长牛肉货架期,增强该膜抑制脂质氧化的能力。由此看出,与单一的壳聚糖薄膜相比,复合壳聚糖薄膜具有更高的机械强度、抗氧化能力及更好的包装性能。然而,国内外大多相关研究集中在大分子多糖对壳聚糖溶液特性及其保鲜作用影响,对小分子物质,如苹果多酚对壳聚糖溶液理化特性的影响尚未报道。【本研究切入点】尽管国内外对壳聚糖在食品保鲜方面进行了深入的研究,但苹果多酚对壳聚糖涂膜溶液的理化特性及膜液体系中分子间产生的相互作用尚未进行。因此,对苹果多酚-壳聚糖复合膜液特性的进一步研究显得尤为重要。【拟解决的关键问题】本研究以苹果多酚和壳聚糖为原料,制备不同多酚添加量的复合膜液,并通过研究不同复合膜液的抗氧化活性、流变学特性及热稳定性等,以期为该复合膜液在食品包装和果蔬保鲜方面的应用提供理论依据和参考。1 材料与方法
试验于2016年11月至2017年7月在陕西师范大学食品工程与营养科学学院进行。1.1 材料与主要试剂
苹果,品种为秦冠,采摘自陕西省西安市礼泉县。儿茶素、原花青素、绿原酸、表儿茶素、芦丁、槲皮素、槲皮苷、4-羟基苯甲酸、咖啡酸、没食子酸、根皮苷和金丝桃苷均购自美国Sigma公司,均为色谱纯;乙腈、甲醇购自美国Fisher公司,为色谱纯;DPPH(1,1-二苯基-2-三硝基苯肼)自由基购自美国Sigma公司,为分析纯;溴化钾购自美国Sigma Aldrich公司,为光谱纯;TBA(2-硫代巴比妥酸)购自美国TEDIA 公司,为分析纯;壳聚糖,脱乙酰度90%购自上海蓝吉科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Thermo高效液相色谱仪,美国热电公司;MS7-H550-S型磁力搅拌器,美国SCILOGEX公司;Tensor27红外光谱仪,德国Bruker;FE20 Plus pH计,上海梅特勒-托利多仪器有限公司;LGJ-18C真空冷冻干燥机,北京四环科学仪器厂;7200可见分光光度计,上海龙尼柯仪器有限公司;AR-G2流变仪,美国TA公司;粉末X射线衍射仪,德国Bruker;热分析系统,美国TA公司。1.3 方法
1.3.1 苹果多酚的提取及组分的检测 苹果多酚采用SUN等[13]的方法进行制备。采用Thermo Ultimate 3000 UPLC对苹果多酚的含量进行分析[14]。1.3.2 苹果多酚-壳聚糖复合膜液制备 配制浓度为5%(w/v)的壳聚糖溶液,搅拌均匀。加入1.0%(v/v)的醋酸和30%(w/w)山梨糖醇[15]。精确称量不同质量的苹果多酚,少量蒸馏水溶解后,将多酚溶液分别加入至壳聚糖溶液中,搅拌至体系完全混匀。最终得到苹果多酚浓度分别为0、0.5%、1.0%、1.5%的苹果多酚-壳聚糖复合膜液。以不加苹果多酚做对照。
1.3.3 不同添加量的苹果多酚对复合膜液pH值的影响 复合膜液pH采用FE20 Plus pH计进行测量[15],每个样品测定3次。
1.3.4 复合膜液剪切流变特性测定 采用AR-G2流变仪测定复合膜液剪切流变学特性。取约2 mL膜液置于流变仪样品台上,采用直径为40 mm的平板进行测试。在0—800 s-1剪切速率范围内记录复合膜液黏度变化情况。测试温度为25℃,平板与样品台间距为1 mm[16]。
根据Ostwald和Dewaele提出的流变特性方程τ=K·εn对试验数据点进行回归拟合。式中,τ为剪切应力(Pa);K为稠度系数(Pa·s),黏度越高,K值也越高;n为流变特性指数;ε为剪切速率(1·s-1)。当n=1时,流体为牛顿流体,其黏度不随ε的变化而变化;当n<1时,流体为非牛顿假塑性流体,其黏度随ε的增大而下降;当n>1时,流体为非牛顿胀塑性流体,其黏度随ε的增大而增大[17]。
1.3.5 复合膜液频率振荡扫描测定 为确定复合膜液的线性黏弹区,需先对复合膜液进行应力扫描[18]。取2 mL复合膜液置于流变仪样品台上,在0—100%应变范围内进行扫描,记录复合膜液的线性黏弹区。随后,在0.1%应变条件下,在0.1—100 rad·s-1频率范围,对复合膜液进行频率振荡扫描测试,记录弹性模量G′和黏性模量G″。测试温度为25℃,平板直径为40 mm,平板与样品台间距为1 mm。
1.3.6 复合膜液DPPH自由基清除能力的测定 取10 µL复合膜液于离心管中,分别加入9 mL DPPH-甲醇溶液(0.05 mg·mL-1),涡旋振荡30 s,避光30 min,517 nm波长下测定吸光度值,记为A1。用超纯水代替样品作为空白组A0,用甲醇代替DPPH-甲醇溶液作为对照组A2。用BHT(2,6-二叔丁基-4-甲基苯酚)作为对照参比。按以下公式计算样品对DPPH自由基的清除率[19,20]:
C= [1-(A1-A2)/A0] ×100%
1.3.7 复合膜液抑制脂质氧化能力的测定 采用硫代巴比妥酸(TBA)比色法测定复合膜液抑制脂质氧化的能力[21,22]。
取1 mL脂质体和200 μL复合膜液于离心管中,涡旋振荡混匀,加入1 mL 50 mmol·L-1 FeSO4溶液,用PBS定容至5 mL。37℃水浴40 min。分别加入2 mL 10% TCA溶液和1.0 mL 0.8% TBA溶液,涡流振荡混匀,100℃水浴中敞盖煮沸15 min,冷却至室温,在5 000×g条件下离心10 min,取上清液,于532 nm波长下测定吸光度值A1。用PBS代替样品溶液设置空白组A0,用PBS代替FeSO4溶液设置对照组A2。用BHT(2,6-二叔丁基-4-甲基苯酚)作为对照参比。按以下公式计算对脂质过氧化的抑制率:
C= [1-(A1-A2)/A0] ×100%
1.3.8 复合膜液总还原能力的测定 复合膜液总还原能力采用普鲁士蓝法测定[23]。取0.2 mL复合膜液,加入0.4 mL 0.2 mol·L-1磷酸缓冲溶液(PBS,pH6.7)及0.4 mL 1% K3Fe(CN)6溶液于离心管中,振荡混匀,50℃水浴20 min,10%三氯乙酸溶液加入0.4 mL,混匀,在5 000×g条件下离心10 min。取上清液0.1 mL,加入1.0 mL蒸馏水和0.5%三氯化铁溶液0.2 mL,混匀。室温静置10 min,700 nm处测定其吸光度值。用BHT作为对照参比。吸光度值越高,代表样品还原能力越强[24]。
1.3.9 复合膜液OH自由基清除能力的测定 复合膜液OH自由基清除能力测定采用Fenton法[25]。取7.5 mmol·L-1FeSO4溶液3 mL于具塞试管中,加入1%H2O2 溶液3 mL,振荡摇匀,加入6 mmol·L-1水杨酸溶液3 mL,混匀,37℃水浴15 min,冷却至室温。在510 nm处测定吸光度值A0。取1 mL复合膜液分别加入试管,混匀,水浴15 min,测定吸光度值Ax。以不加H2O2溶液作为空白对照,测定吸光度值Ax0。用BHT作为参比对照。按以下公式计算OH自由基清除率:
OH自由基清除率(%)=[A0-(AX-AX0)]/A0
1.3.10 红外光谱测定 将不同多酚添加量的复合膜液采用真空冷冻干燥48 h后,采用红外光谱仪对冻干样品进行红外光谱分析。称取少量样品(约5 mg)和100 mg KBr混合研磨、压片,在4 000—400 cm-1范围内进行扫描,每个样品扫描32次,以扫描波数为横坐标,以样品透光率为纵坐标绘图[26]。
1.3.11 X射线衍射光谱检测 采用D8 Advance型X射线衍射仪对冻干样品进行结晶性能测定[27]。扫描速度为5°·min-1,扫描范围(2θ)为10°—35°。
1.3.12 热稳定性的测定 取5 mg冻干样品放置标准铝盘内,升温速率为10℃·min-1,温度范围为25— 400℃。所有样品测定3次,采用TA Universal Analysis软件进行结果分析[27]。
1.4 数据分析
试验数据采用Origin 8.0和Microsoft Excel 2010软件分析处理。采用Duncan′s new multiple range法,利用DPS软件进行显著性分析,取P<0.05为显著性差异,P<0.01为极显著性差异。2 结果
2.1 HPLC法检测苹果多酚组分
根据1.3.1的色谱条件,取20 μL多酚的混合标样进行检测,得到多酚标准品的高效液相色谱图,见图1-A。在相同试验条件下,取20 μL苹果多酚样品溶液进行检测,得到样品的高效液相色谱图,见图1-B。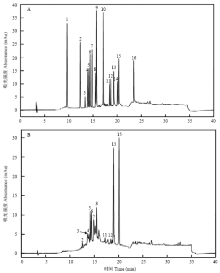 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1多酚混合标准品(A)和AP(B)高效液相色谱图
色谱峰:1.没食子酸,2.原儿茶酸,3.表没食子儿茶素,4.儿茶素,5.原花青素B2,6.绿原,7.4-羟基苯甲酸,8.表儿茶素,9.咖啡酸,10.表儿茶素没食子酸酯,11.芦丁,12.金丝桃苷,13.鞣花酸,14.槲皮苷,15.根皮苷,16.槲皮素
-->Fig. 1HPLC chromatogram of standard mixture(A) and AP(B)
Individual peaks: 1.gallic acid, 2.protocatechuic acid, 3.epigallocatechin, 4.catechin, 5.procyanidin B2, 6.chlorogenic acid, 7.4-hydroxybenzoic acid, 8.Epicatechin, 9.caffeic acid, 10.epicatechin gallate, 11.rutin,12.hyperin, 13.ellagic acid, 14.quercitin, 15.phloridzin, 16.meletin
-->
由苹果多酚样品的高效液相色谱图(图1-B)可以看出,检测到11种多酚,与标准品的高效液相色谱图(图1-A)对照,其中根皮苷(Phloridzin)、鞣花酸(Ellagic acid)、原花青素B2(Procyanidin B2)、表没食子儿茶素(Epigallocatechin)、表儿茶素(Epicatechin)、绿原酸(Chlorogenic acid)、儿茶素(Catechin)、4-羟基苯甲酸(4-hydroxybenzoic acid)、芦丁(Rutin)、原儿茶酸(Protocatechuic acid)、金丝桃苷(Hyperin)的保留时间分别是20.107、18.970、14.178、13.642、15.492、14.408、13.912、14.913、18.415、12.575、18.697 min。图1-A和1-B所示,标准品和样品的分离度均较好,没有干扰峰出现。在多酚样品的高效液相色谱图中(图1-B),根皮苷有较高的吸收峰,其含量为21.22±0.79%。由表1可知,检测到的11中多酚含量占样品总量的68.6%,表明该苹果多酚样品的纯度较高。
Table 1
表1
表1AP成分及含量
Table 1Composition and content of AP
| AP中单酚种类 Mono-phenol in AP | 含量 Content (%) |
|---|---|
| 根皮苷 Phloridzin | 21.22±0.79 |
| 鞣花酸 Ellagic acid | 10.11±0.24 |
| 原花青素B2 Procyanidin B2 | 9.29 ±0.05 |
| 表没食子儿茶素 Epigallocatechin | 7.86±0.18 |
| 表儿茶素 Epicatechin | 7.38±0.03 |
| 绿原酸 Chlorogenic acid | 4.60±0.12 |
| 儿茶素 Catechin | 3.20±0.01 |
| 4-羟基苯甲酸 4-hydroxybenzoic acid | 2.59±0.81 |
| 芦丁 Rutin | 1.07±0.01 |
| 原儿茶酸 Protocatechuic acid | 0.41±0.11 |
| 金丝桃苷 Hyperin | 0.33±0.21 |
新窗口打开
2.2 不同苹果多酚添加量对复合膜液pH的影响
壳聚糖是一种含氨基的弱碱性多糖,可溶于酸性水溶液,难溶于水[28]。因此配制壳聚糖复合膜液时,通常添加少量乙酸促进壳聚糖溶解,使得壳聚糖溶液显酸性。由图2可知,对照组的pH为4.30,当苹果多酚添加量为0.5%时,复合膜液的pH降低至4.10(P<0.05)。当多酚添加量为1.5%时,膜液的pH为4.28,与对照组无显著差异(P<0.05)。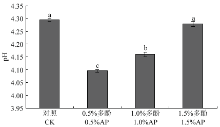 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同多酚添加量对复合膜液pH的影响
误差线代
-->Fig. 2Effects of polyphenol concentrations on the pH of the composite membrane liquids
Error bars represent the standard deviation of three biological replicates. Lowercase letters indicate statistically significant difference at P<0.05
-->
2.3 不同苹果多酚添加量的复合膜液静态流变特性
由图3可知,不同多酚添加量的复合膜液均表现出剪切变稀的流变学行为,即膜液表观黏度随剪切速率增大而降低。在剪切速率0的条件下,对照组膜液的初始表观黏度为47 Pa·s,当苹果多酚添加量为0.5%时,复合膜液的初始表观黏度上升至60 Pa·s;随着苹果多酚添加量的继续增加,复合膜液的初始表观黏度继续增大。当剪切速率由0增加至200 s-1时,不同苹果多酚添加量的复合膜液表观黏度均呈快速降低的趋势。然而,剪切速率从200 s-1增至800 s-1时,复合膜液的表观黏度呈缓慢降低趋势,最终稳定在5 Pa·s左右,表明较高剪切速率对复合膜液的表观黏度影响较小。此外,随着剪切速率增加,不同多酚浓度的复合膜液剪切应力均呈现迅速增加再逐渐趋于平缓的趋势。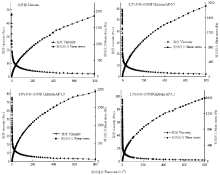 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同多酚添加量对复合膜液静态流变特性的影响
-->Fig. 3Effects of polyphenol concentrations on the static rheological properties of the complex membrane liquids
-->
表2结果显示,各拟合方程中R2均大于0.99,表明该模型拟合程度较高。不同苹果多酚添加量的复合膜液的流动指数均小于1,为非牛顿假塑性流体。而且随着苹果多酚添加量增大,复合膜液的稠度指数K呈增大趋势,而流动指数n呈减小趋势,说明苹果多酚添加量越高,复合膜液黏稠性越大,假塑性流体的特征越明显。
Table 2
表2
表2不同多酚添加量的复合膜液流变特性参数
Table 2Static rheological properties of composite membrane fluids with different polyphenols
| 流变方程 Rheological equation | τ= Kεn | ||
|---|---|---|---|
| K | n | R2 | |
| 壳聚糖 Chitosan | 27.326 | 0.6694 | 0.9913 |
| 0.5%多酚壳聚糖Chitosan-AP-0.5 | 30.340 | 0.6537 | 0.9971 |
| 1.0%多酚壳聚糖Chitosan-AP-1.0 | 37.352 | 0.6331 | 0.9962 |
| 1.5%多酚壳聚糖Chitosan-AP-1.5 | 40.739 | 0.5711 | 0.9978 |
新窗口打开
2.4 不同苹果多酚添加量的复合膜液动态流变特性
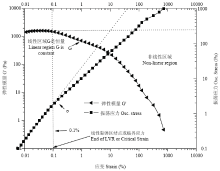
苹果多酚和壳聚糖溶液混合均匀后可形成黏稠状的液体,该液体同时表现出黏性和弹性的特征[29]。因此,本文进一步研究了该膜液的动态流变特性。由图4可知,该膜液在0.1%应变范围内具有良好的弹性特征,剪切应力与应变呈现较好的线性关系,因此频率扫描应在0.1%应变范围内进行。由图5可知,随着扫描频率增加,不同多酚添加量的复合膜液G′和G″均呈上升趋势。当多酚添加量为0时,在整个频率扫描范围内膜液G″总高于G′,表明该膜液黏性特征高于弹性特征。然而,当多酚添加量增加至0.5%和1.0%时,在频率0.1—9 rad·s-1内,复合膜液的G″略高于G′;当频率增至10 rad·s-1时,G″有所降低,但仍高于G′,表明在此频率范围内,复合膜液黏性特性大于弹性特性。当多酚添加量增至1.5%时,在频率0.1—1rad·s-1范围内,复合膜液G′略高于G″,说明复合膜液的流变特性逐渐由黏性转为弹性。此外,当频率从1 rad·s-1逐渐增至100 rad·s-1,复合膜液的G′高于G″,说明在此频率范围内,复合膜液的弹性特性大于黏性特性,流动性降低。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4复合膜液的应力-应变关系
-->Fig. 4Stress-strain relationship of composite membrane fluid
-->
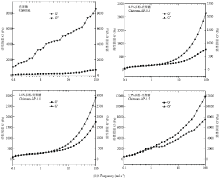 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同多酚添加量对复合膜液动态流变特性的影响2.5 不同苹果多酚添加量对复合膜液抗氧化活性的影响
-->Fig. 5Effect of polyphenol concentrations on the dynamic rheological properties of the composite membrane liquids
-->
苹果多酚具有良好的抗氧化活性,能起到明显的抑菌作用[30]。如图6-A所示,随着苹果多酚添加量增加,膜液DPPH自由基清除率呈显著增加趋势(P<0.01)。当苹果多酚添加量为1.5%时,膜液的DPPH自由基的清除率达94.3%,而同等浓度的 BHT溶液对DPPH自由基的清除率为84.8%,低于复合膜液的DPPH清除能力。如图6-B所示,随着多酚添加量的增加,复合膜液的脂质氧化抑制率呈显著上升趋势(P<0.01)。当多酚添加量为1.0%时,膜液的脂质氧化抑制率为85.6%。当添加量达到1.5%时,膜液的脂质氧化抑制率高达95.9%。如图6-C所示,随着多酚添加量增加,复合膜液总还原力也呈显著上升趋势(P<0.01)。当多酚添加量为1.5%时,膜液的总还原力最大,且高于同等浓度的BHT溶液的总还原力。如图6-D所示,随着苹果多酚添加量的增加,膜液的OH自由基清除率呈显著增加趋势(P<0.01)。
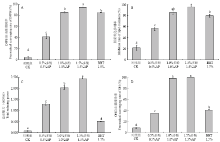 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6不同多酚添加量对复合膜液抗氧化活性的影响
A:DPPH自由基清除率;B:脂质氧化抑制率;C:总还原力;D:OH自由基清除率
-->Fig. 6Effect of polyphenol concentrations on the antioxidant capacity of the complex membrane liquids
A: Free radical scavenging rate of DPPH; B: Inhibition rate of lipid oxidation; C: Total reducing power; D: Free radical scavenging rate of OH
-->
2.6 复合膜液红外光谱分析
红外光谱法可分析复合膜液中多酚和壳聚糖分子之间的相互作用力及存在形式。由图7可知,苹果多酚、壳聚糖及不同复合膜液红外光谱曲线均在在3 500 cm-1和3 000 cm-1之间出现较宽的吸收峰,这是多酚中O-H的伸缩振动峰和壳聚糖中-NH的伸缩振动峰重合叠加的多重吸收峰。随着多酚添加量增加,复合膜液在3 400 cm-1处的宽峰有轻微扁平趋势,而且此处的吸收峰出现轻微的红移。在2 940 cm-1处的伸缩振动峰是C-H的振动吸收峰。在1 650、1 545、1 398和1 100 cm-1处的吸收峰分别是C=O、N-H、C-N和C-O-C的伸缩振动吸收峰,而且1 545 cm-1处的N-H吸收峰有轻微的减弱。随着苹果多酚加入,1 245 cm-1处的吸收峰明显减弱,这表明苹果多酚与壳聚糖之间产生了分子间相互作用。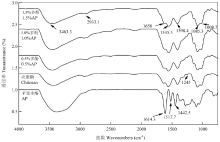 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7不同多酚添加量对复合膜液红外光谱的影响
-->Fig. 7Effect of polyphenol concentrations on the infrared spectroscopy of the complex membrane liquids
-->
2.7 复合膜液X-ray分析
天然多糖通常不能形成明显的结晶,但在适宜的条件下,能够以微晶态形式存在[31]。壳聚糖复合膜的晶体结构主要存在3种形式:非晶体结构,无水结晶结构和水合结晶结构。由图8-A可知,在对照组,主要有4个衍射峰,衍射角(2θ)分别为11.3°、18.6°、22.2°和29.2°。在11.3°处的衍射峰是无水结晶,在18.6°处的衍射峰是水合结晶,而22.2°处的衍射峰是壳聚糖的特征衍射峰。如图8-B所示,苹果多酚在2θ为10°—80°范围内无明显的吸收峰,仅有少量小峰存在,说明苹果多酚在常态下不能形成单晶,为无定形状态。由图8-C可知,随着多酚添加量增加,11.2°、18°和22.2°处的衍射峰均明显变小,表明复合膜液的结晶度有所降低,当多酚添加量为1.5%时,衍射峰完全消失。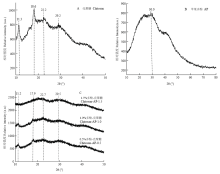 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8X衍射图
A:壳聚糖;B:苹果多酚;C:不同多酚添加量的复合膜液
-->Fig. 8X-RAD diffraction patterns
A: Chitosan; B: Apple Polyphenol (AP); C: Composite membrane fluid with different polyphenols concentrations
-->
2.8 不同苹果多酚添加量对复合膜液热稳定性的影响
由图9可知,对照组和不同多酚添加量的复合膜液质量损失可分为3个阶段[32,33]。当温度在50℃到100℃之间时,主要是样品中自由水蒸发,样品有轻微的失重现象。在此阶段,由表3可知,对照组和不同复合膜液的失重率为7%—12%。样品在100℃—200℃温度范围内进行第二阶段的质量损失。在此阶段,主要是样品中结合水或其他挥发性物质的损失,失重率为15%—18%。随着多酚添加量的增加,第二阶段的失重率逐渐减小。不同苹果多酚添加量的复合膜液的主要失重率发生在第三阶段。在此阶段温度达到280℃左右,复合膜液质量急剧降低,失重率最大达到50%。但添加多酚后,复合膜液在第三阶段的质量损失低于对照组。由图9-B可知,对照组3个阶段的质量损失温度分别为50.8℃,110.7℃和269.9℃。然而,由图9-C、9-D和9-E可知,苹果多酚的引入使复合膜液在这3个阶段的温度均有所上升。Table 3
表3
表3不同温度范围内复合膜液的失重率
Table 3Weight loss rate of composite membrane fluid in different temperature range (%)
| 样品 Samples | 第一阶段失重率 The first weight loss stage(50-100℃) | 第二阶段失重率 The second weight loss stage(100-200℃) | 第三阶段失重率 The third weight loss stage (200-400℃) | 残留量 The residual mass (at 400℃) |
|---|---|---|---|---|
| AP | 9.51±0.01 | — | 18.09±0.05 | 68.89±0.05 |
| Chitosan | 11.35±0.03 | 18.19±0.04 | 50.05±0.69 | 22.67±0.06 |
| Chitosan-AP-0.5 | 11.27±0.11 | 17.32±0.10 | 46.12±0.09 | 25.32±0.07 |
| Chitosan-AP-1.0 | 10.37±0.02 | 17.27±0.03 | 46.79±0.00 | 25.52±0.48 |
| Chitosan-AP-1.5 | 7.86±0.06 | 15.65±0.33 | 42.17±0.23 | 34.76±0.02 |
新窗口打开
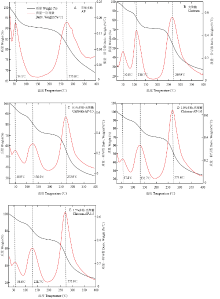 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9不同多酚添加量的复合膜液的热分析曲线
-->Fig. 9TG-DTG curve of the composite membrane liquids with different polyphenol concentrations
-->
3 讨论
本研究以5%的壳聚糖溶液为基质,以苹果多酚为添加剂制备出一种复合膜液,并研究了不同苹果多酚添加量对复合膜液抗氧化性、流变学性质的影响。据研究报道,壳聚糖分子结构中含有的羟基和酚羟基可以与超氧阴离子自由基之间产生相互作用,抑制氧化反应进程,因此使壳聚糖溶液具有一定的抗氧化活性[34,35]。然而,单纯的壳聚糖溶液抗氧化性较弱,不能对涂膜果蔬起到较好的保鲜效果。因此,将苹果多酚[36]加入壳聚糖溶液中提高复合膜液的抗氧化性无疑是提高复合膜液抗氧化性的重要途径。本文研究发现,随着多酚添加量的增加,壳聚糖膜液的抗氧化性逐渐升高,当多酚添加量为1.5%时,复合膜液DPPH自由基清除率、脂质氧化抑制率和OH自由基清除率高于与同等浓度条件下的的BHT溶液,表明向壳聚糖溶液中添加苹果多酚是提高复合膜液抗氧化性的有效途径。多酚作为一种天然小分子物质,含有相当数目的酚羟基,可以和壳聚糖分子之间形成明显的氢键作用[37]。本文研究发现,加入苹果多酚后,复合膜液在3 400 cm-1处的红外吸收峰出现明显红移,可能是由于苹果多酚中的-OH和壳聚糖分子中的-OH或者-NH2产生氢键相互作用,这与PENG等[38]的研究结果基本一致。此外,苹果多酚和壳聚糖分子之间没有产生新的伸缩振动峰,也没有观察到明显的波长位移,表明苹果多酚和壳聚糖之间并没有共价键生成[39,40,41]。壳聚糖是一种天然高分子多糖,其溶液表现出非牛顿流体的剪切稀化效应[42],当体系中加入多酚时,与壳聚糖分子形成氢键,可改变壳聚糖复合膜液的流变特性。本文研究发现,不同多酚添加量的复合膜液均表现出剪切变稀行为,即随剪切速率增加,复合膜液表观黏度逐渐降低,最终趋于平稳。然而,多酚添加量不同,复合膜液的流变学行为也有略微差异。例如,当苹果多酚添加量为1.5%时,复合膜液动态流变特性由黏性模量主导转变为弹性模量主导,表明该膜液流变学弹性特征高于黏性特征[43,44]。壳聚糖分子和苹果多酚之间的氢键除了影响复合膜液的流变学性质外,还影响壳聚糖分子的结晶特性。苹果多酚的引入,明显降低壳聚糖的结晶度,这可能是由于多酚和壳聚糖分子之间的氢键改变了壳聚糖分子之间的作用力,干扰了壳聚糖分子结晶的形成。有研究表明,某些大分子多糖加入到壳聚糖体系中,也会引起复合膜X射线衍射图谱的改变。例如,土豆淀粉的-OH和壳聚糖中-NH2形成分子间氢键,阻碍了壳聚糖分子链的相互作用,使得壳聚糖结晶不易形成,甚至出现无定形状态[45]。从复合膜液的pH也可以看出,正是因为苹果多酚中的-OH与壳聚糖中-NH2产生相互作用,束缚了复合膜液体系中H+的释放,导致H+浓度降低,水溶液呈酸性的苹果多酚加入到壳聚糖溶液中,只会引起复合膜液体系的pH短暂降低,当苹果多酚添加量增加时,pH逐渐上升。壳聚糖在酸性溶液中长时间存放会发生分子长链的部分水解[15],分子间缠联结构降解,导致复合膜液黏度降低,因此苹果多酚的引入提高了复合膜液体系的pH,这对后续加工及膜液成膜具有十分重要的价值。
由于苹果多酚和壳聚糖分子之间的氢键作用,壳聚糖的热稳定性也有所增加。本文研究发现,壳聚糖质量损失过程分为3个阶段,在100℃主要是由游离水蒸发引起质量损失[46],在200℃内的质量损失主要由结合水损失引起[47],在第三阶段主要是由多糖分子解聚引起多糖分解而引起[48,49]。本文通过对壳聚糖进行热分析,发现苹果多酚的引入促使多酚与壳聚糖形成了分子间作用力,提升了多糖初始分解温度,这与MATHEW[45]等的研究结果一致。
4 结论
苹果多酚纯度为68.6%,加入到5%(w/v)壳聚糖溶液中,随着苹果多酚添加量的增加,显著提高复合膜液的初始表观黏度(P<0.01),增强膜液的假塑性流体特征。当苹果多酚添加量为1.5%时,使膜液的动态流变特性由黏性转变为弹性,流动性降低。苹果多酚添加量为1.5%时,复合膜液的抗氧化活性高于同等浓度条件下的BHT溶液(P<0.01)。此外,红外光谱和X射线衍射结果表明,苹果多酚添加量为1.5%的复合膜液体系中存在大量氢键,促使分子间形成相互作用,降低壳聚糖结晶度,从而提升复合膜液的热稳定性。The authors have declared that no competing interests exist.
