0 引言
【研究意义】土壤盐碱化已经成为限制植物生长和产量的主要非生物因子之一[1],随着盐碱面积的不断扩大,如何有效利用和改良盐碱土地资源成为亟待解决的重大问题。大量的研究发现土壤中的盐分分布存在空间异质性[2,3],即土壤中的盐分在较小的区域范围内,可以从低浓度到高出海水盐分几倍的范围内变化,同一株植物的根系可能会处于不同的盐分梯度下[4]。但是目前对于盐胁迫的研究,主要集中于均匀盐分对植物的影响[5],不均匀盐分对植物的影响研究相对较少。已有的研究发现,与均匀的盐分处理相比,不均匀盐胁迫可以缓解盐分对植物的伤害[6,7,8,9,10]。研究表明,盐生植物能够在高出海水浓度几倍的盐土中维持生长,其中土壤盐分的不均匀分布起到了重要作用,因为在控制试验下,植物在均匀的高浓度盐土中不能存活[4]。此外,DONG等[11]通过建立盐碱地定向诱导盐分不均匀分布的犁沟播种种植技术,显著提高了棉花在盐碱地的成苗率。因此,研究植物在不均匀盐分下的响应是对均匀盐分下植物生理的一个重要补充。紫花苜蓿是一种全球性广泛栽培的牧草,素有“牧草之王”的美称[12]。同时,紫花苜蓿属于中等耐盐碱的植物,具有调节土壤酸碱性的作用[13]。但当盐胁迫环境NaCl浓度达到50—200 mmol·L-1时,会显著抑制紫花苜蓿的生长和产量[14]。加强紫花苜蓿耐盐机制的研究和耐盐品种的选育,对盐碱地的开发利用有重要的意义。【前人研究进展】盐胁迫对植物造成的直接危害首先表现为渗透胁迫,影响水分的吸收利用,并且持续存在[5]。植物需要产生一系列的耐性机制来抵抗盐胁迫造成的不利影响。在不均匀盐胁迫下,处于低盐胁迫环境下的部分根系可以进行补偿吸水以满足或部分满足植物对水分的需求[6-9, 15-16]。植物在受到渗透胁迫后还会产生脯氨酸、甜菜碱、可溶性糖等渗透调节物质[17,18]或者通过植物组织中无机离子的积累[5,6]对逆境下的植物进行渗透调节,但在不均匀盐胁迫下渗透调节物质的作用还需进一步验证。其次,盐胁迫的另一个不利影响表现为离子失调引起的离子毒害和营养元素的亏缺。高浓度的Na+会降低植物的光合作用[19],还会与其他营养元素竞争,导致营养失衡,特别是对K+的影响,抑制K+参与的重要生理代谢过程,进而影响植物生长发育[5, 20]。因此降低Na+在植物地上部分的积累,保持较高的K+/Na+是植物重要的耐盐机制之一[21]。对大洋洲滨藜(Atriplex nummularia)[8]和棉花(Gossypium hirsutum)[9]的研究发现,与均匀盐胁迫处理相比,不均匀盐胁迫处理下叶片具有较低的Na+浓度和较高的K+浓度,说明不均匀盐胁迫有利于植物对地上部分离子的调控,保持较高的K+/Na+。而对紫花苜蓿(Medicago sativa)的研究发现,叶片Na+浓度的降低只在低盐胁迫部分根系所处环境NaCl浓度为0的不均匀盐胁迫中发现,当低盐胁迫NaCl浓度为75 mmol·L-1时,叶片Na+浓度与均匀盐胁迫无显著差异,并且盐胁迫处理对植物叶片中的K+浓度影响不大[6]。此外,盐胁迫还会引起氧化胁迫导致膜质过氧化,细胞膜透性发生改变,进而引起植物生长发育和形态建成的改变[22,23]。【本研究切入点】相较于均一盐胁迫环境下的植物耐盐生理机制研究,不均匀盐胁迫对植物生长发育、离子调控、氧化损伤等方面的影响和耐受机制还需要进行探讨。【拟解决的关键问题】本试验以紫花苜蓿为研究对象,采用分根装置将植物的根系分为两部分,设置无盐胁迫、不均匀盐胁迫和均匀盐胁迫处理,通过测定其植株生长速率、地上生物量、地下生物量、水分吸收、叶绿素含量、离子浓度、膜质过氧化程度等指标,了解不均匀盐胁迫对紫花苜蓿生长特性的影响。1 材料与方法
1.1 材料培养与胁迫处理
供试紫花苜蓿品种为“中苜一号”,由中国农业科学院北京畜牧兽医研究所提供。选取均匀一致的紫花苜蓿种子,用70%的酒精表面消毒30 s后,置于5%的次氯酸钠溶液中浸泡15 min,最后用蒸馏水反复冲洗4—5次。将种子播种于灭菌的湿砂中,7 d后待幼苗根系长度5 cm左右时,选取均匀一致的幼苗剪去根尖(5 mm),以促进其侧根生长,便于后面的分根试验。参照SUN等[6]的培养和分根方法,用宽约2 cm的海绵包裹幼苗置于0.1倍的营养液中培养4 d,更换为0.5倍的营养液中培养7 d,在1倍的营养液中进一步培养4 d后选择长势一致的幼苗移到分根装置中。营养液组成及浓度为:2.5 mmol·L-1 Ca(NO3)2、2.5 mmol·L-1 KNO3、1 mmol·L-1 MgSO4、0.5 mmol·L-1 (NH4)H2PO4、0.1 mmol·L-1 EDTA-FeNa、0.2 µmol·L-1 CuSO4、1 µmol·L-1 ZnSO4、20 µmol·L-1 H3BO3、0.005 µmol·L-1 (NH4)6Mo27O4和1 µmol·L-1 MnSO4。分根装置由两个0.35 L的塑料杯和一块中间带有圆孔的泡沫板组成,植物根系穿过圆孔固定于泡沫板上,将植物的根系分为均匀的两部分,分别置于两个塑料杯中,以便通过调节杯中的NaCl浓度使各半根系处于不同的盐胁迫条件下。植物幼苗在分根装置中培养5 d后进行胁迫试验。试验共分为14个处理,包括:无盐胁迫(0/0);一半根系无盐胁迫、另一半根系环境NaCl浓度分别为100、150、200、250 mmol·L-1的不均匀盐胁迫系列(0/S,分别记为0/100、0/150、0/200和0/250);一半根系环境NaCl浓度为50 mmol·L-1、另一半根系环境NaCl浓度分别为100、150、200、250 mmol·L-1的不均匀盐胁迫系列(50/S,分别记为50/100、50/150、50/200和50/250)以及两边根系环境NaCl浓度相同的均匀盐胁迫系列(S/S:50/50、100/100、150/150、200/200和250/250);“/”两边数值代表各半根系所处环境的盐胁迫状况,以NaCl浓度mmol·L-1表示。每个处理18个重复。为避免盐分震荡,所有幼苗的盐分浓度分别以每隔24 h增加12.5,25,37.5,50,62.5 mmol·L-1 NaCl的梯度增加,直到4 d后分别达到最终浓度。试验于2017年5月在人工气候室中进行,光/暗周期为16 h/8 h,温度为白天25℃/夜晚20℃,空气相对湿度为白天55%/夜晚90%。
1.2 指标测定
1.2.1 植物生长指标的测定 植物接受胁迫15 d后进行取样,分别取植物地上部分、左右两侧根系,在95℃烘箱中杀青30 min后,65℃中烘干48 h至恒重,分别测定其地上部分及两侧根系的干重。测量胁迫前及胁迫15 d后紫花苜蓿的主茎高度,计算其生长速率。1.2.2 水分吸收的测定 所有分根装置中的营养液体积均为350 mL,每3 d更换一次营养液。更换营养液时及胁迫15 d后用量筒测量装置中的剩余营养液体积,并设置无植物培养的装置计算营养液蒸发量,最终计算得出植物水分吸收量。
1.2.3 叶片Na+、K+离子含量的测定 取0.1 g植物干样品,于HNO3溶液中酸化过夜后进行微波消解(CEM,Matthews,NC,USA),植物组织中的离子浓度用电感耦合等离子体发射光谱仪(ICP-OES,Optima 8000;Perkin Elmer,Waltham,MA,USA)进行测定,每个处理4次重复。
1.2.4 生理指标的测定 采用Arnon的丙酮提取法测定叶绿素(chlorophyll,Chl)含量[24];采用硫代巴比妥酸法测定丙二醛(malondialdehyde,MDA)含量[25];采用酸性茚三酮比色法测定脯氨酸(proline,Pro)含量[26],每个处理5次重复。
1.3 数据分析
采用SPSS 19.0进行方差分析和t检验,用Sigmaplot 12.0进行作图。2 结果
2.1 对紫花苜蓿生长速率及生物量的影响
均匀的高盐胁迫对紫花苜蓿生长速率的抑制作用大于不均匀盐胁迫。与处理0/0相比,处理0/100、0/150、0/200和0/250的植株生长速率分别下降了15.50%、13.13%、14.64%和28.55%。而均匀的盐处理100/100、150/100、200/200和250/250植株生长速率则分别下降了14.83%、48.82%、66.00%和84.78%。处理0/100与处理100/100的植株生长速率差异不显著,但随着胁迫端盐浓度的增加,不均匀胁迫对生长速率的作用效果显著增加(P<0.05)。处理0/150的植株生长速率是150/150的1.7倍、处理0/200是200/200的2.4倍、处理0/250是250/250的4.7倍(图1-A)。与处理50/50相比,50/150、50/200和50/250的植株生长速率分别下降3.40%、18.28%和26.99%,而处理150/150、200/200和250/250相比处理50/50则分别下降38.49%、59.14%和81.70%(图1-B)。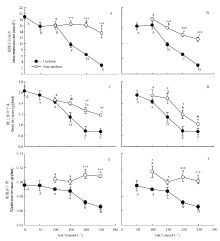 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同盐胁迫对紫花苜蓿植株生长速率(A,B)、地上生物量(C,D)及总的地下生物量(E,F)的影响
全填充圆点表示均匀的盐胁迫处理(0/0、50/50、100/100、150/150、200/200、250/250),空心圆点表示不均匀盐胁迫处理(0/100、0/150、0/200、0/250(A,C,E)和50/100、50/150、50/200、50/250(B,D,F))。*,**,***表示均匀高盐胁迫处理与不均匀盐胁迫处理在P<0.05,P<0.01和P<0.001差异显著。不同大写字母表示均匀盐胁迫处理间差异显著(P<0.05),不同小写字母表示不均匀盐胁迫处理间差异显著P<0.05。下同
-->Fig. 1Response of the stem extension rate (A, B), shoot dry mass (C, D) and root dry mass (E, F) of alfalfa to different salt stress
Uniform salt treatments (0/0, 50/50, 100/100, 150/150, 200/200, 250/250) are indicated by full fill circle and non-uniform salt treatments (0/100, 0/150, 0/200, 0/250 (A, C, E) and 50/100, 50/150, 50/200, 50/250 (B, D, F)) by hollow circle.*, **, ** indicate significant difference between uniform high salt stress treatment and non-uniform salt stress treatment at P<0.05, P<0.01, P<0.001. The different capital letters indicate significantly different between uniform salt treatments (P<0.05), the different lowercase letters indicate significantly different between non-uniform salt treatments (P<0.05). The same as below
-->
均匀胁迫处理150/150、200/200和250/250下紫花苜蓿的地上生物量显著低于0/0处理(P<0.05),与之相比分别降低29.59%、45.34%和46.14%。不均匀盐胁迫处理0/150、0/200和0/250比均匀的150/150、200/200、250/250处理地上生物量分别提高了21.98%、42.57%和35.02%(图1-C)。50/150、50/200、50/250处理与150/150、200/200、250/250处理相比地上生物量分别提高了30.00%、34.12%和15.47%(图1-D)。
与处理0/0相比,处理50/50、100/100、150/150的整株植物根系生物量无显著差异,而200/200和250/250的根系生物量显著降低(P<0.05),分别比0/0降低了25.07%和31.59%(图1-E)。0/100、0/150、0/200、0/250的无盐胁迫部分根系生物量比0/0的一半根系生物量分别增加39.00%、36.50%、60.50%和62.00%。处理50/100、50/150、50/200、50/250的低盐胁迫部分根系生物量比50/50处理的一半根系生物量分别增加43.14%、25.00%、50.49%和56.37%。同时,不均匀盐胁迫环境下低胁迫一侧根系的生物量显著高于高胁迫一侧根系的生物量(P<0.05)(表1)。0/200、0/250、50/200和50/250处理的整株植物根系生物量显著高于200/200、250/250处理(P<0.05)(图1-E,F)。
Table 1
表1
表1不同盐胁迫处理对紫花苜蓿根系生物量的影响
Table 1Response of the root dry mass of alfalfa to different salt stress
| NaCl处理 NaCl treatment (mmol·L-1) | 植株根系生物量 Root dry mass (g/plant) | |
|---|---|---|
| A侧/B侧 Side A/Side B | A侧根系生物量 Dry mass of side A root system | B侧根系生物量 Dry mass of side B root system |
| 0/0 | 0.050±0.0064d | 0.046±0.0036a |
| 50/50 | 0.051±0.0036d | 0.044±0.0062a |
| 100/100 | 0.044±0.0026de | 0.046±0.0031a |
| 150/150 | 0.047±0.0036d | 0.041±0.0021abc |
| 200/200 | 0.035±0.0011ef | 0.037±0.0027abcd |
| 250/250 | 0.034±0.0013f | 0.032±0.0028cde |
| 0/100 | 0.070±0.0030bc | 0.034±0.0018bcd*** |
| 0/150 | 0.068±0.0022bc | 0.033±0.0025bcd*** |
| 0/200 | 0.080±0.0034a | 0.030±0.0025de*** |
| 0/250 | 0.081±0.0020a | 0.027±0.0005de*** |
| 50/100 | 0.073±0.0042abc | 0.042±0.0038ab** |
| 50/150 | 0.064±0.0025c | 0.037±0.0015bcd*** |
| 50/200 | 0.077±0.0037ab | 0.030±0.0028de*** |
| 50/250 | 0.080±0.0026a | 0.022 ±0.0026e*** |
新窗口打开
2.2 不均匀盐胁迫对紫花苜蓿水分吸收的影响
在均匀的盐胁迫下,随着盐浓度的升高,紫花苜蓿整株植物的水分吸收呈现下降趋势(图2)。与100/100、150/150、200/200、250/250处理相比,不均匀盐胁迫0/100、0/150、0/200、0/250处理整株植物的水分吸收分别是前者的1.3、1.3、2.2和6.1倍。50/100、50/150、50/200、50/250处理整株植物的水分吸收分别是均匀胁迫的1.5、1.6、2.9和6.3倍,均达到显著水平(P<0.05)(图2)。在0/S系列处理中,0处理一端的根系吸水占整株植物吸水量的80%—92%,50/S系列处理中,50一端的根系吸水占整株植物吸水量的70%—88%。处于不均匀盐胁迫环境下的两半根系水分吸收量差异极显著(P<0.001)(表2)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同盐胁迫对紫花苜蓿总水分吸收的影响
全填充圆点表示均匀的盐胁迫处理(0/0、50/50、100/100、150/150、200/200、250/250),空心圆点表示不均匀盐胁迫处理(0/100、0/150、0/200、0/250(A)和50/100、50/150、50/200、50/250(B))
-->Fig. 2Response of the whole plant water uptake of alfalfa to different salt stress
Uniform salt treatments (0/0, 50/50, 100/100, 150/150, 200/200, 250/250) are indicated by full fill circle and non-uniform salt treatments (0/100, 0/150, 0/200, 0/250 (A) and 50/100, 50/150, 50/200, 50/250 (B) ) by hollow circle
-->
Table 2
表2
表2不同盐胁迫处理对紫花苜蓿根系水分吸收的影响
Table 2Response of the root water uptake of alfalfa to different salt stress
| NaCl处理 NaCl treatment (mmol·L-1) | 植株根系水分吸收 Plant water uptake (mL) | |
|---|---|---|
| A侧/B侧 Side A/Side B | A侧根系水分吸收 Water uptake of side A | B侧根系水分吸收 Water uptake of side B |
| 0/0 | 243.25±12.27cd | 248.00±19.52a |
| 50/50 | 231.25±16.11d | 205.75±14.48b |
| 100/100 | 140.75±8.29e | 160.25±14.10c |
| 150/150 | 133.00±9.12e | 136.75±12.77c |
| 200/200 | 85.50±5.69f | 82.25±7.32de |
| 250/250 | 39.50±2.75g | 33.75±4.37f |
| 0/100 | 305.50±4.35b | 76.50±4.44e*** |
| 0/150 | 284.00±3.03bc | 56.50±3.59ef*** |
| 0/200 | 307.50±17.78b | 56.25±4.87ef*** |
| 0/250 | 408.75±29.59a | 37.75±1.49f*** |
| 50/100 | 311.25±19.49b | 135.25±5.06c*** |
| 50/150 | 322.50±14.52b | 107.50±3.48d*** |
| 50/200 | 411.50±10.05a | 78.00±3.85e*** |
| 50/250 | 406.00±24.95a | 57.00±4.49ef*** |
新窗口打开
2.3 不均匀盐胁迫对紫花苜蓿叶片Na+、K+浓度及K+/Na+比的影响
随着盐胁迫程度的增加,叶片中Na+浓度呈现上升趋势。均匀的100/100、150/150、200/200、250/250处理下叶片Na+浓度比0/0处理分别增加了241.39%、249.12%、418.05%和495.98%,均达到显著水平(P<0.05)。0/100比100/100处理、0/150比150/150处理、0/200比200/200处理及0/250比250/250处理的叶片Na+浓度分别降低了45.12%、38.20%、42.64%和55.93%(图3-A)。处理50/100、50/150、50/200和50/250比均匀的盐胁迫处理叶片Na+浓度分别降低了43.37%、15.85%、39.11%和42.19%(图3-B)。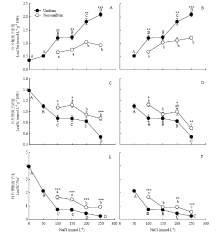 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同盐胁迫对紫花苜蓿叶片钠离子浓度(A,B)、钾离子浓度(C,D)及钾钠比(E,F)的影响
全填充圆点表示均匀的盐胁迫处理(0/0、50/50、100/100、150/150、200/200、250/250),空心圆点表示不均匀盐胁迫处理(0/100、0/150、0/200、0/250(A,C,E)和50/100、50/150、50/200、50/250(B,D,F))
-->Fig. 3Concentration of Na+(A, B), K+(C, D)and K+/Na+ ratio(E, F)in the leaves of alfalfa to different salt stress
Uniform salt treatments (0/0, 50/50, 100/100, 150/150, 200/200, 250/250) are indicated by full fill circle and non-uniform salt treatments (0/100, 0/150, 0/200, 0/250 (A, C, E) and 50/100, 50/150, 50/200, 50/250 (B, D, F) ) by hollow circle
-->
盐胁迫处理下,伴随着叶片Na+浓度的升高,叶片中的K+浓度显著降低(P<0.05)。与均匀的100/100、150/150、200/200、250/250处理相比,不均匀盐胁迫0/100、0/150、0/200、0/250处理的叶片K+浓度分别提高22.37%、28.23%、14.69%和62.50%(图3-C)。50/100、50/150、50/200、50/250处理的叶片K+浓度比均匀盐协迫分别提高了28.36%、8.79%、21.12%和28.76%(图3-D)。
不均匀盐胁迫系列0/S的叶片K+/Na+显著高于均匀的S/S处理的,而50/S处理的叶片K+/Na+(除50/150处理外)与均匀的S/S系列处理相比均显著增加(P<0.05)(图3-E,F)。
2.4 不均匀盐胁迫对紫花苜蓿膜质过氧化的影响
丙二醛(MDA)是直接反映膜质过氧化的指标之一。试验结果表明,随着盐胁迫处理浓度的增加,紫花苜蓿叶片中的MDA含量显著增加(P<0.05)。与处理0/0相比,均匀盐胁迫100/100、150/150、200/200、250/250 处理的MDA含量分别增加了16.95%、51.01%、78.42%和96.78%;不均匀盐胁迫处理0/100、0/150、0/200、0/250的MDA含量分别增加了27.74%、19.74%、25.33%和92.35%。0/150和0/200处理的MDA含量显著低于150/150和200/200处理(P<0.05),分别降低了20.70%和29.76%(图4-A)。不均匀盐胁迫处理50/100、50/150、50/200、50/250的MDA含量比0/0处理分别增加了34.66%、39.51%、51.73%和100.00%。50/150和50/200 处理的MDA含量比150/150和200/200处理分别降低了7.62%和14.96%(图4-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同盐胁迫对紫花苜蓿丙二醛含量的影响
全填充圆点表示均匀的盐胁迫处理(0/0、50/50、100/100、150/150、200/200、250/250),空心圆点表示不均匀盐胁迫处理(0/100、0/150、0/200、0/250(A)和50/100、50/150、50/200、50/250(B))
-->Fig. 4Responses of the MDA contents of alfalfa to different salt stress
Uniform salt treatments (0/0, 50/50, 100/100, 150/150, 200/200, 250/250) are indicated by full fill circle and non-uniform salt treatments (0/100, 0/150, 0/200, 0/250 (A) and 50/100, 50/150, 50/200, 50/250 (B) ) by hollow circle
-->
2.5 不均匀盐胁迫对紫花苜蓿叶绿素含量的影响
与处理0/0处理相比,均匀的50/50、100/100处理增加了紫花苜蓿的叶绿素含量,但盐胁迫程度较高的200/200、250/250处理,其叶绿素含量显著降低(P<0.05),分别比0/0降低59.31%和65.86%。而不均匀的盐胁迫处理0/200和0/250的叶绿素含量分别是200/200和250/250处理的2.0倍和2.2倍(图5-A)。50/200、50/250处理的叶绿素含量分别是200/200和250/250处理的2.3倍和2.3倍(图5-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同盐胁迫对紫花苜蓿叶绿素含量的影响
全填充圆点表示均匀的盐胁迫处理(0/0、50/50、100/100、150/150、200/200、250/250),空心圆点表示不均匀盐胁迫处理(0/100、0/150、0/200、0/250(A)和50/100、50/150、50/200、50/250(B))
-->Fig. 5Responses of the chlorophyll contents of alfalfa to different salt stress
Uniform salt treatments (0/0, 50/50, 100/100, 150/150, 200/200, 250/250) are indicated by full fill circle and non-uniform salt treatments (0/100, 0/150, 0/200, 0/250 (A) and 50/100, 50/150, 50/200, 50/250 (B) ) by hollow circle
-->
2.6 不均匀盐胁迫对紫花苜蓿脯氨酸含量的影响
随着盐分浓度的增加,紫花苜蓿叶片中的脯氨酸(Pro)含量逐渐升高。均匀的100/100、150/150、200/200、250/250处理的Pro含量分别是0/0处理的3.6、3.5、6.6和7.9倍。不均匀盐胁迫处理系列0/S间Pro含量差异不显著,但与均匀的高盐胁迫相比各处理间表现不同。0/150的Pro含量比150/150的增加了34.95%,而0/200和0/250处理的Pro含量则分别比200/200和250/250处理减少了24.26%和37.39%(图6-A)。50/150 处理的Pro含量比150/150处理增加了24.00%,而50/200和50/250处理的Pro含量则分别比200/200和250/250处理减少了27.13%和34.91%(图6-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6不同盐胁迫对紫花苜蓿脯氨酸含量的影响
全填充圆点表示均匀的盐胁迫处理(0/0、50/50、100/100、150/150、200/200、250/250),空心圆点表示不均匀盐胁迫处理(0/100、0/150、0/200、0/250(A)和50/100、50/150、50/200、50/250(B))
-->Fig. 6Responses of the proline contents of alfalfa to different salt stress
Uniform salt treatments (0/0, 50/50, 100/100, 150/150, 200/200, 250/250) are indicated by full fill circle and non-uniform salt treatments (0/100, 0/150, 0/200, 0/250 (A) and 50/100, 50/150, 50/200, 50/250 (B) ) by hollow circle
-->
3 讨论
紫花苜蓿在受到盐分胁迫,特别是高盐胁迫后会发生渗透胁迫和离子毒害,植物生长受到抑制,生物量降低,植物组织中Na+含量增加,K+含量降低,导致较低的K+/Na+,细胞的膜质过氧化程度增加,光合作用受阻等[27,28,29]。本研究通过分根试验探讨了均匀盐胁迫和不均匀盐胁迫对紫花苜蓿的影响。研究发现,紫花苜蓿无论在哪种盐胁迫下其生长都会受到一定的抑制,但与均匀的盐胁迫处理相比,不均匀盐胁迫0/S和50/S处理具有相对较高的生物量和植株生长速率,并且随着高盐胁迫浓度的增加,效果越显著。说明不均匀盐胁迫可以缓解高盐胁迫对紫花苜蓿生长的抑制作用,这与前人对酸橙(Citrus aurantium)[15]、番茄(Lycopersicon esculentum)[16]、大洋洲滨藜[30]、棉花[10]和小麦(Triticum aestivum)[31]等的研究结果相一致。生长于不均匀盐胁迫环境下的紫花苜蓿,其根系生物量,无盐或低盐一侧的显著高于高盐一侧;并且与均一盐胁迫处理相比,不均匀盐胁迫下植物根系的总生物量更接近于无盐胁迫处理。FLORES等[13]对番茄的研究也得到了同样的结果,即当植物处于不均匀的盐胁迫时,高盐胁迫对根系生长的抑制可以通过促进低盐胁迫一侧根的生长进行补偿。但对盐生植物大洋洲滨藜的研究发现,当植物处于0/500 mmol·L-1 NaCl处理下(500 mmol·L-1 NaCl不影响其根系生长),低盐一侧根系无补偿生长作用,两侧根系生物量差异不显著。而当一侧根系处于极端高盐环境(1500 mmol·L-1 NaCl)下时,低盐一侧根系生长显著增加[8]。我们的研究发现,均匀盐胁迫100/100和150/150处理下,植物根系生物量与0/0无盐处理差异不显著,但当植株两侧根系所处环境胁迫状态不同时,0/S或50/S处理,低盐一侧根系生长显著增加,高盐一侧根系生物量降低。0/S与50/S处理的不均匀盐胁迫下,低盐或无盐侧均表现出根的补偿性生长。这可能与不同植物耐受盐胁迫的程度不同有关,特别是甜土植物和盐生植物在根系的补偿生长方面的表现存在一定差异[4]。
当盐分存在于植物根际时会降低土壤渗透势,导致植物吸水困难,进而影响植物的生理生化功能,抑制生长[32]。不均匀盐胁迫下对于水分吸收的研究相对较多[4],多数研究证明当植物根系受到不均匀的盐胁迫时,低盐或无盐一侧根系水分吸收的增加会补偿高盐一侧水分吸收的减少,整株植物的水分吸收状况好于均一盐胁迫条件下的水分吸收状况[8-9, 15, 30],这与本研究的结果一致。本分根试验中,当紫花苜蓿的生境存在盐分浓度差异时,处于无盐胁迫或低盐胁迫一侧的根系其水分吸收量显著高于均一的无盐胁迫或低盐胁迫处理的根系水分吸收量,并且整株植物的水分吸收状况显著好于均一高盐胁迫下的植物整株水分吸收状况。SUN等[6]通过相关性分析发现,不均匀盐胁迫下植物低盐一侧根系的水分吸收与植物的生长速率显著正相关,说明低盐一侧根系的补偿性吸水对促进不均匀盐胁迫环境下植物的生长具有重要作用。MCLEAN等[33]的研究对这种现象的解释是,当植物处于不均匀盐胁迫环境时,低盐一侧根系短期内(0—24 h)的补偿吸水作用依靠根系导水率的增加维持水分吸收,长期的反应机则是通过补偿生长作用增加该侧根系的水分吸收。植物在高盐环境下生长不仅要保证水分吸收还要维持良好的渗透调节作用。盐胁迫下紫花苜蓿的Pro含量随着盐分浓度的增加逐渐增加,而在不均匀盐胁迫下,各处理的Pro含量均维持在较低水平,但显著高于无盐胁迫处理(P<0.05),这可能是由于不均匀盐胁迫下低盐一侧根系的补偿吸水作用维持了盐胁迫下整株植物的水分吸收,或无机离子在植物地上部分的积累,即叶片中Na+浓度的升高起到了较好的渗透调节作用[34],使不均匀盐胁迫下植物的渗透势高于均匀的盐胁迫[9]。但植物在逆境条件下会积累多种物质进行渗透调节,因此关于不均匀盐胁迫下渗透调节的响应机制,特别是低盐与高盐处理的两端根系在渗透调节中所起的作用还需进一步验证。
盐胁迫下植物叶片中过多的积累Na+,会影响其他营养元素如K+、Ca2+等的吸收,造成离子毒害和营养失衡,进而影响植物正常的生长发育[35,36]。本研究发现,在盐胁迫下,随着盐分浓度的增加,紫花苜蓿叶片中的Na+浓度升高,伴随着K+浓度的降低,这与MORADI[37]、景艳霞等[38]对紫花苜蓿的研究结果相一致。因此,植物在盐胁迫下减少Na+的吸收和地上部分的积累对于植物抵抗盐害十分重要。而与均匀的盐胁迫处理相比,不均匀盐胁迫处理下的紫花苜蓿Na+浓度显著降低,这与对海马齿(Sesuvium portulacastrum)[39]、大洋洲滨藜[30]和棉花[9]的研究结果相同,并且棉花中通过非损伤性微测技术(NMT)测得了不均匀盐胁迫下低盐一侧根系增加了Na+的外排。研究指出,不均匀盐胁迫下,地上部分Na+浓度的降低可能是由于高盐侧吸收的Na+转移到了低盐侧,并通过增加低盐侧Na+的外排缓解盐害。此外,钾作为植物生长的必需元素在盐胁迫下参与光合作用、酶活化、Na+吸收等过程,盐胁迫下防止K+流失,维持较高的K+/Na+被作为重要的耐盐机制之一[18, 40-41]。本研究发现与均匀的盐胁迫处理相比,不均匀盐胁迫0/S和50/S处理叶片的K+浓度增加,具有较高的K+/Na+。而SUN等[6]研究发现,紫花苜蓿幼苗无论在均匀(75、150、225 mmol·L-1 NaCl)的盐胁迫环境和不均匀(0/S,75/S mmol·L-1 NaCl)的盐胁迫环境下处理9 d,其叶片中的K+浓度均无显著变化。MUNNS[5]指出植物在受到盐胁迫后离子的积累和调控相较于渗透胁迫是一个比较缓慢的过程,因此可以判断出盐胁迫下Na+和K+的调控可能与植物的生长阶段和盐胁迫处理时间有关。紫花苜蓿在盐胁迫下特别是当NaCl浓度超过150 mmol·L-1后,植物的光合作用受到抑制,叶绿素含量降低。不均匀盐胁迫下叶绿素含量显著高于均匀的高盐胁迫,因此得出降低Na+在紫花苜蓿地上部分的积累,减少K+流失,维持地上部分较高的K+/Na+可能是不均匀盐胁迫下维持植物生长和光合作用的重要因素之一。
在均匀的盐胁迫下,随着盐浓度的增加,紫花苜蓿的MDA含量逐渐升高。说明随着盐胁迫的加重,紫花苜蓿的膜质过氧化程度增加,植物受盐胁迫的伤害加重。与均匀的盐胁迫处理相比,不均匀盐胁迫处理0/150、0/200、50/150和50/200的MDA含量显著低于均匀的盐胁迫处理,而处理0/250和50/250的MDA含量与均匀的250/250处理无显著差异。说明在一定浓度范围内,不均匀盐处理可以缓解盐害对植物造成的氧化损伤,而当盐浓度达到一定阈值,虽然不均匀盐胁迫下植物的生长状况优于均匀的盐胁迫,但其细胞可能已经受到氧化损伤。或者说不均匀盐胁迫下,当高胁迫一侧环境的盐浓度增加到一定程度,植物体内发生氧化损伤,植物在不均匀盐胁迫下缓解盐害的机制可能会发生改变。因此不均匀盐胁迫下植物的抗氧化机制在今后还值得进一步研究。
4 结论
盐胁迫会抑制紫花苜蓿的生长,但当植株有部分根系处于无盐或低盐胁迫环境时,与处在均一的高盐胁迫环境下相比,植物叶绿素含量显著增加,膜质过氧化程度降低,叶片中的K+/Na+相对较高;无胁迫或低盐胁迫一侧根系表现出补偿性吸水和补偿性生长现象,进而促进了植物生长,增加了地上和地下的生物量。在一定的浓度范围内(0—200 mmol·L-1 NaCl),与均匀的高盐胁迫处理相比,不均匀盐胁迫下根系所处环境的盐分浓度差异越大,其对植物盐害的缓解作用越显著。The authors have declared that no competing interests exist.
