0 引言
【研究意义】番茄叶霉病是由无性态真菌黄枝孢菌(Fulvia fulva)侵染引起的一种世界性病害,在保护地和露地条件下均可发生[1,2,3,4]。该病在中国黑龙江、吉林、辽宁、北京、天津、河北、山西、山东等地均有发生。高温高湿有利于病菌传播,其主要侵染叶片,发病初期叶正面产生褪绿斑,背面有白色霉层,严重时霉层变为棕褐色,叶片卷曲、黄化干枯,致使番茄叶片光合效率降低,营养物质积累量减少,严重影响番茄产量,一般损失为20%—30%,严重时可达50%以上[5,6]。目前,化学防治是控制番茄叶霉病的主要手段,由于该病菌易变异导致抗药性产生,需要不断研发新型高效药剂以满足生产需要。【前人研究进展】目前,国内外登记用于防治番茄叶霉病的药剂主要有甲氧基丙烯酸酯类的嘧菌酯、苯并咪唑类的多菌灵和甲基硫菌灵、麦角甾醇生物合成抑制剂类的氟硅唑、有机硫类的克菌丹、抗生素类的多抗霉素和春雷霉素等。但随着各类杀菌剂的大量、广泛使用,抗药性问题越来越突出。王美琴等[7,8]对山西省的番茄叶霉病菌进行了抗药性监测,发现各地菌株对多菌灵、乙霉威和代森锰锌的抗性频率分别在70%、33.3%和80%以上,且抗性能够稳定遗传。同时又测定了山西各地区、辽宁沈阳、山东寿光和河北保定的番茄叶霉病菌对多菌灵和乙霉威的抗性水平,结果表明各菌株对这两种杀菌剂均产生了不同程度的抗性,且抗性水平较高[8]。已有报道表明,辽宁省番茄叶霉病菌已对氟硅唑产生了不同程度的抗性,且氟硅唑与腈菌唑、三唑酮存在交互抗性[9]。赵建江等[10]研究表明,河北、浙江、江苏等6省的番茄叶霉病菌对嘧菌酯也产生了不同程度的抗性。咯菌腈已在田间用于番茄灰霉病的防治,用于蘸花处理预防灰霉病,其在100 mg·L-1的剂量下防治效果达到100%[11]。【本研究切入点】咯菌腈属非内吸性的苯基吡咯类杀菌剂,具有高效、广谱及持效期长的特点,因能专一性抑制病菌生长,广泛用于防治农业生产中的真菌性病害[12,13]。国际杀菌剂抗性行动小组(FRAC)认为咯菌腈的作用机理是影响渗透压调节信号相关的组氨酸激酶的活性,即咯菌腈主要作用于组氨酸激酶(HOG)信号途径,最终导致病菌死亡。咯菌腈具有独特的作用机制,与其他已知的杀菌剂没有交互抗性,目前未发现对此类药剂抗性菌株[11,14]。笔者实验室前期研究发现,咯菌腈对番茄叶霉病菌具有较高的毒力[15],但尚未进行系统研究。【拟解决的关键问题】建立番茄叶霉病菌对咯菌腈的敏感基线,明确咯菌腈对番茄叶霉病菌的作用方式及田间防治效果,为指导其合理使用提供依据。1 材料与方法
试验于2016—2017年在山东农业大学植物保护学院完成。1.1 材料
供试菌株:2016年在山东济南(JN)、泰安(TA)、聊城(LC)、潍坊(WF)、莱芜(LW)、淄博(ZB)6个地区采集番茄叶霉病病叶,实验室分离纯化,得到126株番茄叶霉病菌,转接于马铃薯葡萄糖琼脂(PDA)培养基斜面上,4℃冰箱保存。供试药剂:95%咯菌腈(fludioxonil)原药,山东潍坊润丰化工股份有限公司;50%咯菌腈可湿性粉剂,瑞士先正达作物保护有限公司;95%多菌灵原药(carbendazim),江苏辉丰农化股份有限公司;70%甲基硫菌灵(thiophanate-methyl)可湿性粉剂,江苏龙灯化学有限公司;70%代森锰锌(mancozeb)可湿性粉剂,江苏南通宝叶化工有限公司;10%苯醚甲环唑(difenoconazole)水分散粒剂,山东东泰农化有限公司;41.7%氟吡菌酰胺(fluopyram)悬浮剂,拜耳作物科学(中国)有限公司。咯菌腈原药溶于丙酮、多菌灵原药溶于0.1 mol·L-1的盐酸,用含0.1%吐温-80的灭菌去离子水配制成10 mg·mL-1的母液备用。
供试培养基:马铃薯葡萄糖琼脂培养基(马铃薯200 g,葡萄糖20 g,琼脂20 g,1 L去离子水),用于叶霉病菌菌株分离、纯化、保存以及菌丝生长速率测定;水琼脂(WA)培养基(琼脂10 g,葡萄糖20 g,1 L去离子水),用于孢子萌发和芽管伸长的测定。
1.2 咯菌腈对番茄叶霉病菌的抑制活性测定
在所有供试菌株中随机选择3株番茄叶霉病菌菌株(LW-2、TA-23、JN-5),用于测定咯菌腈对番茄叶霉病菌菌丝生长、分生孢子萌发和芽管伸长的抑制活性。采用菌丝生长速率法[16]测定咯菌腈对番茄叶霉病菌菌丝生长的抑制活性。将10 mg·mL-1咯菌腈母液稀释为系列浓度,与冷却至50℃左右的灭菌PDA培养基混合,配制咯菌腈浓度为0.2、0.5、1、2、5 μg·mL-1的含药平板。将菌株培养7 d后用打孔器在菌落边缘打取直径为8 mm的菌饼,接种在含药平板上。以不含药剂的处理为空白对照。25℃下培养14 d后十字交叉法测量菌落直径,每处理重复4次,根据公式(2)计算各药剂处理对菌丝生长的抑制率。
菌落增长直径(mm)=菌落直径-菌饼直径 (1)
菌丝生长抑制率(%)=(对照菌落增长直径-处理菌落增长直径)/对照菌落增长直径×100 (2)
采用孢子萌发法[17]测定咯菌腈对番茄叶霉病菌分生孢子萌发和芽管伸长的抑制活性。供试菌株培养7 d后,用无菌去离子水将分生孢子洗下,双层纱布过滤得到孢子悬浮液,在显微镜下调节孢子浓度为1×105个/mL。将咯菌腈母液稀释成系列浓度,与冷却至50℃左右的WA培养基混匀,配制成药剂浓度为0.1、0.5、1、2、5、10、20、100 μg·mL-1的含药WA平板。移取100 μL孢子悬浮液并均匀涂布在培养基表面,置于25℃生化培养箱黑暗培养。以不加药剂为空白对照,每处理重复3次。培养14 h后显微镜下观察孢子萌发情况,以芽管长度大于孢子短半径视为萌发,待对照萌发率达到90%以上时,记录各处理孢子萌发情况。每重复随机调查3个视野,并且每个重复测量20—40个萌发孢子的芽管长度。按照公式(4)和(5)计算各处理的孢子萌发抑制率和芽管伸长抑制率。
孢子萌发率(%)=孢子萌发数/孢子总数×100(3)
孢子萌发抑制率(%)=(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100 (4)
芽管伸长抑制率(%)=(对照芽管长度-处理压管长度)/对照芽管长度×100 (5)
1.3 番茄叶霉病菌对咯菌腈的敏感基线建立
采用菌丝生长速率法[16]测定126株番茄叶霉病菌对咯菌腈的敏感性。参照1.2的方法,配制咯菌腈浓度为0.1、0.2、0.5、1、2、5 μg·mL-1和多菌灵浓度为0.1、0.5、1、10、50、250、500、1000 μg·mL-1的PDA含药平板,接菌后25℃黑暗培养14 d,以添加多菌灵的处理为药剂对照,以不加药剂处理为空白对照,每处理重复4次。采用十字交叉法测量菌落直径,计算各处理菌丝生长抑制率。利用数据统计软件计算药剂对各菌株的抑制中浓度(EC50)。1.4 咯菌腈对番茄叶霉病的田间防治效果
田间药效试验参照GB/T17980.111-2004《杀菌剂防治番茄叶霉病药效试验准则》。分别于2016年4—5月、9—10月和2017年9—10月在泰安市岱岳区大汶口镇番茄叶霉病常年自然发生的日光温室进行试验,种植的番茄品种均为金鹏11-8。50%咯菌腈WP试验用量为20.25、40.50、60.75 g a.i./hm2,以10%苯醚甲环唑WDG 100 g a.i./hm2、41.7%氟吡菌酰胺SC 150 g a.i./hm2、70%代森锰锌WP 700 g a.i./hm2和70%甲基硫菌灵WP 540 g a.i./hm2为对照药剂,清水处理为空白对照,每处理设置4次重复,采用完全随机区组设计,每小区面积30 m2,设置保护行。使用WS-16农用背负式喷雾器施药。番茄叶霉病发病前施药作为保护作用试验,发病后施药作为治疗作用试验,施药前调查病情指数,每隔7 d施药一次,共施药3次。末次施药后7 d调查病情指数,每小区三点取样,每点调查5棵番茄植株,每株调查上中下3个复叶,以复叶上每张小叶片病斑面积占整个小叶片面积的百分率分级。分级标准:0级:无病斑;1级:病斑面积占整个小叶面积的5%以下;3级:病斑面积占整个小叶面积的6%—10%;5级:病斑面积占整个小叶面积的11%—20%;7级:病斑面积占整个小叶面积的21%—50%;9级:病斑面积占整个小叶面积的51%以上;并根据公式(6)—(8)计算病情指数及防治效果。病情指数=∑(病级数×病级叶数)/(调查总叶数×9)×100 (6)
防治效果(%)(药前有基数)= [1-(空白对照药前病情指数×处理组药后病情指数)/(空白对照药后病情指数×处理组药前病情指数)]×100 (7)
防治效果(%)(药前无基数)=(对照组病情指数-处理组病情指数)/对照组病情指数×100 (8)
1.5 数据处理与分析
采用DPS 7.05软件计算药剂对番茄叶霉病菌菌丝生长、孢子萌发及芽管伸长的毒力回归方程、EC50(EC90)及95%置信限。田间药效试验数据用Tukey法进行差异显著性分析(P<0.05)。2 结果
2.1 咯菌腈对不同发育阶段番茄叶霉病菌的抑制活性
咯菌腈对3株番茄叶霉病菌的芽管伸长和菌丝生长抑制作用较强,平均EC50值分别为0.30和0.80 μg·mL-1,对孢子萌发抑制作用较弱,平均EC50值均>100 μg·mL-1(表1)。Table 1
表1
表1咯菌腈对不同发育阶段番茄叶霉病菌的抑制活性
Table 1The inhibitory activity of fludioxonil against F. fulva at different stages of development
| 菌株 Strain | 孢子萌发 Spore germination EC50 (μg·mL-1) | 芽管伸长Germ tube elongation | 菌丝生长 Mycelial growth | ||
|---|---|---|---|---|---|
| 回归方程 Toxic regression equation (y=) | EC50 (μg·mL-1) (95% CL) | 回归方程 Toxic regression equation (y=) | EC50 (μg·mL-1) (95% CL) | ||
| LW-2 | >100 | 5.3785+0.8756x | 0.37 (0.30-0.45) | 5.1391+1.6575x | 0.82 (0.69-0.99) |
| TA-23 | >100 | 5.4989+0.8740x | 0.27 (0.20-0.37) | 5.0424+0.6442x | 0.86 (0.70-1.05) |
| JN-5 | >100 | 5.4591+0.7928x | 0.26 (0.19-0.37) | 5.1658+1.6395x | 0.79 (0.71-0.89) |
| 平均值Mean | >100 | — | 0.30 | — | 0.80 |
新窗口打开
2.2 山东省不同地区番茄叶霉病菌菌丝对咯菌腈的敏感性
采自山东省6个地区的番茄叶霉病菌对咯菌腈的敏感性均较高,EC50值范围为0.16—1.69 μg·mL-1,不同地区病原菌群体间对咯菌腈的敏感性均无显著差异。潍坊地区叶霉菌株对咯菌腈敏感性最高,平均EC50值为0.43 μg·mL-1,淄博地区叶霉菌株敏感性相对较低,平均EC50值为0.79 μg·mL-1。泰安、济南、聊城、莱芜地区的叶霉菌株敏感性平均EC50值分别为0.65、0.75、0.71、0.58 μg·mL-1。番茄叶霉病菌对多菌灵的敏感性明显低于咯菌腈,除发现少数敏感菌株外,多菌灵对73.81%的叶霉菌株EC50值均>1 mg·mL-1,表明山东地区番茄叶霉病菌对多菌灵的抗性频率较高(表2)。Table 2
表2
表2山东省不同地区番茄叶霉病菌菌丝对咯菌腈的敏感性
Table 2The sensitivity of F. fulva strains collected from different regions in Shandong Province to fludioxonil
| 采集地点Collection site | 菌株数 Number of strains | 咯菌腈Fludioxonil | 多菌灵Carbendazim | ||
|---|---|---|---|---|---|
| EC50平均值 Mean of EC50 values (μg·mL-1) | EC50范围 Range of EC50 values (μg·mL-1) | EC50范围 Range of EC50 values (μg·mL-1) | EC50>1 mg·mL-1 的菌株数 Number of strains | ||
| 泰安TA | 25 | 0.65±0.07a | 0.24-1.48 | 0.21- >1000 | 16 |
| 聊城LC | 22 | 0.71±0.08a | 0.40-1.29 | 0.41- >1000 | 13 |
| 潍坊WF | 18 | 0.43±0.07a | 0.16-0.88 | >1000 | 18 |
| 莱芜LW | 21 | 0.58±0.05a | 0.22-1.02 | 0.32- >1000 | 14 |
| 济南JN | 20 | 0.75±0.12a | 0.26-1.57 | 0.28- >1000 | 12 |
| 淄博ZB | 20 | 0.79±0.14a | 0.29-1.69 | >1000 | 20 |
新窗口打开
2.3 番茄叶霉病菌对咯菌腈的敏感基线
利用菌丝生长速率法测定了126株番茄叶霉病菌对咯菌腈的敏感性,其EC50分布范围为0.16—1.69 μg·mL-1,平均值为(0.64±0.03)μg·mL-1,敏感性频率分布呈单峰曲线,经Shapiro-Wilk 法分析得到P=0.63>0.05,符合正态分布(图1),可以作为山东地区番茄叶霉病菌对咯菌腈的敏感基线。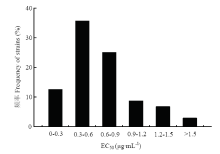 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1番茄叶霉病菌对咯菌腈的敏感性频率分布
-->Fig. 1Sensitivity frequency distribution of F. fulva to fludioxonil
-->
2.4 咯菌腈对番茄叶霉病的田间防治效果
每年4—5月、9—10月是番茄叶霉病发生的最佳时期,同时番茄叶霉病发生的严重程度较高,所以本研究田间试验防治效果均在76%以下。两年的试验结果表明,咯菌腈对番茄叶霉病均具有较高的防治效果。2016—2017年咯菌腈有效成分为60.75 g a.i./hm2时对番茄叶霉病保护作用和治疗作用的防治效果分别为72.21%—75.02%和61.94%—70.65%,均高于对照药剂苯醚甲环唑100 g a.i./hm2、氟吡菌酰胺150 g a.i./hm2、代森锰锌700 g a.i./hm2和甲基硫菌灵540 g a.i./hm2的防治效果,但2017年咯菌腈60.75 g a.i./hm2对番茄叶霉病保护作用和治疗作用的防治效果与对照药剂氟吡菌酰胺150 g a.i./hm2的保护和治疗防治效果差异均不显著。2016年咯菌腈有效成分为40.50 g a.i./hm2时对番茄叶霉病保护作用和治疗作用的防治效果分别高于对照药剂甲基硫菌灵540 g a.i./hm2的保护和治疗防治效果;2017年咯菌腈有效成分为40.50 g a.i./hm2时对番茄叶霉病保护作用和治疗作用的防治效果分别高于对照药剂苯醚甲环唑100 g a.i./hm2、代森锰锌700 g a.i./hm2和甲基硫菌灵540 g a.i./hm2的保护和治疗防治效果。而2016年咯菌腈有效成分为20.25 g a.i./hm2时对番茄叶霉病保护作用和治疗作用的防治效果分别显著高于对照药剂甲基硫菌灵540 g a.i./hm2的保护作用和治疗作用的防治效果;2017年咯菌腈有效成分为20.25 g a.i./hm2时对番茄叶霉病保护作用和治疗作用的防治效果分别显著高于对照药剂代森锰锌700 g a.i./hm2和甲基硫菌灵540 g a.i./hm2的保护作用和治疗作用的防治效果。2016—2017年咯菌腈20.25、40.50和60.75 g a.i./hm2的保护作用防治效果均略高于其治疗作用的防治效果(表3—表5)。Table 3
表3
表3咯菌腈对番茄叶霉病的田间防治效果(2016年4—5月)
Table 3The field control efficacy of fludioxonil to tomato leaf mold (April-May in 2016)
| 药剂 Fungicide | 剂量 Dosage (g a.i./hm2) | 保护作用 Protective effect | 治疗作用 Curative effect | |||
|---|---|---|---|---|---|---|
| 末次施药后7 d 7 days after the last treatment | 药前病情指数 Disease index before treatment | 末次施药后7 d 7 days after the last treatment | ||||
| 病情指数 Disease index | 防治效果 Control effect (%) | 病情指数 Disease index | 防治效果 Control effect (%) | |||
| 50%咯菌腈WP 50% Fludioxonil WP | 20.25 | 22.81±0.38c | 50.56±0.25c | 24.76±0.07a | 43.20±0.16c | 48.22±0.25c |
| 40.50 | 17.54±0.53d | 61.98±0.34b | 24.76±0.62a | 38.75±0.07d | 53.51±1.34b | |
| 60.75 | 12.31±0.49de | 73.32±0.21a | 25.39±0.41a | 32.55±0.39e | 61.94±0.92a | |
| 70%甲基硫菌灵WP 70% Thiophanate-methyl WP | 540 | 42.64±0.56ab | 7.55±0.79d | 24.83±0.39a | 73.73±0.07b | 11.84±0.56d |
| 对照 CK | — | 46.13±0.99a | — | 24.24±0.29a | 81.64±0.50a | — |
新窗口打开
Table 4
表4
表4咯菌腈对番茄叶霉病的田间防治效果(2016年9—10月)
Table 4The field control efficacy of fludioxonil to tomato leaf mold (September-October in 2016)
| 药剂 Fungicide | 剂量 Dosage (g a.i./hm2) | 保护作用 Protective effect | 治疗作用 Curative effect | |||
|---|---|---|---|---|---|---|
| 末次施药后7 d 7 days after the last treatment | 药前病情指数 Disease index before treatment | 末次施药后7 d 7 days after the last treatment | ||||
| 病情指数 Disease index | 防治效果 Control effect (%) | 病情指数 Disease index | 防治效果 Control effect (%) | |||
| 50%咯菌腈WP 50% Fludioxonil WP | 20.25 | 17.56±1.24c | 51.60±1.76b | 4.16±0.09a | 24.87±0.48c | 46.90±0.51c |
| 40.50 | 12.03±1.06d | 66.86±1.77ab | 4.27±0.12a | 19.07±0.71d | 60.40±0.49b | |
| 60.75 | 10.07±0.47de | 72.21±0.34a | 4.32±0.08a | 14.30±0.52e | 70.65±0.74a | |
| 70%甲基硫菌灵WP 70% Thiophanate-methyl WP | 540 | 27.67±0.18b | 23.50±3.13c | 4.13±0.04a | 36.00±0.65b | 22.59±0.80d |
| 对照 CK | — | 36.22±1.24a | — | 4.22±0.03a | 47.52±0.21a | — |
新窗口打开
Table 5
表5
表5咯菌腈对番茄叶霉病的田间防治效果(2017年9—10月)
Table 5The field control efficacy of fludioxonil to tomato leaf mold (September-October in 2017)
| 药剂 Fungicide | 剂量 Dosage (g a.i./hm2) | 保护作用 Protective effect | 治疗作用 Curative effect | |||
|---|---|---|---|---|---|---|
| 末次施药后7 d 7 days after the last treatment | 药前病情指数 Disease index before treatment | 末次施药后7 d 7 days after the last treatment | ||||
| 病情指数 Disease index | 防治效果 Control efficiency (%) | 病情指数 Disease index | 防治效果 Control efficiency (%) | |||
| 50%咯菌腈WP 50% Fludioxonil WP | 20.25 | 15.14±0.23cd | 55.80±0.90c | 6.52±0.17a | 21.78±1.82cd | 52.62±1.92c |
| 40.50 | 10.28±1.05e | 69.99±1.89ab | 6.05±0.24a | 14.94±0.89de | 64.72±1.41ab | |
| 60.75 | 8.57±0.03ef | 75.02±1.07a | 6.23±0.38a | 13.04±0.49e | 69.85±1.23a | |
| 10%苯醚甲环唑WDG 10% Difenoconazole WDG | 100 | 12.17±0.10de | 64.46±0.97bc | 6.07±0.09a | 16.91±1.15de | 60.36±0.35b |
| 41.7%氟吡菌酰胺SC 41.7% Fluopyram SC | 150 | 10.01±0.01e | 70.76±1.05ab | 6.33±0.17a | 13.6±0.63e | 69.28±0.88a |
| 70%代森锰锌WP 70% Mancozeb WP | 700 | 18.96±0.03bc | 44.61±1.87d | 6.39±0.22a | 29.55±1.80bc | 34.00±1.48d |
| 70%甲基硫菌灵WP 70% Thiophanate-methyl WP | 540 | 23.28±1.51b | 32.14±2.02e | 6.11±0.15a | 30.14±2.54b | 30.05±0.43d |
| 对照 CK | — | 34.27±1.21a | — | 6.62±0.36a | 46.08±0.32a | — |
新窗口打开
3 讨论
咯菌腈对不同发育阶段番茄叶霉病菌的抑制活性存在差异。其中,咯菌腈对番茄叶霉病菌的芽管伸长和菌丝生长具有较高的毒力,而对孢子萌发基本无抑制作用,这与郭贝贝等的研究结果基本一致[15,18-19]。陈治芳等研究发现,咯菌腈对番茄灰霉病菌的孢子萌发、芽管伸长和菌丝生长均具有较好的抑制活性[20,21],与本试验结果不同,表明不同病原菌对咯菌腈的反应存在差异。咯菌腈对番茄叶霉病菌的作用机制及其对叶霉病菌和灰霉病菌不同发育阶段抑制作用差异的原因有待进一步明确。
山东省6个地区的番茄叶霉病菌对咯菌腈均具有较高的敏感性,其中潍坊地区菌株敏感性最高,淄博地区菌株敏感性较低,其他各地区敏感性居中且差异不显著。咯菌腈目前尚未登记用于防治番茄叶霉病,但各地区却存在敏感性低的菌株,这是否与地理差异和不同地区间天然的耐药个体有关还需要进一步研究。近年来,咯菌腈逐步开始用于防治番茄灰霉病,而叶霉病与灰霉病在环境适宜条件下可在同一时期发生,在同一地块用其防治灰霉病也可能会导致部分叶霉病菌株敏感性降低[22]。
咯菌腈作用广谱,建立敏感基线对监测病原菌的敏感性变化和抗药性发生具有重要价值[23,24,25],也为药剂的科学使用提供理论依据。范子耀等[12]建立了马铃薯早疫病菌对咯菌腈的敏感性基线,指出咯菌腈与吡唑醚菌酯和苯醚甲环唑之间无交互抗性关系;LIU等建立了河南省番茄灰霉病菌对咯菌腈的敏感性基线,研究了抗性菌株的生物学特性,认为咯菌腈防治灰霉病具有潜在的抗性风险[22,26]。目前,已在西班牙、以色列、德国、美国发现了抗咯菌腈的灰霉菌株[27,28,29,30]。王智等[31]研究表明,咯菌腈对番茄灰霉病菌具有较高的抑制活性,且与腐霉利和多菌灵之间均不存在交互抗性。由于咯菌腈在番茄叶霉病上尚未取得登记,本研究建立的番茄叶霉病菌对咯菌腈的敏感性基线,可为其在该病上使用提供依据。灰霉病、早疫病和叶霉病均为番茄上的常见病害,根据本研究及其他作物上类似病害研究结果,在这些病害同时发生时,科学合理地施用咯菌腈能够实现兼治作用。目前生产中可用于番茄叶霉病防治的药剂种类较少,且番茄叶霉病对多种药剂产生不同程度的抗性。而咯菌腈具有独特的作用机制,不易与其他类药剂产生交互抗性,所以该药具有登记防治番茄叶霉病的前景。
田间条件下50%咯菌腈可湿性粉剂60.75 g a.i./hm2对番茄叶霉病的保护和治疗防治效果均显著高于对照药剂70%代森锰锌可湿性粉剂700 g a.i./hm2和70%甲基硫菌灵可湿性粉剂540 g a.i./hm2的防治效果,与41.7%氟吡菌酰胺和10%苯醚甲环唑防治效果差异不显著,因此,咯菌腈有可能与氟吡菌酰胺以及苯醚甲环唑等药剂轮换使用防治番茄叶霉病。咯菌腈对叶霉病菌芽管伸长具有较高的抑制活性,这表明咯菌腈可以通过抑制分生孢子芽管的伸长,阻止菌丝体的形成和入侵植株,而对植株起到较好的保护作用。咯菌腈属于非内吸性杀菌剂,可被植物少量吸收,但不能在植株体内输导,不过咯菌腈性质稳定,能够在施药部位长期存在,因此保护作用优异。而对于已侵入植株体内的病菌,咯菌腈仅能够限制着药部位叶霉菌丝的扩展,治疗效果有限。本研究证明咯菌腈的治疗作用略低于保护作用,建议在发病前预防性使用。
4 结论
咯菌腈对番茄叶霉病菌的芽管伸长和菌丝生长具有较高的毒力,而对孢子萌发基本无抑制作用。山东省不同地区番茄叶霉病菌对咯菌腈相对比较敏感。在田间咯菌腈对番茄叶霉病的保护性防治效果高于治疗性防治效果,应在发病前或初期使用。The authors have declared that no competing interests exist.
