0 引言
【研究意义】N2O是一种重要的温室气体,其全球增温潜势是CO2的300倍[1]。农田生态系统是大气N2O的主要来源,对全球N2O排放(17.7 Tg N2O-N·a-1)的贡献为6.2 Tg N2O-N· a-1,约占全球N2O排放量的1/3[2]。微生物的硝化作用和反硝化作用是土壤主要的N2O产生途径,这些过程受土壤含水量、温度、通气性、铵态氮和硝态氮浓度、可矿化碳的含量以及pH的影响[3-4,5],其中,土壤水分含量是N2O排放来源的主要控制因素[6],不同含水量下,这些过程可能会在同一土壤中的不同微区同时发生[7],但是对于土壤中N2O的主要产生途径仍具有不确定性。因此,不同湿度土壤N2O溯源研究对于N2O减排具有重要指导意义。【前人研究进展】土壤含水量为84%—86% WFPS时,N2O排放量最强;低于这个范围时,土壤含水量与N2O排放量呈正相关,反之,则呈负相关关系[8]。施加氮肥后,土壤N2O排放量随着土壤含水量的增加而增加,通常当土壤含水量低于70%WFPS时,硝化作用成为主要的N2O来源[7, 9-10]。用15N标记NO- 3的研究发现,当土壤含水量大于70%WFPS时,其产生的N2O主要由反硝化作用产生[10-11,12]。也有研究指出,只有当含水量超过80%WFPS时,反硝化作用才会成为主要的N2O产生途径[13]。乙炔(Acetylene,C2H2)是一种常用的自养硝化抑制剂,较低的乙炔浓度(1—100 Pa)可以抑制土壤的自养硝化作用,较高的乙炔浓度(10 kPa)可以抑制N2O还原成N2,同时也能抑制硝化作用,而异养硝化作用在较大的乙炔浓度范围(1—10 kPa)不受抑制[14,15]。以往研究,主要利用乙炔抑制技术和同位素标记技术区分N2O产生和消耗过程,但是这些技术存在局限性[16,17,18]。目前,国外将同位素位嗜值(site preference,SP),作为N2O溯源研究的重要工具。理论上,参与硝化和反硝化过程产生的N2O的NO还原酶类型不同,会导致两个N原子位置15N的富集程度不同[19,20];N2O还原过程中N-O键断裂会导致剩余N2O中间位置氮原子富集15N(15Nα)[19,21-23],这些均可以作为利用SP值区分N2O来源的理论基础。除此之外,SP值可以弥补δ15N和δ18O受前体同位素值干扰的不足,且对样品干扰小[24,25,26]。与细菌反硝化作用相比,由真菌反硝化作用和硝化作用产生N2O过程具有更高的SP值[27]。与硝化作用相比,一般土壤反硝化过程产生的N2O有较高的δ15N和δ18O值[28]。国外研究发现,在55% WFPS处理中,有一多半的N2O来自于硝化作用,75%和85%WFPS土壤中反硝化作用是主要的N2O产生途径[29]。【本研究切入点】国内很少利用自然丰度的稳定同位素特征值对参与N2O排放的硝化和反硝化过程贡献率进行量化研究,本研究利用该技术结合乙炔抑制法探索不同土壤含水量下N2O的溯源问题。【拟解决的关键问题】本研究将同位素自然丰度法与乙炔抑制技术相结合,通过室内培养试验,研究不同含水量(WFPS)对北京顺义潮土N2O排放及同位素特征值(δ15Nbulk,δ18O和SP)的影响,以期获得不同土壤含水量条件下施用铵态氮肥后,其N2O产生途径及变化规律。
1 材料与方法
试验于2016年10—11月在中国农业科学院农业环境与可持续发展研究所环境稳定同位素实验室进行。1.1 试验材料
供试土壤来自中国农业科学院农业环境与可持续发展研究所北京顺义试验基地,为连续10年以上小麦与玉米一年两熟种植制度的潮褐土,其玉米和小麦的产量分别约为8 250和6 000 kg·hm-2。玉米收获后的0—20 cm表层土壤的主要理化性质为:容重1.48 g·cm-3、pH 7.87、有机质15.40 g·kg-1、NH+ 4-N 2.33 mg·kg-1、NO- 3-N 6.33 mg·kg-1。采用蛇形五点法收集土样,土壤取回后,过4 mm筛,稍微风干后,混匀,便开始进行培养。C2H2 购自北京氦普北分气体工业有限公司(纯度≥99.6%)。1.2 试验方法
试验设置3个含水量梯度,分别为67%、80%和95%WFPS(土壤体积含水量与总孔隙度的百分比或实际重量含水量与饱和含水量的百分比,简称WFPS),每个含水量梯度设置不加C2H2(CK)、加0.1%(V/V)C2H2和加10%(V/V)C2H2,共9个处理,每个处理均设有3次重复。向土壤中添加肥料用量为100 mgN·kg-1烘干土的(NH4)2SO4,拌匀。土壤初始含水量为67% WFPS,根据重量法通过加蒸馏水调成80%和95% WFPS,得到3个含水量梯度,将土样装于无盖的塑料盒子里,表面覆膜,并扎若干个6 mm的小孔,以减缓水分蒸发,培养过程中根据重量法每3天补加一次蒸馏水,使土壤含水量与培养初期保持一致,于25℃培养箱进行黑暗培养。在培养第1、2、3、4、5、7、10、14和18天进行气体和土壤样品收集。具体采样过程为:称取高(95% WFPS)、中(80% WFPS)和低(67% WFPS)含水量的土壤样品分别为51.6、49.6和48.0 g(均相当于40 g烘干土)于280 mL培养瓶中,培养瓶盖上胶塞,并用铝盖压紧密封。0.1%(V/V)C2H2处理用注射器注入0.3 mL C2H2,并混匀;10%(V/V)C2H2处理用注射器从培养瓶中抽出30 mL 空气,再注入30 mL C2H2,并混匀。将处理好的培养瓶于25℃培养箱中黑暗培养2 h,从培养瓶中用注射器抽取20 mL气体(加C2H2的处理采气前要将培养瓶中的气体混匀),注入20 mL提前抽成真空状态的顶空瓶中用于测定N2O浓度及同位素值(δ15Nbulk和δ15Nα),同时收集培养瓶中的土样,于-20℃冷冻,用于测定土壤氮素含量。
无C2H2处理的土壤N2O由硝化和反硝化作用共同产生;0.1%(V/V)C2H2处理的土壤N2O均由反硝化作用产生;10%(V/V)C2H2处理的土壤N2O是反硝化作用产生的N2O与N2之和。
1.3 测定项目与方法
1.3.1 N2O排放通量及同位素特征值的测定 利用稳定同位素质谱仪(IRMS, Isoprime100, Isoprime,Cheadle,UK)配合痕量气体浓缩系统(Trace Gas, UK)测定N2O峰面积(m/z=44,具体参照文献中提到的方法[30,31],根据样品N2O和采样时空气中N2O峰面积比值算出样品中N2O浓度。N2O排放通量计算公式[32]为F=
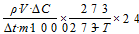 (1)
(1) 式中,F表示N2O排放速率,μg·kg-1·d-1;ρ表示标准状况下N2O的密度,1.25 kg·m-3;V为培养瓶内有效体积,0.24 L;∆C表示测定的N2O浓度,ppbv;∆t表示每次取样培养时间,2 h;m为干土重量,40×10-3 kg;T表示培养时的平均温度,25℃;24表示一天24 h;N2O累积排放量为不同培养时间段气体排放量的加权求和,μg·kg-1。
N2O同位素特征值(δ15Nbulk和δ15Nα)利用1.3.1中提到的IRMS进行测定得到。
N2O分子是不对称的直线型结构,根据中间和末端氮原子的不同,分别称为α原子和β原子[23],微生物对N2O分子内不同位置N的嗜好性差异产生的值称为位嗜值,简称SP。N2O同位素特征值相关公式[30]如下
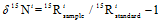
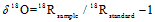
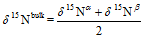
式中,R=15N/14N,18O/16O,R的下角标分别表示样品和标准样品。
N2O的同位素位置嗜值SP的计算公式[30]为
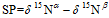
式中,δ15Nα和δ15Nβ分别表示N2O分子内α和β位氮原子的同位素值。
1.3.2 基于SP的N2O来源评估 假设土壤排放的N2O全部来自于硝化作用和反硝化作用,利用同位素二源混合模型计算硝化和反硝化作用各自的贡献率,公式[29]如下
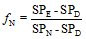
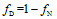
式中,SPE和SPN、SPD分别表示环境样品的SP值以及纯细菌培养条件下硝化和反硝化作用各自的SP值(33‰和0),fN和fD分别表示来自硝化和反硝化作用的N2O占总量的比例。
1.3.3 土壤无机氮含量的测定 QuikChem 8000 流动注射全自动分析仪(LACHAT,USA)测NH+ 4-N和NO- 3-N体积含量(mg·L-1),并计算出质量含量(mg·kg-1),测定方法和公式参照《土壤农化分析》[33]。
1.4 数据处理及分析
采用Microsoft Excel 2013和SAS 9.2软件进行数据分析和处理,采用Sigmaplot 12.5进行数据的统计和作图,利用LSD(P=0.05)法对处理间差异进行显著性分析。2 结果
2.1 N2O排放速率与累积排放量
本研究结果表明,土壤N2O排放速率随着土壤含水量升高而增加(图1-A)。在80%、95% WFPS条件下,各处理间土壤N2O排放速率在培养第2—4天出现排放高峰,并且其最大排放速率分别为1.46和3.30 mgN·kg-1·d-1,随后N2O排放速率逐渐降低。67% WFPS土壤N2O整体排放水平比较低(低于0.20 mgN·kg-1·d-1),在培养第1—2天出现较高的N2O排放量。高、中和低含水量土壤N2O加权平均排放通量分别为1.17、0.27和0.08 mgN·kg-1·d-1。其中,高、中含水量土壤在培养前7—10 d具有较高的N2O排放速率,之后排放速率较低且变化不大。低含水量各处理间N2O排放速率差异显著,且无C2H2处理>10%(V/V)C2H2处理>0.1%(V/V)C2H2处理(表1)。Table 1
表1
表1两种C2H2处理对土壤N2O排放速率及累积排放量的影响
Table 1The effect of two C2H2 treatments on the rate and cumulative emissions of N2O
| 处理 Treatments | 67% WFPS | 80% WFPS | 95% WFPS | |||
|---|---|---|---|---|---|---|
| ER (mgN·kg-1·d-1) | CE (mgN·kg-1) | ER (mgN·kg-1·d-1) | CE (mgN·kg-1) | ER (mgN·kg-1·d-1) | CE (mgN·kg-1) | |
| CK | 0.0824±0.0347a | 1.4827±0.0502a | 0.2694±0.4058a | 4.7685±0.3469b | 1.1702±1.2403a | 21.0641±0.9153a |
| 0.1%(V/V)C2H2 | 0.0646±0.0241b | 1.1635±0.0285c | 0.2244±0.3192a | 4.0958±0.1252c | 0.8472±1.0099a | 15.5504±0.6576c |
| 10%(V/V)C2H2 | 0.0759±0.0291ab | 1.3496±0.0551b | 0.3313±0.4405a | 5.7216±0.1798a | 1.1063±1.0676a | 19.6124±0.2163b |
新窗口打开
整个培养周期,高、中和低含水量土壤N2O累积排放量分别为21.06、4.77和1.48 mgN·kg-1,分别为培养初期总的无机氮含量的19.39%、4.39%和1.36%(NH+ 4-N+NO- 3-N初始含量均为108.62 mgN·kg-1),这说明,随着土壤含水量增大,气态氮损失量增加;高、中含水量土壤N2O累积排放量分别比低含水量高13.23和2.22倍,高含水量土壤N2O累积排放量比中含水量高3.42倍。各水分处理间N2O累积排放量均达到显著水平(P<0.01)。
各含水量土壤,无C2H2处理N2O累积排放量均显著高于0.1%(V/V)C2H2处理(P<0.01),这说明0.1%(V/V)C2H2处理有效抑制了硝化过程中的自养氨氧化过程;同时,10%(V/V)C2H2处理N2O累积排放量均显著高于0.1%(V/V)C2H2处理(P<0.01),这表明10%(V/V)C2H2处理有效抑制了N2O还原成N2的过程(表1)。
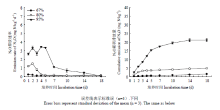 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同含水量土壤培养期间N2O排放速率(A)和累积排放量(B)
-->Fig. 1N2O flux and cumulative emissions under different water contents during incubation time
-->
2.2 土壤中无机氮NH+ 4-N和NO- 3-N
培养期间,土壤中NH+ 4-N和NO- 3-N浓度变化说明了氮的转化过程。各处理土壤NH+ 4-N浓度大体上均呈逐渐下降趋势。中、低含水量处理,土壤NH+ 4-N浓度在培养开始后急剧下降,至培养第3天分别降低了95.54%和97.22%,之后稍有波动,但变化不大。高含水量处理NH+ 4-N浓度与另外两个处理相比下降缓慢,到培养第3和10天分别减少了49.85%和77.89%(图2-A)。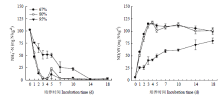 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同含水量土壤培养期间NH+ 4-N(A)和NO- 3-N(B)含量
-->Fig. 2Soil ammonium and nitrate contents under different water contents during incubation time
-->
土壤NO- 3-N含量在整个培养周期呈增加的趋势。中、低含水量处理,土壤中NO- 3-N浓度从培养开始至第3天迅速升高,之后未出现明显变化。至培养第18天,高、中和低含水量处理NO- 3-N浓度分别为80.66、101.54和100.03 mgN·kg-1(3个含水量NO- 3-N初始含量均为6.29 mgN·kg-1),高含水量处理与中、低含水量处理间差异显著(P=0.0086),中低含水量处理间差异不显著(图2-B)。
2.3 不同乙炔处理下反硝化产物N2O和N2O+N2的产生规律
N2O还原成N2的途径对于了解农业土壤中N2O消耗非常重要,并且这可能是一个考虑如何减缓N2O 排放的方向。0.1%(V/V)C2H2抑制自养氨氧化作用,10%(V/V)C2H2抑制N2O还原成N2,同时抑制自养氨氧化作用。本研究通过分析0.1%(V/V)C2H2和10%(V/V)C2H2处理组N2O排放通量来估测可能的反硝化产物(N2O+N2)排放量以及N2O/(N2O+N2)比率。培养期间,土壤反硝化作用产生的N2O和(N2O+N2)加权平均排放通量,高含水量处理(分别为0.85和1.11 mgN·kg-1·d-1)显著高于中(分别为0.22和0.33 mgN·kg-1·d-1)、低含水量处理(分别为0.06和0.08 mg·N·kg-1·d-1),两个较低含水量处理间也均达显著水平(均为P<0.0001;表1)。高、中和低含水量土壤N2O/(N2O+N2)比率分别为0.61、0.72和0.86,并且各水分处理间差异显著(P<0.0001),这说明,在67%WFPS处理下,只有14%的N2O还原成了N2,大部分以N2O形式排放到了外界环境中(表1)。2.4 土壤N2O的同位素特征
N2O峰值一般出现在施肥后一周内[34]。因此,以下探讨了培养第一周期间N2O同位素特征。N2O同位素特征值受土壤含水量的影响显著(图3)。对于N2O的δ15Nbulk和δ18O,各含水量处理间差异均达显著性水平(P<0.0001)。高、低含水量处理的SP值显著高于中含水量(P<0.0001)。所有处理下δ15Nbulk平均值均为负值,变化范围为从-43.95‰到-5.31‰,δ18O和SP平均值均为正值,变化范围分别为12.28‰—40.66‰以及10.30‰—21.58‰。土壤含水量对N2O同位素特征值影响利用相关性进行分析发现,WFPS与δ15Nbulk具有显著负相关关系(r=-0.77,P<0.0001),另外,其与δ18O和SP均无显著相关性;SP与δ15Nbulk呈显著正相关(r=0.34,P<0.01),与δ15Nbulk相比,SP与δ18O相关性更加显著(r=0.56,P<0.0001);δ15Nbulk和δ18O具有显著正相关关系(r=0.61,P<0.0001)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同含水量土壤培养第一周N2O同位素特征值(δ15Nbulk,δ18O和SP)
-->Fig. 3Isotope signatures of N2O under different water contents during the first week incubation
-->
土壤排放N2O的δ15Nbulk值随着土壤含水量的增加而减小(图3)。根据同位素分馏效应,添加NH+ 4会诱导土壤发生硝化作用,随着硝化作用进行,剩余底物会富集重同位素,导致NH+ 4的δ15N增加,这可能会促使N2O的δ15Nbulk发生显著变化,因此,可能会使利用δ15Nbulk区分N2O产生途径复杂化。研究发现,3个含水量在无C2H2处理下N2O的δ15Nbulk在培养第一周均呈增加趋势,变化范围为-54.78‰—3.62‰,这与之前的研究一致,即施用尿素和铵态氮肥料后,N2O的δ15Nbulk通常会随着培养时间升高[35,36]。δ15Nbulk加权平均值为高含水量(-42.93‰)<中含水量(-28.81‰)<低含水量(-4.07‰),且各水分处理间差异显著(P<0.0001)。
不加C2H2条件下,两个较高含水量处理N2O的δ18O值在培养第一周呈先降低后升高的变化趋势。整体上,3个含水量处理N2O的δ18O值在培养第一周呈增加趋势(图3)。各含水量土壤中,加0.1%(V/V)C2H2处理的δ18O值显著高于加10%(V/V)C2H2处理(P<0.01,表2),这或许可以解释为两种处理土壤中均主要发生反硝化作用,只是10%(V/V)C2H2会抑制土壤中N2O还原成N2的过程,而反硝化作用会消耗土壤中的NO- 3,并使土壤中剩余的NO- 3

Table 2
表2
表2两种C2H2处理对土壤N2O 同位素特征值(δ15Nbulk,δ18O, SP)的影响
Table 2The effect of two C2H2 treatments on N2O isotope signatures (δ15Nbulk,δ18O, SP)(‰)
| 处理 Treatments | 67% WFPS | 80% WFPS | 95% WFPS | ||||||
|---|---|---|---|---|---|---|---|---|---|
| SP | δ15Nbulk | δ18O | SP | δ15Nbulk | δ18O | SP | δ15Nbulk | δ18O | |
| CK | 21.07a | -4.07a | 32.15a | 10.26a | -28.81a | 21.69a | 20.70a | -42.93a | 27.14a |
| 0.1%(V/V)C2H2 | 19.96ab | -4.51a | 30.87a | 8.88a | -29.14a | 22.68a | 17.38a | -43.33a | 28.29a |
| 10%(V/V)C2H2 | 18.67b | -4.34a | 28.35b | 5.95b | -33.07a | 16.73b | 15.71b | -41.97a | 25.18a |
新窗口打开
2.5 基于SP值的硝化和反硝化过程对土壤N2O排放的贡献率
不加C2H2各处理SP值在培养第一周均呈先升高再下降的趋势(图3)。高、中和低含水量土壤N2O的SP加权平均值,不加C2H2处理下分别为20.70‰、10.26‰和21.07‰,这与之前纯培养研究相比,高于反硝化作用SP值(-10‰—0‰),低于硝化作用SP值(33‰—37‰)[39],这说明在各含水量土壤中可能同时具有多个N2O产生途径。0.1%(V/V)C2H2处理下高、中和低含水量的SP加权平均值分别为17.38‰、8.88‰和19.96‰,10%(V/V)C2H2处理下,高(15.71‰)、中(5.95‰)和低(18.67‰)含水量土壤N2O的SP加权平均值分别比0.1%(V/V)C2H2处理降低了10%、33%和6%。该结果表明,反硝化过程中可能发生N2O还原(表2)。低含水量处理的SP值在培养前两天均较低(分别为6.74‰和12.04‰),以反硝化作用为主,分别占N2O生成量的66.15%和56.36%;之后主要以硝化作用为主;中含水量土壤的SP值在培养第1—7天均较低(3.92‰—15.21‰),N2O主要由反硝化作用产生,由反硝化作用排放的N2O贡献率为40.90%—74.04%(表3);高含水量处理10%(V/V)C2H2的SP值在培养第一周比较高(7.61‰—21.11‰),而添加10%(V/V)C2H2处理会抑制自养氨氧化过程以及N2O还原成N2过程,故该处理不会因此出现较高的SP值,这说明可能发生了部分真菌反硝化作用。MAEDA等通过研究67种真菌发现其SP平均值为30‰±4.8‰(测得的SP值范围为15.8‰—36.7‰)[40]。Table 3
表3
表3不同含水量土壤硝化和反硝化作用对N2O排放的贡献率
Table 3Contribution of nitrification and denitrification to N2O emission under different soil moisture levels(%)
| 培养时间 Incubation time(d) | 67% WFPS | 80% WFPS | 95% WFPS | |||
|---|---|---|---|---|---|---|
| 硝化作用Nitrification | 反硝化作用Denitrification | 硝化作用 Nitrification | 反硝化作用Denitrification | 硝化作用Nitrification | 反硝化作用Denitrification | |
| 1 | 33.85±0.98 | 66.15±0.98 | 25.96±6.23 | 74.04±6.23 | 67.45±4.64 | 32.55±4.64 |
| 2 | 43.64±8.01 | 56.36±8.01 | 27.26±1.06 | 72.74±1.06 | 79.65±13.94 | 20.35±13.94 |
| 3 | 100 | 0 | 53.82±10.59 | 46.18±10.59 | 90.48±8.25 | 9.52±8.25 |
| 4 | 100 | 0 | 59.10±21.75 | 40.90±21.75 | 92.99±12.14 | 7.01±12.14 |
| 5 | 86.44±13.52 | 13.56±13.52 | 45.01±15.01 | 54.99±15.01 | 92.07±4.79 | 7.93±4.79 |
| 7 | 55.78±8.91 | 44.22±8.91 | 42.64±16.76 | 57.36±16.76 | 65.75±10.22 | 34.25±10.22 |
| 加权平均值 Weighted mean | 67.93 | 32.07 | 42.35 | 57.65 | 79.16 | 20.84 |
新窗口打开
3 讨论
相似,高、中含水量土壤N2O累积排放量分别比低含水量处理高13.23倍和2.22倍,这可能是由于随着土壤含水量(WFPS)的增加,水不断充满土壤孔隙,O2向土壤中扩散受到限制,土壤的厌氧条件逐渐增强并促进反硝化作用,N2O也随之大量产生并排放出土壤[46,47]。随着土壤含水量(WFPS)增加,N2O排放量增加,在含水量为80%—95% WFPS条件下出现最大的N2O排放量[48]。当土壤水势达到-5 kPa(约为97% WFPS),出现最大的N2O排放量,土壤含水量(-2.5 kPa)进一步增加,N2O产生量减少,可能是由于N2O还原速率增加[49,50]。但是,也有研究提出在70% WFPS下出现较高的N2O排放量[11]。DAVIDSON研究发现,最大N2O排放量产生于60% WFPS,硝化作用和反硝化作用对N2O产生均具有重要作用[6]。出现该矛盾原因可能是由试验和土壤类型的不同导致。同一土体中可以同时发生多个N2O产生过程,利用稳定同位素与C2H2(0.1%和10%V/V)抑制相结合的方法可以确定自养硝化作用和反硝化作用对土壤N2O排放的贡献率。本研究发现自养硝化作用和反硝化作用对土壤排放N2O的贡献率随着土壤含水量的变化而有所不同,但绝对贡献率因所选择的方法不同有很大的差异。仅利用乙炔抑制技术估测的反硝化作用(含水量为67%—80% WFPS时贡献率为82%—83%)对N2O排放贡献率大于同位素技术(含水量为67%—80% WFPS时贡献率为32%—58%)测得的结果,利用两种方法估测反硝化作用对N2O排放的贡献率,大于25%的差异仅出现在67% WFPS条件下,这有可能是乙炔抑制技术忽略了异养硝化作用对土壤排放N2O的贡献。但是,不同途径对土壤N2O排放的贡献随着土壤含水量的变化趋势是相同的。
在大部分生态系统中,反硝化作用是主要的N2O产生途径。其最后一步是N2O还原酶将中间产物N2O还原成N2的过程,这步反应对估测N2O消耗、了解土壤中氮积累和排放到大气中的气态氮量至关重要,并且这可能是如何减缓N2O排放的重要方向。反硝化产物N2O/(N2O+N2)比率用于评估N2O转化为N2的程度,变化范围从0(所有的N2O全部转化为N2)到1(N2O是反硝化过程的唯一最终产物)[51]。本研究发现,土壤含水量越高,土壤排放的N2O转化成N2的比例越高,土壤排放到外界环境的N2O绝对量也越高。这将会导致更多的N2O排放到大气中,加剧温室效应。之前的一些研究也提出较高含水量的土壤出现最大的N2O排放量[8,48],这与本研究结果一致。这说明可以通过控制土壤水分条件来减缓N2O排放。
一些文献报道δ15Nbulk是区分硝化作用和反硝化作用的重要指标,这是因为与反硝化作用相比,硝化作用会加速δ15N-NO- 3贫化[35,52],其他****主张δ15Nbulk取决于底物来源NH+ 4和NO- 3以及土壤异质性,并没有考虑N2O还原过程对剩余N2O的影响[28,53]。本研究发现施用NH+ 4后,由于硝化过程中同位素分馏导致δ15Nbulk值随着培养时间逐渐升高。底物(NH+ 4)充足,硝化作用产物NO- 3受底物影响,根据同位素分馏原理,微生物优先利用轻同位素,导致δ15N-NO- 3 逐渐贫化,而发生反硝化作用的底物几乎全部来自于硝化作用产物(NO- 3),故反硝化作用占据主导地位的较高土壤含水量,其δ15Nbulk值越低,本研究显示δ15Nbulk值随着含水量的增加而降低(δ15Nbulk加权平均值,95% WFPS处理<80% WFPS处理<67% WFPS处理)。
δ18O值受N2O向N2还原过程的影响,同时O2,H2O与NO- 3之间的O原子交换也会影响其大小[54,55]。与δ15Nbulk和SP相比,对N2O分子中δ18O的解释更为复杂[56]。N2O-O可能来源于不同途径,理论上,硝化细菌-反硝化过程中(NH+ 4→NH2OH→NO- 2→NO→N2O)一半的氧原子来自于空气中O2,另一半氧原子来自于H2O,羟胺氧化过程中,100%的N2O-O来源于O2[54]。如果反硝化细菌利用NO- 3产生N2O,那么N2O中所有的O都来自于NO- 3。但是在实际环境中,H2O-O与NO- 2-O和NO- 3-O发生氧交换,且H2O-O和NO- 3-O对N2O-O的贡献与微生物种类有关[55]。基于以上理论和研究结果,采用δ18O-N2O值对N2O来源进行分析比较复杂,需要考虑多种因素。本试验中,δ18O与乙炔抑制技术相结合,提高了其准确性。各含水量土壤中,0.1%(V/V)C2H2处理组的δ18O值显著高于10%(V/V)C2H2处理组(P<0.01),这可能是由于两种处理土壤中均主要发生反硝化作用,只是10%(V/V)C2H2会抑制土壤中N2O还原成N2的过程,而反硝化作用会消耗土壤中的NO- 3,并使土壤中剩余NO- 3富18O,增加其δ18O值。有研究提出,反硝化过程中发生N2O还原会使N-O键断裂,导致剩余N2O相对富集δ15Nα和δ18O[34,37-38]。尽管一些研究中利用δ18O来区分N2O产生途径[53,57],但是只依靠δ18O-N2O 值对N2O来源进行分析仍备受争议,如果δ18O与其他同位素值(如δ15N,SP)结合来分析,可能会提高其准确性。
与δ15Nbulk和δ18O相比,SP值是区分土壤N2O排放途径的一种重要工具,其优势在于受样品干扰小,与N2O前体的δ15N同位素组成没有相关关系[24-25-26-]。一般随着土壤含水量(WFPS)的增加,土体的厌氧体积逐渐增大并使反硝化作用加强,N2O也随之大量产生并排放出土壤[46,47]。本研究高含水量处理厌氧体积高于中含水量处理,其SP值之所以高于中含水量处理,可能是发生了部分真菌反硝化作用[27]。MAEDA等[40]通过对67种真菌测试发现,其SP平均值为30.0‰±4.8‰(变化范围为15.8‰—36.7‰)[40]。另有文献报道真菌产生N2O的SP值为36.9‰—37.1‰,这与细菌硝化作用的相似(34.1‰—39.6‰)[27]。
本研究利用同位素技术结合乙炔抑制技术,高含水量处理中,加10%(V/V)C2H2只发生反硝化作用,其会抑制自养氨氧化过程和N2O还原成N2的过程,故该处理不会因为这两个过程而产生较高的SP值[26],而95% WFPS在10%(V/V)C2H2条件下土壤排放N2O的SP加权平均值为15.71‰,这正说明高含水量处理中发生部分真菌反硝化作用。与细菌反硝化作用相比,真菌反硝化作用和硝化作用排放N2O的过程均会产生较高的SP值[27]。因此,利用同位素技术区分细菌硝化作用和真菌反硝化作用产生的N2O遇到挑战[27]。另外,较高土壤含水量更有利于反硝化反应的发生,而施加硫酸铵后,虽然同样产生厌氧环境,由于硫酸铵提供大量可利用氮,在土壤表层硝化反应得到促进。除此之外,SP值会随着N2O还原过程发生变化,使对N2O产生途径评估产生偏差。由完全的硝化作用和细菌反硝化作用产生N2O的SP值,分别约为33‰和0‰,还原过程会使SP值升高[26],这与本研究结果一致。高、中和低含水量土壤,10%(V/V)C2H2处理组N2O累积排放量分别比0.1%(V/V)C2H2处理增加了26%、40%和16%,说明未加10%(V/V)C2H2处理的土壤发生N2O还原过程;同时,与10%(V/V)C2H2处理相比,0.1%(V/V)C2H2处理下高、中和低含水量的SP加权平均值分别升高了11%、49%和7%,这正验证了该理论。根据同位素二源混合模型,以上过程会使由SP值估测的N2O产生途径低估反硝化作用对N2O排放的贡献[26,58]。
与示踪技术相比,利用自然丰度同位素技术(例如SP值的运用)不需要人为标记培养、操作方便,具有明显优势。但是微生物氮循环过程相当复杂,对SP值用于区分N2O产生途径的方法应慎重利用,如硝酸盐异化还原成铵和异养硝化作用也会产生N2O[11,59-60],并影响氮循环过程中一些含氮化合物的同位素特征值。目前为止,这些过程对土壤产生N2O的15N的SP值的影响还不明确[61]。因此,本研究并未对这些过程对SP值的影响进行分析。虽然SP值在应用中存在一些不足,但其确实是一种有效的N2O溯源方法,并已在国际上得到广泛认可。当下中国对SP值研究刚刚起步,本文对其进行初步探讨,接下来将进一步探究微生物群落结构及其酶组成对土壤产生N2O的同位素特征值随时间变化的影响,从而能提高利用SP值区分N2O产生途径的准确性;另外,土壤反硝化的NO- 3还原成N2O过程中,真菌和细菌反硝化作用对土壤产生N2O的贡献及其对SP值变化的影响,也需要做进一步研究。
4 结论
本试验将自然丰度的同位素技术与乙炔抑制技术相结合测定不同含水量(WFPS)下硝化作用和反硝化作用对土壤N2O排放的贡献率。随着土壤含水量增大,N2O排放量增加。各处理均在前4天具有较高的N2O排放量,之后排放量相对较小,并且变化不大。随着土壤含水量增加,N2O/(N2O+N2)比率降低,土壤以N2O形式排放到大气中的比例降低,以N2形式排放到大气中的比例升高,N2O还原过程增强。本研究通过SP值估算硝化和反硝化作用的贡献率得出,培养前7 d内,67% WFPS土壤N2O排放以硝化作用为主,且在前2 d以反硝化作用为主,之后主要通过硝化作用排放N2O。在一定范围内,含水量升高会使反硝化作用增强。The authors have declared that no competing interests exist.
