0 引言
【研究意义】土壤微生物是土壤生物区系中最重要的功能组分,参与土壤有机质的分解及腐殖质的形成等过程[1],在土壤生态系统中发挥着重要作用,可用来反映土壤质量的变化。土壤质量的变化是一个相对缓慢的过程,期间环境条件也在不断地发生难以预测的变化,因此,长期农田肥料试验对研究土壤质量演化具有重要价值[2]。土壤微生物能在土壤有机质变化被测度之前对土壤的变化提供可靠的预警,是表征土壤质量变化的敏感指标之一[3-4]。随着研究的广泛、深入,有很多方法被引入到土壤微生物研究中,其中,PLFA生物标记法方法灵敏且具备快速、直接、有效地提供较为客观可靠的土壤微生物含量、组成及群落信息等优点而被广泛运用[5-6] 。【前人研究进展】张焕军等[7]在潮土上的研究发现,有机肥的长期施用提高了土壤微生物PLFA总量和细菌的生物量,却抑制了放线菌的生长;GUNNAR等[8]对瑞典饱和始成土的研究指出,与长期单施无机肥相比,长期施用有机肥料会增加土壤总PLFA含量,却对真菌生物量无影响,pH会抑制革兰氏阴性菌的生长;KAMAA等[9]的研究发现长期施用有机肥可提高腐殖质黏绨土(humic nitisol)真菌和细菌的多样性;夏昕等[10]认为有机肥施用会显著增加红壤性水稻土细菌和放线菌的生物量。尽管应用PLFA方法对不同土壤微生物群落结构的研究已较多,但结果不尽相同,在不同土壤类型和气候条件下的进一步工作仍具有重要意义。【本研究切入点】土是陕西省关中平原的主要土壤类型,对其土壤微生物群落功能的研究已有一些报道[11-12],但PLFA研究报道较少。本文采用PLFA方法研究不同施肥和土壤管理方式土壤微生物群落的变化,对于评价施肥对关中地区土土壤质量的影响具有重要意义。【拟解决的关键问题】本研究以陕西杨凌国家黄土肥力与肥料效益监测基地的长期肥料定位试验为平台,探讨长期施用化肥、有机无机配施及不同土壤管理方式(休闲和撂荒)对土壤微生物群落结构产生的影响,为合理的肥料管理措施制定及土壤可持续利用提供决策依据。1 材料与方法
1.1 试验地点与试验设计
试验在“国家黄土肥力与肥料效益监测基地”进行,位于陕西杨凌示范区五泉镇 (34°17′51″N,108°00′48″E),海拔516 m,年平均气温13℃,≥10℃积温4 196.2℃,年均降水量550—600 mm,主要集中在7—9月,年均蒸发量993 mm,无霜期184—216 d。供试土壤为土垫旱耕人为土,黄土母质。长期试验始于1990年秋,共设13个处理,本研究选用其中8个处理,即:(1)长期不施肥(CK);(2)长期施氮肥(N);(3)施氮钾肥(NK);(4)施磷钾肥(PK);(5)施氮磷肥(NP);(6)有机肥与氮磷钾肥配施(MNPK);(7)休闲(FL),与农田同样耕作,不施肥,期间及时除草,基本保持没有植被生长;(8)撂荒(AB),不施肥,自然生长荒草。其中撂荒和休闲的小区面积为98 m2(7 m×14 m),其余处理的小区面积均为196 m2(14 m×14 m),各处理均单次重复。施肥处理的种植制度实行当地普遍采用的冬小麦—夏玉米一年两熟制。冬小麦所有肥料于播种前一次施入,氮肥用量为165.0 kg N·hm-2,磷肥为132.0 kg P2O5·hm-2,钾肥为82.5 kg K2O·hm-2;夏玉米于大喇叭口期结合中耕除草施入,用量187.5 kg N·hm-2,56.25 kg P2O5·hm-2,93.75 kg K2O·hm-2。有机肥与氮磷钾配施处理,有机肥仅小麦季施用,总施氮量与其他无机肥处理相等,有机肥氮:无机肥氮=7:3,未考虑有机肥带入的磷钾量;玉米季全部为无机肥。小麦生长期内灌溉1—2次,每次灌水量为90 mm左右。玉米的灌溉根据降雨情况而定,一般2—3次,每次灌水量也为90 mm左右。
1.2 土壤样品的采集与处理
于2013年6月小麦收获后采集各处理0—20 cm耕层土样。采样时每小区采9点组成一个混合样品,重复采集3次,样品装入塑封袋并置于冰盒中运回实验室。新鲜样品剔除动植物残体,过2 mm筛后分两部分,一部分土样保存在-80℃,用于PLFA分析;其余土样风干测定基本理化性状。1.3 测定项目及方法
pH用水浸提(水土比为1:1)法测定;有机碳、全氮分别用重铬酸钾容量法、硫酸消煮-凯氏定氮法测定;速效磷、速效钾分别用NaHCO3浸提-钼锑抗比色法、NH4OAC浸提-火焰光度法;土壤水分含量用烘干法测定;土壤容重测定采用环刀取土烘干称重法,每个处理平均划分为3个区域,作为3次重复(表1)。Table 1
表1
表1供试土壤理化指标(平均值)
Table 1Properties of tested soils (Mean)
| 处理 Treatment | 土壤有机质 SOM (g·kg-1) | 全氮 Total N (g·kg-1) | 速效磷 Olsen-P (mg·kg-1) | 速效钾 Available K (mg·kg-1) | pH | 容重 Bulk density (g·cm-3) |
|---|---|---|---|---|---|---|
| CK | 12.85e | 0.90e | 1.90d | 166.50h | 8.19a | 1.49b |
| N | 14.54d | 1.06d | 2.60d | 183.48f | 8.18a | 1.51a |
| NK | 14.12d | 1.02d | 2.30d | 393.53c | 8.21a | 1.47cd |
| PK | 15.48d | 1.02d | 51.17b | 402.76b | 8.17a | 1.46de |
| NP | 18.64c | 1.19c | 39.20c | 173.58g | 8.08b | 1.45e |
| MNPK | 26.85a | 1.73a | 138.54a | 424.10a | 7.99c | 1.40f |
| FL | 15.10d | 1.04d | 4.48d | 229.09e | 8.16a | 1.47cd |
| AB | 19.98b | 1.27b | 3.28d | 310.15d | 7.99c | 1.48bc |
新窗口打开
土壤微生物磷脂脂肪酸(PLFA)的测定采用BOSSIO等[13]的方法进行提取:称取3 g冷冻干燥土样于Teflon试管中,用柠檬酸缓冲溶液(pH 4.0):氯仿:甲醇(体积比为0.8:1:2)振荡提取总脂类,经过SPE硅胶柱分离去除中性脂、糖脂,从而得到磷脂,碱性甲酯化后,用Agilent7890A气相色谱仪分析PLFA的成分,内标为正十九烷酸甲酯(19:0),各成分脂肪酸通过MIDI Sherlock软件进行微生物的鉴定。
研究发现,从土壤中直接提取磷脂类化合物的量,可以准确表达微生物的生物量[14](表2)。PLFA的命名采用以下原则[15]:X:YωZ(c/t),其中:X为碳原子总数;Y代表不饱和烯键的数目;ω表示甲基末端;Z为烯键或环丙烷链的位置,前缀a(anteiso)和i(iso)分别代表支链的反异构和异构,cy代表环丙基支链;后缀c和t分别代表顺式和反式同分异构体;10Me表示1个甲基团在距分子末端第10个碳原子上。
1.4 数据处理
PLFA测定的数据按公式(1)、(2)、(3)分别计算Shannon-Winner多样性指数H、Simpson 优势度D和Pielou均匀度指数J[19]。Shannon-Wiener多样性指数(H):H=-∑PilnPi (1)
Simpson优势度指数(D):D=1-∑Pi2 (2)
Pielou均匀度指数(J):J=-∑PilnPi/lnS (3)
Table 2
表2
表2估算微生物生物量的脂肪酸
Table 2The PLFAs used to evaluate the microbial biomass
| 微生物类群 Microbial community | 磷脂脂肪酸标记 PLFA Markers | 文献 Reference | |
|---|---|---|---|
| 细菌 Bacteria | 饱和脂肪酸 Saturated Fatty Acid | 14:0, 15:0, 16:0, 17:0, 18:0, 20:0, 22:0, 24:0, 10Me22:0 | [14-15] |
| 革兰氏阳性菌 Gram-positive | i15:0, a15:0, i16:0, i17:0, a17:0, i17:1ω9c, i22:0 | [16] | |
| 革兰氏阴性菌 Gram-negative | 16:1ω7c, 17:1ω8c, 18:1ω9c, 18:1ω7c, 18:1ω5c, cy19:0ω7c, 22:1ω5c | [16] | |
| 放线菌 Actinomycete | 10Me17:1ω7c, 10Me18:0, 10Me16:0 | [14-15,17] | |
| 真核生物 Eukaryot | 18:3ω6c, 16:3ω6c, 22:2ω6c | [17] | |
| 真菌 Fungi | 18:2ω6c | [18] | |
| 丛枝菌根真菌 AM Fungi | 16:1ω5c | [18] | |
新窗口打开
式中,Pi为特征脂肪酸占该试验中总的特征脂肪酸个数比例,Pi=Ni/N,Ni为处理i的特征脂肪酸个数,N为该试验中总特征脂肪酸个数,S为特征脂肪酸i在供测土样中出现的次数。
试验所得数据采用SPSS19.0、CANOCO4.5软件分别进行方差分析、主成分分析和冗余分析(RDA分析)。
2 结果
2.1 PLFA总量
MNPK、NP和撂荒(AB)处理土壤PLFA总量显著高于其他处理,分别比CK土壤高218.8%、 73.9和74.3%;休闲(FL)最低,而N、NK和PK土壤PLFA总量与CK相似(表3)。Table 3
表3
表3不同施肥和土壤管理方式下土壤微生物PLFA含量(平均值)
Table 3Content of soil microbial PLFAs under different fertilizations and soil managements (Mean)
| 处理 Treatment | 总磷脂脂肪酸 Total PLFA (nmol·g-1) | 细菌 Bacteria (nmol·g-1) | 真菌 Fungi (nmol·g-1) | 放线菌 Actinomycete (nmol·g-1) | 革兰氏阳性菌 Gram-positive (G+)(nmol·g-1) | 革兰氏阴性菌 Gram-negative (G-)(nmol·g-1) | 真菌/细菌 Fungi/ Bacteria | 革兰氏阳性菌/革兰氏阴性菌 G+/ G- |
|---|---|---|---|---|---|---|---|---|
| CK | 13.59c | 10.33c | 0.61de | 0.80b | 2.07c | 1.74c | 0.06bc | 1.19bc |
| N | 13.65c | 10.35c | 0.60de | 0.82b | 2.11c | 1.77c | 0.05c | 1.20bc |
| NK | 13.66c | 10.30c | 0.63de | 0.84b | 2.11c | 1.78c | 0.06bc | 1.19bc |
| PK | 13.62c | 10.31c | 0.64d | 0.61c | 2.12bc | 1.73c | 0.06bc | 1.23b |
| NP | 23.64b | 18.68b | 1.29c | 0.97a | 2.13b | 2.37b | 0.07b | 0.90d |
| MNPK | 43.31a | 29.78a | 2.53a | 0.99a | 2.31a | 2.62a | 0.08a | 0.88d |
| FL | 10.25d | 9.44d | 0.30e | 0.60c | 1.65e | 1.07e | 0.03d | 1.54a |
| AB | 23.67b | 18.86b | 1.62b | 0.93a | 1.84d | 1.65d | 0.08a | 1.11c |
新窗口打开
2.2 PLFA指纹
土土壤微生物PLFA特征,以细菌为主体(9.44—29.78 nmol·g-1),其次为革兰氏阳性菌(1.65—2.31 nmol·g-1),再次为革兰氏阴性菌(1.07—2.62 nmol·g-1),真菌和放线菌最低。各土壤细菌PLFA变化趋势与PLFA总量变化趋势一致;MNPK、NP和AB土壤真菌含量显著高于其他土壤,分别比CK高315.5%、111.5%和165.6%,而N、NK和PK土壤真菌含量与CK相似,FL最低但与CK差异不显著;MNPK、NP和AB土壤放线菌含量显著高于其他土壤,分别比CK土壤高23.7%、21.3%和16.3%,PK和FL最低,而N和NK土壤放线菌含量与CK土壤相近;MNPK土壤G+和G-含量最高,NP次之,AB和FL最低,而N、NK和PK土壤与CK相近(表3)。由表3可见,MNPK和AB处理土壤真菌/细菌比显著高于其他处理,NP次之,FL最低,而N、NK和PK土壤真菌/细菌比与CK相近;FL处理土壤G+/G-显著高于其他处理,MNPK和NP最低,而N、NK、PK和AB与CK相近。
MNPK、NP和AB的土壤微生物的Shannon- Winner多样性指数显著高于其他处理,N、NK和PK次之,FL与CK最小且显著低于其他处理。MNPK土壤微生物的Simpson优势度指数显著高于其他处理,FL最低,N、NP和AB与CK相近。MNPK、NP和N土壤微生物的Pielou均匀度指数显著高于其他处理,AB、NK和PK次之,FL最低(表4)。
Table 4
表4
表4不同施肥和土壤管理方式下土壤微生物多样性指数(平均值)
Table 4Soil microbial diversity indices under different fertilizations and soil managements (Mean)
| 处理 Treatment | 多样性指数 Shannon-Winner Diversity Index (H) | 优势度指数 Simpson Dominance Index (D) | 均匀度指数 Pielou Evenness Index (J) |
|---|---|---|---|
| CK | 2.408c | 0.900b | 0.779e |
| N | 2.582b | 0.903b | 0.840a |
| NK | 2.576b | 0.888cd | 0.811cd |
| PK | 2.549b | 0.886d | 0.802d |
| NP | 2.800a | 0.896bc | 0.832ab |
| MNPK | 2.828a | 0.915a | 0.824bc |
| FL | 2.424c | 0.859e | 0.784e |
| AB | 2.799a | 0.895bc | 0.815cd |
新窗口打开
PCA分析表明,N、NK和PK土壤微生物群落结构与CK相似,而MNPK、NP、AB和FL土壤微生物群落结构发生较大变化;MNPK显著提高革兰氏阴性菌(18:1ω5c,cy19:0ω7c)、细菌(16:0,10Me22:0饱和脂肪酸)及真核生物(18:3ω6c,16:3ω6c,22:2ω6c)的多度值,AB和NP显著提高细菌(15:0,18:0,22:0,17:0饱和脂肪酸)的多度值(图1)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同施肥和土壤管理方式下土壤微生物群落PLFA的主成分分析射线代表土壤微生物PLFA,圆圈代表处理,每个处理后的数字1、2、3代表处理的3次重复,处理之间的线段距离越短代表土壤微生物结构差异性越小,反之越大
-->Fig. 1PCA of PLFAs of soil microbial communities of different long-term fertilizations and soil managementsRays represent soil PLFAs, circles represent treatments, the number1, 2 and 3 after the treatments represent three replicates, the shorter the lines between treatments represent the smaller the soil microbial structure difference, vice versa
-->
2.3 PLFA与土壤理化指标的关系
为了探讨PLFA与土壤理化性质之间的关系,对二者进行冗余分析(RDA)。由表5可见,对土壤微生物菌群影响的重要性由大到小依次为有机质、全氮、含水量、速效磷、pH、容重和速效钾。除速效钾对土壤微生物影响显著外(P<0.05),其他理化指标均对土壤微生物群落结构影响极显著(P<0.01),说明这些理化因子均是影响微生物群落的关键因子。Table 5
表5
表5理化因子变量解释的重要性排序和显著性检验结果
Table 5Importance and significance levels of physico-chemical parameters
| 土壤理化指标 Soil physicochemical parameters | 重要性排序 Importance rank | 理化因子所占解释量 Variance explanation of different parameters (%) | F | P | 膨胀因子 Inflation factor |
|---|---|---|---|---|---|
| 有机质 Organic matter | 1 | 73.9 | 62.2 | 0.002 | 56.9 |
| 全氮 Total N | 2 | 72.2 | 57.3 | 0.002 | 25.7 |
| 含水量 Water content | 3 | 63.6 | 38.5 | 0.002 | 20.0 |
| 速效磷 Olsen-P | 4 | 62.2 | 36.2 | 0.002 | 9.7 |
| pH | 5 | 54.8 | 26.6 | 0.002 | 8.0 |
| 容重 Bulk density | 6 | 47.0 | 19.5 | 0.002 | 9.7 |
| 速效钾 Available K | 7 | 18.0 | 4.8 | 0.044 | 4.9 |
新窗口打开
有机质和全氮具有较高的膨胀因子(>20),表明与其他因子具有较高的多重共线性[20],因此对其他因子进行T-value检验,明确各指标与各微生物类群的关系。从图2-a可以看出,真菌、细菌和总PLFA完全落在含水量的实线圈内,表明随着含水量的增加,土壤真菌、细菌和总微生物量将呈现明显增加的趋势;速效磷对革兰氏阳性菌、真核生物和丛枝菌根真菌有显著促进作用(图2-b);真菌、细菌和总PLFA完全落在pH的虚线圈内,表明pH的升高会显著降低细菌、真菌和总微生物量的含量(图2-c);土壤容重的升高会显著增加真核生物和丛枝菌根真菌的生物量(图2-d);土壤速效钾与细菌呈显著正相关(图2-e)。
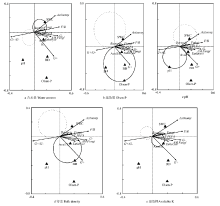 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2单一理化因子对土壤PLFA影响的T-value检验结果T PLFA:土壤微生物PLFA总量;实线圈区域表示正相关;虚线圈区域表示负相关
-->Fig. 2T-value test result of influence of single physic-chemical parameter on soil PLFAT PLFA: Total of PLFA; Solid circle area represents a positive correlation; Dashed circle area represents a negative correlation
-->
3 讨论
本研究表明,与CK相比,长期施NP肥土壤中细菌、真菌、放线菌和革兰氏细菌明显提高,这是由于NP肥的施入会增加作物产量,从而增加了根茬及根分泌物的投入,因此增加了微生物碳源,促进了其生长[21]。N、NK和PK土壤细菌、真菌、放线菌、革兰氏细菌和总PLFA含量无差异且明显低于NP处理,主要原因是供试土壤作物主要限制因子为N和P,长期不平衡施肥导致作物生长受到限制,随根茬等残落物及根分泌物进入土壤的有机碳显著低于NP处理[22]。PK土壤放线菌含量显著降低,这可能是因为长期磷钾施用加剧了矿质养分的不平衡,造成氮素供应严重不足,从而影响了放线菌的生长。HOGBERG等[23]的研究就发现氮元素的充足提供不仅增加放线菌的生物量,而且还会使稀有放线菌更多地出现。有机无机配施(MNPK)可显著提高土壤细菌、真菌、放线菌和总PLFA含量,可能原因有:(1)有机肥能使土壤中不能被植物所利用的有机态含氮化合物转化为可给态氮[24],可以为微生物提供更多的可利用底物;(2)有机肥本身含有大量活的微生物、活性有机碳源和能源,会起到“接种”和“导入”作用;(3)施用有机肥会使土壤pH显著下降(表1),同时会使土壤有效水分得到改善[25],pH下降和含水量升高均会会促进细菌、真菌的生长(图2-d)。闫浩等[26]的研究结果也表明土壤微生物 PLFA 含量与土壤含水率显著正相关,在良好的土壤水分条件下土壤微生物各类群活性较强。PCA分析也进一步表明MNPK显著提高16:0和10Me22:0等饱和脂肪酸的多度值(图1)。裴雪霞等[27]的研究指出,施用有机肥会显著增加土壤真菌和革兰氏阴性菌的生物量,却降低了细菌和放线菌的生物量,而ZHONG等[28]认为有机肥施用会显著增加土壤细菌和放线菌的生物量,造成结果不同的原因可能是土壤类型、环境及施肥的差异。休闲土壤因长期处于无地表植被覆盖的状态,即没有外源有机物的输入,使得土壤有机质处于消耗状态,因而降低土壤各菌群微生物量(表3)。PATERSON等[29]对草原和裸地的研究也表明长期没有植物残体施入的土壤中微生物的含量明显降低。撂荒处理因长期未扰动土层,根系多集中在土壤表层,且每年随地上部生物量和根系归还土壤的有机物料较多[12],有利于土壤细菌、真菌和放线菌的繁衍。休闲明显增加G+/G-,主要是因为G+更能适应饥饿环境[30],在肥力极低的休闲土壤中G+的生长速度比G-快。
有研究表明,真菌比细菌能更好地降解复杂化合物[31],此外真菌还能与作物共生形成菌根, 因此较高的农田真菌/细菌比对促进植物生长具有重要作用[32]。本研究中有机肥配施化肥处理结果与此一致,MNPK不仅显著提高土壤有机质、全氮、速效磷和速效钾(表1),为作物生长创造了良好的生长环境,还提高了真菌/细菌比。但与CWALINA等[33]和魏巍等[34]的结果不一致,其研究表明真菌细胞中的C/N比远高于细菌细胞,真菌群落需要从环境中摄取更多的有机质作为自身的营养物质,因此较低的农田真菌/细菌比可以为作物提供更加良好的生长环境。其原因有待结合宏基因组及高通量测序等手段进一步分析。
较高的生物多样性指数、均匀度指数和优势度指数,是生态系统稳定和健康的重要表现[35-36]。本研究长期有机无机配施能明显提高土壤微生物群落的Shannon-Winner多样性指数、Simpson 优势度和Pielou均匀度指数,丁伟等[37]也得到类似的结果。撂荒和NP显著提高土壤微生物群落的Shannon-Winner多样性指数和Pielou均匀度指数。说明土长期有机无机肥配施、NP和撂荒增加了土壤微生物种群密度,从而使土壤对抗病原菌的综合能力增强,同时保持了优势种群,因此改善了土壤的生态环境。而休闲却显著降低这些指数,因此长期休闲不利于土壤生态系统的稳定和健康。
土壤有机质是衡量土壤肥力的重要指标,合理施肥对土壤有机碳库功能及其演变过程均具有重要影响[2]。本研究RDA的分析结果表明,土壤有机质和全氮对土壤微生物菌群的影响最大,但在分析单因子对土壤微生物类群的影响时,有机质和全氮对所有微生物菌群则都没有显著的影响。多数研究结果表明土壤有机质和全氮与各微生物指标之间均呈显著正相关[38-39],这似乎和上述文献结果有一定的冲突,主要是因为土壤有机质和全氮与其他环境因子存在多重共线性,土壤有机质和全氮是通过其他因子对土壤微生物群落起作用的。通过对表1中不同环境因子之间的相关性分析也可以发现,土壤有机质和全氮的相关系数则达到0.98**,而土壤有机质与土壤水分(SWC)、速效磷、pH、容重和速效钾的相关系数分别为0.89**、0.83**、-0.87**、-0.81**、和0.48*,全氮则分别为0.88**、0.84**、-0.82**、-0.78**、和0.47*。这表明土壤有机质和全氮的提高可以进一步改善其他环境因子,进而对土壤微生物群落产生影响,也进一步证明了长期土壤培肥(如有机无机配施和平衡施肥等)在提高土壤肥力的同时对于促进土壤生态系统稳定和健康具有重要意义。
4 结论
长期有机无机肥配施、氮磷配施和撂荒显著提高了土细菌、真菌、放线菌PLFA量及真菌/细菌比,同时提高了土壤微生物群落结构多样性,从而改善了土壤的生态环境,而长期休闲不利于土壤生态系统的稳定和健康。土土壤养分对微生物菌群影响的重要性依次为有机质>全氮>含水量>速效磷>pH>容重>速效钾,土壤有机质和全氮通过影响其他因子进而影响土壤微生物群落结构。建立科学的施肥和管理制度,通过有机无机配施等培肥措施提高土壤肥力的同时改善土壤生物学特性对于促进土壤生态系统稳定和健康具有重要意义。The authors have declared that no competing interests exist.
