 , 周振翔, 李志康, 戴琪星, 孔祥胜, 王志琴, 杨建昌
, 周振翔, 李志康, 戴琪星, 孔祥胜, 王志琴, 杨建昌* 通讯作者(Corresponding author): 顾骏飞, E-mail: gujf@yzu.edu.cn, Tel: 0514-87979381 收稿日期:2015-08-19 接受日期:2016-01-11网络出版日期:2016-01-25基金:
摘要
关键词:水稻; 叶绿素; 光合作用; 高光效; 氮素
Effects of the Mutant with Low Chlorophyll Content on Photosynthesis and Yield in Rice
GU Jun-Fei
 , ZHOU Zhen-Xiang, LI Zhi-Kang, DAI Qi-Xing, KONG Xiang-Sheng, WANG Zhi-Qin, YANG Jian-Chang
, ZHOU Zhen-Xiang, LI Zhi-Kang, DAI Qi-Xing, KONG Xiang-Sheng, WANG Zhi-Qin, YANG Jian-ChangFund:
Abstract
Keyword:Rice; Chlorophyll; Photosynthesis; High photosynthetic efficiency; Nitrogen
Show Figures
Show Figures









光合作用不仅是水稻生长发育的基础, 也是产量的决定因素。水稻的光合作用是一个复杂系统, 受一系列内在生理生化途径和外界环境因子的调控。在低光条件下或饱和CO2浓度下, 类囊体上的电子传递受限或满足不了碳同化速率的需要, 进而影响ATP的合成, 影响RuBP再生(RuBP再生限制); 在饱和光强或低CO2浓度下, 暗反应关键酶Rubisco的数量与活性, 及反应底物CO2的浓度是限制光合作用的重要因素(Rubisco羧化限制); 在长期光照下, 大量形成的光合产物需要借助叶绿体被膜上的磷酸运转器及时运转出叶绿体, 此时光合速率受细胞质中无机磷运转速率限制(磷酸丙糖运转限制)[1, 2, 3, 4]。在现有大气CO2浓度下, 饱和光强下的光合速率主要受Rubisco酶催化效率影响, 而不受电子传递限制[5, 6]。植物吸收的光能远远满足植物的需要。饱和光强下C3植物的光能利用效率只有1.9%[7], 长时间过强的光照甚至会引起光系统II反应中心的破坏, 植物需要通过热耗散等机制来消除多余的光能, 从而减少活性氧的产生[8]。因此, 适当降低叶绿素含量或者光反应电子传递速率在理论上不会影响叶片的光合作用。Ort等[9, 10]提出如果能够降低植物叶片中叶绿素如天线色素、反应中心色素的含量, 将不仅有利于减少光抑制, 提高冠层中的光分布, 而且有利于氮素在光合系统内的分配, 提高光合氮素利用效率。相应的研究已经在藻类和蓝藻细菌中取得成功[11, 12], 在水稻中, 影响叶绿素合成的突变体的遗传学研究已经有诸多报道[13, 14, 15, 16, 17, 18, 19, 20], 但是叶色突变体对光合作用的生理学分析却很少, 尤其是叶绿素含量降低对提高水稻光合生理及其产量的报道较少。浙辐802是20世纪80年代中期至90年代中期在我国南方稻区推广面积最大的早籼常规品种。本研究在不同氮素
水平下, 探讨了浙辐802及低叶绿素含量突变体的光合生理生化特性, 分析了其在高光效育种中的潜在应用价值。
1 材料与方法1.1 试验材料与栽培概况试验于2014年在扬州大学实验农场进行。土壤类型为沙壤土, 土壤含有机质22.7 g kg-1、全氮1.96 g kg-1、速效氮96.5 mg kg-1、速效磷20.4 mg kg-1、速效钾120.0 mg kg-1。试验材料为低叶绿素含量突变体(YL)与其野生型对照(WT, 浙辐802)。低叶绿素含量突变体由籼稻品种浙辐802经物理辐射诱变而成, 由浙江大学程方民教授提供。该突变体已多年种植, 株型形态等遗传性状已经稳定。
大田试验于5月12日播种育秧, 6月7日插秧, 株行距为25 cm × 15 cm, 每穴2苗。采用随机区组设计, 设置3个氮肥处理, 即0N (全生育期不施氮肥)、MN (全生育期施纯氮120 kg N hm-2)和HN (全生育期施纯氮240 kg N hm-2)。小区面积为15 m2, 重复3次。氮肥作基肥(移栽前1 d施入)、分蘖肥(移栽后7 d施入)、穗肥(约移栽后40 d施入), 其比例分别为50%、20%、30%。移栽前各小区施用过磷酸钙(含P2O5 13.5%) 300 kg hm-2和氯化钾(含K2O 52%) 195 kg hm-2。按照常规高产栽培管理水分, 全生育期严格控制杂草与病虫害。
盆栽试验于5月12日播种, 大田育秧, 6月12日移栽至盆钵, 盆钵直径25 cm, 高30 cm, 内装过筛土18 kg (取自大田)。每盆3穴, 每穴2苗。盆栽种植密度约为61穴 m-2。盆栽密度较大田栽插密度高, 这是因为盆栽植物较大田植物长势弱, 为了使水稻群体内光照条件一致适当增加种植密度, 同时也考虑到盆与盆之间的间隔距离。设置氮肥处理0N (全生育期不施氮肥)、MN (中氮, 每盆1.8 g尿素)和HN (高氮, 每盆3.6 g尿素)。每盆施尿素移栽前∶ 移栽后7 d∶ 穗分化期(抽穗前30~35 d) = 5∶ 2∶ 3。对所有处理施0.5 g磷酸二氢钾(KH2PO4)作基肥。设置重复15盆。取样与光合生理测量时间为开花期。
1.2 取样与测定1.2.1 叶绿素含量、Rubisco酶含量的测定
取新鲜叶片0.2 g, 加少量石英沙和碳酸钙粉末, 2 mL 95%乙醇研磨呈匀浆状, 继续加乙醇研磨直至叶片变白。静置, 过滤至棕色瓶, 将滤纸上绿色洗净, 定容, 混匀, 以95%乙醇为空白, 分别在665 nm、649 nm和470 nm下测定吸光度, 并计算叶绿素含量[21]。参照Makino等[22, 23]的方法测定Rubisco酶含量。
1.2.2 光合参数与荧光参数测定
采用美国LI- COR公司生产的LI-6400便携式光合测定仪, 测定剑叶净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度。于晴天上午9:00— 11:00测定, 使用红蓝光源, 设定光量子密度(Photosynthetic Photo Flux Density, PPFD)为1000 µ mol m-2 s-1, CO2浓度为400 µ mol mol-1。
使用MINI-PAM-II (德国WALZ公司生产)测定剑叶叶绿素荧光参数。作用光1000 µ mol m-2 s-1, 饱和脉冲约4000 µ mol m-2 s-1, 闪光0.9 µ mol m-2 s-1, 间隔30 s。参照Genty等[24, 25]的方法测定并计算光适应状态下光化学效率(Fv′ /Fm′ )、光化学淬灭(qP)、PSII的实际量子产量(Φ PSII)。
1.2.3 光合响应曲线测定
于测定开始前1 d 将盆栽水稻移入人工气候室, 人工气候室温度设定为白天28℃ (12 h), 夜晚23℃ (12 h), 相对湿度65%, 光照强度为1000 µ mol m-2 s-1。使用LI-6400便携式光合测定仪测定光响应曲线, 设叶室内初始光照强度为1500 µ mol m-2 s-1, 分别控制叶片温度和叶室内空气湿度在25℃和65%。将叶片夹入叶室约10 min后调用自动程序, 设定叶室内光强梯度为2000、1500、1200、1000、800、600、400、200、150、100、50和0 µ mol m-2 s-1。每个光强下测定时间为3~4 min, 整个程序需要约40 min。
1.2.4 叶片的显微结构与叶绿体的超微结构观察
制作徒手切片, 于光学显微镜下观察。叶绿体超微结构的观测步骤如下。用锋利刀片将叶片从中部截断, 取离体叶片立即投入预冷的2.5%戊二醛中固定; 2 h后用0.1 mol L-1 pH 7.2的磷酸缓冲液(PBS)清洗3次, 每次15 min; 再用1% OsO4固定; 2 h后再用PBS清洗, 方法同上; 再经梯度浓度乙醇脱水; 环氧丙烷过渡; 环氧树脂浸透和包埋, 聚合成包埋块后在Ultra-Jung超薄切片机上切成50~70 nm的切片, 以醋酸双氧铀和柠檬酸铅双重染色, 最后置透射电子显微镜(Philips, CM100, 荷兰)下观察, 拍照并作记录。
1.2.5 水通道蛋白基因表达(实时荧光定量PCR技术)方法 测定水通道蛋白基因OsPIP1; 1、OsPIP1; 2、OsPIP1; 3表达量。参照TRIzol试剂(Invitrogen)使用说明书用叶片提取水稻总RNA。运用紫外分光光度法检测样品的RNA纯度。以1%的变性琼脂糖凝胶电泳检测RNA的完整性。
cDNA合成的准备反应体系含5× ExSeript RTase缓冲液2 μ L、dNTP混合液(各10 mmol L-1) 0.5 μ L、Oligo dT引物(50 mmol L-1) 0.5 μ L、ExScript RTase (200 U μ L-1) 0.25 μ L、RTase抑制剂(40 U μ L-1) 0.25 μ L、总RNA 500 ng, 加ddH2O至10 μ L, 稍离心后, 于PCR仪中42℃反应10~15 min (反转录反应), 95℃反应2 min (反转录酶的失活反应)。
两步法PCR扩增, 参照Sakurai等[26]设计水通道蛋白基因的引物。其中看家基因actin的正向引物为5′ -TGTAAGCAACTGGGATGA-3′ , 反向引物为5′ -CCTTCGTAGATTGGGACT-3′ 。参照TaKaRa SYBR Premix Ex Taq使用说明书配置反应体系。25 μ L反应体系含SYBR Premix Ex Taq 12.5 μ L、正向和反向引物各1.0 μ L、cDNA模板2.5 μ L、无菌水8.0 μ L。将配制混合物充分混匀后平均分配至48孔PCR板中。创建反应管设置文件后, 设置PCR热循环文件。然后启动程序, 运行状态监控。在调整baseline cycles和计算threshold value (阈值)后, 进行实时数据分析。
1.3 生育期记录及考种计产记录各材料各处理生育期, 并于成熟期取各小区中间4 m2水稻考种计产, 测定产量各构成因素。
1.4 数据处理用Microsoft Excel软件整理数据, SAS软件统计分析数据, SigmaPlot 10.0绘图。
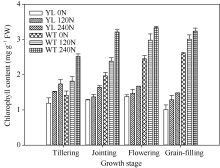
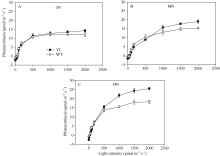
2 结果与分析2.1 突变体材料与野生型材料叶片叶绿素含量与光合差异突变体叶片中叶绿素的含量较野生型品种显著减少(图1)。在氮空白(0 kg N hm-2), 中氮(120 kg N hm-2), 高氮(240 kg N hm-2)处理中, 突变体叶片中叶绿素含量平均分别比野生型对照材料低44%、51%与51%。但是叶绿素含量的降低并没有抑制光合速率(图2), 尤其在高氮、高光强处理下, 突变体材料的光合值显著高于野生型材料。在饱和光(约1000 µ mol m-2 s-1)条件下, 在氮空白(0 kg N hm-2), 中氮(120 kg N hm-2), 高氮(240 kg N hm-2)处理中, 叶绿素含量降低突变体叶片光合值分别比野生型对照高3.7%、20.4%和39.1%。与高光强条件下相反, 低光强下野生型材料的光合值略高于突变体, 这是因为低光照条件下光照强度是叶片光合的限制因素, 高叶绿素含量有利于叶片光的吸收。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 突变体材料与野生型材料不同生育阶段叶片叶绿素含量的变化 YL 0N: 叶绿素含量降低突变体, 0 kg N hm-2处理; YL 120N: 叶绿素含量降低突变体, 120 kg N hm-2处理; YL 240N: 叶绿素含量降低突变体, 240 kg N hm-2处理; WT 0N: 野生型突变体, 0 kg N hm-2处理; WT 120N: 野生型突变体, 120 kg N hm-2处理; WT 240N: 野生型突变体, 240 kg N hm-2处理。Fig. 1 Changes of chlorophyll content at different growth stages YL 0N, chlorophyll-deficit rice mutant with 0 kg N hm-2 treatment; YL 120N, chlorophyll-deficit rice mutant with 120 kg N hm-2 treatment; YL 240N, chlorophyll-deficit rice mutant with 240 kg N hm-2 treatment; WT 0N, wild type plant with 0 kg N hm-2 treatment; WT 120N, wild type plant with 120 kg N hm-2 treatment; WT 240N, wild type plant with 240 kg N hm-2 treatment. |
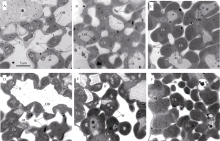
2.2 突变体与野生型水稻的叶绿体超微结构氮肥的施用量显著影响叶绿体的发育(图3)。在氮空白处理中, 叶绿体较小, 随着氮肥施用量的增加, 叶绿体体积显著变大。与野生型相比, 虽然突变体水稻的叶片叶绿素含量降低了50%左右, 但是叶绿体发育状况与野生型水稻相比, 并没有显著差别(图3)。
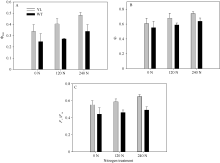
2.3 突变体与野生型水稻的荧光参数由图4可知, 在光照强度为1000 µ mol m-2 s-1时, 突变体水稻的光系统II的量子产量(Φ PSII)、光化学淬灭(qP)、光下最大光化学效率(Fv′ /Fm′ )显著高于对照野生型材料。随着氮肥施用量的增加, 这些光合荧光参数也显著提高, 表明氮肥可以显著增加叶片对光能的利用效率, 更有利于光反应电子传递。由图4-A可知, 突变体水稻与对照野生型水稻光系统II的效率分别为33.9%~48.2%和24.8%~33.9%, 表明只有< 50%的叶片吸收的光能被用来驱动光合电子传递。植物吸收的光能远远满足植物的需要, 大部分光能通过热耗散等途径消耗掉。
2.4 突变体与野生型水稻的CO2导度、叶片显微结构、水通道蛋白基因表达与Rubisco酶含量 光合羧化反应发生在类囊体基质中, 因此CO2被固定前必须通过气孔与叶肉的传导。气孔与叶肉的导度显著影响胞间CO2浓度与反应中心CO2浓度, 从而限制光合作用的暗反应速率。由图5-A可知, 突变体水稻叶片的气孔导度在氮空白(0 kg N hm-2)、中氮(120 kg N hm-2)、高氮(240 kg N hm-2)处理中分别为0.17、0.17和0.26 mol m-2 s-1, 显著高于对照野生型水稻0.13、0.10和0.21 mol m-2 s-1。在图5-B中只有在氮空白(0 kg N hm-2)条件下, 突变体水稻叶片的胞间二氧化碳浓度(Ci)才显著高于野生型水稻, 而在中氮处理(120 kg N hm-2)、高氮处理(240 kg N hm-2)条件下, 突变体水稻与野生型水稻间Ci无显著差异。这说明只有在中氮与高氮处理下, 突变体水稻光合才显著高于野生型水稻(图2), 较高的光合速率会较快地固定与消耗胞间CO2, 从而在一定程度上降低突变体水稻的Ci, 使其与野生型材料的Ci差异不大(图5-B)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 盆栽试验突变体材料(YL)与野生型材料(WT)在氮空白(A, 0N, 对照)、中氮(B, MN, 每盆1.8 g尿素)与高氮(C, HN, 每盆3.6 g尿素)条件下光反应曲线Fig. 2 Light curves of chlorophyll-deficit rice mutant (YL) and its wild type plant (WT) at nitrogen rate of 0 g urea pot-1(A), 1.8 g urea pot-1 (B), and 3.6 g urea pot-1 (C) |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 突变体材料(YL)与野生型材料(WT)在氮空白(A, 0 kg N hm-2), 中氮(B, 120 kg N hm-2)与高氮(C, 240 kg N hm-2)条件下叶绿体发育情况 其中A、B、C为突变体材料, D、E、F为野生型材料; A、D为0 kg N hm-2处理, B、E为120 kg N hm-2处理, C、F为240 kg N hm-2处理。Ch为叶绿体; OB为嗜锇体; S为淀粉体; W为细胞壁; M为线粒体。Fig. 3 Electron micrographs of chloroplasts in chlorophyll-deficit rice mutant (A, B, C) and its wild type plant (D, E, F) at 0 kg N hm-2(A, D), 120 kg N hm-2 (B, E), and 240 kg N hm-2 (C, F) Ch: chloroplast; OB: osmiphilic body; S: starch; W: cell wall; M: mitochondria. |
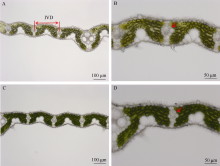
对比叶绿素含量降低突变体与野生型水稻叶片的显微结构发现, 突变体水稻的叶片结构(如较高的维管束分布密度, 发达的维管束组织)有利于提高叶片水稻水势。较高的叶片水势有助于维持较高的气孔导度。由图6-A、C可知, 突变体水稻维管束间距离为(210.3 ± 2.2) µ m, 略小于野生型水稻(222.1 ± 5.9) µ m。突变体水稻叶片内密度较高的维管束分布有利于水分的运输。同时, 由图6-B、D可知, 突变体水稻叶片内维管束的大小也大于野生型水稻, 木质部更发达, 更有利于水份运输。
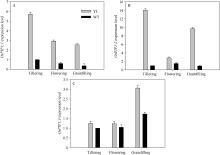
叶肉导度是CO2从胞间传递到类囊体基质反应中心的导度。根据Yin等[27]的计算方法, 突变体材料的平均叶肉导度为(0.121 ± 0.008) mol m-2 s-1, 显著高于对照野生型材料的叶肉导度(0.0109 ± 0.006) mol m-2 s-1。其中水通道蛋白是影响叶片叶肉导度的主要因素。实时荧光定量PCR结果表明突变体水稻水通道蛋白OsPIP1; 1、OsPIP1; 2、OsPIP1; 3表达水平显著高于野生型水稻(图7), 与叶肉导度趋势一致。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 突变体材料(YL)与野生型材料(WT)在氮空白(0 N, 0 kg N hm-2), 中氮(120 N, 120 kg N hm-2)与高氮(240 N, 240 kg N hm-2)处理下, 光强为1000 µ mol m-2 s-1适应条件下, 叶绿素荧光参数: 光系统II效率(A, Φ PSII), 光化学淬灭(qP)和光下光化学效率(Fv′ /Fm′ )Fig. 4 Chlorophyll fluorescence parameter Φ PSII (A), qP (B), and Fv′ /Fm′ (C) of chlorophyll-deficit rice mutant (YL) and its wild type (WT) at 0 kg N hm-2, 120 kg N hm-2, and 240 kg N hm-2 treatments |
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 突变体材料(YL)与野生型材料(WT)在氮空白(0 N, 0 kg N hm-2), 中氮(120 N, 120 kg N hm-2)与高氮(240 N, 240 kg N hm-2)处理下, 饱和光强下(1000 µ mol m-2 s-1)气孔导度(A)和胞间CO2浓度(B)Fig. 5 Stomatal conductance and intercellular CO2 concentration of chlorophyll-deficit rice mutant (YL) and its wild type (WT) under irradiance of 1000 µ mol m-2 s-1 at 0 kg N hm-2, 120 kg N hm-2, and 240 kg N hm-2 treatments |
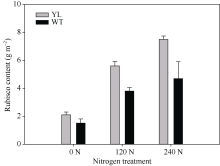
影响光合作用暗反应的另一个重要因素是Rubisco酶。Rubisco酶催化CO2与RuBP生成三碳糖。叶片中Rubisco酶含量高, 有利于提高光合速率, 但合成Rubisco酶需要消耗大量的氮素。由图8可知, 突变体水稻的Rubisco酶含量显著高于对照野生型水稻。表明突变体材料更倾向于将氮素用于Rubisco的合成, 而不是叶绿素的合成。
2.5 突变体与野生型水稻的产量与生育期由表1可知, 相对于对照, 突变体水稻虽然单位面积穗数较少, 但是每穗粒数较高, 因而产量差异不显著。但是突变体材料的生育期显著少于野生型水稻, 表明突变体材料干物质积累速率快, 这是与突变体材料较高的光合速率(图1)密不可分的。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 突变体材料(A、B)与野生型材料(C、D)叶片横切面显微结构 A、C图中标尺为100 µ m; B、D图中标尺为50 µ m。IVD: 维管束间距离。图中箭头指向维管束。Fig. 6 Light micrographs of chlorophyll-deficit rice mutant (YL, A, and B) and its wild type (WT, C, and D) Bars = 100 µ m in A and B, and 50 µ m in C and D. IVD: inter-vein distance. Arrows indicate the localization of vein. |
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 突变体材料(YL)与野生型材料(WT)水通道蛋白基因OsPIP1; 1 (A)、OsPIP1; 2 (B)和OsPIP1; 3 (C) mRNA表达水平Fig. 7 Comparison of the expression of rice aquaporin genes OsPIP1; 1 (A), OsPIP1; 2 (B), and OsPIP1; 3 (C) in chlorophyll-deficit rice mutant (YL) and its wild type (WT) at tillering, flowering, and grainfilling stages. |
表1
Table 1
表1(Table 1)
| 表1 突变体材料与野生型产量与生育期数据 Table 1 Yield and yield components of chlorophyll-deficit rice mutant (YL) and its wild type (WT) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 突变体材料(YL)与野生型材料(WT)叶肉中Rubisco酶 含量Fig. 8 Rubisco content in chlorophyll-deficit rice mutant (YL) and its wild type (WT) |
3 讨论叶绿素吸收光能的过程中, 电子从基态激发到激发态, 并将光能转化为化学能。叶片吸收的光能只有小部分用于光化学反应, 大部分通过热能或者荧光形式散失。Yin等[28]的研究表明在C3与C4作物中光能利用效率只有2.2%与3.0%。Ort等[9]也认为植物吸收的光能远远地超过了植物生理代谢的需求, 过量吸收的光能甚至需要通过热耗散等机制来消除, 从而避免产生活性氧等有害物质[8]。那为什么植物仍然合成那么多的叶绿素呢?Ort等[10]认为虽然高叶绿素含量将导致光能的吸收, 但是在进化中高叶绿素含量的植物具有竞争优势, 从而高叶绿素含量这个性状被保留下来。然而在现代农业生产中, 高叶绿素含量会加剧个体之间竞争, 不利用群体光合[9, 10]。我们的荧光检验结果也表明, 高叶绿素含量的野生型水稻其光系统II的效率较低。而且在大气CO2浓度条件下, 光合作用并不受光合电子传递限制, 而是受暗反应限制[5]。
暗反应是不断消耗通过光合电子传递形成的ATP与NADPH并固定CO2形成葡萄糖的过程。其中CO2底物浓度与Rubisco酶的含量与活性是主要的限制性因子。我们分析发现突变体水稻叶片的气孔导度与叶肉导度高于野生型材料, 有利于提高光合速率。同时突变体材料倾向于合成更多的Rubisco酶, 这也有利于提高光合速率。Zhu等[29]研究表明, 现有叶片内的氮素分配并不是最优化的, 如果能够优化叶片内氮素分配, 叶片氮素应更多地用于合成Rubisco、SBPase、果糖-1, 6-二磷酸醛缩酶和腺苷二磷酸葡萄糖焦磷酸化酶, 叶片光合将能提高76%。Lefebvre等[30]和Tamoi等[31]的试验表明, 更多的氮素用于SBPase表达可以提高光合与生物量10%。本试验中突变体材料与野生型材料在叶绿素合成、Rubisco酶合成等方面有显著的差异, 可用来研究氮素在不同光合器官中最优分配, 最大化光合效率与氮素利用效率。
从群体角度看, 叶片叶绿素含量降低有利于光在冠层中的分布, 增加群体光合。在现代超级稻育种中, 一个重要的农艺选择性状就是直立株型[32]。直立株型有利于光在群体内的分布, 光辐射能够到达冠层底部的叶片。同理, 叶绿素含量降低突变体叶片对光吸收少, 光更容易透射过叶片, 这将增加低层叶片的光吸收, 有利于群体光合[9]。
4 结论高叶绿素含量并不是叶片高光合速率的必需条件。在现代大气条件下, 植物吸收的光能远远超过了植物生理代谢的需求, 叶片叶绿素含量存在‘ 冗余’ 现象。适当降低叶片叶绿素含量, 将有助于减少叶片氮素在合成叶绿素过程中的消耗, 增加影响光合速率的关键限制性因子的合成(如Rubisco酶等), 最终提高叶片光合速率。叶绿素含量降低突变体在高光效育种中有潜在的研究价值。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] |
