AD患者的特征是大脑中存在具有神经毒性的β淀粉样蛋白(Aβ) 沉积物。Aβ由淀粉样蛋白前体蛋白(APP)的正常水解裂解产生。最近的一项惊人研究发现(Science 2019, 363, 143【1】),成熟APP分泌的sAPP的延伸域可与γ-氨基丁酸B型受体1a型亚基(GABABR1a)的固有紊乱的Sushi 1域结合并调节其突触传递。这项工作可能为治疗AD开辟新的途径——不仅通过靶向Aβ,而且通过加强APP的替代切割途径。然而,其中的详细分子相互作用机制仍然难以捉摸。
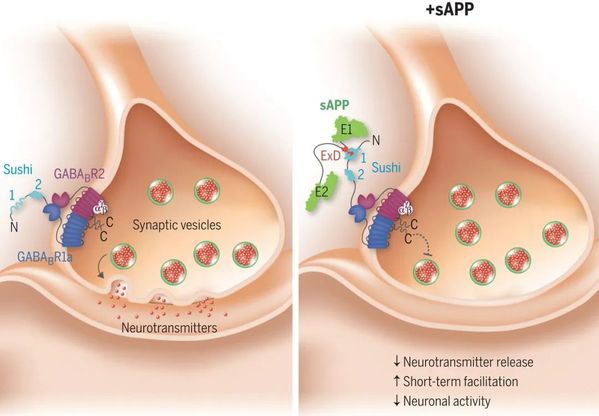
图1:sAPP是一种功能性GABABR1a特异性配体(图源:文献【1】)
在这里,我们使用全原子分子动力学模拟研究了17个残基sAPP肽(APP 17-mer)及其最低活性的9个残基片段的sAPP肽(APP 9-mer)与天然非结构化的Sushi 1结构域之间的动力学相互作用。揭示了sAPP肽可用来稳定天然非结构化sushi 1结构域的重要的结构结合模式和主要驱动力,确定了APP 9-mer肽中的三个关键结合残基(D4,W6和W7),并通过计算机诱变研究对其进行了进一步检查。更重要的是,通过严格的自由能微扰(FEP)计算来探索APP 9-mer的突变表明,基于进化过程中不同脊椎动物APP序列的一个双突变表现出更强的结合力,表明可能是增强的GABABR1a调节剂。
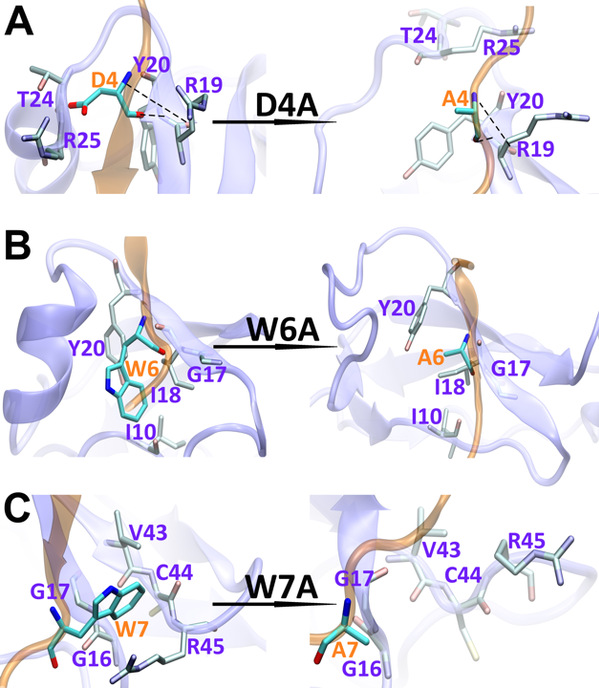
图2:野生型(左)和突变型(右)APP 9-mer结合sushi 1域的结构比较
这些发现揭示了对App 9mer-sushi 1域结合的新颖见解,这可能为与许多涉及GABABR信号传导的神经疾病相关的GABABR1a同种型特异性疗法的开发提供新的途径。
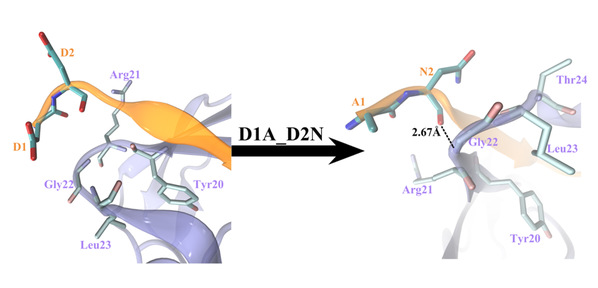
图3:APP 9-mer双突变D1AD2N引起的结合复合物结构变化
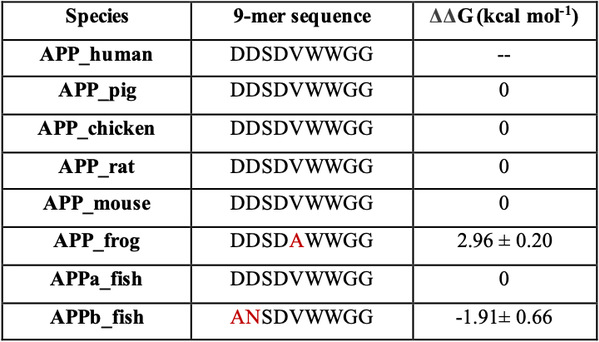
表1:针对其他物种的相应APP 9-mer序列的突变
浙江大学定量生物中心/兰州大学物理学院青年研究员冯梅和浙江大学物理学系博士生宋伊为论文共同一作,浙江大学周如鸿教授为论文通讯作者。橡树岭国家实验室的Serena H. Chen和康奈尔大学应用数学中心的章元肇也参与了本论文。
这项工作得到了中国国家自然科学基金、国家自主创新示范区上海张江重大专项、中国博士后科学基金,以及W.M. Keck基金会的资助。
原文链接:https://doi.org/10.1039/D0SC06946A
图文来源:浙大定量生物中心
