泛素-蛋白酶体系统通过E3泛素连接酶识别底物的降解信号。1986年,最早发现的降解信号是蛋白质N-末端的不稳定氨基酸(N-degron)。之后又发现蛋白质的C-末端也可以成为蛋白质的降解信号(C-degron)。这些不同的降解信号可以通过不同的E3泛素连接酶识别并介导底物的泛素化降解。董城教授长期致力于蛋白质末端识别与修饰的结构和功能研究,之前工作阐述了NTMT1/2甲基化N-末端蛋白的分子机制(Genes & Development, 2015; Communications Biology, 2018)和GID4识别底物N-末端脯氨酸降解信号的分子机制(Nature Chemical Biology, 2018; PNAS, 2020),近期该课题组又解析了E3连接酶CRL2复合物中的底物识别因子ZYG11B和ZER1分别和不同N-末端甘氨酸降解信号的复合物晶体结构以及底物识别因子FEM1C和C-末端精氨酸降解信号的高分辨率复合物晶体结构,并通过一系列生化、细胞实验阐述了不同E3蛋白识别底物的特异性,揭示了CRL2通过识别底物N-末端甘氨酸和C-末端精氨酸降解信号并降解底物的分子机制,系统性地描绘了两大类降解子识别底物的全新分子模型。这些研究为后续设计和筛选E3泛素连接酶的小分子抑制剂提供了结构基础,也为靶向降解蛋白质技术(PROTAC)提供了新的E3识别靶点。
该工作与天津医科大学基础医学院宓文义教授、马振毅教授和多伦多大学闵金荣教授合作完成,并得到国家自然科学基金、天津医科大学卓越人才计划资助。
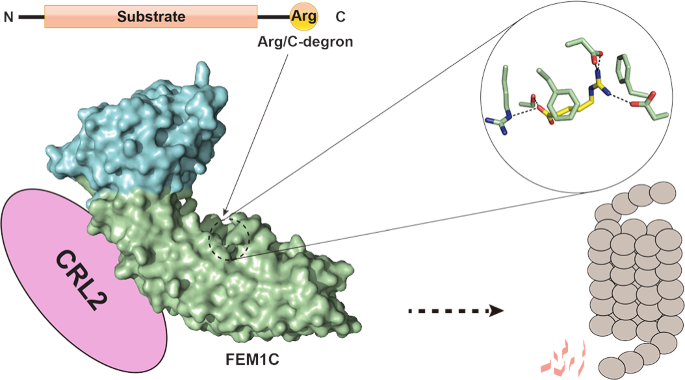
FEM1C识别底物C-末端精氨酸的分子机制
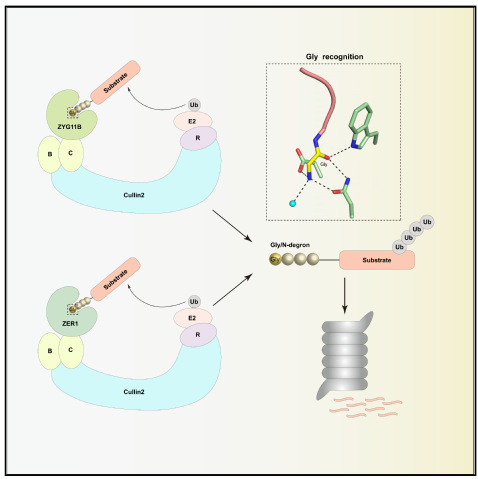
ZYG11B和ZER1识别底物N-末端甘氨酸的分子机制
