
动物卵母细胞的发生和早期胚胎的发育在很大程度上依赖母源因子,即在卵母细胞中积累的mRNA和蛋白质。毫不夸张的说,早期胚胎发育过程实际上是“妈妈让我这样做的”注。这是因为合子基因组激活前的发育过程,如卵子发生、受精、卵裂、胚轴形成、原始生殖细胞的命运决定和合子基因的转录激活主要受这些母源因子控制。母源因子的影响力甚至还可以延伸到基因组激活后很长一段时间,作为一种可能的胚胎抗逆机制与合子基因表达产物形成功能上的相互补偿,协同调控原肠胚形成前后的形态发生运动、细胞分化和器官原基形成等,因此由于母源因子的作用,很多基因的合子突变体看不到明显的异常表型。母源因子的功能紊乱会导致不育和先天性畸形,对母源因子功能的分析有助于认识这些出生缺陷的成因并以此衍生出应对策略。(注:引号中的说法引自Florence L. Marlow在Maternal Control of Development in Vertebrate一书的副标题“My Mother Made Me Do It!”)
作为一种卵生且体外发育的脊椎动物,斑马鱼是开展母源因子与胚胎发育研究的良好模型。在斑马鱼中,有接近17000个基因存在显著的母源输入(FPKM>0),占斑马鱼基因总数的66%1。所以要彻底揭示这些基因的功能,不但需要清除这些基因的合子表达,而且需要抑制其母源产物的功能,主要途径是获取母源合子突变体。
 | 斑马鱼基因的母源表达 饼图显示25691个斑马鱼基因的母源转录物水平。该图的数据来自White, R. J. et al., 2017。母源mRNA的表达量定义为某基因在合子期、2细胞期、128细胞期和1k细胞期FPKM(Fragments Per Kilobase of exon model per Million mapped fragments)的平均值。 |
为了解决这一技术难题,邵明教授课题组利用CRISPR/Cas9系统建立了在卵母细胞中进行快速条件性敲除的策略,可以实现一个世代获取母源突变体。该系统主要包括两个成分,一是Tg(zpc:zcas9)转基因斑马鱼,其在早期卵母细胞中特异表达Cas9蛋白2;二是串联3-4个sgRNA表达框和泛表达GFP报告基因的转基因质粒系统。借助I-SceI转基因体系,sgRNA的表达载体可以导入Tg(zpc:zcas9)转基因品系基因组以实现在卵母细胞中同时表达多个sgRNA的Cas9核蛋白复合体(Cas9 RNP),从而进行卵母细胞特异的条件性基因编辑。通过这一系统,该课题组仅用一个世代就成功获取了nanog和ctnnb2的母源突变体,在GFP阳性胚胎中,有超过1/4表现出典型的母源突变体表型,某些F0个体产生的GFP阳性胚胎中母源突变体的比例高达50%以上。
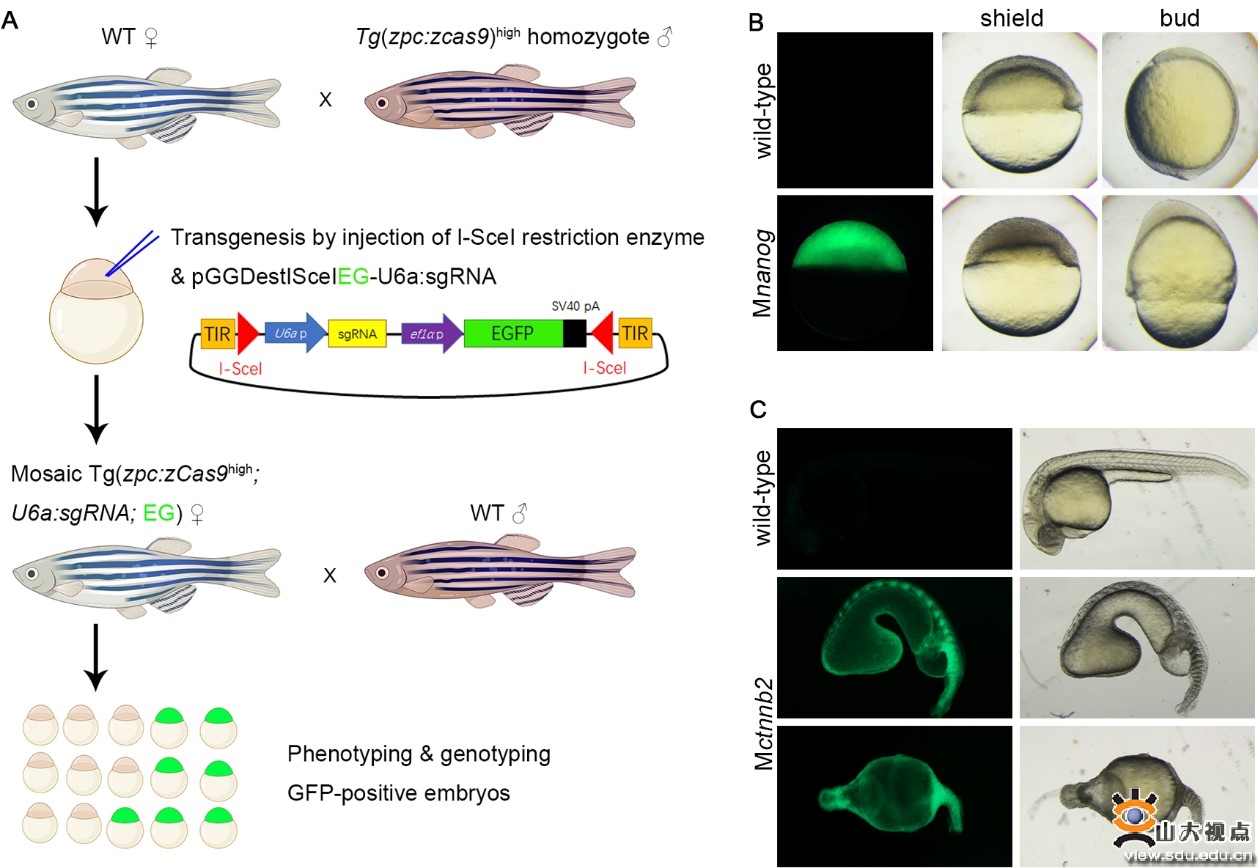
母源因子快速条件性敲除技术
A.实验方案示意图;B.通过该方案得到的nanog母源突变体,其表现出严重的下包延迟;C.用条敲策略获取的ctnnb2母源突变体,GFP阳性胚胎显示出严重的体轴发育缺陷。
为了同时鉴定母源突变体表型和其母源mRNA突变类型,利用斑马鱼胚胎调整型发育的特点,研究者将合子基因组激活前胚胎的部分细胞吸出,通过RT-PCR检查靶基因mRNA开放读框中的突变,而供体胚胎仍可以继续发育以进行表型鉴定。令人震惊的是,几乎所有母源突变体的胚胎中都含有大片段截短的母源转录物,这种删除突变也同时体现在靶基因的基因组上,并且可以遗传给下一代。除了可以预计的sgRNA靶点之间的删除外,还会出现意料之外的大片段删除(unintended large deletion),其删除的区域远远超出了两端的sgRNA靶点。这种情况与在哺乳动物早期胚胎和胚胎干细胞进行基因编辑所出现的“在靶效应”(On Target Effect,OnTE)有一定的相似性3,4。
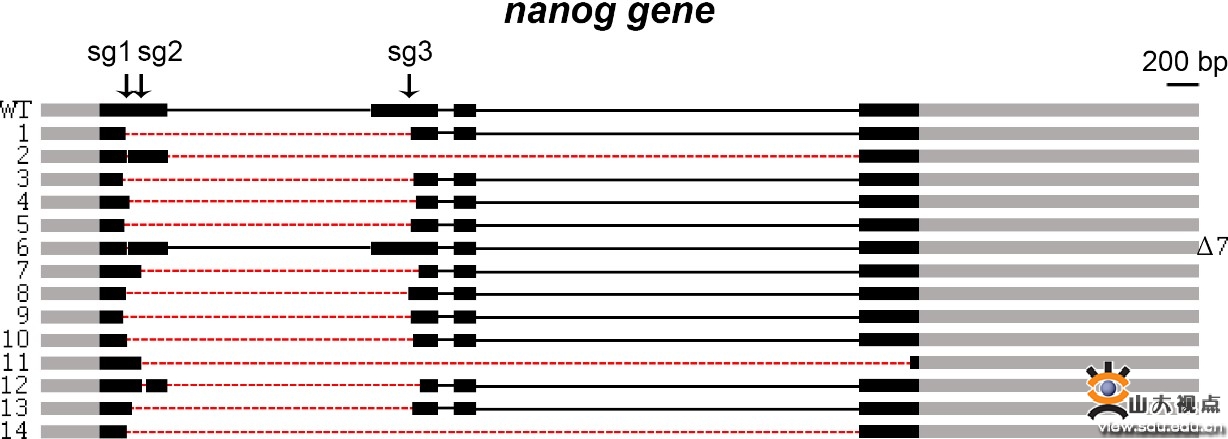
卵母细胞特异性基因编辑在nanog基因上主要产生可遗传的大片段删除
sg1、sg2和sg3指示三个sgRNA靶点在基因组上的位置,红色虚线指示删除区域。
在斑马鱼中,常规的基因编辑是向受精卵中注射Cas9 RNP,其产生的突变类型以小的插入缺失突变(indel)为主。通过与卵母细胞基因编辑对比,该课题组发现在斑马鱼早期胚胎中注射多个Cas9 RNP产生大片段DNA删除的概率很低,其中可产生携带大片段删除后代的F0个体的比例只占约17%,而携带大片段DNA删除突变的胚胎在所有突变后代中只占10%左右;尤其有意思的是,异常的大片段删除在常规Cas9 RNP注射中从未出现。与此形成鲜明对比的是,卵母细胞基因编辑主要产生大片段DNA删除,所有F0个体都产生携带大片段删除的母源突变体后代,而且90%以上的母源突变体都含有sgRNA靶点附近的基因组大片段缺失,其中近30%会出现超大片段的异常缺失。因此,通过在卵母细胞中表达多个Cas9 RNP来产生DNA片段删除的优势是碾压性的。
综上,这项研究成果提供了快速获取母源突变体的解决方案,该方案不但可以大大缩短获取母源突变体所耗费的时间,而且使更多基因母源产物的功能有机会得到阐明,尤其是在遇到合子突变致死或不育的情况时,这种手段的价值将显得更加突出。卵母细胞条件性敲除技术的建立和进一步优化为破解母源因子功能提供了新的契机,也为较大规模开展母源因子功能筛选提供了机遇。同样重要的是,卵母细胞基因编辑产生大片段DNA删除的倾向性使得它极适于进行启动子、增强子和转录后调控元件的删除,这为研究基因组中占绝大比例的非编码序列的功能提供了理想工具。
动物学科是山东大学传统的优势学科,近5年来已在Science Advances、Nature Communications、PNAS(2篇)、J Clin Invest、Development(3篇)、Autophagy(2篇)、PLoS Genetics(3篇)和PLoS Pathogens(4篇)等高影响力期刊发表了一系列重要成果。本工作得到了国家自然科学基金(31871451和32070813)、国家重点研发计划(2018YFA0801000)和山东大学齐鲁青年****项目的资金支持。
文章链接:
https://advances.sciencemag.org/content/7/32/eabg4243
参考文献:
1. R. J. White, J. E. Collins, I. M. Sealy, N. Wali, C. M. Dooley, Z. Digby, D. L. Stemple, D. N. Murphy, K. Billis, T. Hourlier, A. Fullgrabe, M. P. Davis, A. J. Enright, E. M. Busch-Nentwich, A high-resolution mRNA expression time course of embryonic development in zebrafish.eLife6, (2017).
2. Y. Liu, C. Zhang, Y. Zhang, S. Lin, D. L. Shi, M. Shao, Highly efficient genome editing using oocyte-specific zcas9 transgenic zebrafish.J Genet Genomics45, 509-512 (2018).
3. M. V. Zuccaro, J. Xu, C. Mitchell, D. Marin, R. Zimmerman, B. Rana, E. Weinstein, R. T. King, K. L. Palmerola, M. E. Smith, S. H. Tsang, R. Goland, M. Jasin, R. Lobo, N. Treff, D. Egli, Allele-Specific Chromosome Removal after Cas9 Cleavage in Human Embryos.Cell183, 1650-1664.e1615 (2020).
4. M. Kosicki, K. Tomberg, A. Bradley, Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements.Nat Biotechnol36, 765-771 (2018).
