Bristol Myers Squibb(BMS)公司是PD-1/PD-L1小分子抑制剂研发的先驱,其最早报道的联苯甲氧基芳基醚是一类高活性PD-1/PD-L1小分子抑制剂,但相对于分子水平的高活性,其细胞渗透性和生物活性较低,难以继续开发。本研究团队在研究这类药物的代谢性质中发现,苄氧基是一个潜在的代谢热位点,在体内条件下易于氧化裂解。基于此,本研究团队首先引入谐二氟亚甲氧基结构作为亚甲氧基(-CH2O-)的生物电子等排体,通过对代谢热位点的优化,大大提高了化合物的稳定性。进一步,在分子骨架末端引入了氨基糖片段,以加强化合物在溶剂相互作用区的结合能力,最终得到新化合物43,对PD-1/PD-L1抑制活性达到10 nM,并在免疫健全的小鼠肿瘤模型中显示出激活T细胞、抑制肿瘤生长作用,值得进一步研发。
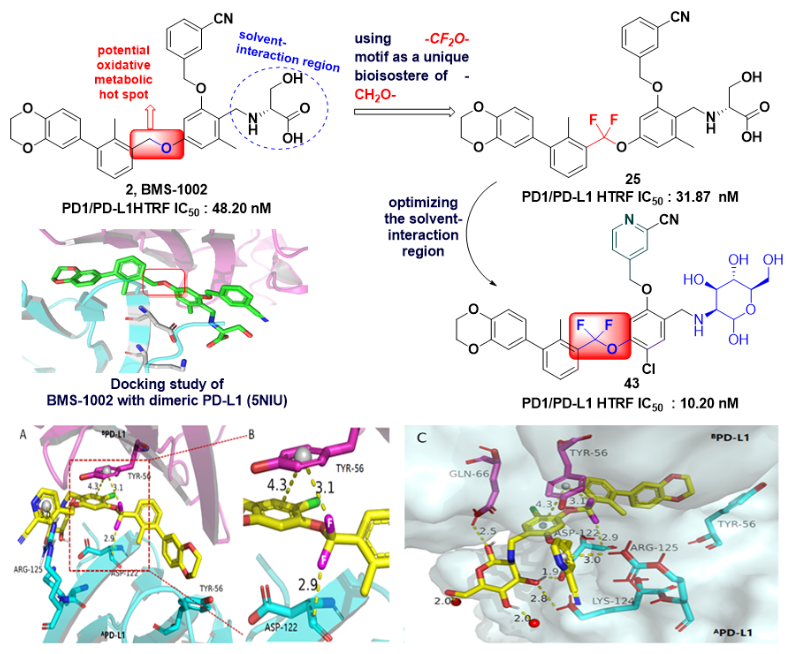
图一 含谐二氟亚甲氧连接链的新型PD1/PD-L1抑制剂的设计
针对对照化合物存在的问题,药化团队针对性设计优化,在药物代谢热位点(hotspot)苄基上巧妙的引入谐二氟亚甲基(-CF2-),既保持了分子原有的构象,并改进了抑制剂的代谢稳定性、还提高了分子与靶标的结合能力(图一)。谐二氟亚甲基在现有药物中虽不陌生但并不多见,作为亚甲基的生物电子等排体应用于药物成药性优化更为鲜见。与BMS-1002对照化合物相比,二氟亚甲氧基链化合物43对PD-1/PD-L1的抑制活性提高了5倍(IC50 = 10.2 nM),代谢性质也得到了明显提高,包括:半衰期延长(T1/2= 4.84 h)、血浆暴露量提高 (AUClast= 464 h*ng/mL)、清除率降低 (CL_obs= 40.0 mL/min/kg)。进一步药理特性拓展研究揭示,该化合物能够通过拮抗PD-1和PD-L1的结合、抑制PD-1/PD-L1细胞通路的传导。多个T细胞功能指标检测共性显示化合物43处理逆转CD8+ T的损耗、促进其活化。体内采用Hepa1-6小鼠肝癌模型(图二),以1 mg/kg剂量给予化合物43有效促进CD8+ T细胞活化、抑制移植瘤的生长,且具有良好的耐受性。而采用缺乏T细胞的裸鼠移植瘤模型、化合物43体内药效丧失,验证了其体内抗肿瘤活性与靶向 PD-1/PD-L1 轴激活T细胞功能有关。
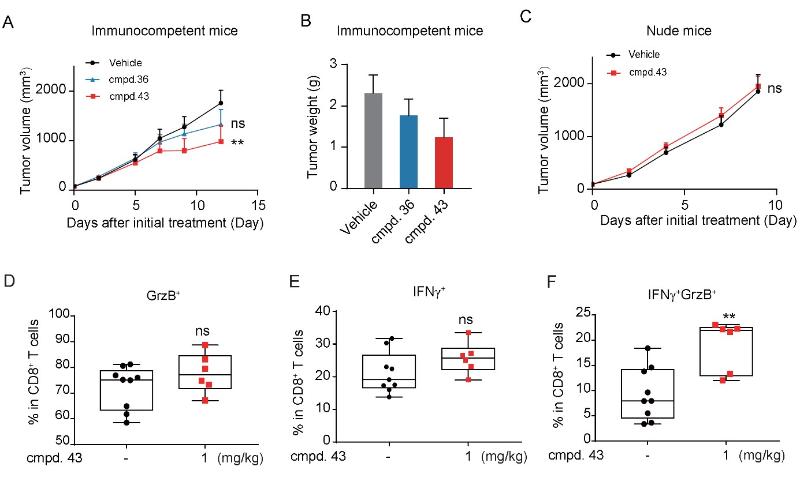
图二 化合物43在Hepa1-6小鼠模型上抑制肿瘤生长
这一成果最近发表在美国化学会药物化学知名国际期刊Journal of Medicinal Chemistry上,文章的第一作者分别是上海交通大学药学院药物化学生物学团队宋子兰、上海药物研究所肿瘤药理研究团队刘博,通讯作者分别为张翱教授和艾菁研究员。该工作受到上海交通大学“双一流”学科建设项目、重点前瞻布局基金以及国家自然科学基金委创新研究群体项目、面上项目的支持。
论文链接:https://pubs.acs.org/doi/pdf/10.1021/acs.jmedchem.1c01422
