
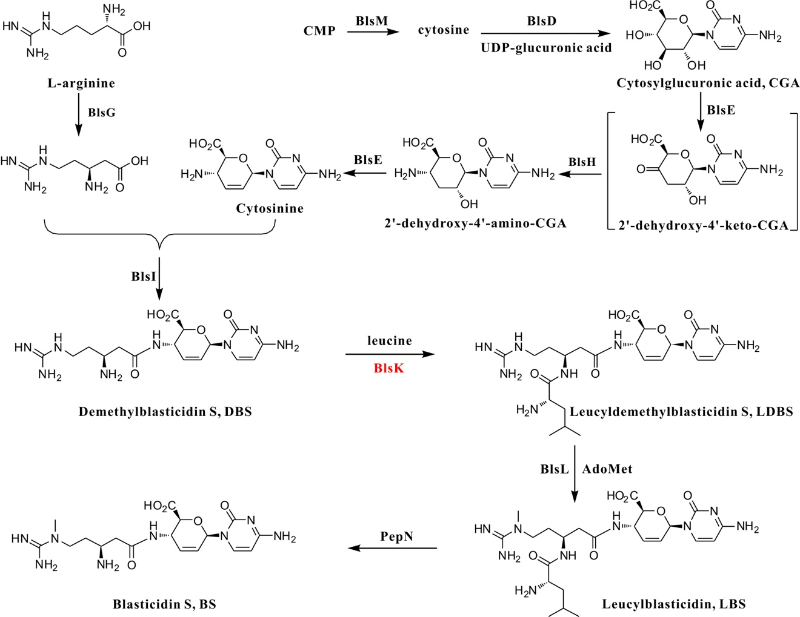
杀稻瘟菌素是第一个大规模取代汞制剂防治水稻稻瘟病的抗生素,目前商用产品仍应用于转基因筛选试剂。前期研究表明,在BS生物合成过程中,除了终产物,还有三种与BS核心结构相似的代谢物,即去甲基杀稻瘟菌素demethylblasticidin S (DBS),亮氨酰去甲基杀稻瘟菌素leucyldemethylblasticidin S (LDBS)和亮氨酰杀稻瘟菌素leucylblasticidin S (LBS),三者的转化关系中有一个隐藏的亮氨酰化过程。DBS精氨酸侧链被亮氨酰化LDBS后,才能别被甲基转移酶BlsL识别并催化生成LBS,亮氨酸在LBS外排过程中被水解掉成为成熟的杀稻瘟菌素BS。亮氨酰化是如何发生的一直没有直接的证据。本研究发现BlsK以一种新的方式催化了这一过程,它能够从初级代谢中高效“劫持”活化的亮氨酸产物Leucyl-tRNA,并将亮氨酰基团转移到DBS精氨酸侧链上的β-氨基上;BlsK在序列和结构上与已经功能表征的蛋白均没有相似性,它包含了一个[3Fe-4S]簇,该铁硫簇对维持蛋白结构和反应活性至关重要。因此该发现不仅使BS的生物合成途径更加清楚,而且同时扩展了我们对氨酰tRNA转移酶家族和铁硫蛋白家族的认识。
副研究员蒋明和研究员贺新义长期从事杀稻瘟菌素等天然产物的生物合成研究。该论文是他们在实现BS的异源表达(Applied and Environmental Microbiology)、鉴定水解亮氨酰基团的水解酶PePN(Scientific Reports)和甲基转移酶BlsL(Frontiers in Microbiology)等研究成果后的又一重要进展。该研究工作获得了国家重点研发计划(2018YFA0901900)和国家自然科学基金(31871250、31670034、31870026)的资助。
论文链接:https://www.pnas.org/content/118/30/e2102318118
