2021年3月5日,上海交通大学系统生物医学研究院张冰团队在Circulation杂志上发表题为LARP7 Protects Against Heart Failure by Enhancing Mitochondrial Biogenesis的文章,首次发现RNA结合蛋白LARP7通过调控线粒体的生物合成和能量代谢促进心肌细胞功能防止心衰的发生。

LARP7是一种与哺乳动物细胞内丰度最高的长链非编码RNA-7SK RNA相结合的 La核糖核蛋白。LARP7,MEPCE和7SK RNA一起组成7SK核糖核蛋白复合体(7SK RNP)的基本结构2。以往研究认为7SK RNP的主要功能是阻止正转录延伸因子b(P-TEFb)与染色质和RNA聚合酶II(RNAPII)结合,进而抑制RNAPII ser2的磷酸化及其转录停滞释放(Pausing release)3。LARP7是一种遗传疾病发病相关基因,在患有侏儒症和Alazami综合征的患者中均发现LARP7的功能缺失。但LARP7在心肌细胞以及心脏疾病中的作用和功能在本研究之前仍然匮乏。
研究人员在患有扩张型心肌病(DCM)的病人心肌组织中观察到LARP7蛋白较正常人心肌组织显著降低。LARP7全身敲除小鼠胚胎致死并伴有室间隔缺损。透射电镜分析显示心脏线粒体形态异常,RNA-seq显示LARP7敲除小鼠心肌中电子呼吸传递链复合物上的基因表达全面下调。
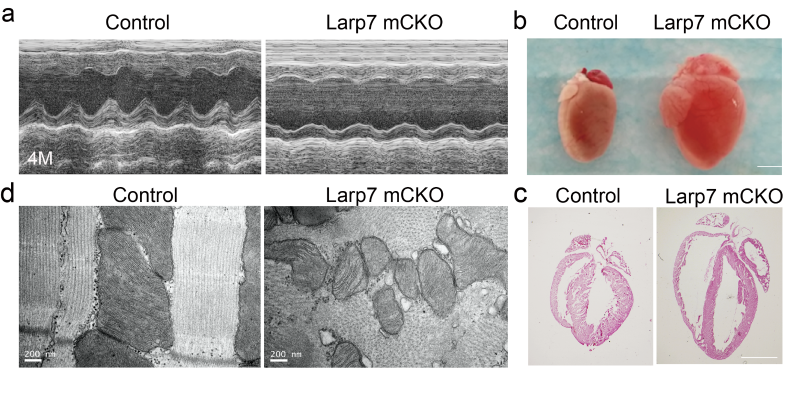
为了研究心肌细胞中LARP7的作用,研究人员采用三种心肌特异性Cre小鼠:NKX2.5 Cre,Myh6 Cre和Myh6 MerCreMer与LARP7 flox小鼠杂交。心动超声分析发现其心功能在4个月龄时显著下降。组织学分析显示LARP7敲除小鼠呈现心腔扩大、室璧变薄和纤维化上升等扩张性心肌病和心衰表型。与全身敲除的胚胎小鼠类似,透射电镜显示线粒体变小,数目变少,内膜嵴消失。Seahorse和线粒体功能测定显示LARP7敲除心肌的线粒体氧化呼吸和ATP产生能力明显降低。RNA-seq和Western-blot进一步证明LARP7敲除小鼠的氧化传递链分子的表达显著降低。上述结果表明LARP7调控心肌细胞中线粒体的生物合成(biogenesis)以及能量代谢,在其功能维持中发挥重要作用。
去乙酰化酶SIRT1是控制线粒体合成的重要转录因子。研究人员进一步发现SIRT1蛋白在LARP7敲除小鼠心脏中显著下降,去乙酰化酶活性明显降低。SIRT1活性降低导致转录激活因子PGC1-α乙酰化水平上升,继而导致线粒体呼吸传递链基因表达下降,线粒体氧化磷酸化的功能障碍。
心肌中氧化应激和活性氧(ROS)的增加是心衰的重要分子标记。该研究进一步发现ROS的累积可以激活毛细血管扩张突变基因ATM,从而导致LARP7泛素化增加,心衰心脏中LARP7的下降。研究者采用小鼠和食蟹猴冠状动脉结扎模型(MI)证明该ROS-ATM-LARP7通路在心衰过程中被明显激活。采用腺相关病毒AAV9在心肌组织内过表达LARP7或者给心梗小鼠注射ATM抑制剂KU60019可以抑制该通路的过度活化,显著提高心功能,预防心衰发生,并降低实验动物的病死率。
综上所述,该项研究阐明了心衰过程中激活的一个新的ROS-ATM-LARP7-SIRT1-OXPHOS分子通路。避免这一通路的过度激活对于维持线粒体的生物合成和能量代谢以及正常的心脏射血功能至关重要。值得一提的是美国西南医学中心的Joseph A. Hill教授在其最近文章中发现敲除RNAPII停滞通路的另一个蛋白Brd4与LARP7敲除类似也可以导致心衰4。现在针对RNAPII停滞通路业已开发了多个肿瘤治疗的抑制剂如(iBET),并正在开展广泛的临床试验5。我们和Joseph A. Hill教授的研究提示iBET治疗存在潜在的心脏毒性,在安全用药方面需要更加审慎,需增加心脏功能的评估指标。
上海交通大学系统生物医学研究院张冰研究组博士生于蕙菁、闫鹏一;助理研究员张芳、张沙沙为本文共同第一作者。上海交通大学系统生物医学研究院和附属新华医院的张冰研究员为本文通讯作者。该工作得到了上海交通大学附属新华医院孙锟教授、基础医学院刘俊岭教授、第三军医大学吴庚泽和曾春雨教授、华中科技大学陈琛和汪道文教授、浙江大学胡新央、朱伟和王建安教授、同济大学东方医院庄涛和张玉珍教授及其团队的大力支持。
论文链接: https://www.ahajournals.org/doi/abs/10.1161/CIRCULATIONAHA.120.050812
