GPCR作为人体最大的细胞膜受体蛋白家族,包含800多个成员,是超过三分之一的临床及在研药物的作用靶标。GPCR主要通过偶联下游G蛋白和阻遏蛋白进行信号传导。阻遏蛋白包括视觉阻遏蛋白(Arrestin1和4)和非视觉阻遏蛋白(Arrestin2和3)。视觉阻遏蛋白主要转导视紫红质受体信号通路,早在2015年,徐华强团队利用世界最强的X射线自由电子激光技术得到了高分辨率的Arrestin1-视紫红质复合物晶体结构。该三维结构第一次展现了阻遏蛋白与GPCR的结合模式,与G-蛋白与GPCR相互作用截然不同,为深入理解GPCR下游信号转导通路奠定了重要基础。而非视觉阻遏蛋白则参与调控其它800多个GPCR下游信号通路,不仅阻断受体与G蛋白的结合,还介导受体的内吞及一系列非G蛋白依赖的信号通路。非视觉阻遏蛋白与GPCR复合物的结构研究一直都是GPCR领域的重点。然而,非视觉阻遏蛋白与GPCR的相互作用较弱,且组装的复合物具有高度的柔性,从而给结构解析带来了很大挑战。
徐华强团队经过多轮筛选,确定了以NTSR1为模式受体,并历经8年的努力系统探究了增强Arrestin2和NTSR1相互作用及提高复合物稳定性的各种因素,包括阻遏蛋白3A突变体的引入、正向别构激动剂ML314与内源性配体NTS的联合使用、构象稳定抗体片段Fab30的辅助,复合物的融合表达、GRK的共表达促进受体磷酸化以及去垢剂的筛选等。该研究最终获得了较为稳定的Arrestin2-NTSR1复合物,并解析了其冷冻电镜结构。该结构与课题组已报导的Arrestin1-视紫红质复合物结构具有类似的结合方式,但其中Arrestin2相比于Arrestin1有90°旋转的构象差异,使得受体的TM5、TM6和ICL3处于Arrestin2中N端结构域的前面方位,这种构象更有利于部分受体采用ICL3取代受体C端招募Arrestin2,可作为探讨非视觉阻遏蛋白与GPCR相互作用的第二种模型。
徐华强课题组博士后尹万超和博士研究生殷裕玲、余学奎课题组博士后李智海和中科院上海生化与细胞所国家蛋白质科学中心(上海)丛尧课题组金明梁博士为该论文的共同第一作者。此研究的合作单位还有美国文安德研究所(Van Andel Research Institute)、浙江大学和哈尔滨工业大学。该研究得到了国家科学技术部、国家自然科学基金委员会、中国科学院重大科技基础设施开放研究项目、上海市科学技术委员会、美国国立卫生研究院等项目的资助。
全文链接:https://www.nature.com/articles/s41422-019-0256-2
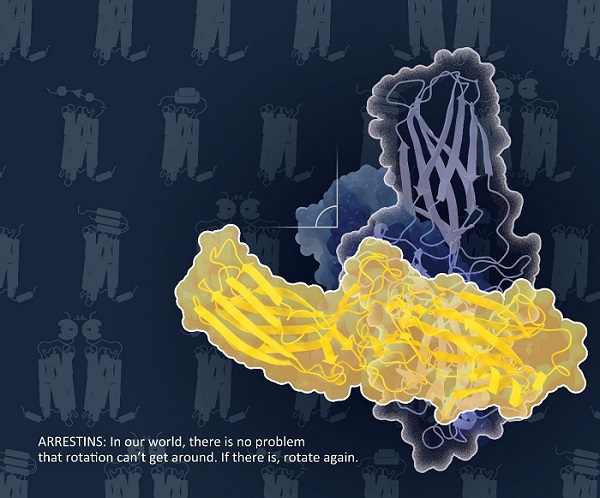
图:Arrestin2-NTSR1复合物与Arrestin1-视紫红质复合物结构相比,Arrestin2相比于Arrestin1有90°旋转的构象差异
(供稿部门:中科院受体结构与功能重点实验室、药物靶标结构与功能中心;供稿人:尹万超)
