近年来,生物大分子的“液-液相分离”(liquid-liquid phase separation, LLPS)被证明是细胞内多种没有脂膜包被的无膜细胞器的重要形成机理。极性复合物聚集体也具有这些无膜细胞器的类似特征,如高度凝聚性、动态性等。复旦大学生物医学研究院温文玉课题组与新加坡国立大学淡马锡生命科学研究院蔡毓课题组前期已经证实,在果蝇神经干细胞(Neuroblast)不对称分裂过程中,细胞命运决定因子Numb和连接蛋白Pon之间多位点结合导致的液-液相分离介导了Numb在神经干细胞底端皮层的极性富集,进而调控了神经干细胞的分化。
近期,温文玉组和蔡毓组再次合作,研究发现神经干细胞不对称分裂过程中,Par蛋白复合物(Par3/Par6/aPKC)也是通过相分离的方式进行组装,进而调控顶-底细胞极性轴的建立以及神经元的分化。研究者进一步提出,极性蛋白复合物多价相互作用介导的液-液相分离可能是细胞极性建立的普遍机制。5月8日,相关研究成果以《相分离介导的Par复合物聚集体形成》(“Par complex cluster formation mediated by phase separation”)为题在线发表于《自然-通讯》(Nature Communications)。
作为最早被报道的极性调控复合物,高度保守的Par复合物由Par3(果蝇中为Bazooka),Par6和aPKC组成,三者可以两两相互结合形成一个极性核心,并进一步招募其他蛋白发挥功能。以果蝇神经干细胞的不对称分裂过程为例,在细胞分裂开始时,均匀分布的Baz/Par6/aPKC逐渐聚集在细胞的顶端皮层,而细胞命运决定因子及其衔接蛋白(包括Numb/Pon复合物)在aPKC磷酸化的调控下,脱离顶端皮层,进而在细胞底端聚集,从而建立了顶-底端极性。极性分布于细胞两端的蛋白质及RNA随即被不均一地分离到两个子细胞中,从而使其具有不同的命运。细胞分裂完成后,细胞两端的蛋白聚集体去组装以进行下一轮的循环。在这项最新工作中,研究者发现Par复合物随着细胞周期,以液滴的形式凝聚于顶部皮层上。进一步体外及细胞内过表达实验表明,Par3由于其NTD结构域的寡聚可发生液液相分离现象,Par6通过其C末端氨基酸与Par3 PDZ3的特异结合而被富集到Par3凝聚体中,同时极大地促进了Par3的相分离能力。
作为复合物中唯一的激酶,aPKC也可以被招募并富集在Par3/Par6凝聚体中,但是凝聚体中的aPKC处于非活性状态。重要的是,激活的aPKC可以磷酸化Par3,并促使Par凝聚体解离。研究者推测,Par凝聚相液滴的形成可能是将胞质中有限的aPKC转运至局部膜区域的一种有效方式。在到达特定膜区域后,aPKC可在其他调节因子(如Cdc42)的作用下激活,进而通过磷酸化Par3使得Par复合物凝聚体解聚;同时,激活的aPKC可发挥其激酶活性以介导细胞命运决定因子的底部定位。干扰Par3/Par6液液相分离的形成会破坏果蝇神经干细胞不对称分裂过程中顶-底端极性的建立,进而导致神经元谱系发育的缺陷(图1)。结合前期工作,该研究表明极性蛋白复合物多价相互作用介导的液液相分离可能是细胞极性建立的普遍机制。
尽管液-液相分离为细胞中大量无膜细胞器的形成、以及多种生理过程中细胞组分的选择性浓缩和分离机制提供了一个全新的视角,其在生理条件下是否真正调控这些生物学过程一直是争论的焦点。毕竟相分离体现出极大的蛋白浓度依赖性,而在体外实验与细胞内过表达体系中,目标蛋白的浓度可能远大于生理浓度。为了解决这一问题,研究者通过设计GFP标签的Baz敲入果蝇,探讨了内源表达量条件下Par复合物相分离对于极性建立的调控。出乎意料的是,对于缺失NTD结构域、低相分离能力的Baz ΔNTD突变体,在转基因果蝇的过表达体系中会造成>80%的神经干细胞极性丧失;而在敲入果蝇中,绝大部分神经干细胞里的Par复合物都可观察到顶部皮层的聚集,但伴随有明显的胞质扩散现象,进而造成发育后脑尺寸的减小。更重要的是,如果用无二级结构,但可发生相分离的FUS的LCD片段替换Baz NTD结构域,可以显著挽救NTD缺失造成的脑发育异常(图1)。这一结果为相分离介导的Par复合物极性分布及极性建立提供了强有力的数据,同时也指出了过表达体系对于研究相分离生理意义的缺陷。
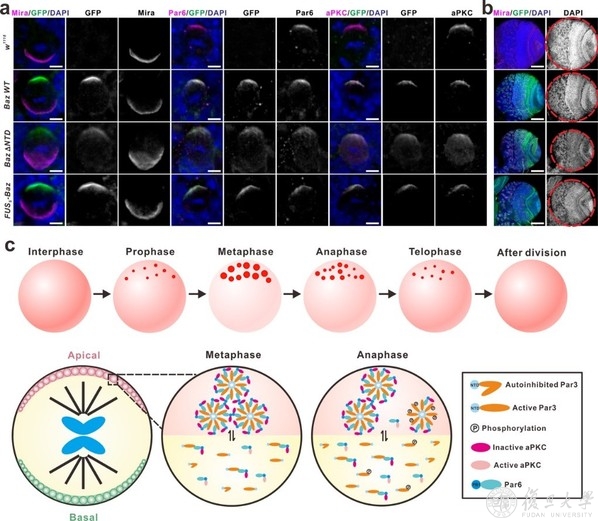
图1 Par复合物相分离调控神经干细胞极性建立
综上所述,这项研究揭示了极性蛋白复合物Par3/Par6/aPKC通过多价相互作用引起的相分离促进了其在局部膜区域的凝聚,而相分离凝聚体对于细胞信号的快速反应也保证了极性建立与解除的高度动态性。由于大多极性复合物都具有类似的多位点结合模式,以及动态分布规律,该研究提出的蛋白质相分离可能是调控细胞极性的普适性规律。
复旦大学博士生刘子亨、硕士生顾爱红,以及新加坡国立大学杨迎博士为论文共同第一作者,复旦大学研究员温文玉和新加坡国立大学教授蔡毓为论文的共同通讯作者。该课题还得到了首都师范大学教授李周华、香港科技大学教授张明杰等的大力支持。
论文链接:https://www.nature.com/articles/s41467-020-16135-6
