王琮,赵健,宋晓峰
(南京航空航天大学 自动化学院,南京 210006)
摘要:
环形RNA是一类广泛存在于真核细胞的内源性RNA,其由前体RNA反向剪接形成,呈闭环结构,没有5’端帽子结构及3’端polyA尾巴。一直以来,环形RNA被认为没有编码能力,不能编码蛋白质,只是作为microRNA“海绵”等方式,发挥调控功能。然而,近年来随着对环形RNA研究的不断深入,部分环形RNA被发现可通过非帽依赖翻译起始机制编码蛋白质。并且,环形RNA编码的蛋白质被证实在多个细胞过程中发挥着至关重要的作用。对目前环形RNA编码蛋白的研究现状进行综述,并对目前环形RNA编码蛋白的相关生物信息学工具进行了总结。
关键词: 环形RNA 编码潜能 内部核糖体进入位点 m6A甲基化修饰
DOI:10.12113/201910002
分类号:Q74
文献标识码:A
基金项目:国家自然科学基金项目(No.61973155,No.61571223)
Review on circular RNA with protein-coding ability in eukaryotes
WANG Cong, ZHAO Jian, SONG Xiaofeng
(College of Automation Engineering, Nanjing University of Aeronautics and Astronautics, Nanjing 210006, China)
Abstract:
Circular RNA (circRNA) is a type of endogenous RNA widely expressed in eukaryotic cells, which is formed by back-splicing of pre-RNA without 5cap and 3tail. circRNA has long been considered to be without coding ability, for it cannot encode protein and just regulates gene expression as microRNA sponge. However, with more and more research results on circRNA over the years, a small number of circRNAs has been proved able to encode protein or peptides in cap-independent manner. These proteins or peptide have been shown to play a vital role in cellular processes. This paper reviews the current circRNA research, and summarizes some bioinformatics methods related to circRNA protein coding ability.
Key words: circRNA Coding potential Internal ribosome entry site m6A modification
王琮, 赵健, 宋晓峰. 真核生物环形RNA编码蛋白的研究进展[J]. 生物信息学, 2020, 18(1): 1-7. DOI: 10.12113/201910002.

WANG Cong, ZHAO Jian, SONG Xiaofeng. Review on circular RNA with protein-coding ability in eukaryotes[J]. Chinese Journal of Bioinformatics, 2020, 18(1): 1-7. DOI: 10.12113/201910002.

基金项目 国家自然科学基金项目(No.61973155, No.61571223) 通信作者 宋晓峰,男,教授,博士生导师,研究方向:生物信息学. E-mail: xfsong@nuaa.edu.cn 作者简介 王琮,男,硕士研究生,研究方向:生物信息学. E-mail: wangcong@nuaa.edu, cn 文章历史 收稿日期: 2019-10-21 修回日期: 2019-12-02
Contents Abstract Full text Figures/Tables PDF
真核生物环形RNA编码蛋白的研究进展
王琮
 , 赵健, 宋晓峰
, 赵健, 宋晓峰

南京航空航天大学 自动化学院,南京 210006
收稿日期: 2019-10-21; 修回日期: 2019-12-02
基金项目: 国家自然科学基金项目(No.61973155, No.61571223)
作者简介:王琮,男,硕士研究生,研究方向:生物信息学. E-mail: wangcong@nuaa.edu, cn
通信作者: 宋晓峰,男,教授,博士生导师,研究方向:生物信息学. E-mail: xfsong@nuaa.edu.cn
摘要: 环形RNA是一类广泛存在于真核细胞的内源性RNA,其由前体RNA反向剪接形成,呈闭环结构,没有5’端帽子结构及3’端polyA尾巴。一直以来,环形RNA被认为没有编码能力,不能编码蛋白质,只是作为microRNA“海绵”等方式,发挥调控功能。然而,近年来随着对环形RNA研究的不断深入,部分环形RNA被发现可通过非帽依赖翻译起始机制编码蛋白质。并且,环形RNA编码的蛋白质被证实在多个细胞过程中发挥着至关重要的作用。对目前环形RNA编码蛋白的研究现状进行综述,并对目前环形RNA编码蛋白的相关生物信息学工具进行了总结。
关键词: 环形RNA 编码潜能 内部核糖体进入位点 m6A甲基化修饰
Review on circular RNA with protein-coding ability in eukaryotes
WANG Cong
 , ZHAO Jian, SONG Xiaofeng
, ZHAO Jian, SONG Xiaofeng

College of Automation Engineering, Nanjing University of Aeronautics and Astronautics, Nanjing 210006, China
Abstract: Circular RNA (circRNA) is a type of endogenous RNA widely expressed in eukaryotic cells, which is formed by back-splicing of pre-RNA without 5'cap and 3'tail. circRNA has long been considered to be without coding ability, for it cannot encode protein and just regulates gene expression as microRNA sponge. However, with more and more research results on circRNA over the years, a small number of circRNAs has been proved able to encode protein or peptides in cap-independent manner. These proteins or peptide have been shown to play a vital role in cellular processes. This paper reviews the current circRNA research, and summarizes some bioinformatics methods related to circRNA protein coding ability.
Key Words: circRNA Coding potential Internal ribosome entry site m6A modification
环形RNA是一类特殊的呈封闭环状结构的RNA分子,其没有5’端帽子结构和3’端PolyA尾巴,由前体RNA(pre-mRNA)通过反向剪接形成。近来研究发现环形RNA也可以编码蛋白,且估计大约10%的环形RNA具有蛋白编码能力。尽管仅有少数编码蛋白的环形RNA被发现,但这些环形RNA编码的小肽在多个生物过程中发挥着重要的作用,且与疾病密切关联。目前尚有大量的环形RNA等待着人们去发现,因此本文对环形RNA编码蛋白的相关研究进行了综述,并对目前现有的可用于编码蛋白环形RNA识别的相关生物信息学工具和方法进行了总结。环形RNA通过编码蛋白这一机制,发挥了与疾病相关的一些作用。因此对于环形RNA编码蛋白的研究具有重要的意义。
1 环形RNA编码蛋白潜能的发现1976年人们首次在病毒中观察到环形RNA的存在[1]。1979年研究人员在电子显微镜下观察到真核细胞中的环形RNA[2]。随着二代测序技术的快速发展和生物信息学工具的开发,环形RNA被检测到广泛存在于真核生物中。在人类和小鼠脑组织分别检测到65 731和15 849个环形RNA [3]。2015年,Wang等人通过将内部核糖体进入位点(Internal Ribosome Entry Site, IRES)人工插入环形RNA的实验方法,发现这类人工构建的环形RNA可以翻译[4],这引起了研究者们的注意。
一直以来,环形RNA被认为不能编码蛋白质,是一类新的非编码RNA,通过竞争性结合microRNA调控基因表达。然而,人工构建的可编码蛋白环形RNA的出现使得人们开始怀疑是否存在内源性的可编码蛋白环形RNA。2015年Chen等人对人类环形RNA的编码能力进行了分析,发现相当多的环形RNA转录本具有蛋白质编码潜能,并通过质谱数据从中鉴定出21个编码蛋白的环形RNA。在2017年,Ivano等人通过northern blot、质谱技术等方法验证了环形RNA(circ-ZNF609)能够编码蛋白质,从而调控肌细胞增殖,并且验证了该环形RNA的非翻译区(Un-translated region, UTR)存在IRES结构[5]。Yang等人通过抗体检测、质谱结果发现了Circ-FBXW7能够编码与恶性胶质瘤发病机制相关的蛋白FBXW7-185aa[6]。Zhang等人验证了circ-SHPRH能够编码新型蛋白质SHPRH-146aa,该蛋白能够抑制神经胶质瘤的发生[7]。2018年Zhang等人还验证了circ-PINT能够编码新型蛋白PINT87aa,抑制多种癌基因转录延伸[8]。2019年Liang等人发现了circβ-catenin能够编码全新蛋白β-Catenin-370aa,调控Wnt/β连环蛋白信号通路[9]。Heesch等人在心脏组织中发现40种环形RNA能被翻译,其中6个在质谱检测中得到验证[10]。
综合以上已经发表的验证环形RNA编码蛋白的文章,验证的过程大致如下:预测环形RNA的开放阅读框(Open reading frame,ORF),包括了跨越接头位置(Junction site)的情况,具有开放阅读框的环形RNA则有编码蛋白质的潜在能力; 根据生物信息学的方法预测环形RNA中是否包含内部核糖体进入位点(Internal ribosome entry site,IRES)结构,如果有,进一步通过双顺反子实验验证IRES结构的活性; 如果预测的开放阅读框跨越反向剪接位点,预测其可能编码的蛋白质序列,通过质谱检测(MS)技术验证是否有环形RNA翻译形成的特定小肽片段,如果有则证实该环形RNA编码蛋白质。
2 环形RNA编码蛋白相关调控机制在基因组中,mRNA编码区的起始密码子必然在终止密码子之前。然而,对于环形RNA,因其闭环结构,其编码区的起始密码子在基因组中的位置可能在终止密码子之后,且编码区的长度可能大于环形RNA自身。此外,因闭环结构,环形RNA不含5’端帽子结构,因此无法依赖帽子结构招募核糖体起始翻译蛋白,而只能通过非帽依赖的内部翻译起始机制编码蛋白。IRES元件作为一段RNA内部序列,可直接招募核糖体结合,从RNA内部起始翻译蛋白,因此IRES元件可视为环形RNA编码蛋白的前提条件之一。m6A甲基化作为RNA中丰度最高的转录后修饰,其所在的短序列可作为IRES元件驱动环形RNA翻译蛋白,由此m6A甲基化也可视作环形RNA编码蛋白的标志。因此,以下将从编码区域的识别及翻译起始驱动方面介绍环形RNA编码蛋白的相关调控机制。
2.1 环形RNA中编码蛋白区域的识别机制环形RNA编码蛋白的先决条件是必须要有一定长度的开放阅读框(ORF)。开放阅读框是指从起始密码子(AUG)开始,结束于终止密码子(UAA, UAG, UGA)的一段连续碱基序列。由于密码子的读写起始位置不同,RNA序列可能按三种开放阅读框阅读和翻译。核糖体从起始密码子开始翻译,沿着RNA序列合成多肽链并不断延伸,遇到终止密码子翻译终止。然而,对于环形RNA这一呈现环状的特殊RNA,情况有所不同。不同于线性mRNA,环形RNA的开放阅读框可能跨越反向剪接位点(Junction site),开放阅读框可能绕环形RNA一圈或者两圈,长度甚至大于环形RNA本身。因此具有开放阅读框的环形RNA才可能编码蛋白质。
2.2 内部核糖体进入位点(IRES)介导的环形RNA内部翻译起始机制RNA的翻译起始可分为帽依赖翻译和非帽依赖翻译两种方式,其中帽依赖翻译主要依靠5’端的帽子结构招募起始因子复合物和核糖体亚基,在起始因子的辅助下,将RNA与40 S核糖体亚基结合,驱动翻译起始。而在非帽依赖翻译机制中,IRES介导的内部翻译起始占了很大一部分,其在反式作用因子的作用下直接招募40 S核糖体亚基与RNA结合,进而启动翻译过程。因此,尽管环形RNA是一个闭环结构,没有5’帽子结构,但环形RNA可以通过内部的IRES元件起始蛋白质翻译过程。
编码蛋白质的环形RNA内部大多都含有IRES元件,并且实验表明IRES确实驱动了环形RNA的翻译起始[5-9]。IRES实验验证的主要手段是通过双顺反子实验,通常使用荧光素酶质粒作为载体,在其5’UTR区插入待测序列,如果下游荧光素酶表达提升,则证明待测序列具有IRES活性。IRES元件不仅在5’非翻译区(5’Un-translated region, UTR)有分布,在CDS区及3’UTR区同样存在IRES元件[11]。并且,研究发现大约10%的人类mRNA的5’UTR区含有IRES元件。环形RNA大多来源于mRNA的外显子,因此有足够理由相信相当一部分的环形RNA含有IRES元件。一般来说,具有IRES元件结构的环形RNA,我们更相信其具有编码蛋白质的能力,因为IRES元件能够招募核糖体亚基与其结合从而启动翻译。
2.3 m6A(N6)甲基化修饰驱动的环形RNA翻译机制N6甲基化修饰促进环形RNA的翻译起始。N6甲基化修饰,即腺苷酸6号N发生甲基化修饰事件,又称m6A。m6A是真核细胞中最广泛的一种RNA甲基化修饰[12-13]。该修饰最可能出现的共有基序(Consensus motif)是“RRm6ACH”,其中R是A或G,H是A, C或U[14-15]。m6A在3’非编码区(UTR)通过与YTHDF1蛋白结合,提高翻译效率[16]。然而,在5’UTR区,m6A通过YTHDF2相关作用机制,促进非帽依赖翻译起始[17-18]。YTHDF3还能与核糖体蛋白相互作用促进mRNA的翻译[19]。
线性mRNA由核糖体扫描起始翻译,然而环形RNA的翻译起始机制完全不同。真核生物常规蛋白翻译起始由eIF4复合物开始,其中eIF4E结合5’帽子结构,eIF4G提供翻译起始复合物组装所需支架,募集核糖体后起始翻译过程。研究人员通过一系列实验表明eIF4G2与eIF3A结合位点与m6A修饰位点重合较高[20]。Yang等人通过circRNA-m6A-seq(m6A抗体免疫共沉淀反应深度测序)的实验手段证实内源性环形RNA中含有大量的m6A修饰位点,经过序列特征分析表明,m6A修饰经常出现在eIF4G2结合位点上游,说明了两者可能存在协同调控翻译活动的作用。基于m6A抗体测序组和全部环形RNA数量推理分析, 大约有13%环形RNA存在m6A修饰事件。因此,具有m6A修饰的环形RNA更有可能具有翻译能力,能够编码蛋白质。
3 环形RNA编码蛋白的相关生物信息学预测工具3.1 编码蛋白环形RNA的预测流程预测编码蛋白环形RNA的流程大致如下:(1)首先预测环形RNA的开放阅读框,具有开放阅读框的环形RNA则有编码蛋白质的潜在能力;(2)对开放阅读框的序列保守性进行计算;(3)通过一些现有工具计算编码得分;(4)根据生物信息学的方法和工具预测环形RNA中是否包含IRES结构;(5)接着进行m6A修饰的预测;(6)结合ribo-seq数据,过滤rRNA读段,去除匹配上线性RNA的部分,若环形RNA接头部分匹配上ribo-seq数据,更有理由相信环形RNA进行了翻译;(7)如果预测的开放阅读框跨越反向剪接位点,预测其可能编码的氨基酸序列,通过质谱检测(MS)技术验证是否有环形RNA翻译形成的特定小肽片段,如果有则证实该环形RNA确实能够编码小肽。流程图见图 1。
图 1(Figure 1)
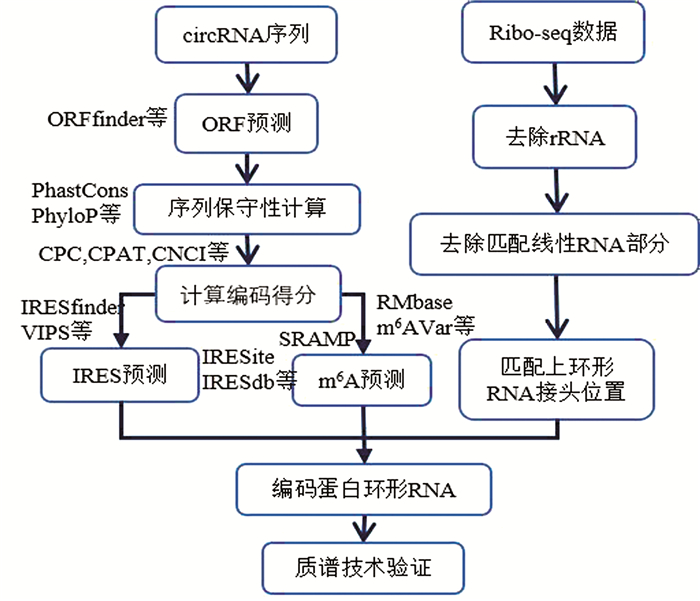 图 1 编码蛋白环形RNA预测流程图Figure 1 Flow chart pipeline for predicting protein-coding circRNAs
图 1 编码蛋白环形RNA预测流程图Figure 1 Flow chart pipeline for predicting protein-coding circRNAs3.2 开放阅读框预测工具ORF预测软件主要有ORFfinder, ORF Investigator, ORF Predictor和ORFik。ORFfinder是一个图形分析工具,可以查找用户输入序列中大于一定长度的所有开放阅读框,或者在已有数据库中存在的序列,并通过BLAST服务器在数据库中检索氨基酸序列。ORF Investigator是基于perl语言编写的程序,能够有效地找到相应氨基酸序列的ORF并将它们转换成它们的单字母氨基酸代码,并在序列中提供它们的位置,还能在序列间进行全局比对,检测单核苷酸多态性。ORF Predictor使用两种不同ORF定义的组合,它搜索从起始密码子开始到终止密码子结束的延伸。作为另外的标准,它在5'非翻译区(UTR)中搜索终止密码子。ORFik是Bioconductor中的R包,用于寻找开放阅读框架并使用新一代测序技术来证明ORF的合理性。然而,环形RNA呈闭合环状结构,开放阅读框能够跨越接头位置,绕环一周以上,所以这些工具都不太适合环形RNA开放阅读框的预测,需要自编程序实现。
3.3 IRES预测工具及相关数据库目前预测IRES元件的工具主要有IRSS[21]、VIPS[22], IRESpred[23]和IRESfinder[24]。其中,IRSS和VIPS通过与已知IRES的二级结构进行相似度比对,得出待测序列为IRES元件的置信度。IRESpred通过支持向量机模型,构建了病毒和细胞IRES元件的35种特征,其中27种特征基于待测序列5'UTR区与小亚基核糖体蛋白结合的可能性,其他特征基于UTR区的序列和结构特征。IRESfinder通过文献验证[11]的583个IRES元件进行机器学习训练,经过10次交叉验证,ROC曲线分析的AUC值达到了0.825。其中,VIPS与已知病毒IRES二级结构进行比对,但当时已知病毒IRES只有4个,且运行时间较长,IRESfinder基于序列特征预测存在IRES元件的可能性,较适用于环形RNA中IRES的预测。
目前收录IRES元件的数据库主要有IRESdb[25], IRESite[26]和Rfam[27]。IRESdb构建于2002年,提供了30个来自病毒的IRES和50个来自真核细胞IRES相关mRNA信息。IRESite构建于2005年,数据库收录了125个IRES序列信息,来自43个病毒和70个真核mRNA。Rfam收集了IRES_RhPV, IRES_cyp24a1两个族类的IRES,提供了来源病毒和参考文献的相关信息。上述IRES数据库收录信息都比较久远,目前已验证的IRES元件已远超上述几个数据库。
3.4 m6A预测工具及相关数据库现有基于序列预测m6A修饰位点的软件主要有SRAMP(Sequence-based RNA adenosine methylation site predictor)[28]。SRAMP联合三种随机森林分类器(基于位置分类器、基于K最邻近算法分类器、基于核苷酸对分类器)给出综合打分。输入可以是基因组序列或是核心DNA序列(cDNA),分别对应两种模式。SRAMP在交叉验证和独立验证方面都具有优势,训练集正样本来自两篇验证哺乳动物单核苷酸分辨率的m6A位点的文章[29-30],负样本来自相同基序(DRACH)在同个数据集中的随机选取,因为m6A修饰并不是随机的[31]。SRAMP还做成了网页服务器的形式提供给用户使用。对于环形RNA中m6A修饰位点的预测,基于序列预测的工具SRAMP能够胜任。
目前收录m6A修饰位点的数据库主要有RMbase[32]和m6Avar[33]。RMbase通过m6A-CLIP的实验技术,收集了来自12个不同物种大约1 373 000个m6A修饰位点信息。m6Avar通过7组miCLIP,2组PA-m6A-Seq实验,244个MeRIP-Seq实验以及工具预测的渠道收集了三类m6A修饰位点数据,共414 241个m6A相关变异位点,基因类型包括了lincRNA, miRNA, piRNA等。
3.5 转录本蛋白编码预测工具目前常用转录本编码蛋白预测工具主要有CPC[34], CPAT[35]和CNCI [36]。工具主要分为两类,基于序列比对(Alignment-based)和不需要基于序列比对(Alignment-free)。其中CPC基于序列比对,可以识别保守性较好的蛋白编码基因,CPAT和CNCI不需要序列比对,主要用于物种间保守性较差的转录本。
2007年,Kong等人开发了评估转录本编码蛋白潜能的工具CPC[34]。CPC基于支持向量机分类器,通过提取具有重要生物学意义的六种序列特征。将输入序列分为编码序列或非编码序列并给出对应得分。训练集上通过十倍交叉验证,在大量数据集上展示出CPC具有很高的准确度(95.77%)。CPC提取的序列特征前三项关于预测的开放阅读框(ORF),由framefinder计算所得(包括The Log-odds score, Coverage of the predicted orf, Integrity of the predicted orf)。后三项特征通过假定ORF编码的蛋白与UniProt数据库经过blast比对结果所得(包括Number of hits, hit score, frame score)。CPC训练集正样本来自EMBL的121 914个编码区(CDS)序列,负样本来自Rfam和RNADB共34 766个非编码序列。
不同于CPC的是,CPAT不需要基于序列比对(Alignment-free),而是通过编码和非编码转录本的序列特征来进行区分[35]。CPAT运用逻辑回归分类器,基于四种序列特征来区分编码与非编码转录本,分别是:(1)开放阅读框长度(Open reading frame size);(2)开放阅读框覆盖度(Open reading frame coverage);(3)Fickett统计,基于碱基组成和密码子分布(Fickett TESTCODE statistic);(4)六聚体频率(Hexamer usage bias)。以上四种特征,都能较好区分编码与非编码转录本。正样本来自RefSeq数据库的10 000个编码蛋白转录本,负样本来自GENCODE数据库的10 000个随机选取的非编码RNA。通过十次交叉验证AUC曲线达到0.992 7。
而CNCI基于碱基三联子的构成来区分编码与非编码转录本,其利用人类和小鼠转录本构建支持向量机模型,用于对脊椎动物进行分类[36]。训练集正样本来自RefSeq数据库,负样本来自GENCODE。测试集数据物种包含了小鼠等脊椎动物和植物。对于人类编码和非编码转录本,经过十次交叉验证所得准确率达到97.3%。
针对环形RNA编码蛋白的预测,需要先将环形RNA序列预处理,保证ORF的完整性,避免跨越接头位置的ORF被分割,才能将环形RNA序列输入上述三种转录本编码蛋白预测工具进行分析。
3.6 编码蛋白环形RNA预测工具及相关数据库随着二代测序技术的快速发展,大量的环形RNA被发现,构建一个编码蛋白的环形RNA的数据库非常有必要。2016年Chen等人构建了首个人类环形RNA数据库circRNAdb,并对环形RNA的蛋白质编码潜能进行了分析[37]。研究者主要通过开放阅读框预测,IRES元件预测,以及蛋白质谱数据比对等几个方面,从32 914个人类环形RNA数据中,筛选出6 608个具有编码蛋白潜能的环形RNA,其中21个得到了质谱数据的验证。Yang等人和Zhang等人通过circRNAdb提供的参考信息,实验验证了Circ-FBXW7和circ-SHPRH能够编码蛋白质,ORF与数据库中预测的信息一致,IRES的验证也与数据库中的信息有很大重叠。由此可见,circRNAdb对于验证环形RNA编码蛋白质具有很大的参考意义。
目前环形RNA编码蛋白潜能预测工具主要有CircPro和CircCode。2017年,Meng等人开发了首个基于RNA-seq及Ribo-seq数据识别编码蛋白环形RNA的工具CircPro[38]。研究者首先使用转录组测序数据(RNA-seq)作为输入,结合.GTF基因注释文件,基因组文件,调用环形RNA检测工具CIRI2预测测序数据中的环形RNA[39]。其次,提取CIRI2所得结果的环形RNA序列,并经过拼接后调用CPC(Coding potential calculator)预测环形RNA编码能力得分。最后,使用翻译组测序数据(Ribo-seq)作为输入,寻找比对不上线性RNA的reads,将其与环形RNA反向剪接位点(Junction sites)的reads做比对,若能比对上,则能为该环形RNA的翻译潜能提供支持。CircPro总共会输出4个文件,其主要内容分别为:(a)预测的环形RNA序列;(b)每个circRNA的编码潜能得分(CPC预测);(c)每个circRNA的RNA-seq reads支持数和Ribo-seq reads支持数;(d)编码蛋白质的circRNAs。
2019年,Sun等人开发了环形RNA翻译的预测软件CircCode,这是一种基于机器学习的方法[40]。工作流程如下:首先应用Ribo-seq测序数据,保留比对不上基因组的reads,将其映射到环形RNA的接头位置,若能映射上则保留作为可翻译的候选环形RNA(该过程与CircPro最后一步类似)。接着通过机器学习工具BASiNET预测跨越街头部分的ribo-seq reads是否可以翻译,确定可以翻译的环形RNA。最后预测环形RNA的ORF及其可能编码的多肽。
CircPro与CircCode中基于ribo-seq数据分析的方法相似,有较高可信度,不同之处在于CircCode基于机器学习再预测这些比对上反向剪接位点的ribo-seq reads是否可翻译,而CircPro将比对上的reads都作为环形RNA可编码蛋白的一个证据。此外,CircCode使用FragGeneScan预测环形RNA开放阅读框,而CircPro通过CPC预测环形RNA编码蛋白潜能。
4 总结与展望一直以来,环形RNA被划分为非编码RNA。然而,近来研究发现,相当一部分的环形RNA具有编码蛋白质的潜能。目前,由于编码蛋白环形RNA的特征尚不明确,相关生物信息学预测及分析方法极为欠缺,严重阻碍了真核生物环形RNA编码蛋白的相关研究。现有RNA编码潜能的预测工具大都是基于线性RNA(mRNA和lncRNA)开发而成,而环形RNA中与mRNA的重叠部分,及其非线性的环状结构,都严重降低了现有工具对环形RNA编码潜能的预测能力。
环形RNA内的IRES及m6A修饰位点已被证实可介导其非帽依赖翻译起始过程,因此IRES及m6A修饰位点识别将有助于提高编码蛋白环形RNA的识别能力。此外,随着越来越多的编码蛋白环形RNA被发现,以及环形RNA编码蛋白机制的深入研究,相信会有更多更有效的编码蛋白环形RNA相关生物信息学工具及数据库出现,反过来进一步促进编码蛋白环形RNA的发现及对其编码起始机制的深入研究。
参考文献
[1] SANGER H L, KLOTZ G, RIESNER D, et al. Viroids are single-stranded covalently closed circular RNA molecules existing as highly base-paired rod-like structures[J]. Proceedings of the National Academy of Sciences, 1976, 73(11): 3852-3856. DOI:10.1073/pnas.73.11.3852 (
 0)
0)[2] HSU M T, MIGUEL C P. Electron microscopic evidence for the circular form of RNA in the cytoplasm of eukaryotic cells[J]. Nature, 1979, 280(5720): 339-340. DOI:10.1038/280339a0 (
 0)
0)[3] RYBAK-WOLF A, STOTTMEISTER C, GLA?AR P, et al. Circular RNAs in the mammalian brain are highly abundant, conserved, and dynamically expressed[J]. Molecular Cell, 2015, 58(5): 870-885. DOI:10.1016/j.molcel.2015.03.027 (
 0)
0)[4] WANG Y, WANG Z. Efficient backsplicing produces translatable circular mRNAs[J]. Rna, 2015, 21(2): 172-179. DOI:10.1261/rna.048272.114 (
 0)
0)[5] LEGNINI I, DI T G, ROSSI F, et al. Circ-ZNF609 is a circular RNA that can be translated and functions in myogenesis[J]. Molecular Cell, 2017, 66(1): 22-37.e9. DOI:10.1016/j.molcel.2017.02.017 (
 0)
0)[6] YANG Y, GAO X, ZHANG M, et al. Novel role of FBXW7 circular RNA in repressing glioma tumorigenesis[J]. JNCI: Journal of the National Cancer Institute, 2017, 110(3): 304-315. DOI:10.1093/jnci/djy116 (
 0)
0)[7] ZHANG M, HUANG N, YANG X, et al. A novel protein encoded by the circular form of the SHPRH gene suppresses glioma tumorigenesis[J]. Oncogene, 2018, 37(13): 1805. DOI:10.1038/s41388-017-0019-9 (
 0)
0)[8] ZHANG M, ZHAO K, XU X, et al. A peptide encoded by circular form of LINC-PINT suppresses oncogenic transcriptional elongation in glioblastoma[J]. Nature Communications, 2018, 9(1): 4475. DOI:10.1038/s41467-018-06862-2 (
 0)
0)[9] LIANG W C, WONG C W, LIANG P P, et al. Translation of the circular RNA circβ-catenin promotes liver cancer cell growth through activation of the Wnt pathway[J]. Genome Biology, 2019, 20(1): 84. DOI:10.1186/s13059-019-1685-4 (
 0)
0)[10] VAN HEESCH S, WITTE F, SCHNEIDER-LUNITZ V, et al. The translational landscape of the human heart[J]. Cell, 2019, 178(1): 242-260. DOI:10.1016/j.cell.2019.05.010 (
 0)
0)[11] WEINGARTEN-GABBAY S, ELIAS-KIRMA S, NIR R, et al. Systematic discovery of cap-independent translation sequences in human and viral genomes[J]. Science, 2016, 351(6270): aad4939. DOI:10.1126/science.aad4939 (
 0)
0)[12] LI S, MASON C E. The pivotal regulatory landscape of RNA modifications[J]. Annual Review of Genomics and Human Genetics, 2014, 15: 127-150. DOI:10.1146/annurev-genom-090413-025405 (
 0)
0)[13] WEI C M, GERSHOWITZ A, MOSS B. Methylated nucleotides block 5' terminus of HeLa cell messenger RNA[J]. Cell, 1975, 4(4): 379-386. DOI:10.1016/0092-8674(75)90158-0 (
 0)
0)[14] CSEPANY T, LIN A, BALDICK C J, et al. Sequence specificity of mRNA N6-adenosine methyltransferase[J]. Journal of Biological Chemistry, 1990, 265(33): 20117-20122. DOI:10.1093/nar/18.19.5735 (
 0)
0)[15] HARPER J E, MICELI S M, ROBERTS R J, et al. Sequence specificity of the human mRNA N6-adenosine methylase in vitro[J]. Nucleic Acids Research, 1990, 18(19): 5735-5741. DOI:10.1093/nar/18.19.5735 (
 0)
0)[16] WANG X, ZHAO B S, ROUNDTREE I A, et al. N6-methyladenosine modulates messenger RNA translation efficiency[J]. Cell, 2015, 161(6): 1388-1399. DOI:10.1016/j.cell.2015.05.014 (
 0)
0)[17] ZHOU J, WAN J, GAO X, et al. Dynamic m6A mRNA methylation directs translational control of heat shock response[J]. Nature, 2015, 526(7574): 591. DOI:10.1038/nature15377 (
 0)
0)[18] MEYER K D, PATIL D P, ZHOU J, et al. 5' UTR m6A promotes cap-independent translation[J]. Cell, 2015, 163(4): 999-1010. DOI:10.1016/j.cell.2015.10.012 (
 0)
0)[19] LI A, CHEN Y S, PING X L, et al. Cytoplasmic m6A reader YTHDF3 promotes mRNA translation[J]. Cell Research, 2017, 27(3): 444. DOI:10.1038/cr.2017.10 (
 0)
0)[20] YANG Y, FAN X, MAO M, et al. Extensive translation of circular RNAs driven by N6-methyladenosine[J]. Cell Research, 2017, 27(5): 626. DOI:10.1038/cr.2017.31 (
 0)
0)[21] WU T Y, HSIEH C C, HONG J J, et al. IRSS: A web-based tool for automatic layout and analysis of IRES secondary structure prediction and searching system in silico[J]. BMC Bioinformatics, 2009, 10(1): 160. DOI:10.1186/1471-2105-10-160 (
 0)
0)[22] HONG J J, WU T Y, CHANG T Y, et al. Viral IRES prediction system-A web server for prediction of the IRES secondary structure in silico[J]. PLoS One, 2013, 8(11): e79288. DOI:10.1371/journal.pone.0079288 (
 0)
0)[23] KOLEKAR P, PATASKAR A, KULKARNI-KALE U, et al. IRESPred: Web server for prediction of cellular and viral internal ribosome entry site (IRES)[J]. Scientific Reports, 2016, 6: 27436. DOI:10.1038/srep27436 (
 0)
0)[24] ZHAO J, WU J, XU T, et al. IRESfinder: Identifying RNA internal ribosome entry site in eukaryotic cell using framed k-mer features[J]. Journal of Genetics and Genomics= Yi Chuan Xue Bao, 2018, 45(7): 403. DOI:10.1016/j.jgg.2018.07.006 (
 0)
0)[25] BONNAL S, BOUTONNET C, PRADO-LOUREN?O L, et al. IRESdb: The internal ribosome entry site database[J]. Nucleic Acids Research, 2003, 31(1): 427-428. DOI:10.1093/nar/gkg003 (
 0)
0)[26] MOKREJ? M, MA?EK T, VOPáLENSKy V, et al. IRESite—A tool for the examination of viral and cellular internal ribosome entry sites[J]. Nucleic Acids Research, 2009, 38(suppl_1): D131-D136. DOI:10.1093/nar/gkp981 (
 0)
0)[27] KALVARI I, ARGASINSKA J, QUINONES-OLVERA N, et al. Rfam 13.0: Shifting to a genome-centric resource for non-coding RNA families[J]. Nucleic Acids Research, 2017, 46(D1): D335-D342. DOI:10.1093/nar/gkx1038 (
 0)
0)[28] ZHOU Y, ZENG P, LI Y H, et al. SRAMP: Prediction of mammalian N6-methyladenosine (m6A) sites based on sequence-derived features[J]. Nucleic Acids Research, 2016, 44(10): e91-e91. DOI:10.1093/nar/gkw104 (
 0)
0)[29] LINDER B, GROZHIK A V, OLARERIN-GEORGE A O, et al. Single-nucleotide-resolution mapping of m6A and m6 Am throughout the transcriptome[J]. Nature Methods, 2015, 12(8): 767. DOI:10.1038/nmeth.3453 (
 0)
0)[30] KE S, ALEMU E A, MERTENS C, et al. A majority of m6A residues are in the last exons, allowing the potential for 3' UTR regulation[J]. Genes & Development, 2015, 29(19): 2037-2053. DOI:10.1101/gad.269415.115 (
 0)
0)[31] MEYER K D, JAFFREY S R. The dynamic epitranscriptome: N6-methyladenosine and gene expression control[J]. Nature Reviews Molecular Cell Biology, 2014, 15(5): 313. DOI:10.1038/nrm3785 (
 0)
0)[32] SUN W J, LI J H, LIU S, et al. RMBase: A resource for decoding the landscape of RNA modifications from high-throughput sequencing data[J]. Nucleic Acids Research, 2015, 44(D1): D259-D265. DOI:10.1093/nar/gkv1036 (
 0)
0)[33] ZHENG Y, NIE P, PENG D, et al. m6A Var: A database of functional variants involved in m6A modification[J]. Nucleic Acids Research, 2017, 46(D1): D139-D145. DOI:10.1093/nar/gkx895 (
 0)
0)[34] KONG L, ZHANG Y, YE Z Q, et al. CPC: Assess the protein-coding potential of transcripts using sequence features and support vector machine[J]. Nucleic Acids Research, 2007, 35(suppl_2): W345-W349. DOI:10.1093/nar/gkm391 (
 0)
0)[35] WANG L, PARK H J, DASARI S, et al. CPAT: Coding-potential assessment tool using an alignment-free logistic regression model[J]. Nucleic Acids Research, 2013, 41(6): e74-e74. DOI:10.1093/nar/gkt006 (
 0)
0)[36] SUN L, LUO H, BU D, et al. Utilizing sequence intrinsic composition to classify protein-coding and long non-coding transcripts[J]. Nucleic Acids Research, 2013, 41(17): e166-e166. DOI:10.1093/nar/gkt646 (
 0)
0)[37] CHEN X, HAN P, ZHOU T, et al. circRNADb: A comprehensive database for human circular RNAs with protein-coding annotations[J]. Scientific Reports, 2016, 6: 34985. DOI:10.1038/srep34985 (
 0)
0)[38] MENG X, CHEN Q, ZHANG P, et al. CircPro: An integrated tool for the identification of circRNAs with protein-coding potential[J]. Bioinformatics, 2017, 33(20): 3314-3316. DOI:10.1093/bioinformatics/btx446 (
 0)
0)[39] GAO Y, WANG J, ZHAO F. CIRI: An efficient and unbiased algorithm for de novo circular RNA identification[J]. Genome Biology, 2015, 16(1): 4. DOI:10.1186/s13059-014-0571-3 (
 0)
0)[40] SUN Peisen, LI Guanglin. CircCode:A powerful tool for identifying circRNA coding ability[J]. Frontiers in Genetics, 2019, 10: 981. DOI:10.3389/fgene.2019.00981 (
 0)
0)