

1. 中国科学院微生物研究所 微生物资源前期开发国家重点实验室,北京 100101;
2. 中国科学院大学,北京 100049
收稿日期:2020-12-01;接收日期:2021-03-01;网络出版时间:2021-03-16
基金项目:国家自然科学基金(No. 91951204) 资助
摘要:铁摄取调节子(Ferric uptake regulator,Fur) 是细菌控制细胞内铁平衡的一类重要的调节子。铜绿假单胞菌Pseudomonas aeruginosa的fur为必需基因,不能直接敲除。文中通过构建诱导型缺失突变株Δfur/attB: : PBAD-fur,来研究该基因对铜绿假单胞菌的生长、生物被膜形成、运动能力和抗氧应激能力等方面的影响。结果表明,当Fur低表达时,铜绿假单胞菌在高铁和低铁环境中出现了生长阻滞的现象;低表达Fur的铜绿假单胞菌抵抗H2O2的能力降低,形成生物被膜的能力减弱,游动、颤动(Twitching) 和丛集(Swarming) 运动能力也出现了减弱的现象。Fur的表达直接影响铜绿假单胞菌荧光嗜铁素的产量。在铜绿假单胞菌体内表达来自格瑞菲斯瓦尔德磁螺菌Fur超级家族中的蛋白,可以部分恢复铜绿假单胞菌荧光嗜铁素的产量。由此说明,Fur对铜绿假单胞菌的生长、生物被膜形成、抗氧应激能力和运动能力方面都起着至关重要的作用。本研究为铜绿假单胞菌的防治提供理论指导。
关键词:铜绿假单胞菌铁摄取调节子荧光嗜铁素生物被膜运动性
Construction and phenotypic study of Pseudomonas aeruginosa inducibly expressing a ferric uptake regulator
Zhipeng Wang1,2, Haiying Yu1, Lüyan Ma1,2


1. State Key Laboratory of Microbial Resources, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
2. University of Chinese Academy of Sciences, Beijing 100049, China
Received: December 1, 2020; Accepted: March 1, 2021; Published: March 16, 2021
Supported by: National Natural Science Foundation of China (No. 91951204)
Corresponding author: Lüyan Ma. Tel: +86-10-64807437; E-mail: luyanma27@im.ac.cn.
Abstract: Members of the ferric uptake regulator (Fur) protein family are bacterial transcriptional repressors that control iron uptake and storage in response to iron availability, thereby playing a crucial role in the maintenance of iron homeostasis. The fur null mutants of Pseudomonas aeruginosa could not be obtained because fur is an essential gene. In this study, We constructed a Fur inducibly expression strain Δfur/attB: : PBAD-fur in order to study the effect of fur on the growth, biofilm formation, motilities and oxidative stress response of P. aeruginosa. The results showed that a low level of fur expression retarded the growth of P. aeruginosa at an iron-depleted condition, or under high concentration of iron, or in the presence of H2O2. Fur affected the biofilm formation and the motilities (swimming, twitching, and swarming) of strain PAO1. The production of pyoverdine is regulated by Fur. Interestingly, proteins from Magnetospirillum gryphiswaldense MSR-1, which shares homology with Fur, can partially recover the pyoverdine production of strain Δfur/attB: : PBAD-fur. This study provides new clues for the prevention and treatment of P. aeruginosa infections.
Keywords: Pseudomonas aeruginosaferric uptake regulator (Fur)pyoverdinebiofilmmotility
铁对于微生物的生长发育和生理代谢是必不可少的。生物体内的很多酶催化反应都需要铁离子的参与。铁通常存在于具有[Fe-S]簇的蛋白质和血红素中,参与包括呼吸和三羧酸循环在内的多种代谢过程。对于病原微生物来说,面临着铁摄取和细胞内的铁平衡两道难题。宿主通过将铁隔离在细胞内的蛋白质(如血红蛋白、细胞色素或铁蛋白) 中,或通过将细胞外Fe3+与糖蛋白、转铁蛋白和乳铁蛋白螯合而主动限制铁的流动性,从而增加了病原菌摄取铁的难度[1]。同时,胞内过量Fe2+会引发芬顿反应(Fenton/Haber-Weiss),产生有害的活性氧(Reactive oxygen species,ROS),如超氧物(O2–)、过氧化氢(H2O2) 和高破坏性羟基自由基等。这些ROS可导致[Fe-S]簇的损伤、蛋白质羰基化、Cys/Met残基氧化、膜脂过氧化以及DNA损伤等[2-3]。所以,细菌胞内铁浓度受到非常精细而严格的调控。铁摄取调节子(Ferric uptake regulator,Fur) 是细菌铁离子代谢中最重要的调节子,是革兰氏阴性菌中的一种保守蛋白。细菌胞内的铁浓度受到Fur的严格调控。Fur通过抑制或者激活基因的转录,来调节与铁摄取、利用和储存相关的基因,维持胞内铁离子浓度动态平衡[4]。此外,Fur还参与细菌的氧化应激、抗酸能力、毒力和能量代谢等多种生物过程的调节。Fur蛋白最常见的调节机制是以金属辅助因子Fe2+作为共阻遏物,以二聚体形式特异结合靶基因启动子A/T丰富的回文序列(Fur box) 区域,从而阻碍了RNA聚合酶的结合,导致基因的转录抑制[5]。多数的细菌只有一个Fur蛋白,但格瑞菲斯瓦尔德磁螺菌Magnetospirillum gryphiswaldense MSR-1基因组中却发现了有5个Fur的同源蛋白,分别为IrrA (MGMSRv2_1721)、IrrB (MGMSRv2_3149)、IrrC (MGMSRv2_ 3660)、Fur (MGMSRv2_3137) 和Zur (MGMSRv2_2136)。来自铜绿假单胞菌的Fur (pFur) 与磁螺菌中上述Fur同源蛋白只有30%– 40%的氨基酸序列一致性[6]。有趣的是,体外实验证明,磁螺菌的Fur (本文中标为mFur)可以与铜绿假单胞菌的Fur box结合,是否可以在铜绿假单胞菌体内发挥作用还未知[7]。
铜绿假单胞菌是条件致病菌,易感染免疫力较弱的人,是医院内感染的主要细菌,也是耐药较为严重的细菌之一。该细菌是导致囊性纤维化病人气道炎症、肺损伤和死亡的主要原因[8]。该菌极易形成生物被膜(Biofilm),导致其相关感染难以根除[9]。转录组分析结果表明,铜绿假单胞菌的许多基因受到Fur调控[10]。Fur可以直接或间接地控制许多与铁摄取有关的基因和毒力基因的转录,如荧光嗜铁素(Pyoverdine)、外毒素A和胞外蛋白酶PrpL等[11]。铜绿假单胞菌的Fur还控制两个小RNA的转录,PrrF1和PrrF2,它们可以调节与氧化应激反应有关的多个基因的转录后修饰,来应对氧化应激和铁储存带来的压力[12]。已有的研究提示Fur是铜绿假单胞菌获取外界的铁过程中的一个关键调节子。fur在铜绿假单胞菌中是一个必需基因,所以无法获得该基因的缺失突变株,以往对Fur的研究基本利用的是点突变的方法来阐明相关的作用原理和机制[13]。本研究拟构建可诱导表达的突变株Δfur/attB: : PBAD-fur,为进一步研究Fur的功能及其在铜绿假单胞菌环境适应中的作用。
1 材料与方法1.1 实验材料1.1.1 菌株与质粒本实验中所用菌株和质粒如表 1。所用的pSW196、pEX18Gm与pUCP20质粒均为本实验室保存。
表 1 本实验所用菌株和质粒Table 1 Strains and plasmids used in this study
| Strains and plasmids | Characteristics | Sources or references |
| Strains | ||
| P. aeruginosa PAO1 | Wild-type strain | [14] |
| Δfur/PBAD-fur | fur in frame deletion with araC-PBAD-fur inserted at attB site of PAO1 chromosome | This study |
| Other strains | ||
| Escherichia coli DH5α | F-, φ 80dlacZ ΔM15, Δ(lacZYA -argF)U169, deoR, recA1, endA1, hsdR17 (rK-, mK+), phoA | |
| Escherichia coli S17-1λpir | thi pro hsdR hsdM+ recA RP4-2-Tc: : Mu-Km: : Tn7 λpir, Gmr | [15] |
| Magnetospirillum gryphiswaldense MSR-1 | Wild-type strain | [16] |
| Plasmids | ||
| pSW196 | mini-CTX lacZ with PBAD promoter | [17] |
| pFLP2 | FLP recombinase expressing plasmid, Apr | [18] |
| pEX18Gm | Allelic exchange and suicide cloning vector, Gmr | [19] |
| pEX18Gm-fur | pEX18Gm derived plasmid for fur in-frame deletion, Gmr | This study |
| pUCP20 | E. coli- P. aeruginosa shuttle plasmid, ori 160 0 Plac, Apr | [20] |
| pUCP20-IrrA | IrrA form MSR-1 expressed in pUCP20, Apr | This study |
| pUCP20-IrrB | IrrB form MSR-1 expressed in pUCP20, Apr | This study |
| pUCP20-IrrC | IrrC form MSR-1 expressed in pUCP20, Apr | This study |
| pUCP20-mFur | Fur form MSR-1 expressed in pUCP20, Apr | This study |
| pUCP20-pFur | Fur form PAO1 expressed in pUCP20, Apr | This study |
| Apr, Tcr and Gmr indicate resistance to ampicillin, tetracycline and gentamycin, respectively. | ||
表选项
1.1.2 培养基及培养条件实验所用培养基配方如下:
LB培养基(1 L):胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g;
Jensen’s培养基(1 L):NaCl 5 g,K2HPO4 3.286 g,谷氨酸15.56 g,缬氨酸2.81 g,苯丙氨酸1.32 g;葡萄糖277.4 g,MgSO4·7H2O 0.33 g,CaCl2 0.021 g,FeSO4 0.001 1 g,ZnSO4 0.002 4 g;
LBNS培养基(1 L):胰蛋白胨10 g,酵母提取物5 g;
Swimming培养基:在Jensen’s培养基成分中加入琼脂粉0.3% (W/V);
Twitching培养基:在Jensen’s培养基成分中加入琼脂粉1.0% (W/V);
Swarming培养基:Nutrient Broth (Oxoid, CM1168B) 8 g,葡萄糖5 g,琼脂粉0.5% (W/V)。
铜绿假单胞菌的菌液在37 ℃培养于Jensen’s培养基中,生物被膜在30 ℃静置培养于Jensen’s培养基。
大肠杆菌抗生素使用终浓度:氨苄青霉素(Ap) 100 μg/mL,四环素(Tc) 12.5 μg/mL,庆大霉素(Gm) 10 μg/mL,三氯生(Irg) 25 μg/mL。
1.1.3 主要试剂分子生物学试剂:快速DNA内切酶(Fermentas);DNA连接酶(Thermo);高保真DNA聚合酶、DNA marker (TaKaRa);质粒抽提试剂盒(TIANGEN)。
1.2 实验方法1.2.1 Fur诱导表达突变株Δfur/attB: : PBAD-fur的构建与验证铜绿假单胞菌PAO1基因组DNA的提取及纯化,质粒DNA的提取、PCR产物回收及纯化、目的基因PCR的扩增、PCR产物及质粒的酶切与连接等均按照相关试剂盒产品说明书进行。
可诱导型菌株的构建:质粒pSW196具有阿拉伯糖诱导的PBAD启动子,同时也有质粒mini-CTX lacZ将目的基因整合到染色体上特异性attB位点的特性。
根据Pseudomonas genome database (www.pseudomonas.com/)查找到的fur基因及侧翼序列设计引物Fur-F、Fur-R,以菌株PAO1基因组为模板,PCR扩增fur基因片段,连接到pSW196载体PBAD启动子之后,得到重组载体pSW196-fur。
按照质粒mini-CTX lacZ相关文献中的实验方法,并用检测引物(表 2)进行PCR验证,验证质粒整合在铜绿假单胞菌染色体attB/P位点[21]。
表 2 引物序列Table 2 Primer sequences
| Primer name | Sequence (5′–3′) a | Size (bp) |
| Fur-F | GGAATTCCATGGTTGAAAATAGCGAAC | 405 |
| Fur-R | CCCCGGGGCTACTTCTTCTTGCGCAC | |
| attB2 | GTCGCCGCCGGCGATGC | 950 |
| CTX1 | CCTCGTTCCCAGTTTGTTCC | |
| attB4 | CGCCCTATAGTGAGTCG | 450 |
| attB5 | CGCCCCAACCTCGCTGG | |
| Fur-up-F | CAGCTATGACCATGATTACGAATTCGGCTGGGTGACGGTGGTGCT | 495 |
| Fur-up-R | ACCAGATTGTGATCGACCAGTTCAACCATGTCTGCTTTCTCAGCG | |
| Fur-down-F | CGCTGAGAAAGCAGACATGGTTGAACTGGTCGATCACAATCTGG | 332 |
| Fur-down-R | ACGACGGCCAGTGCCCCCGGGTCCTCACCGTGACCCACTTG | |
| Fur-M-F | GAATTCATGGTTTCGCGTATTGAACAGC | 432 |
| Fur-M-R | AAGCTTCTATTTGTCGTCGGAATCACCG | |
| IrrB-M-F | GAATTCATGCTTGTCCGCCATCAAGCAC | 420 |
| IrrB-M-R | AAGCTTTTACCCGTGCGGCAGACGCCGC | |
| IrrA-M-F | GAATTCGTGCTGCGTATCGACGAAGCGA | 402 |
| IrrA-M-R | AAGCTTTTACGATGCCCGGCGCAAGCGG | |
| IrrC-M-F | GAATTCATGAGCATGGTAACCGTACGCC | 420 |
| IrrC-M-R | AAGCTTTCAACCGTCAACCCTGACTATA | |
| Zur-M-F | GAATTCATGAGTTTTCCCCAGCCGCAGC | 465 |
| Zur-M-R | AAGCTTTCATGGGCTTTCCCCCCGGCAG | |
| Fur-P-F | GAATTCATGGTTGAAAATAGCGAACTTC | 405 |
| Fur-P-R | AAGCTTCTACTTCTTCTTGCGCACGTAG | |
| aBold fonts indicate the recognition sites of the corresponding restriction enzymes. | ||
表选项
敲除fur基因:设计两对引物Fur-up-F/Fur-up-R和Fur-down-F/Fur-down-R (表 2),分别以菌株PAO1基因组为模板,扩增fur基因的上下游序列。上下游片段经过T4 DNA连接酶连接同一载体pEX18Gm,通过测序验证后得到重组自杀载体pEX18Gm-fur。在前一突变株基础上利用双亲接合的方法筛选二次重组突变体,并用检测引物Fur-up-F、Fur-down-R (表 2) 进行PCR验证,最终得到诱导型缺失突变体Δfur/attB: : PBAD-fur菌株。
1.2.2 基因表达水平的测定细菌RNA的提取:取约1×107细菌细胞收集至15 mL离心管。然后加1 mL Trizol,然后在4 ℃条件下10 000× g离心10 min。取上清至新的1.5 mL离心管,加入200 μL氯仿,剧烈振荡混匀后,室温静置5 min。在4 ℃条件下,10 000×g离心15 min后,小心吸取分层后的上清500 μL转移至新的1.5 mL离心管,加入等体积异丙醇,剧烈振荡混匀后,室温静置或?20 ℃放置30 min。在4 ℃条件下10 000× g离心15 min,小心弃上清后加入1 mL 75 %乙醇洗涤。在4 ℃条件下10 000×g离心5 min,弃上清,充分晾干后,使用RNase-free H2O 30–50 μL溶解RNA。
反转录:使用全式金EasyScript? First-Strand cDNA Synthesis SuperMix (AE301-02) 来去除RNA中的DNA,并将RNA反转录为cDNA,按照说明书进行实验。
RT-qPCR:使用LightCycler480 (Roche) 进行,使用荧光染料SYBR Green Ⅰ (Thermo Fisher) 对扩增出来的DNA进行染色,反应体系如表 3。
表 3 qRT-PCR反应体系Table 3 qRT-PCR reaction system
| Component | Volume (μL) |
| EvaGreen 2×qPCR MasterMix | 5.0 |
| Forward primer (10 μmol/L) | 0.3 |
| Reverse primer (10 μmol/L) | 0.3 |
| Template DNA | 0.5 |
| Nuclease-free H2O | 3.9 |
| Note: reference gene is rpsL in strain PAO1. | |
表选项
1.2.3 生长曲线的测定铜绿假单胞菌PAO1接种于5 mL的Jensen’s培养液中,37 ℃、200 r/min培养至稳定生长期;按1∶100 (V/V)的比例接于100 mL的Jensen’s培养液中,37 ℃、200 r/min培养;培养7 h后开始取样,测定其在600 nm处的吸光值(OD600),每3 h取样1次,重复3次。
1.2.4 铜绿假单胞菌生物被膜形成能力的测定生物被膜检测平板的制备:将铜绿假单胞菌PAO1接种于LBNS平板,放置于37 ℃过夜培养。挑取过夜培养平板上的单菌落,将其接种于5 mL LBNS培养液中,37 ℃、200 r/min过夜培养。然后取50 μL过夜培养的菌液接种于5 mL Jensen’s培养液中,37 ℃ 200 r/min培养至OD600等于0.5左右。取100 μL菌液接种于96孔PVC板中,30 ℃静置培养1 h。
生物被膜形成能力的测定:用排枪吸走PVC板中的菌液(游离及松散吸附的菌体),用生理盐水轻柔地洗3次。将120 μL 0.1%结晶紫加入PVC板中,30 ℃静置培养30 min (结晶紫溶液可以对牢固吸附的细菌细胞进行染色)。取出PVC板,用排枪吸走结晶紫溶液,并用生理盐水清洗3遍(洗去残余的结晶紫溶液)。将200 μL 30%乙酸加入PVC板中,检测OD560值(乙酸能溶解结晶紫)。
1.2.5 铜绿假单胞菌荧光噬铁素产量的测定培养细菌至生长对数期,取样品于Jensen’s无菌培养基中,并适当稀释培养样品,分为同样的两份。一份等体积稀释至无菌培养基中用酶标仪测定其OD600值。另一份离心使得菌体沉淀,取培养上清液于等体积的缓冲液0.1 μmol/L Tris-HCl (pH 8) 中,使用酶标仪测其OD405值。OD405需要用其相应培养物的OD600进行标准化。OD405/OD600则为其荧光噬铁素产量(Relative pyoverdine)[22]。
1.2.6 铜绿假单胞菌运动能力的检测(1) 鞭毛运动能力的检测(Swimming)
用牙签将单菌落接种到swimming固体培养基平板表面上。37 ℃过夜培养后测量平板上细菌游动所形成的半透明区域的直径[22]。
(2) 菌毛运动能力的检测(Twitching)
用牙签将单菌落穿刺接种到twitching固体培养基平板底部。30 ℃培养1–2 d后测量培养基与塑料板交界面细菌颤触运动所形成的半透明区域的直径[23]。
(3) 丛集运动能力的检测(Swarming)
将活化好的菌株接种到LBNS液体培养基,37 ℃振荡培养过夜。取1 μL菌液接种于swarming固体培养基平板表面,37 ℃过夜培养。测量每个平板细菌运动区域的直径[24]。
2 结果与分析2.1 Fur诱导表达突变株Δfur/attB: : PBAD-fur的构建与验证构建Fur诱导表达突变株,即先在菌株PAO1基因组上不影响铜绿假单胞菌正常生理代谢的attB位点插入以PBAD为启动子的fur基因,然后在阿拉伯糖诱导表达的fur基因的情况下,敲除基因组上原来的fur基因,最终经测序验证获得Fur诱导表达突变株Δfur/attB: : PBAD-fur (图 1)。
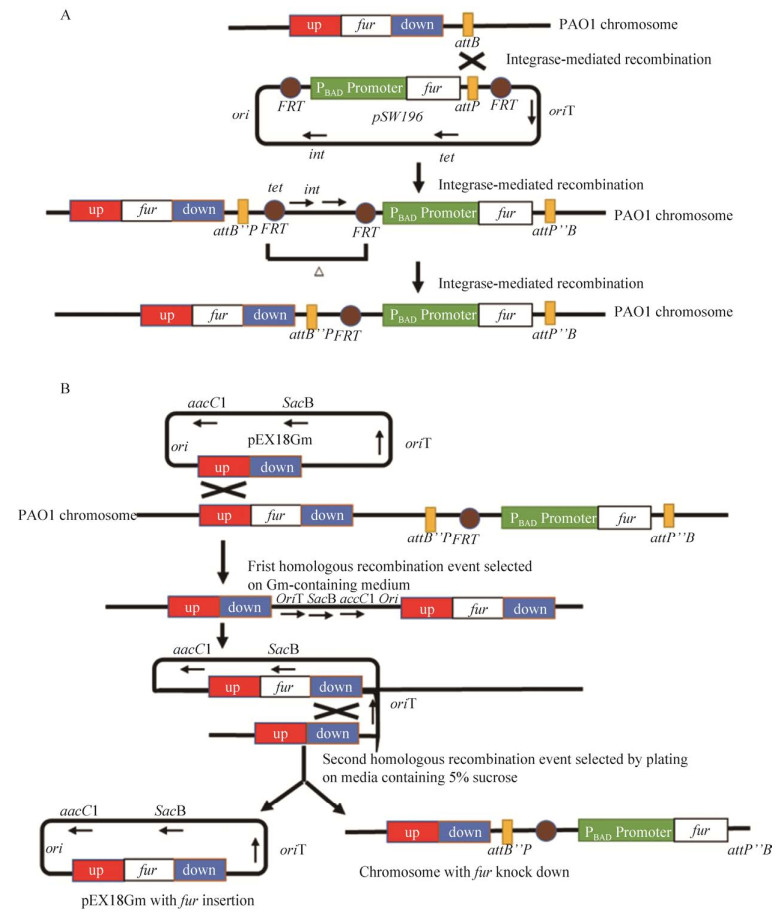 |
| 图 1 Δfur/attB: : PBAD-fur突变株构建示意图 Fig. 1 Schematic diagram of the construction of mutant strain Δfur/attB: : PBAD-fur. (A) The fur gene with PBAD promoter was inserted into the attB site of the genome of strain PAO1. (B) Deletion of fur gene in strain PAO1/attB: : PBAD-fur. |
| 图选项 |
2.2 突变株Δfur/attB: : PBAD-fur在不同铁浓度的环境中的生长情况在本研究中,为了便于控制铜绿假单胞菌培养基中的铁浓度,选用基础培养基Jensen’s培养基。根据文献报道,100 μmol/L的铁浓度被认为是铜绿假单胞菌所处环境中的高铁浓度[25]。Jensen’s培养基中的FeSO4浓度为4 μmol/L。在本研究中检测了高铁(100 μmol/L) 和培养基中不加FeSO4 (约为0 μmol/L,本实验中作为低铁条件) 对铜绿假单胞菌及其突变株生长的影响。
结果如图 2所示,以野生型PAO1为对照,突变株Δfur/attB: : PBAD-fur以剂量依赖的方式在阿拉伯糖的诱导下表达,完全未诱导的突变株Δfur/PBAD-fur的表达量只有野生型PAO1的40%左右,而1%或0.4%的阿拉伯糖诱导下,突变株Δfur/attB: : PBAD-fur中fur的表达可以达到野生型的表达水平(图 2A)。
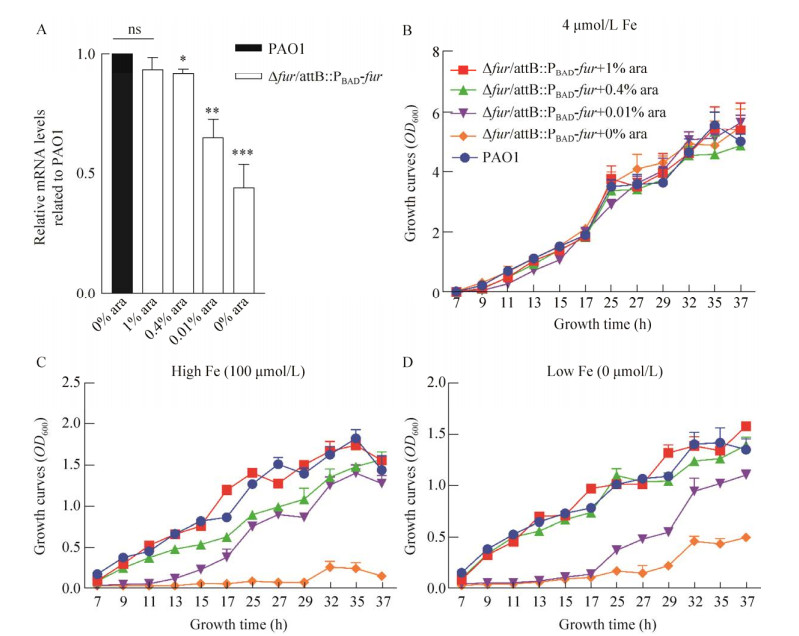 |
| 图 2 添加不同浓度诱导剂条件下突变株Δfur/attB: : PBAD-fur中Fur的表达以及该菌在不同铁浓度环境中的生长曲线 Fig. 2 Expression of Fur in strain Δfur/attB: : PBAD-fur under different arabinose and the growth curves with different concentrations of iron. (A) Expression of Fur in strain Δfur/attB: : PBAD-fur induced by different arabinose. The amount of strain Δfur/attB: : PBAD-fur is normalized to the level of strain PAO1. The corresponding arabinose (ara) concentration are listed below each bar, the superscript letter "*" indicates a significant difference compared to strain PAO1. t-test of unpaired unequal variance was performed for testing differences between groups. *P < 0.03, **P < 0.02, ***P < 0.000 2. (B–D) Growth curves (OD600) of strain Δfur/attB: : PBAD-fur in Jensen's media with 4 μmol/L, 100 μmol/L (high iron concentration), or without iron (low iron) at increasing concentrations of arabinose. Values are the mean of at least three independent assays. |
| 图选项 |
野生型菌株PAO1在高铁和低铁的环境中OD600最高可以达到1.5–2.0之间,而在Jensen’s培养基的铁浓度下OD600可以达到6左右,这表明菌株PAO1在高铁和低铁环境中生长能力都受损。相对于菌株PAO1,突变株Δfur/attB: : PBAD-fur在高铁或低铁的环境中的生长都会受到极大的损害,接近于不生长的状态,并逐渐被阿拉伯糖以剂量依赖的方式恢复生长能力,在0.4%阿拉伯糖诱导时,可以恢复到与菌株PAO1一样的生长能力(图 2C,D)。在正常培养基的铁浓度下,突变株Δfur/attB: : PBAD-fur的生长情况不受阿拉伯糖的调控,生长情况与野生型一样(图 2B)。综上所述,环境中的铁浓度会影响铜绿假单胞菌的生长能力,在高铁和低铁的环境中,铜绿假单胞菌生长都会受限,尤其是突变株Δfur/attB: : PBAD-fur在未诱导的情况下,在高铁和低铁环境中表现出严重的生长抑制,接近于不长的状态。当外界的铁或多或少地超过Fur所能调节的范围,细菌的生长就会受到抑制,在极端的条件下可能出现生长不了的情况。该结果验证了fur诱导表达突变株构建成功,同时验证了fur是必需基因及其在铁调控中的重要性。
2.3 突变株Δfur/attB: : PBAD-fur的氧化还原应激的研究作为全局性调控因子Fur被报道可以调节氧化应激反应过程中的过氧化氢酶KatG、超氧化物歧化酶SodB等。在固体培养基培养状态下,铜绿假单胞菌fur点突变株相比于菌株PAO1,对外源添加H2O2敏感性增加[26]。本研究进一步验证液体环境中过多的H2O2是否会影响突变株Δfur/attB: : PBAD-fur的生长能力。
结果如图 3所示,当H2O2浓度为1 200 μmol/L,前11 h内菌株PAO1的生长受损,然后恢复正常,这说明1 200 μmol/L的浓度是对菌株PAO1生长有压力的浓度,但压力是在菌株PAO1的调节范围之内,通过一段时间的调节,菌株PAO1的生长回归正常水平。突变株Δfur/attB: : PBAD-fur在H2O2为1 200 μmol/L时,一直表现出生长受到限制,说明当缺失Fur以后,细菌面对环境中的巨大氧压力,失去了部分调节能力,从而影响了细菌的生长,结果表明Fur在铜绿假单胞菌对液体环境的氧化应激反应中发挥着调节作用。
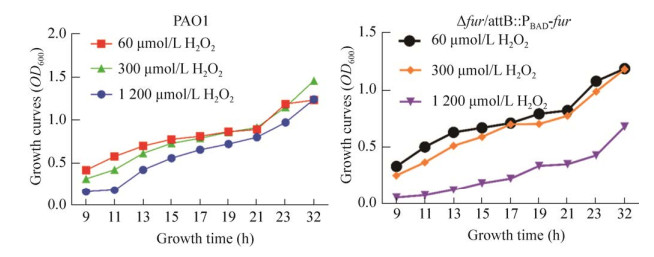 |
| 图 3 野生型菌株PAO1和突变株Δfur/attB: : PBAD-fur在不同H2O2浓度的环境中的生长曲线 Fig. 3 Growth curves of strains PAO1 and Δfur/attB: : PBAD-fur in different H2O2 concentrations. Values are the mean (±standard deviation) from at least three independent assays. |
| 图选项 |
2.4 Fur对铜绿假单胞菌在不同铁浓度的环境中形成生物被膜的影响环境中的铁浓度可以作为一种信号调节铜绿假单胞菌生物被膜的发育。这种铁对铜绿假单胞菌生物被膜的调节效应可能是受到铁摄取调节子Fur的调控[27]。为了研究Fur对生物被膜的影响,本研究检测了菌株PAO1和突变株Δfur/attB: : PBAD-fur在不同铁浓度的环境下,它们的生物被膜形成能力的差异。经过6、12、24、36 h的不同时间阶段的取样,发现早期的培养时间内,生物被膜形成能力差异最为显著。所以,本研究生物被膜形成能力培养时间均为6 h。
结果如图 4所示,与野生型菌株PAO1相比,未加诱导的突变株Δfur/attB: : PBAD-fur生物被膜的形成能力显著降低,生物被膜的产量减少接近30%;0.01%阿拉伯糖诱导水平下,突变株Δfur/ attB: : PBAD-fur的生物被膜形成也显著减少。而0.4%和1%阿拉伯糖诱导下,突变株Δfur/attB: : PBAD-fur生物被膜形成恢复到野生型PAO1水平。
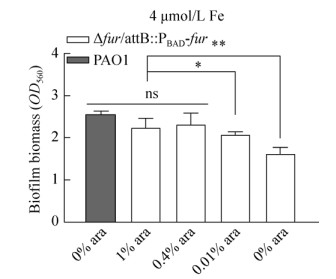 |
| 图 4 菌株PAO1与Δfur/attB: : PBAD-fur在4 μmol/L铁浓度的环境中生物被膜形成生物量 Fig. 4 Biofilm biomass of strains PAO1 and Δfur/attB: : PBAD-fur in 4 μmol/L iron concentrations. The biofilm biomass of strain Δfur/attB: : PBAD-fur is compared with the level of strain PAO1. The corresponding arabinose concentration are listed below each bar. Values are means from two independent experiments, each with three replicates. T-test of unpaired unequal variance was performed for testing differences between groups. *P < 0.03, **P < 0.02. |
| 图选项 |
为进一步探究不同铁浓度对铜绿假单胞菌生物被膜形成的影响,本研究在高铁和低铁浓度下进行了相同的实验。
结果如图 5所示,野生型菌株PAO1在铁浓度不同的环境下,生物被膜的形成能力有所差异。当铁浓度为100 μmol/L时,相比于低铁和4 μmol/L铁的环境中,菌株PAO1的生物被膜形成量高出50%左右,说明充足铁环境(10–100 μmol/L) 能促进铜绿假单胞菌生物被膜的形成,与已有的研究结果一致。无论环境中铁的浓度为多少,与野生型菌株PAO1相比,未加诱导的突变株Δfur/attB: : PBAD-fur生物被膜的形成能力都减弱,生物被膜的产量减少接近50%。
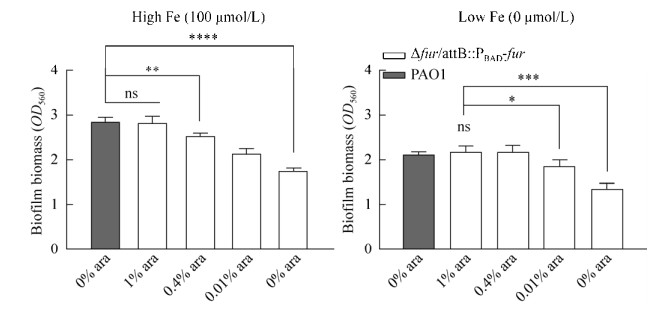 |
| 图 5 突变株Δfur/attB: : PBAD-fur在高铁(100 μmol/L) 和低铁(0 μmol/L) 的环境中生物被膜形成生物量 Fig. 5 Biofilm biomass of strain Δfur/attB: : PBAD-fur in high and low iron environments. The biofilm biomass of strain Δfur/attB: : PBAD-fur is compared with the level of strain PAO1. The corresponding arabinose concentration are listed below each bar. Values are means from two independent experiments, each with three replicates. t-test of unpaired unequal variance was performed for testing differences between groups. *P < 0.03, **P < 0.02, ***P < 0.000 2, ****P < 0.000 1. |
| 图选项 |
2.5 Fur对细菌运动的影响铜绿假单胞菌存在3种主要的运动方式,分别是twitching、swarming和swimming。这3种运动形式和铜绿假单胞菌生物被膜的形成、毒力、趋化、慢性感染等众多生理生化过程都息息相关。对细菌在新的介质表面吸附和定植过程都发挥着重要作用。本研究以野生型菌株PAO1为对照,对突变株Δfur/attB: : PBAD-fur在不同阿拉伯糖诱导下的运动能力进行了实验。
Twitching运动是由四型菌毛(Type Ⅳ pili,T4P) 介导的在固体表面的一种运动形式。铜绿假单胞菌的twitching运动还被证明和生物被膜的形成和细菌的致病性密切相关[28]。
通过一系列梯度浓度的阿拉伯糖诱导下的突变株Δfur/attB: : PBAD-fur的twitching实验检测菌毛运动,证明未诱导的突变株丧失了twitching运动能力,低诱导水平的突变株Δfur/attB: : PBAD-fur的菌毛运动能力减弱,并且呈现出一种对诱导剂量依赖的效应,随着阿拉伯糖浓度的增加,twitching运动能力逐渐增加,当阿拉伯糖浓度为0.4%及以上可以恢复到野生型水平(图 6)。
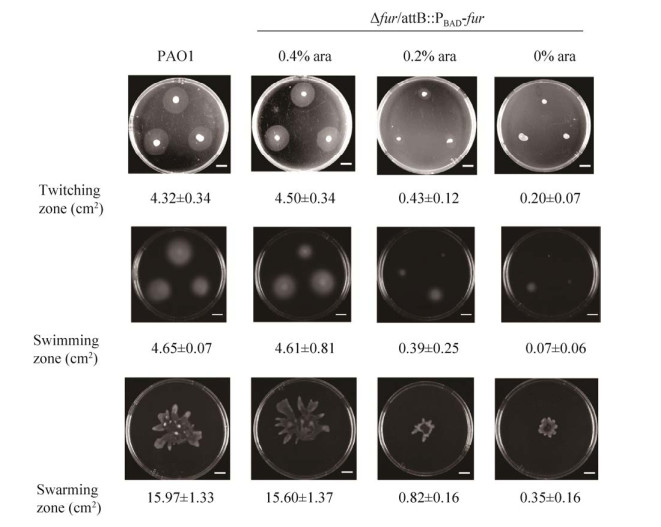 |
| 图 6 突变株Δfur/attB: : PBAD-fur的运动能力 Fig. 6 Motilities analysis of strain Δfur/attB: : PBAD-fur. The flagella mediated swimming motility, type Ⅳ pili mediated twitching motility and swarming motility were tested for strains PAO1 and Δfur/attB: : PBAD-fur. The corresponding arabinose concentration are listed on the line. Strain PAO1 is used as a positive control. Shown are the means of three independent experiments and standard deviations. Scale bar, 1 cm. |
| 图选项 |
铜绿假单胞菌的swimming运动需要依赖有功能的极生鞭毛的驱动[29]。通过同样的一系列梯度浓度的阿拉伯糖诱导下的突变株Δfur/attB: : PBAD-fur的swimming实验检测鞭毛运动,证明低诱导水平的突变株Δfur/attB: : PBAD-fur的swimming运动能力减弱,并且可以用阿拉伯糖以剂量依赖的方式回补到野生型PAO1的水平(图 6)。
Swarming是一种受群体感应调控在培养基表面形成的有分枝样的运动形式。影响swarming的因素有鞭毛、T4P以及鼠李糖脂[30]。通过同样的一系列梯度浓度的阿拉伯糖诱导下的突变株Δfur/attB: : PBAD-fur的swarming实验检测菌毛运动,证明低诱导水平的突变株Δfur/attB: : PBAD-fur的swarming运动能力减弱,并且同样可以在阿拉伯糖诱导下,以剂量依赖的方式恢复(图 6)。
上述结果说明fur的低表达影响细菌的运动性。
2.6 突变株Δfur/attB: : PBAD-fur的荧光嗜铁素产量荧光嗜铁素(Pyoverdine) 是由一个肽链和一个发色团组成的混合型铁载体,受到Fur负调控[31]。通过检测野生型菌株PAO1和突变株Δfur/attB: : PBAD-fur在不同浓度阿拉伯糖诱导下荧光嗜铁素的产量变化的方法,以此来测试Fur的表达对荧光嗜铁素的调控。
结果如图 7所示,在不同铁浓度的培养基中,未诱导和以0.01%阿拉伯糖诱导时,突变株Δfur/attB: : PBAD-fur的荧光嗜铁素合成量显著高于野生型菌株的荧光嗜铁素合成量,说明突变株的荧光嗜铁素的产量几乎没有受到Fur的抑制调控作用;而当以1%阿拉伯糖诱导时,由于Fur的抑制作用,突变株Δfur/attB: : PBAD-fur的荧光嗜铁素合成量基本可以恢复到野生型菌株PAO1的合成水平。在高铁(100 μmol/L) 环境条件下,PAO1野生型菌株和1%阿拉伯糖诱导的突变株的荧光嗜铁素合成量明显下降,约为未诱导和0.01%诱导的突变株Δfur/attB: : PBAD-fur的荧光嗜铁素合成量的1/10。
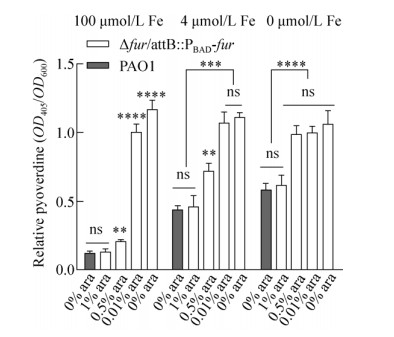 |
| 图 7 突变株Δfur/attB: : PBAD-fur在4 μmol/L、100 μmol/L和0 μmol/L不同铁浓度的环境中荧光嗜铁素的产量 Fig. 7 Pyoverdine production of strain Δfur/attB: : PBAD-fur in environmental sinks with 4 μmol/L, 100 μmol/L and low iron concentrations. The relative pyoverdine production of strain Δfur/attB: : PBAD-fur is compared with the level of strain PAO1. The corresponding arabinose concentration are listed below each bar. Values are means from two independent experiments, each with three replicates. t-test of unpaired unequal variance was performed for testing differences between groups. *P < 0.03, **P < 0.02, ***P < 0.000 2, ****P < 0.000 1. |
| 图选项 |
这说明在充足的铁环境中,铜绿假单胞菌不需要形成很多荧光嗜铁素释放到环境中去摄取铁,荧光嗜铁素的合成受到Fur的抑制,而在突变株Δfur/attB: : PBAD-fur中,在未诱导条件下,没有Fur去抑制荧光嗜铁素的表达,因此细胞仍然大量合成荧光嗜铁素,造成了细菌物质和能量的浪费。由此证明诱导型突变株Δfur/attB: : PBAD-fur构建正确并且可以通过不同阿拉伯糖浓度的诱导来控制Fur的表达进而控制Fur的调控作用,可以利用该突变株来研究铜绿假单胞菌中fur基因的敲除对细菌生理的影响。
实验结果显示,在Fur存在的情况下,即野生型PAO1和1%的阿拉伯糖诱导条件下的突变株Δfur/attB: : PBAD-fur在不同铁浓度的环境下荧光嗜铁素合成量明显不同,在高铁(100 μmol/L) 环境中,菌株PAO1的荧光嗜铁素产量约为低铁环境中荧光嗜铁素产量的1/5。这表明野生型铜绿假单胞菌可以感应并根据环境中的铁含量来改变自己摄取铁的策略。
铜绿假单胞菌中的Fur属于Fur金属调节子家族中的调控因子。fur在铜绿假单胞菌中是必需基因,不能获得其完全的缺失突变株。为了验证在铜绿假单胞菌中,其他类型的Fur金属调节子家族的成员是否可以回补突变株Δfur/attB: : PBAD-fur的相应表型,本研究将来自磁螺菌MSR-1中Fur金属调节子家族中Fur-M、IrrA、IrrB、IrrC、Zur连接到组成型表达质粒pUCP20上,转入到菌株PAO1和突变株Δfur/attB: : PBAD-fur。通过检测荧光嗜铁素产量来判断磁螺菌来源的Fur金属调节子家族是否可以在铜绿假单胞菌中发挥作用。
结果如图 8所示,含有质粒pUCP20-mFur的突变株Δfur/attB: : PBAD-fur与含有空质粒的空白对照相比,荧光嗜铁素产量下降接近30%左右。这表明在组成型质粒上表达出来自磁螺菌的mFur蛋白可以在突变株Δfur/attB: : PBAD-fur中抑制荧光嗜铁素的产量,结合先前文章报道mFur可以结合在铜绿假单胞菌的Fur box上,实验证明在铜绿假单胞菌中mFur也同样可以发挥作用。磁螺菌的Fur金属调节子家族中的成员都可以在突变株Δfur/attB: : PBAD-fur中抑制荧光嗜铁素的产量。而在菌株PAO1中,除了表达IrrC蛋白外,表达其他Fur金属调节子家族中的蛋白的情况下,荧光嗜铁素产量也出现了增多的现象。
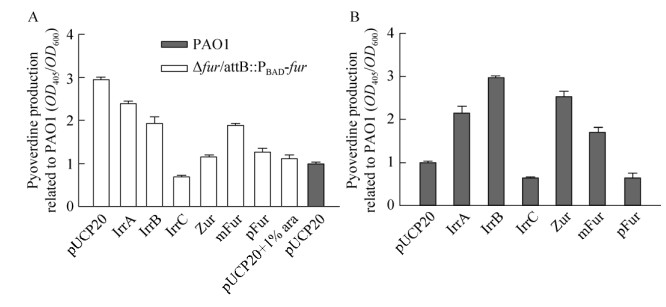 |
| 图 8 磁螺菌MSR-1的Fur超级家族蛋白影响铜绿假单胞菌荧光嗜铁素产量 Fig. 8 The Fur superfamily of MSR-1 affect the production of pyoverdine in P. aeruginosa. (A) The Fur superfamily of MSR-1 affect the production of pyoverdine in strain Δfur/attB: : PBAD-fur. (B) The Fur superfamily of MSR-1 affect the production of pyoverdine in strain PAO1. The amount production of pyoverdine is normalized to the level of strain PAO1. The corresponding Fur protein of strains PAO1 or MSR-1 are listed under each bar. Values are means from two independent experiments, each with three replicates. |
| 图选项 |
3 讨论对Fur的研究由来已久,由于Fur是铜绿假单胞菌中全局性调节子,也是关键的必需基因。因为不能获得铜绿假单胞菌fur缺失突变株,之前的研究都建立在Fur与DNA结合关键位点的点突变株上;或者对铜绿假单胞菌在不同铁浓度环境中的转录组进行生物信息学分析,得到Fur可能调控的基因。根据已经获得fur基因敲除突变株的其他细菌的研究,可以总结出Fur在铁吸收系统或毒力因子的表达、抗酸或氧化应激抵抗、运动和生物被膜形成等方面都发挥着重要的作用。最近,两项独立的转座子测序研究证实了Fur与铜绿假单胞菌在环境适应性方面的相关性[32-33]。为了进一步探索Fur对于铜绿假单胞菌在环境适应方面的作用,我们构建出诱导型缺失突变株Δfur/attB: : PBAD-fur,并探索了突变株的表型方面的变化。结果表明,在不同铁浓度的环境中,Fur的缺失可以影响到细菌的生长。Fur可以对铜绿假单胞菌早期的生物被膜形成能力有影响;它还影响铜绿假单胞菌的twitching、swimming、swarming等运动能力;来自磁螺菌中Fur家族蛋白抑制突变株Δfur/attB: : PBAD-fur中荧光嗜铁素的合成。
在铜绿假单胞菌中无法获得Fur的缺失突变株可能是因为Fur影响铜绿假单胞菌的生长。所以,本研究对突变株Δfur/attB: : PBAD-fur在不同铁浓度的生长环境中进行了生长曲线的测定。结果表明,在低铁和高铁的情况下,Fur的低表达会导致铜绿假单胞菌在铁短缺和铁充足的环境中生长受损的现象,并且可以在阿拉伯糖诱导下,以剂量依赖的方式来恢复突变株的生长能力。
生物被膜是一种微生物由自身分泌的胞外多聚基质包被而形成的聚集群体。生物被膜具有极强的环境适应性,可以对抗菌药物产生耐药性。有文章报道,铁可以作为信号,高铁浓度的环境有利于生物被膜的形成。经过实验,证明Fur的低水平表达会对铜绿假单胞菌生物被膜的形成造成影响,根据实验结果的分析,排除了生物被膜形成能力受损原因是细菌生长和胞内铁浓度的可能性,其原因还需进一步实验探索。
已有报道表明Fur可以调节鞭毛的合成从而对细菌的运动能力产生影响。当幽门螺旋杆菌处于低pH环境下时,Fur能激活鞭毛合成蛋白基因fliP和脂肪族氨酰酶基因amiE来抵抗酸环境。在大肠杆菌K-12中,Fur直接调控flhD、flhC,它们对鞭毛的生长起着主要的调节作用[34]。除此之外,最新发现在铜绿假单胞菌中,受Fur调节的两个小RNA可以参与调节菌毛、鞭毛的合成[35]。
荧光嗜铁素是直接被Fur抑制且非常容易检测的表型,可以以荧光噬铁素的产量来指示Fur的表达。本研究构建的Δfur/attB: : PBAD-fur突变株荧光噬铁素的产量与诱导剂阿拉伯糖剂量呈现出负相关的关系,这表明突变株构建成功。来自磁螺菌中的Fur金属调节子家族的蛋白能够在突变株Δfur/attB: : PBAD-fur中抑制荧光嗜铁素的合成,但是在野生型菌株PAO1中反而可以增加荧光嗜铁素的产量,这可能与组成型表达的Fur金属调节子家族蛋白与铜绿假单胞菌自身表达的Fur蛋白相互竞争Fur box有关,当组成型表达的Fur金属调节子家族蛋白结合在Fur box上,但又达不到pFur对荧光嗜铁素的抑制效果(图 8A),所以出现荧光嗜铁素产量增多的现象;也可能因为过量的Fur会竞争Fe2+,使Fur从活性状态变为非活性状态;也可能由于两种来源的Fur蛋白形成杂合二聚体导致荧光嗜铁素产量增多。具体原因还需进一步实验验证。
综上所述,本研究在Fur诱导性缺失突变的情况下探索了Fur在铜绿假单胞菌中的全局性调控作用。Fur在细菌生长、生物被膜形成、运动、氧化应激方面都发挥着重要的调控作用,更加深刻地了解了Fur在铜绿假单胞菌环境适应方面的调控作用,并且为下一步探索其调控机制提供一定的实验基础。
致谢: 感谢中国农业大学生物学院李颖老师的建议,关国华老师赠送磁螺菌。
参考文献
| [1] | Cornelissen CN, Sparling F. Iron piracy: acquisition of transferrin-bound iron by bacterial pathogens. Mol Microbiol, 1994, 14(5): 843-850. DOI:10.1111/j.1365-2958.1994.tb01320.x |
| [2] | Imlay JA, Chin SM, Linn S. Toxic DNA damage by hydrogen peroxide through the Fenton reaction in vivo and in vitro. Science, 1988, 240(4852): 640-642. DOI:10.1126/science.2834821 |
| [3] | Rodopulo AK. Oxidation of tartaric acid in wine in the presence of heavy metal salts (activation of oxygen by iron). Izv Akad Nauk SSSR Biol, 1951, 3: 115-128. |
| [4] | Beauchene NA, Mettert EL, Moore LJ, et al. O2 availability impacts iron homeostasis in Escherichia coli. Proc Natl Acad Sci USA, 2017, 114(46): 12261-12266. DOI:10.1073/pnas.1707189114 |
| [5] | Yu CX, Genco CA. Fur-mediated global regulatory circuits in pathogenic Neisseria species. J Bacteriol, 2012, 194(23): 6372-6381. DOI:10.1128/JB.00262-12 |
| [6] | Wang Q, Wang MW, Wang X, et al. Iron response regulator protein IrrB in Magnetospirillum gryphiswaldense MSR-1 helps control the iron/oxygen balance, oxidative stress tolerance, and magnetosome formation. Appl Environ Microbiol, 2015, 81(23): 8044-8053. DOI:10.1128/AEM.02585-15 |
| [7] | Deng ZQ, Wang Q, Liu Z, et al. Mechanistic insights into metal ion activation and operator recognition by the ferric uptake regulator. Nat Commun, 2015, 6: 7642. DOI:10.1038/ncomms8642 |
| [8] | Gellatly SL, Hancock REW. Pseudomonas aeruginosa: new insights into pathogenesis and host defenses. Pathog Dis, 2013, 67(3): 159-173. DOI:10.1111/2049-632X.12033 |
| [9] | Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science, 1999, 284(5418): 1318-1322. DOI:10.1126/science.284.5418.1318 |
| [10] | Cornelis P, Matthijs S, Van Oeffelen L. Iron uptake regulation in Pseudomonas aeruginosa. Biometals, 2009, 22(1): 15-22. DOI:10.1007/s10534-008-9193-0 |
| [11] | Cornelis P. Iron uptake and metabolism in pseudomonads. Appl Microbiol Biotechnol, 2010, 86(6): 1637-1645. DOI:10.1007/s00253-010-2550-2 |
| [12] | Wilderman PJ, Sowa NA, FitzGerald DJ, et al. Identification of tandem duplicate regulatory small RNAs in Pseudomonas aeruginosa involved in iron homeostasis. Proc Natl Acad Sci USA, 2004, 101(26): 9792-9797. DOI:10.1073/pnas.0403423101 |
| [13] | Vasil ML, Ochsner UA. The response of Pseudomonas aeruginosa to iron: genetics, biochemistry and virulence. Mol Microbiol, 1999, 34(3): 399-413. DOI:10.1046/j.1365-2958.1999.01586.x |
| [14] | Holloway BW. Genetic recombination in Pseudomonas aeruginosa. J Gen Microbiol, 1955, 13(3): 572-581. |
| [15] | Kristensen CS, Eberl L, Sanchez-Romero JM, et al. Site-specific deletions of chromosomally located DNA segments with the multimer resolution system of broad-host-range plasmid RP4. J Bacteriol, 1995, 177(1): 52-58. DOI:10.1128/jb.177.1.52-58.1995 |
| [16] | Wang X, Wang Q, Zhang WJ, et al. Complete genome sequence of Magnetospirillum gryphiswaldense MSR-1. Genome Announc, 2014, 2(2): e00171-14. |
| [17] | Baynham PJ, Ramsey DM, Gvozdyev BV, et al. The Pseudomonas aeruginosa ribbon-helix-helix DNA-binding protein AlgZ (AmrZ) controls twitching motility and biogenesis of type Ⅳ pili. J Bacteriol, 2006, 188(1): 132-140. DOI:10.1128/JB.188.1.132-140.2006 |
| [18] | Studier FW, Rosenberg AH, Dunn JJ, et al. Use of T7 RNA polymerase to direct expression of cloned genes. Methods Enzymol, 1990, 185: 60-89. |
| [19] | Hoang TT, Karkhoff-Schweizer PR, Kutchma AJ, et al. A broad-host-range Flp-FRT recombination system for site-specific excision of chromosomally-located DNA sequences: application for isolation of unmarked Pseudomonas aeruginosa mutants. Gene, 1998, 212(1): 77-86. DOI:10.1016/S0378-1119(98)00130-9 |
| [20] | Olsen RH, DeBusscher G, McCombie WR. Development of broad-host-range vectors and gene banks: self-cloning of the Pseudomonas aeruginosa PAO chromosome. J Bacteriol, 1982, 150(1): 60-69. DOI:10.1128/jb.150.1.60-69.1982 |
| [21] | Becher A, Schweizer H P. Integration-proficient Pseudomonas aeruginosa vectors for isolation of single-copy chromosomal lacZ and lux gene fusions. Biotechniques, 2000, 29(5): 948-950, 952. DOI:10.2144/00295bm04 |
| [22] | Imperi F, Ciccosanti F, Perdomo AB, et al. Analysis of the periplasmic proteome of Pseudomonas aeruginosa, a metabolically versatile opportunistic pathogen. Proteomics, 2009, 9(7): 1901-1915. DOI:10.1002/pmic.200800618 |
| [23] | Wang SW, Parsek WR, Wozniak DJ, et al. A spider web strategy of type Ⅳ pili-mediated migration to build a fibre-like Psl polysaccharide matrix in Pseudomonas aeruginosa biofilms. Environ Microbiol, 2013, 15(8): 2238-2253. DOI:10.1111/1462-2920.12095 |
| [24] | Wang SW, Yu S, Zhang ZY, et al. Coordination of swarming motility, biosurfactant synthesis, and biofilm matrix exopolysaccharide production in Pseudomonas aeruginosa. Appl Environ Microbiol, 2014, 80(21): 6724-6732. DOI:10.1128/AEM.01237-14 |
| [25] | Reimmann C, Serino L, Beyeler M, et al. Dihydroaeruginoic acid synthetase and pyochelin synthetase, products of the pchEF genes, are induced by extracellular pyochelin in Pseudomonas aeruginosa. Microbiology (Reading), 1998, 144(11): 3135-3148. DOI:10.1099/00221287-144-11-3135 |
| [26] | Hassett DJ, Sokol PA, Howell ML, et al. Ferric uptake regulator (Fur) mutants of Pseudomonas aeruginosa demonstrate defective siderophore-mediated iron uptake, altered aerobic growth, and decreased superoxide dismutase and catalase activities. J Bacteriol, 1996, 178(14): 3996-4003. DOI:10.1128/jb.178.14.3996-4003.1996 |
| [27] | Singh PK, Parsek MR, Greenberg EP, et al. A component of innate immunity prevents bacterial biofilm development. Nature, 2002, 417(6888): 552-555. DOI:10.1038/417552a |
| [28] | Burrows LL. Pseudomonas aeruginosa twitching motility: type Ⅳ pili in action. Annu Rev Microbiol, 2012, 66: 493-520. DOI:10.1146/annurev-micro-092611-150055 |
| [29] | Mann EE, Wozniak DJ. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev, 2012, 36(4): 893-916. DOI:10.1111/j.1574-6976.2011.00322.x |
| [30] | Harshey RM, Matsuyama T. Dimorphic transition in Escherichia coli and Salmonella typhimurium: surface-induced differentiation into hyperflagellate swarmer cells. Proc Natl Acad Sci USA, 1994, 91(18): 8631-8635. DOI:10.1073/pnas.91.18.8631 |
| [31] | Imperi F, Massai F, Facchini M, et al. Repurposing the antimycotic drug flucytosine for suppression of Pseudomonas aeruginosa pathogenicity. Proc Natl Acad Sci USA, 2013, 110(18): 7458-7463. DOI:10.1073/pnas.1222706110 |
| [32] | Ochsner UA, Wilderman PJ, Vasil AI, et al. GeneChip expression analysis of the iron starvation response in Pseudomonas aeruginosa: identification of novel pyoverdine biosynthesis genes. Mol Microbiol, 2002, 45(5): 1277-1287. DOI:10.1046/j.1365-2958.2002.03084.x |
| [33] | Palma M, Worgall S, Quadri LEN. Transcriptome analysis of the Pseudomonas aeruginosa response to iron. Arch Microbiol, 2003, 180(5): 374-379. DOI:10.1007/s00203-003-0602-z |
| [34] | Vassinova N, Kozyrev D. A method for direct cloning of fur-regulated genes: identification of seven new fur-regulated loci in Escherichia coli. Microbiology, 2000, 146 Pt 12: 3171-3182. |
| [35] | Brewer LK, Huang WL, Hackert BJ, et al. Static growth promotes PrrF and 2-alkyl-4(1H)-quinolone regulation of type Ⅵ secretion protein expression in Pseudomonas aeruginosa. J Bacteriol, 2020, 202(24). |
