

北京农学院 农业农村部华北都市农业重点实验室,北京 102206
收稿日期:2020-08-11;接收日期:2020-11-19;网络出版时间:2021-02-01
基金项目:国家自然科学基金(Nos. 21606020,31370674) 资助
摘要:树莓酮具有重要的医药价值,如抗流感、预防糖尿病等。为了在莱茵衣藻Chlamydomonas reinhardtii中获得树莓酮,本研究将树莓酮合成的最后两个步骤中的酶,即4-香豆酰-CoA连接酶(4-coumaryl-CoA ligase,4CL) 和聚酮合酶(Polyketide synthase,PKS1) 通过甘氨酸-丝氨酸-甘氨酸(Gly-Ser-Gly,GSG) 三肽接头融合在一起,构建莱茵衣藻表达载体pChla-4CL-PKS1。通过电转化的方法将由PSAD启动子驱动的融合基因4CL-PKS1插入野生型莱茵衣藻(CC125) 和细胞壁缺失型莱茵衣藻(CC425) 中。结果在表达4CL-PKS1融合蛋白的野生型莱茵衣藻和细胞壁缺失型莱茵衣藻中,树莓酮含量分别为6.7 μg/g (鲜重) 和5.9 μg/g (鲜重),高于天然植物中树莓酮的含量(2–4 μg/g)。
关键词:树莓酮4-香豆酰-CoA连接酶聚酮合酶融合基因
Overexpression of a fusion protein of 4-coumaroyl-CoA ligase and polyketide synthase for raspberry ketone production in Chlamydomonas reinhardtii
Wenqing Niu, Hangtao Wei, Feiyan Xue, Mingfeng Yang


Key Laboratory for Northern Urban Agriculture of Ministry of Agriculture and Rural Affairs, Beijing University of Agriculture, Beijing 102206, China
Received: August 11, 2020; Accepted: November 19, 2020; Published: February 1, 2021
Supported by: National Natural Science Foundation of China (Nos. 21606020, 31370674)
Corresponding author: Mingfeng Yang. E-mail: mfyang@bua.edu.cn.
Abstract: Raspberry ketones have important therapeutic properties such as anti-influenza and prevention of diabetes. In order to obtain raspberry ketone from Chlamydomonas reinhardtii, two enzymes catalyzing the last two steps of raspberry ketone synthesis, i.e. 4-coumaryl-CoA ligase (4CL) and polyketide synthase (PKS1), were fused using a glycine-serine-glycine (GSG) tripeptide linker to construct an expression vector pChla-4CL-PKS1. The fusion gene 4CL-PKS1 driven by a PSAD promoter was transformed into a wild-type (CC125) and a cell wall-deficient C. reinhardtii (CC425) by electroporation. The results showed the recombinant C. reinhardtii strain CC125 and CC425 with 4CL-PKS1 produced raspberry ketone at a level of 6.7 μg/g (fresh weight) and 5.9 μg/g (fresh weight), respectively, both were higher than that of the native raspberry ketone producing plants (2–4 μg/g).
Keywords: raspberry ketone4-coumaroyl-CoA ligase (4CL)polyketide synthase (PKS1)fusion proteins
树莓酮(Raspberry ketone),又称覆盆子酮,是一种烷基酚类化合物的衍生物,存在于树莓、黑莓、葡萄、苹果以及浆果等多种植物中的香气成分[1-2]。树莓酮因其香味独特,不仅在食品和化妆品领域广泛应用,更具有重要的药用价值,如促进脂肪代谢[3]、抗癌[4]、抑菌[5]、抗氧化[6]等。
苯丙烷代谢途径(Phenylpropanoid pathway) 是树莓酮生物合成的主要途径[7]。该途径为4-香豆酰辅酶A与丙二酰辅酶A在苯亚甲基丙酮合酶(Benzalacetone synthase,BAS) 的催化作用下,经缩合反应生成对羟基苄丙酮。最后由苄基丙酮还原酶(Benzalacetone reductase,BAR)催化还原对羟基苄丙酮,从而得到树莓酮[1]。在底物4-香豆酰辅酶A的合成过程中,4-香豆酰-CoA连接酶(4CL)起到了至关重要的作用,因此4-香豆酰-CoA连接酶(4CL) 和苯亚甲基丙酮合酶(BAS) 是树莓酮合成过程中的两个重要的酶。然而,天然树莓酮在大多数生产树莓酮植物中的产量较低,大约只有2–4 μg/g[8]。李斌等[9]用甲醇作为提取溶剂,用热回流的方法从树莓中提取树莓酮,得到树莓酮产量约为0.2 μg/g;张成涛等[10]从红树莓中提取树莓酮,得到最终产量为3.32 μg/g,且从果实中提取树莓酮的成本太高,不利于树莓的工业化生产。虽然利用化学合成的方法合成树莓酮的产量较高,王冠[11]以天然大茴香醛和天然乙醛为原料,采用化学方法合成树莓酮,总得率达到54.3%;乞少红[12]以丙酮和甲醛为原料,以浓硫酸为催化剂合成树莓酮,回收率达70%以上,但化学合成的树莓酮并不是天然树莓酮,使其在实际应用中受到限制。因此需要付出大量努力来提高其在包括原核生物在内的生物体中的水平。
近年来,许多微生物表达系统如大肠杆菌、酵母等已经建立。Beekwilder等[1]首次将4CL和苯亚甲基丙酮合酶转化到大肠杆菌,并成功在大肠杆菌中检测到了5 mg/L的树莓酮,并伴有柚皮素的其他杂质产生。Lee等[13]通过酵母构建了树莓酮的合成途径,产量为2.8 mg/L;同时以香豆酸为底物,使树莓酮产量达到7.5 mg/L。王程程等[14]将4CL、苄基丙酮合酶和苄基丙酮还原酶(Raspberry ketone/zingerone synthase,RZS1)基因转化到大肠杆菌进行发酵,并成功在大肠杆菌中检测到了178.13 mg/L的树莓酮,但其过程需要连续进行补料分批发酵。
基因融合是将多个基因的编码区相连,去掉首个基因的终止密码子并连上含有终止密码子的后续基因序列,在相同调控序列下形成融合基因[15]。莱茵衣藻具有易栽培、生长快、光合效率高等优点外,还具有环境友好、易于转基因、代谢途径与高等植物相似等优点,它是一种理想的重组蛋白反应器和生物表达系统。目前已有关于使用莱茵衣藻进行白藜芦醇的合成和产氢的研究[16]。因此,莱茵衣藻也可能是一种较好的生产树莓酮的生物反应器。
苯亚甲基丙酮合酶(BAS) 是树莓生物合成途径中的关键酶,目前还没有从树莓中分离到专门编码苯亚甲基丙酮合酶的基因BAS,本实验室前期工作从植物虎杖中克隆到具有CHS和BAS活性的双功能酶PKS1[17]。为了探索利用藻类生产树莓酮的可能,将4-香豆酰-CoA连接酶(4CL) 和聚酮合酶(PKS1) 通过连接肽融合在一起,融合蛋白4CL-PKS1在莱茵衣藻中高效表达,为生物合成量产树莓酮奠定基础。
1 材料与方法1.1 材料莱茵衣藻CC125 (野生型,mt+)、CC425 (细胞壁缺失型, arg2 cw15 mt+ sr-u-2-60) 和衣藻表达载体pChlamiRNA3int由首都师范大学胡勇教授惠赠。衣藻培养条件:TAP培养基为基本培养基(CC425加入精氨酸200 μg/L),在温度为25 ℃、光照强度30 μmol/(m2·s)下,光照16 h,暗培养8 h。
1.2 方法1.2.1 树莓酮植物生产用4CL-PKS1表达载体的构建及转化按照Horton等的重叠延伸(Overlap extension)方法将4CL基因与PKS1基因通过连接肽融合在一起[18]。首先根据两个基因cDNA序列设计重叠延伸引物(表 1);用引物F1和P2扩增烟草4CL (GenBank登录号:NM_001325625.1) cDNA序列;用引物P1和R1扩增虎杖PKS1 (GenBank登录号:JQ654448.1) 的cDNA序列。最后用引物F1和R1扩增前两个扩增产物的混合物,即得到4CL和PKS1的融合基因。将融合基因连入载体pChlamiRNA3int的NdeⅠ和XbaⅠ酶切位点,替换载体原有的GFP片段[19],得到重组质粒pChla-4CL-PKS1。
表 1 重叠延伸PCR引物序列Table 1 Primers used in overlap extension PCR
| Primer name | Sequences (5′–3′) |
| F1 | ATGGAGAAAGATACAAAACAGGTTGACATAATTTTCCGATC |
| R1 | CATCATTCTAGAGTGATGAGCAACTGGTACACTGTGTAGAAC |
| P1 | GCTGCTGGGCTTCCAAATGAAAATCTCTACTTCCAGGGTGGTGGTATGGCACCATCGGTCCAG |
| P2 | CTGGACCGATGGTGCCATACCACCACCCTGGAAGTAGAGATTTTCATTTGGAAGCCCAGCAGC |
| Note: F1 and P2 are the upstream and downstream primers of 4CL gene. P1 and R1 are the upstream and downstream primers of PKS1, respectively. P1 and P2 primers have partial overlap to form overlapping regions after amplification of 4CL and PKS1, and P1 and P2 are the sites of linker peptides. | |
表选项
质粒转化衣藻参照刘佳等[20]的衣藻电转化法。衣藻细胞在液体TAP培养基中培养至对数生长期OD750=0.6,取250 μL细胞悬液和线性化质粒放入预冷的0.4 cm电击杯(美国BTX,122) 中,使用电穿孔仪(BTX EMC399,126USA) 电转化(1 800 V/cm,1个脉冲,1 ms)。电转结束后将莱茵衣藻培养于1 mL TAP非选择培养基,37 ℃水浴恢复培养5 min。然后进行光照培养48 h。在含有5 mg /mL巴龙霉素(Paromomycin,Par) 的TAP琼脂平板上筛选转基因藻落。
1.2.2 藻落PCR验证参照王亮[21]藻落PCR验证方法。挑取1 mL悬浮液OD750=0.6在95 ℃下煮5 min后放入?80 ℃冰冻10 min。将莱茵衣藻从?80 ℃中取出,待融化后6 000× g离心5 min,取1 μL上清液作为模板进行藻落PCR验证。PCR的反应程序为:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 50 s,33个循环;最后72 ℃ 5 min。PCR使用PCR试剂盒(Transgen Biotech)。测序证实4CL-GSG-STS序列正确。
1.2.3 莱茵衣藻中树莓酮的提取将莱茵衣藻培养至对数生长期OD750=0.6。离心收集莱茵衣藻沉淀,共称取1.0 g,加入液氮研磨至粉末状。衣藻研磨后加入100 mL氯仿,避光放置48 h。将液体进行真空抽滤,并将抽滤后的液体进行55 ℃旋蒸,后加入20 mL 60%的色谱级甲醇溶解,再加入5倍体积的石油醚萃取。接着加入2倍体积的乙酸乙酯萃取,取下层溶液,进行55 ℃旋蒸,旋蒸完后用1 mL色谱级甲醇溶解,放入5 mL离心管,6 000× g离心2 min。离心后用有机滤膜将液体过滤至安瓿瓶,即可得到树莓酮提取物。
1.2.4 树莓酮产物高效液相色谱检测使用配有Agilent ZORBAX SB-C18 250 mm反相色谱柱的Water 1525高效液相色谱仪。设定方法:流动相A甲醇和B水,流速1 mL/min,梯度洗脱条件A 0–10 min、0%,A 10–26 min、30%,A 26–28 min、30%。树莓酮最大吸收波长275 nm。标准曲线的绘制:将树莓酮标品稀释为1 000 μg/mL、500 μg/mL、250 μg/mL、125 μg/mL、64.5 μg/mL不同浓度,依次进样绘制标准曲线。
1.2.5 树莓酮产物质谱检测为了在线HPLC-MS分析,液相色谱在Agilent 1290 infinity Ⅱ 212 HPLC系统上进行[9]。优化的质谱检测条件为:电喷雾离子源(ESI);正离子扫描;多反应监测(MRM);电喷雾电压(IS) 5 500 V;雾化气压力(GSI) 448.175 kPa;气帘气压力(CUR) 68.95 kPa;辅助气压力(GS2) 448.175 kPa;离子源温度(TEM) 550 ℃;定性离子对、定量离子对、碰撞气能量(CE) 及去簇电压。
2 结果与分析2.1 融合基因表达载体构建和衣藻转化首先将4CL和PKS1的cDNA序列通过重叠延伸方法融合在一起,然后PCR扩增4CL-PKS1,连入载体pChlamiRNA3int得到表达4CL和PKS1融合蛋白的重组质粒pChla-4CL-PKS1 (图 1)。
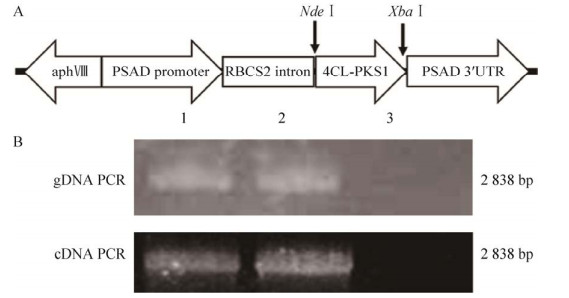 |
| 图 1 融合基因表达载体图及电泳图 Fig. 1 Schematic diagram and electrophoregram of fusion gene. (A) Schematic diagram of pChla-4CL-PKS1. The fusion gene 4CL-PKS1 was cloned between the NdeⅠ and XbaⅠ restriction sites of the Chlamydomonas expression vector pChlamiRNA3int, resulting in plasmid pChla-4CL-PKS1. (B) electrophoregram of pChla-4CL-PKS1. Lanes 1 and 2 are the bands of the fusion gene 4CL-PKS1 of the transgenic Chlamydomonas CC125 and CC425 respectively, the size of the fusion gene is 2 838 bp; lane 3 is non-transgenic algae. |
| 图选项 |
载体中PSAD启动子是衣藻内源启动子,可以驱动4CL和PKS1融合基因在莱茵衣藻中高效表达。氨基糖苷3′-磷酸转移酶(aphⅧ) 具有抗巴龙霉素的特性,可作为转基因衣藻的选择标记。从转化衣藻中提取基因组DNA和总RNA,能够扩增出全长4CL-PKS1基因。测序后表明,融合基因在转基因衣藻基因组已经成功整合并能够正常转录表达。
2.2 树莓酮的提取和鉴定为了检测树莓酮在转基因衣藻中的积累情况,从莱茵衣藻中提取树莓酮,并用高效液相色谱(HPLC) 测定树莓酮的含量。转基因莱茵衣藻CC125与CC425在HPLC图谱中有较高的树莓酮峰(保留时间为22 min),而野生型衣藻则未检测到树莓酮峰(图 2)。通过对衣藻提取物进行全扫描LC-MS分析发现有一个明显的树莓酮峰(165,已加氢) (图 3A);多反应监测(MRM)扫描显示该树莓酮的产物离子峰(119和147) (图 3B)。因此,质谱分析确认转基因衣藻产生了树莓酮。
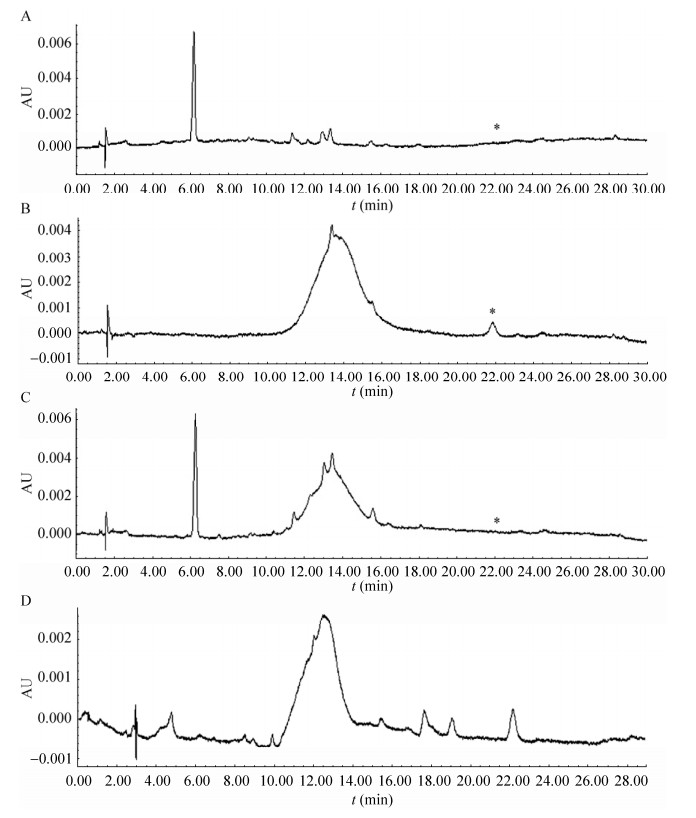 |
| 图 2 树莓酮HPLC色谱图 Fig. 2 Production of raspberry ketone in Chlamydomonas analyzed by HPLC. (A) Strain CC425. (B) Strain CC425t (strain CC425 transformed with 4CL-PKS1). (C) Strain CC125. (D) Strain CC125t (Strain CC125 transformed with 4CL-PKS1). An asterisk designates retention time of raspberry ketone. |
| 图选项 |
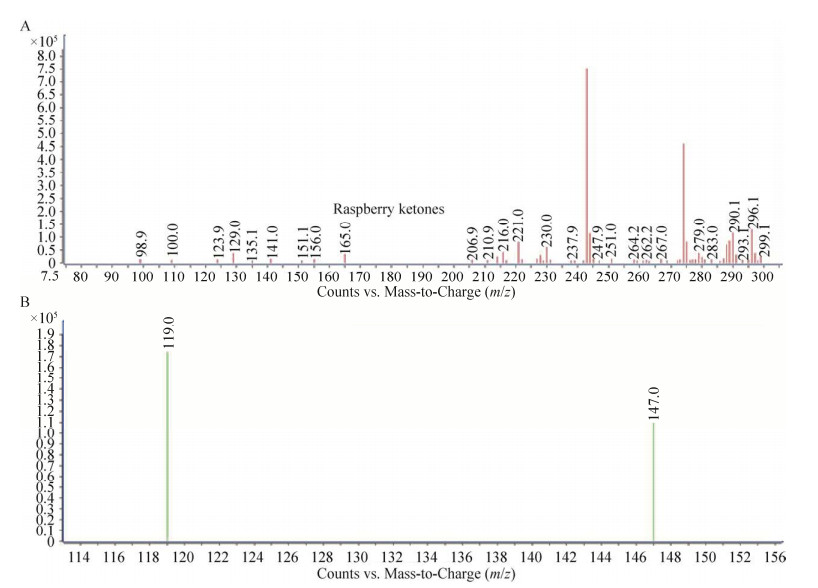 |
| 图 3 树莓酮二级质谱扫描图 Fig. 3 Identification of raspberry ketone by HPLC-MS. (A) The raspberry ketone peak (165) was shown in Full Scan LC-MS. (B) The product ion peaks of raspberry ketone (119 and 147) were shown in the Multiple Reaction Monitoring (MRM) scan. |
| 图选项 |
根据树莓酮标准品的液相色谱结果得到标准曲线y=4 825x?14 983 (R2=0.999 3),转基因衣藻树莓酮的峰面积定量分析得到转基因莱茵衣藻CC125的树莓酮含量为(6.7±1.2) μg/g (鲜重),在转基因CC425中的含量为(5.9±1.3) μg/zg (鲜重)。两种转基因衣藻的树莓酮含量有些差异,但是没有达到显著水平(P > 0.05)。这些结果表明,在本来不含树莓酮的藻类植物中,把树莓酮合成途径中的两个重要基因融合后在衣藻中表达,可以产生树莓酮,并能在衣藻细胞中积累。
3 讨论利用基因重组技术将4-香豆酰-CoA连接酶(4CL) 和聚酮合酶(PKS1) 基因转入衣藻,成功构建转基因藻株。通过液相色谱和质谱检测到转基因莱茵衣藻中含有树莓酮产物,表明融合基因4CL-PKS1已成功转入莱茵衣藻并获得表达。本实验利用莱茵衣藻作为生物反应器,选择甲醇作为提取溶剂提取树莓酮,在没有底物诱导和激素刺激的情况下,转基因莱茵衣藻树莓酮的最终产量按鲜重计算CC125藻株产量是6.7 μg/g,CC425藻株产量是5.9 μg/g,按衣藻培养体积计算CC125藻株产量是22.33 μg/L,CC425藻株产量是19.67 μg/L。虽然野生型莱茵衣藻中树莓酮的含量略高于细胞壁缺失型,但在实际操作中细胞壁缺失型莱茵衣藻比野生型的电转化率更高,且细胞壁薄更容易破碎,因此在工业生产中可能会有优先选择。转基因莱茵衣藻中树莓酮的含量比从红树莓果实[10]中提取的含量(3.32 μg/g) 提高2倍多,但是仍然明显低于采用微生物发酵法得到的树莓酮[1-13]。
本实验成功利用莱茵衣藻生产制备树莓酮,但树莓酮的提取效率受提取时间、提取温度、莱茵衣藻OD值等因素的影响,需要优化用衣藻生产树莓酮的整体工艺,包括底物添加、培养条件、提取工艺等。目前关于使用莱茵衣藻生产树莓酮工艺的研究尚未见报道,而本实验展现了利用莱茵衣藻作为反应器生产制备树莓酮的工业化生产前景。
参考文献
| [1] | Beekwilder J, Van Der Meer IM, Sibbesen O, et al. Microbial production of natural raspberry ketone. Biotechnol J, 2007, 2(10): 1270-1279. DOI:10.1002/biot.200700076 |
| [2] | Lee J. Further research on the biological activities and the safety of raspberry ketone is needed. NFS J, 2016, 2: 15-18. DOI:10.1016/j.nfs.2015.12.001 |
| [3] | Morimoto C, Satoh Y, Hara M, et al. Anti-obese action of raspberry ketone. Life Sci, 2005, 77(2): 194-204. DOI:10.1016/j.lfs.2004.12.029 |
| [4] | 黎庆涛, 王远辉, 王丽. 树莓功能因子研究进展. 中国食品添加剂, 2001(2): 172-77. Li QT, Wang YH, Wang L. Investigative progress of functional factors in raspberry. China Food Addit, 2001(2): 172-177 (in Chinese). |
| [5] | 孟宪军, 杨磊, 李斌. 树莓酮对高血脂症大鼠血脂及炎症因子的影响. 食品科学, 2012, 33(13): 267-270. Meng XJ, Yang L, Li B. Effect of raspberry ketone on lipid metabolism and inflammatory factors in hyperlipidemic rats. Food Sci, 2012, 33(13): 267-270 (in Chinese). |
| [6] | Storozhok NM, Gureeva NV, Khalitov RA, et al. Antioxidant activity of synthetic analogs and pure active principles of rhodiola rosea and raspberry ketone. Pharm Chem J, 2012, 45(12): 732-735. DOI:10.1007/s11094-012-0713-4 |
| [7] | Borejsza-Wysocki W, Hrazdina G. Biosynthesis of p-hydroxyphenylbutan-2-one in raspberry fruits and tissue cultures. Phytochemistry, 1994, 35(3): 623-628. DOI:10.1016/S0031-9422(00)90575-2 |
| [8] | Larsen M, Poll L, Callesen O, et al. Relations between the content of aroma compounds and the sensory evaluation of 10 raspberry varieties (Rubus idaeus L). Acta Agric Scand, 1991, 41(4): 447-454. DOI:10.1080/00015129109439927 |
| [9] | 李斌, 王小杰, 杨磊, 等. HPLC-MS/MS法测定树莓中树莓酮含量的研究. 生物技术进展, 2013, 3(6): 439-442. Li B, Wang XJ, Yang L, et al. Determination of raspberry ketone in raspberry by HPLC-MS/MS. Curr Biotechnol, 2013, 3(6): 439-442 (in Chinese). DOI:10.3969/j.issn.2095-2341.2013.06.12 |
| [10] | 张成涛, 万国盛, 赵余庆, 等. 红树莓果实中鞣花酸和树莓酮的含量测定. 中国实验方剂学杂志, 2013, 19(19): 140-143. Zhang CT, Wan GS, Zhao YQ, et al. Determination of the content of ellagic acid and raspberry ketone in red raspberry (Rubus corchorifolius) fruit. Chin J Exp Tradit Med Formulae, 2013, 19(19): 140-143 (in Chinese). |
| [11] | 王冠. 一种天然覆盆子酮的合成方法研究. 香料香精化妆品, 2017, 8(4): 14-16. Wang G. Study on synthesis of natural raspberry ketone. Flavour Fragr Cosmet, 2017, 8(4): 14-16 (in Chinese). DOI:10.3969/j.issn.1000-4475.2017.04.004 |
| [12] | 乞少红. 4-对羟基苯基-2-丁酮的合成. 河北化工, 2004(2): 35, 37. Qi SH. Synthesis of 4-parahydroxy-phenyl-2- butanone. Hebei Chem Eng Ind, 2004(2): 35, 37 (in Chinese). |
| [13] | Lee D, Lloyd NDR, Pretorius IS, et al. Heterologous production of raspberry ketone in the wine yeast Saccharomyces cerevisiae via pathway engineering and synthetic enzyme fusion. Microb Cell Factor, 2016, 15: 49. DOI:10.1186/s12934-016-0446-2 |
| [14] | 王程程, 郑璞, 陈鹏程, 等. 重组大肠杆菌发酵生产树莓酮. 食品与发酵工业, 2019, 45(9): 9-14. Wang CC, Zheng P, Chen PC, et al. Production of raspberry ketone by recombinant Escherichia coli. Food Ferment Ind, 2019, 45(9): 9-14 (in Chinese). |
| [15] | 武东亮, 郭三堆. 融合基因研究进展. 生物技术通报, 2001(2): 5-7. Wu DL, Guo SD. The advances in research of fused gene. Biotechnol Inf, 2001(2): 5-7 (in Chinese). DOI:10.3969/j.issn.1002-5464.2001.02.002 |
| [16] | 蒋欣芩. 莱茵衣藻光控系统的构建及其在产氢中的应用[D]. 深圳: 深圳大学, 2017. Jang XC. Construction of chlamydomonas reinhardtii lighting contral system and its application in prod ucing hydrogen[D]. Shenzhen: Shenzhen University, 2017 (in Chinese). |
| [17] | Ma LQ, Guo YW, Gao DY, et al. Identification of a Polygonum cuspidatum three-intron gene encoding a type Ⅲ polyketide synthase producing both naringenin and p-hydroxy-benzalacetone. Planta, 2009, 229(5): 1077-1086. DOI:10.1007/s00425-009-0899-1 |
| [18] | Horton RM, Hunt HD, Ho SN, et al. Engineering hybrid genes without the use of restriction enzymes: gene splicing by overlap extension. Gene, 1989, 77(1): 61-68. DOI:10.1016/0378-1119(89)90359-4 |
| [19] | Xiang C, Liu J, Ma LQ, et al. Overexpressing codon-adapted fusion proteins of 4-coumaroyl-CoA ligase (4CL) and stilbene synthase (STS) for resveratrol production in Chlamydomonas reinhardtii. J Appl Phycol, 2020, 32(3): 1669-1676. DOI:10.1007/s10811-020-02123-2 |
| [20] | 刘佳, 何炫程, 项晨, 等. 一种高效的莱茵衣藻电转化方法. 北京农学院学报, 2019, 34(2): 5-9. Liu J, He XC, Xiang C, et al. An efficient electroporation electroporation transformation method for Chlamydomonas reinhardtii. J Beijing Univ Agric, 2019, 34(2): 5-9 (in Chinese). |
| [21] | 王亮. CrKin13在衣藻鞭毛组装与解聚中功能和机制的研究[D]. 北京: 清华大学, 2013. Wang L. Function and mechanism of CrKin13 underlying flagellar assembly and dissassembly in Chlamydomonas[D]. Beijing: Tsinghua University, 2013 (in Chinese). |
