

中国医学科学院 & 北京协和医学院药物研究所 天然药物活性物质与功能国家重点实验室 国家卫生健康委员会天然药物生物合成重点实验室,北京 100050
收稿日期:2020-11-13;接收日期:2021-01-27;网络出版时间:2021-02-23
基金项目:国家重点研发计划(No. 2020YFA0908000) 资助
作者简介:孔建强 ?? 博士,中国医学科学院药物研究所研究员、博士生导师。主要从事天然药物的生物合成及合成生物学研究。发表文章80余篇,申请专利10余项(授权5项)。《生物工程学报》编委,Acta Pharmaceutica Sinica B和《药学学报》青年编委。荣获中国药学会科学技术奖三等奖和中国药学会赛诺非安万特青年生物药物奖等在内的学术奖励10余项.
摘要:槲皮素3-O-糖苷是一类重要的槲皮素糖苷类化合物,具有抗氧化、抗炎、抗癌和抗病毒等多种药理活性,其代表性化合物芦丁和曲克芦丁已被开发成临床用药。由此可见,槲皮素3-O-糖苷已经成为创新药物的重要来源之一。然而,较低的生物利用度限制了槲皮素3-O-糖苷在食品、制药等行业中更广泛地应用。为提高这些化合物的生物利用度,选择性酰基化修饰是有效的途径之一,而生物酶法则是获得槲皮素3-O-糖苷酯类衍生物的重要方法。文中介绍了酰基化槲皮素3-O-糖苷的酶促合成方法,重点综述了4种能执行体外酶促酰化的工具酶(酰基转移酶、脂肪酶、蛋白酶、酯酶) 和全细胞生物催化剂在槲皮素3-O-糖苷酯的酶促合成中的研究进展,详细阐述了酰基化修饰对槲皮素3-O-糖苷生物活性的影响。此外,还针对槲皮素3-O-糖苷酯的高效合成方法和修饰位点多样化进行了讨论,以期为槲皮素3-O-糖苷类药物的结构修饰、开发提供新思路。
关键词:槲皮素异槲皮苷芦丁曲克芦丁酰基化生物催化
Enzymatic synthesis of acylated quercetin 3-O-glycosides: a review
Xuening Wang, Jianqiang Kong


State Key Laboratory of Bioactive Substance and Function of Natural Medicines, NHC Key Laboratory of Biosynthesis of Natural Products, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
Received: November 13, 2020; Accepted: January 27, 2021; Published: February 23, 2021
Supported by: National Key Research and Development Program of China (No. 2020YFA0908000)
Corresponding author: Jianqiang Kong. Tel: +86-10-63033559; E-mail: jianqiangk@imm.ac.cn.
Abstract: Quercetin 3-O-glycosides (Q3Gs) are important members of quercetin glycosides with excellent pharmacological activities such as anti-oxidation, anti-inflammation, anti-cancer and anti-virus. Two representatives of Q3Gs, rutin and troxerutin, have been developed into clinical drugs, demonstrating Q3Gs have become one of the important sources of innovative drugs. However, the applications of Q3Gs in food and pharmaceutical industries are hampered by its poor bioavailability. Of the known means, selective acylation modification of Q3Gs through enzymatic catalysis to obtain Q3G esters is one of the effective ways to improve its bioavailability. Herein, the enzyme-mediated acylation of Q3Gs were reviewed in details, focusing on the four tool enzymes (acyltransferases, lipases, proteases and esterases) and the whole-cell mediated biotransformation, as well as the effect of acylations on the biological activities of Q3Gs. Furthermore, the highly efficient synthesis and diversification of acylated site for Q3G esters were also discussed. Taken together, this review provides a new perspective for further structural modifications of Q3Gs towards drug development.
Keywords: quercetinisoquercitrinrutintroxerutinacylationbiocatalysis
槲皮素(Quercetin) (图 1) 是一种具有多种药理活性的多羟基黄酮醇类活性天然产物,在自然界中主要以糖苷的形式存在。槲皮素3-O-糖苷(Quercetin 3-O-glycosides,Q3Gs),即糖基以糖苷键和槲皮素C环上的C3位相连形成的槲皮素衍生物,是一类主要的槲皮素糖苷。不同类型的糖基基团连接在槲皮素C3位上,形成种类繁多的3-O-糖苷,如槲皮素-3-O-鼠李糖苷(Quercitrin, 槲皮苷)、槲皮素-3-O-葡萄糖苷(Isoquercitrin,异槲皮苷)、槲皮素-3-O-半乳糖苷(Hyperoside,金丝桃苷)、槲皮素-3-O-呋喃阿拉伯糖苷(Avicularin,萹蓄苷)、槲皮素-3-O-木糖苷(Quercetin 3-O-xylopyranoside) 以及槲皮素-3-O-芸香糖苷(Rutin,芦丁) 等(图 1)。槲皮素3-O-糖苷具有广泛的药理活性,能够清除2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸) (2, 2-azino-bis-3- ethylbenzothiazoline-6-sulphonic acid,ABTS)、2, 2-联苯基-1-苦基肼基(2, 2-diphenyl-l-picrylhydrazyl,DPPH) 和超氧自由基,发挥抗氧化作用[1-3]。此外,槲皮素3-O-糖苷还具有抗癌[4]、抗炎[5]、降血糖[6]、抗过敏[7]和抗病毒[8]等多种药理活性。槲皮素3-O-二糖苷芦丁和曲克芦丁则已经被开发成药,临床上主要用于改善血管功能和抑制血栓形成。上述事实表明,槲皮素3-O-糖苷已经成为创新药物的重要来源之一。然而,该类化合物的亲脂性不高,导致细胞膜渗透性差、口服利用度低等问题,限制了其在食品、制药等行业中更广泛地应用。
 |
| 图 1 槲皮素及代表性槲皮素3-O-糖苷的结构 Fig. 1 Structures of quercetin and typical quercetin 3-O-glycosides. |
| 图选项 |
酰基化修饰是槲皮素3-O-糖苷结构修饰的主要途径之一,通常指在其母核或糖基侧链的羟基中引入不同种类酰基的反应,这些酰基既可以是脂肪族酰基,也可以是芳香族酰基。酰基化修饰可以显著提高槲皮素3-O-糖苷的脂溶性,增强生物利用度,使其更易到达靶组织/细胞,也可以进一步稳定结构中的糖苷键,并将有助于发现新化合物[9]。化学合成和生物催化是实现槲皮素3-O-糖苷酰基化修饰的重要手段。然而,槲皮素3-O-糖苷对pH、高温和金属离子等比较敏感,化学法剧烈的反应条件易破坏化合物的自身结构。同时,槲皮素3-O-糖苷的多羟基性使化学合成槲皮素3-O-糖苷单酯衍生物极具挑战性。考虑到位点选择性、绿色环保等相关问题,生物催化法则更加受到研发者们的青睐。酶法介导的槲皮素3-O-糖苷酰化反应可以极大地简化催化过程,通常可高效地一步合成目标化合物,减少副产物的产生,并引入传统化学合成无法实现的多样性修饰基团。目前,槲皮素3-O-糖苷的酰化修饰方法已被广泛研究。本文综述了酶法合成槲皮素3-O-糖苷酰基化衍生物的研究进展,主要包括体外酶法合成和全细胞生物转化法,并总结了酰基化修饰对槲皮素3-O-糖苷生物活性的影响。
1 体外酶法合成以生物酶作为生物催化剂,在体外以可控的方式进行酶法合成是生物合成槲皮素3-O-糖苷酯的主要方式。目前,已开发出4种能执行槲皮素3-O-糖苷体外酰基化修饰的工具酶,分别为酰基转移酶、脂肪酶、蛋白酶以及酯酶。
1.1 酰基转移酶自然界中,次级代谢产物的酰化修饰过程通常由两大类酰基转移酶所介导,即BAHD酰基转移酶家族(BAHD acyltransferases,BAHD-ATs) 和SCLP酰基转移酶家族(SCLP acyltransferases,SCLP-ATs)[10]。根据酰基供体的不同,BAHD-ATs进一步分为芳香族酰基转移酶(Aromatic acyltransferases) 和脂肪族酰基转移酶(Aliphatic acyltransferases)。芳香族酰基转移酶利用芳香酰辅酶A作为酰基供体,如肉桂酰辅酶A (Cinnamoyl CoA)、香豆酰辅酶A (p-coumaroyl CoA)、阿魏酰辅酶A (Feruloyl CoA)、咖啡酰辅酶A (Caffeoyl CoA) 和芥子酰辅酶A (Sinapoyl CoA) 等。脂肪族酰基转移酶则利用不同碳链长度的脂肪酰辅酶A作为酰基供体,如乙酰辅酶A (Acetyl-CoA) 和丙二酰辅酶A (Malonyl-CoA)。在目前已报道的BAHD-ATs中,至少有14个来源于不同物种的酰基转移酶对槲皮素3-O-糖苷显示出催化活性(表 1),包括7个脂肪族的BAHD-ATs和6个芳香族的BAHD-ATs。然而,这些BAHD-ATs中有相当一部分的最适受体底物是花青素,对槲皮素3-O-糖苷仅展现出较低的催化活性。迄今为止,只有Vh3Mat1[11]、Lp3MaT1[11]、OsMaT-2[12]、3′′HCT[17]、4′′HCT[17]以及6′′HCT[17]对异槲皮苷具有极高的识别能力。SCLP-ATs则以1-O-β-葡萄糖酯为酰基供体,在植物体内主要参与了花青素的酰基化修饰。目前尚未发现对黄酮醇糖苷有酰化活性的SCLP-ATs。
表 1 BAHD-ATs催化的槲皮素3-O-糖苷酯的合成Table 1 BAHD-ATs-catalyzed acylation of Q3Gs
| Acyltransferase | Donor | Q3G acceptor | Species | References |
| Aliphatic ATs | ||||
| Vh3MAT1 | Malonyl-CoA | Isoquercitrin | Verbena hybrida | [11] |
| Lp3MAT1 | Malonyl-CoA | Isoquercitrin | Lamium purpureum | [11] |
| OsMaT-2 | Malonyl-CoA | Isoquercitrin | Oryza sativa | [12] |
| Dv3MAT | Malonyl-CoA | Isoquercitrin | Dahlia variabilis | [13] |
| Dm3MaT1 Dm3MaT2 | Malonyl-CoA | Isoquercitrin | Dendranthema×morifolium | [14] |
| NtMaT-1 | Malonyl-CoA | Isoquercitrin | Nicotiana tabacum | [15] |
| Aromatic ATs | ||||
| At3AT1 At3AT2 | p-coumaroyl CoA Feruloyl CoA Caffeoyl CoA Sinapoyl CoA | Isoquercitrin | Arabidopsis thaliana | [16] |
| 3″HCT 4″HCT 6″HCT | p-coumaroyl-CoA | Isoquercitrin Hyperoside Avicularin | Pinus sylvestris | [17] |
| SIFdAT1 | p-coumaroyl-CoA | Isoquercitrin | Antirrhinum majus | [18] |
表选项
1.2 脂肪酶脂肪酶(Lipases) 是有机合成中最常用的水解酶之一[19],广泛存在于植物、动物和微生物中。自然条件下,它们催化油脂中的甘油三酯水解成游离脂肪酸和甘油。但在低水介质中,脂肪酶还能催化酯化、转酯和酯交换等逆向反应[20],而这些逆向功能被广泛用于槲皮素3-O-糖苷的酰化修饰。
广泛用于槲皮素3-O-糖苷酯体外酶促合成的脂肪酶主要包括南极假丝酵母脂肪酶B Candida antarctica lipase B (CAL-B) 和来源于洋葱假单胞菌的脂肪酶(Pseudomonas cepacian lipase,PCL) (表 2)。CAL-B能接受广泛的底物,具有较高的有机溶剂耐受性和热失活性。与大多数脂肪酶相比,CAL-B因缺少覆盖活性位点入口的盖子而不具备界面激活效应,这使得它能够在单相溶媒介质中始终处于高效催化的状态[21]。工业上,为了提高脂肪酶的催化稳定性和重复利用性,CAL-B常被制备成固定化形式的酶制剂。其中,商品化程度最高的固定化CAL-B是Novozymes公司开发的Novozym 435,该酶在槲皮素3-O-糖苷的体外酰化过程中应用广泛。PCL则是另一种广泛用于合成槲皮素3-O-糖苷酯的脂肪酶,日本Amano公司也已将其开发成多种可用于天然产物酰基化的酶制剂。
表 2 脂肪酶介导的芦丁酯和异槲皮苷酯的生物合成Table 2 Lipase-catalyzed biosynthesis of rutin and isoquercitrin esters
| Enzyme | Acyl donor | Operation condition | Acylated site | References |
| Acyl acceptor: Isoquercitrin | ||||
| ??Novozym 435 | Fatty acids: monocarboxylic acids(C4–C16), dicarboxylic acids (C2–C12) | Acetone 45 ℃, 2–24 h | 6″-OH 3″, 6″-OH | [30-31] |
| ??Novozym 435 | Fatty acids (C18–C22) | Acetone 45–50 ℃, 12–24 h | 6″-OH | [32] |
| ??Novozym 435 | Fatty acids (C4–C18) | 2-methyl-2-butanol 65 ℃, 72 h | 6″-OH | [22] |
| ??Novozym 435 | Vinyl acetate (C2) | THF, acetone, dioxane and mixture solvents with pyridine. 45 ℃, 60 h | 3″, 6″-OH | [26] |
| ??CAL-B/PCL | Vinyl acetate (C2), vinyl propionate (C3), vinyl butyrate (C4), vinyl palmitate (C16), palmitic acid (C16) | Acetonitrile, acetone, tert-amyl alcohol 50 ℃, 7 days | PCL: 6″-OH/4′, 6″-OH CAL-B: 6″-OH/3″, 6″-OH/ 2″, 3″, 6″-OH | [29] |
| Acyl acceptor: Rutin | ||||
| ??Novozym 435 | Vinyl acetate (C2) | Isopropanol 60 ℃, 96 h | 4″-OH 4″, 4′′′-OH | [33] |
| ??CAL-B | Fatty acids (C4–C18) | 2-methyl-2-butanol 60 ℃, 168 h | 4′′′-OH | [24] |
| ??Novozym 435 | Unsaturated fatty acid (C18) | Acetone 50 ℃, 96 h | 4′′′-OH | [25] |
| ??CAL-B | Lauric acid (C12) | Acetone 20–55 ℃, 120 h | 4′′′-OH | [34] |
| ??Novozym 435 | Lauric acid (C12), palmitic acid (C16) | Acetone 50 ℃, 96 h | 4′′′-OH | [35] |
| ??Novozym 435 | PUFAs (n-3 polyunsaturated fatty acids, C18–C22) | Acetone 50 ℃, 96 h | 4′′′-OH | [36] |
| ??Novozym435 | α-linolenic acid (C18︰3) | Acetone 55 ℃, 60 h | – | [37] |
| ??Novozym435 | Palmitic methyl ester (C16) | 2-methyl-2-butanol 60 ℃, 80 h | – | [38] |
| ??Novozym 435 ??Lipozyme TLIM ??Lipozyme RMIM | Vinyl laurate (C12) Vinyl stearate (C18) Oleic acid (C18︰1) | Ionic liquids, acetone 50/60 ℃, 96 h | 4″-OH | [39] |
| ??CAL-B | Fatty acids, dicarboxylic acids and ω-substituted fatty acids (C6–C18) | 2-methyl-2-butanol 60 ℃, 150 h | 4′′′-OH | [40-41] |
| ??Novozym 435 | Vinyl acetate (C2) | THF, acetone, dioxane and mixture solvents with pyridine 45 ℃, 45 h | 3′′, 4′′′-OH | [26] |
| ??Novozym 435 | Fatty acids (C8, C10, C12) | solvent-free, acetone, THF, 2-methyl-2-butanol, 45 ℃, 45 h | – | [42-43] |
| ??CAL- | Decanoic acid (C10) | Acetone, tert-butanol 55 ℃, 96 h | 4′′′-O | [44] |
| * THF: tetrahydrofuran. | ||||
表选项
1.2.1 酰基受体脂肪酶对槲皮素3-O-糖苷的酰基化修饰具有位点选择性,其修饰位点与糖基中可修饰羟基的种类(伯、仲) 及其位置密切相关。在伯醇(C6″位) 存在时,由于伯羟基具有高反应活性和可接近性,CAL-B优先攻击该位点。Salem等[22]的结果证实了这个观点;他们发现当以异槲皮苷为底物时,CAL-B优先催化合成6″-O-异槲皮苷衍生物。进一步的研究表明,当没有伯醇时,第二酰化位点则是仲醇(如C3″位)。当底物为芦丁时,由于芦丁二糖基不含伯羟基,CAL-B便作用于其鼠李糖基和葡萄糖基的仲醇C3″-OH[23]和C4′′′-OH[24-25],或同时发生于上述两个位点[26]。
不同的脂肪酶对底物的区域选择性存在差异。CAL-B和PCL对槲皮素3-O-糖苷苷元和糖基上的羟基均具有催化能力[27-28]。PCL对槲皮素的3′, 4′和7-OH具有活性[29],CAL-B也可以酰基化槲皮素苷元,修饰位点分别为槲皮素B环的3′-OH和4′-OH,得到的醋酸酯衍生物的比例约为3︰1[28]。PCL可以乙酰化异槲皮苷的6″-OH,而CAL-B则可以攻击异斛皮苷糖基上的2″-OH,3″-OH和6″-OH。
此外,供受体比例也会对产物的区域选择性产生影响,较高的供受体比例有利于多酰化衍生物的合成。当供体与受体摩尔比为5︰1时,Chebil等[29]合成了异槲皮苷单酯和双酯,产物占比分别为63%和37%。Danieli等[26]在供体与受体摩尔比为10︰1的条件下得到了79%的异槲皮苷-3″, 6″- O-二乙酸酯。继续增大供体与受体的摩尔比至40︰1后,则可以进一步检测到异槲皮苷的C6",C3″,C2″-OH三酰化衍生物[29]。然而,过高的底物浓度也可能对脂肪酶的活性产生干扰。在供体与受体摩尔比为4︰1的条件下,Wang等[37]发现随着芦丁浓度的升高,反应速率加快,但是最终转化率大幅下降。当底物浓度过高时,芦丁出现溶解不完全的现象。在所测定的底物浓度范围(10–60 mmol/L) 内,10 mol/L为最佳的底物浓度。
1.2.2 酰基供体在槲皮素3-O-糖苷酯的制备过程中,酰基供体的性质和浓度等对反应效率产生极大的影响。最常见的酰基供体包括不同链长的饱和或不饱和脂肪酸(Fatty acids),如癸酸(Decanoic acid,C10)、月桂酸(Lauric acid,C12)、棕榈酸(Palmitic acid,C16)、油酸(Oleic acid,C18︰1)、α-亚麻酸(α-linolenic acid,C18︰3) 以及芳香酸。此外,活化的乙烯酯类也可用于槲皮素3-O-糖苷酯的生物合成(表 2),如乙酸乙烯酯(Vinyl acetate,C2)、丙酸乙烯酯(Vinyl propionate,C3)、丁酸乙烯酯(Vinyl butyrate,C4)、月桂酸乙烯酯(Vinyl laurate,C12)、棕榈酸乙烯酯(Vinyl palmitate,C16) 和硬脂酸乙烯酯(Vinyl stearate,C18) 等。在酯交换过程中,乙烯酯是最有效的酰基供体,形成的乙烯醇能够互变异构为低沸点的乙醛,从而使平衡转向酯的形成[45-46] (图 2)。
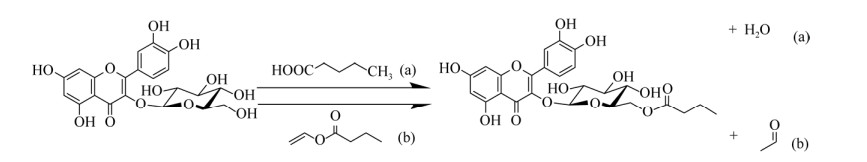 |
| 图 2 脂肪酶介导的异槲皮苷的酶促酰化修饰方法[45-46] Fig. 2 Lipase-mediated acylation of isoquercitrin[45-46]. (a): esterification mediated by fatty acids or aromatic acids; (b): transesterification mediated by vinyl esters. |
| 图选项 |
酰基供体链长往往会对槲皮素3-O-糖苷酯的合成过程产生影响。Viskupicova等[24]研究了脂肪酸链长(C4–C18)对芦丁酯形成的影响。结果表明,短链、中链脂肪酸(C4–C12) 与芦丁的成酯反应效率较高,均大于50%。随着脂肪酸链长的增加(C12–C18),芦丁酯的转化率逐渐降低。Salem等[22]研究了酰基供体碳链长度对异槲皮苷酰化效率的影响。总体上,转化率取决于脂肪酸酰基供体的链长,当酰化产物从丁酸乙酯变为硬脂酸乙酯时,转化效率从66%下降到38%。同样的,Katsoura等[39]也报道了类似的趋势,CAL-B在离子液体中利用游离脂肪酸和乙烯酯合成芦丁酯的过程中,短链酰基供体具有更高的转化率约65%。Ziaullah等[32]以Novozym 435为催化酶,以长链不饱和/饱和脂肪酸(C18–C22)为酰基供体。异槲皮苷酯的产量随着链长的增加而略有下降,可能是过长的脂肪酸链对酶活性位点产生影响所致。然而,Kontogianni等[42]表明,在不同溶剂体系下,脂肪酸(C8、C10、C12) 催化芦丁酯的转化率与酰基供体链的长度没有直接关系。相反,Ardhaoui等[40]的结果表明,对于C6至C12之间的碳链长度,反应效率随脂肪酸链长的增加而增加。当使用长链脂肪酸(C12、C16、C18) 为酰基供体时,碳链长度对转化率和初始速率没有显著影响。因此,酰基供体链长对转化效率的影响往往不能一概而论,其差异性可能是酰基供体与反应介质、酰基受体共同作用的结果。在乙腈和四氢呋喃中,芦丁酯(C8、C10、C12) 的转化率随链长的增加逐渐升高,但当酰基受体为柚皮苷时则呈现相反的趋势。然而当反应溶剂为叔丁醇时,脂肪酸链长为C10的芦丁酯和柚皮苷酯则具有最大转化率[42]。
酰化反应的性能还取决于羧酸的取代模式,当酰基供体的主链结构相同时,CAL-B催化月桂酸和十二烷二酸的转化率和初始速率均显著高于巯基、氨基取代型脂肪酸[40]。此外,当酰基供体为二元羧酸时,酰化效率还严格依赖于碳链长度。较短的二元羧酸往往不被Novozym 435所识别,如草酸(Oxalic acid,C2)、丙二酸(Malonic acid,C3)、琥珀酸(Succinic acid,C4) 和顺丁烯二酸(Maleic acid,C4),但Novozym 435可以利用C5至C12的二元羧酸生成相应的异槲皮苷戊二酸酯、己二酸酯和十二烷二酸酯[30]。当碳链长度从C6增加到C16时,芦丁二元羧酸酯的转化率则从48%增加到87%[40]。此外,CAL-B对戊二酸和己二酸的亲和力显著高于丁二酸和庚二酸[47]。总体上,CAL-B不识别短链二元羧酸(C2–C4)为酰基供体的原因可能是其极性过高,而随着碳链长度的增加,二元羧酸的亲脂性逐渐增大,因此能够和CAL-B的疏水催化腔发生更加紧密地结合。
另一方面,酰基供体与槲皮素3-O-糖苷的摩尔比对酰化反应的效率也有显著影响。过量的酰基供体可能促进酯化反应的正向进行,得到更高的转化率[48]。Ziaullah等[32]测试了不同的酰基供体浓度,当异槲皮苷/酰基供体摩尔比为1︰5时,可在最短的时间内将异槲皮苷完全转化为相应的酯。此外,多数芦丁和异槲皮苷的酰化修饰报道也均是在1︰5的条件下进行的[24-25, 42, 49]。
1.2.3 反应条件CAL-B介导的槲皮素3-O-糖苷的酰基化常采用丙酮(Acetone)、2-甲基-2-丁醇(2-methyl-2- butanol)、二氧六环(Dioxane) 和叔丁醇(tert-butanol) 等为溶剂。这些溶剂毒性较低、极性适中,在提高底物溶解度的同时也可维持CAL-B的催化活性[50],从而更易获得较高的转化率。但四氢呋喃(Tetrahydrofuran,THF) 则可能无法作为CAL-B的有效反应溶剂[42] (表 2)。
尽管在槲皮素3-O-糖苷的酰化反应中使用的介质不尽相同,但为了使反应平衡向酯化方向移动,减少水解反应带来的影响,必须限制反应介质中的含水量。一方面,酯化过程中产生的水可能作为底物促进脂肪酶水解反应的发生,从而降低酯化速率。但另一方面,水分子通过非共价作用直接或间接地维持了酶的催化构象。因此,如何在转化率与酶活性之间找到最合适的含水量平衡点是至关重要的。研究表明,在棕榈酰芦丁酯的合成过程中,当含水量从小于200 mg/L增加到大于400 mg/L时,转化率由最高值76%下降到55%。这一现象的发生可能与反应体系中水活度的剧烈变化有关[40]。Kontogiannia等[43]发现Novozym 435在水活度为0.11的干燥介质中具有最高的转化率。此外,使用P2O5将酶烘干18–20 h或在反应中添加分子筛,均能有效地提高脂肪酶的反应效率[32]。
1.3 蛋白酶蛋白酶根据活性氨基酸的不同被分为多个类型,其中丝氨酸蛋白酶家族的枯草菌素蛋白酶(Subtilisin) 是最早被应用于合成黄酮糖苷酯的工具酶[49, 51]。
Daniel团队[51]研究了Subtilisin对黄酮单糖苷的位点选择性,以三氟丁酸酯作为酰基供体,酰化修饰可发生在异槲皮苷的6′′-OH和3′′-OH。随后,在同样的条件下,他们针对一系列黄酮二糖苷进行了探索,并在吡啶中合成了芦丁的3′′-OH衍生物。将芦丁二糖结构中的鼠李糖基和葡萄糖基的位置进行交换后,即底物为槲皮素-3-O-β-D-葡萄糖基(1→4)-鼠李糖苷时,Subtilisin的作用位点仍为葡萄糖基的3-OH。然而,当槲皮素母核被替换为橙皮素和柚皮素时,且糖苷键以及糖配基种类发生变化时,酰化位点则可能是葡萄糖基的6-OH或阿拉伯糖基的4-OH[49]。Danieli等[52]还利用Subtilisin在异槲皮苷的3′′-OH和羟甲基位置引入丙二酸甲酯残基,得到了异槲皮苷的单取代和双取代混合物。随后在生物碱酯酶的作用下对甲酯基进行选择性水解。通过一系列缩合反应最终得到目标化合物异槲皮苷-6-O′′-(3-芳基丙-2-烯酰) 衍生物。此外,在吡啶溶液中,Subtilisin还能够催化二乙烯二羧酸和芦丁3′′-OH的缩合[53]。
蛋白酶也被广泛地应用在曲克芦丁(Troxerutin) (图 1) 的酰基化修饰中。Xiao等[54]在非水介质中合成了一系列单取代的曲克芦丁酯。以不同链长的二乙烯二羧酸酯(CH2=CH–OOC–(CH2)n–COO–CH=CH2,n=2, 3, 4, 7, 8, 11) 为酰基供体,以枯草芽孢杆菌来源的碱性蛋白酶为催化剂,在曲克芦丁的4′B′乙氧基上进行区域选择性酰化。结果表明,该过程的区域选择性不受酰基供体链长的影响。此外,超声和振动对碱性蛋白酶的位点选择性也均无影响,但超声处理可提高酰化反应速率。且酶的预辐照、超声功率和频率、操作方式等因素对该催化过程产生不同程度的影响。随着酰基供体链长由C13降低到C4,这些外部条件加快反应速率的效应逐渐增强[55]。在此基础上,以曲克芦丁的二乙烯二羧酸酯和非杂环胺(哌嗪、甲基哌嗪、吗啉) 为底物,测试了10种商用酶的酰胺化反应。结果表明酰胺化修饰均发生在乙烯基酯键上,可产生20种含氮杂环的新型曲克芦丁衍生物,其中脂肪酶LS-10催化合成产量最高[56]。以饱和脂肪酸的乙烯酯和不饱和脂肪酸为酰基供体,该团队还探究了酰基供体链长、摩尔比例、含水量以及酶量对合成曲克芦丁酯的影响。当吡啶含水量小于1%、酰基供体与受体的摩尔比为3︰1且碱性蛋白酶用量为30 mg/mL时,转化率可达到最高值58%。随着酰基供体的链长从C6增加到C18时,产率从58%下降到17%[57]。
1.4 酯酶酯酶在槲皮素3-O-糖苷的体外酰基化修饰中的应用相对较少,目前仅有其催化芦丁酯合成的相关报道。来源于纤维素水解真菌里氏木霉Trichoderma reesei的乙酰酯酶可催化芦丁的酰化反应,但仅能识别短链醋酸乙烯酯为酰基供体[59]。
总体上,植物来源的酰基转移酶大多在水相介质中发挥活性,这在重构槲皮素3-O-糖苷酯的体内代谢途径方面具有应用潜力。然而,槲皮素3-O-糖苷分子通常排列紧密,难溶于水、降低了该类化合物在水相中的体外酰化效率。此外,酰基转移酶自身的性质也限制了其在槲皮素3-O-糖苷体外酶促酰化中的应用。首先,酰基转移酶需要昂贵的酰基辅酶A作为供体,不利于槲皮素3-O-糖苷酯的体外规模化制备。其次,植物源的酰基转移酶具有较为严格的供体选择性,限制了多样化槲皮素3-O-糖苷酯的制备。通常情况下脂肪族酰基转移酶更偏好丙二酰辅酶A,而芳香族酰基转移酶大多利用羟基肉桂酰辅酶A作为供体(表 1)。
相比之下,水解酶因其易获得性、经济性、宽泛的区域选择性、良好的溶剂耐受性以及不需要辅助因子等特性,可作为更优的催化剂用于槲皮素3-O-糖苷的体外酰化修饰。迄今为止,已发现3种水解酶可以负责槲皮素3-O-糖苷的酰基化,包括脂肪酶、蛋白酶和酯酶。
尽管蛋白酶、酯酶的折叠方式与脂肪酶存在差异,但它们均具有由Asp/Glu-His-Ser组成的催化三联体结构和相同的催化机制,反应时都遵循双转换机制(Double displacement mechanism)[60]。反应时,催化三联体结构中的丝氨酸残基(Ser) 被组氨酸(His)-天冬氨酸(Asp) 二联体活化,形成亲核原子进攻底物酯键的羰基碳(RCH2COOR′),形成酶-酰基复合物。该复合物中的O–离子与活性中心附近的氧阴离子洞(Oxyanion hole) 残基上的-NH–形成氢键,获得稳定的四面体过渡态(Tetrahedral intermediate 1)。四面体过渡态底物的酯键发生断裂,形成酰基-酶复合物(Acyl-enzyme),同时释放出产物R′-OH。另一个亲核试剂R′′-OH进攻酰基-酶复合物,形成新的四面体中间体(Tetrahedral intermediate 2)。酶从该中间体中解离出来,形成游离酶(Free enzyme),并释放出新的产物RCH2COOR′′ (图 3)。
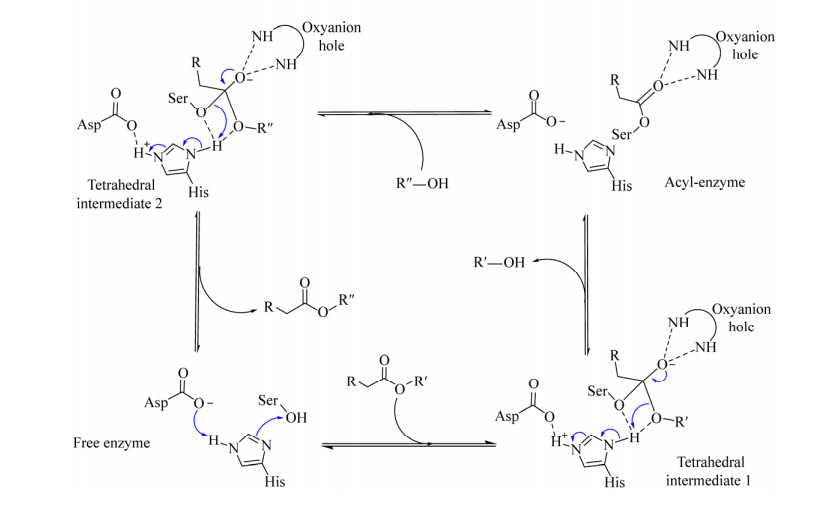 |
| 图 3 脂肪酶和丝氨酸蛋白酶的转酯催化机制 Fig. 3 The catalytic mechanism of transesterification catalyzed by lipases or serine-proteases. |
| 图选项 |
尽管催化机制具有相似性,但这3种酶在位点选择性、酰基供体的识别、有机溶剂耐受性等方面展现出较大的差异(表 2、3)。与脂肪酶相比,丝氨酸蛋白酶的活性位点位于蛋白结构的表面,因此可能比脂肪酶更易接受体积较大的底物[60]。脂肪酶和蛋白酶常具有不同的位点选择性。尽管脂肪酶和Subtilisin均对异槲皮苷的6′′-OH表现出较强的选择性,但脂肪酶更易修饰芦丁的4′′′-OH,而Subtilisin则对芦丁中位于糖链内侧的葡萄糖3′′-OH具有优先识别能力。此外,Subtilisin的具体的酰化位点与底物的结构还存在较大的联系,糖配基的结构及其糖苷键的连接位点的改变均对其位点选择性产生影响。
表 3 蛋白酶和酯酶介导的槲皮素3-O-糖苷酯的合成Table 3 Proteases- and esterases-catalyzed biosynthesis of acylated Q3Gs
| Enzyme | Substrate | Operation condition | Acylated site | References |
| Subtilisin from Bacillus licheniformis | Donor: 2-chloroethyl methyl succinate (C3) Acceptor: isoquercitrin | Anhydrous pyridine 45 ℃, 7 d | 6″-OH: 3″-OH: 3″, 6″-OH (45%: 5%: 5%) | [52] |
| Subtilisin (Carlsberg) from Bacillus licheniformis | Donor: trifluoroethyle butyrate and cinnamate Acceptor: isoquercitrin | Pyridine anhydrous 45 ℃, 48 h | 6″-OH: 3″-OH: 3″, 6″-OH (20%: 13%: 24%) | [51] |
| Subtilisin from Bacillus licheniformis | Donor: trifluoroethyl butanoate (C4) Acceptor: rutin | Anhydrous pyridine 45 ℃, 48 h | 3″-OH | [49] |
| Subtilisin from Bacillus subtilis | Donor: trichloroethyl butyrate (C4) Acceptor: rutin | Pyridine anhydrous 45 ℃, 8 h | 3″-OH | [58] |
| Alkaline protease from Bacillus subtilis | Donor: divinyl dicarboxylate (COOCH=CH2-(CH2)n-COOCH=CH2, n=2, 4, 8) Acceptor: rutin | Pyridine 50 ℃, 4 d | 3″-OH | [53] |
| Alkaline protease from Bacillus subtilis | Donor: divinyl dicarboxylates (CH2=CH–OOC–(CH2)n–COO–CH=CH2, n=2, 3, 4, 7, 8, 11) Acceptor: troxerutin | Pyridine 50 ℃, 80 h | 4′B′ ethoxyl group | [54-55] |
| Alkaline protease from Bacillus subtilis | Donor: fatty acid vinyl esters (C6-C8) Acceptor: troxerutin | Pyridine 50 ℃, 80 h | 4′B′ ethoxyl group | [57] |
| Acetyl esterase of Trichoderma reesei | Donor: vinyl acetate (C2) vinyl propionate (C3) Acceptor: rutin | 2-propanol 40 ℃, 66 h | Rutin monoacetate Rutin monopropionate | [59] |
表选项
酯酶在大规模合成槲皮素3-O-糖苷酯中的应用范围较为受限,其相关报道也较少。一方面,酯酶通常情况下仅能利用短链脂肪酸作为酰基供体,而脂肪酶识别的供体范围较广,并且更偏好于中长链脂肪酸[27]。另一方面,相比之下,脂肪酶具有良好的有机溶剂耐受性,但目前仅有少数的酯酶能够在非水环境中发挥作用。
2 全细胞生物转化尽管脂肪酶等水解酶在槲皮素3-O-糖苷酯的体外酶促合成的研究已较为广泛,但脂肪酶介导的酰化反应往往需要在有机溶剂中进行,易造成环境污染,且不利于和其他水溶性途径酶进行偶联。全细胞生物催化剂可在一定程度上解决上述问题,因此也是获取槲皮素3-O-糖苷酯的一种重要手段。迄今为止,可用于槲皮素3-O-糖苷酯合成的细菌生物催化剂包括斯氏假单胞菌Pseudomonas stutzeri GIM1.273、荧光假单胞菌Pseudomonas fluorescens GIM1.209、铜绿假单胞菌Pseudomonas aeruginosa GIM1.46和枯草芽孢杆菌Bacillus subtilis GIM1.135[61-62],而真菌生物催化剂则包括少孢根霉Rhizopus oligosporus GIM3.515、黑曲霉Aspergillus niger GIM3.25、桔青霉Penicillium citrinum GIM3.100、华根霉Rhizopus chinensis GIM3.440、米赫根毛霉Rhizomucor miehei GIM3.544、米根霉Rhizopus oryzae GIM3.509、米曲霉Aspergillus oryzae GIM3.5232和念珠地丝菌Geotrichum candidum GIM2.21[61] (表 4)。
表 4 全细胞介导的槲皮素3-O-糖苷酯的生物转化Table 4 Whole-cell-mediated biosynthesis of Q3G esters
| Microbial cell | Acyl donor | Product (s) | References |
| P. aeruginosa GIM1.46 | Vinyl propionate (C3) | TME (yield: 81.1%) TDE (yield: 13.0%) Rutin: 4′′′-OH | [61-62] |
| P. stutzeri GIM1.273 | Vinyl propionate (C3) | TME (yield: 30.2%) TDE (yield: 60.0%) | [61-62] |
| P. fluorescens GIM1.209 B. subtilis GIM1.135 R. oligosporus GIM3.515 A. niger GIM3.25 P. citrinum GIM3.100 R. chinensis GIM3.440 R. miehei GIM3.544 R. oryzae GIM3.509 Aspergillus oryzae GIM3.5232 Geotrichum candidum GIM2.21 | Vinyl propionate (C3) | TME and TDE | [61] |
| *TME: troxerutin monoester (4′B′ethoxyl group); TDE: troxerutin diester (4′B′, 8B ethoxyl group). | |||
表选项
溶剂的选择是非水相生物转化法的关键因素,它不仅影响底物的溶解度,还影响整个细胞的催化活性。槲皮素3-O-糖苷具有较高的极性,因此需要极性较强的有机溶剂增大其溶解度。然而,强极性有机溶剂会与蛋白活性中心的结合水相互作用,使蛋白失去活性[63]。此外,有机溶剂的使用也会改变细胞膜的完整性和细胞形态。因此,为了平衡溶剂与细胞活性之间的关系,Xin等[61]采用全细胞生物催化剂在二元溶剂体系中对曲克芦丁、芦丁等活性黄酮化合物进行脂肪酸酰化修饰,通过对15种菌株的酰化活性进行评价,开发了一种同时含有疏水性溶剂和亲水性溶剂的二元溶剂催化体系,可有利于维持脂肪酶的稳定性并提高极性底物的溶解度。以曲克芦丁为反应模型,P. aeruginosa GIM 1.46细胞在非水介质中的酰化活性最高,生成了主产物曲克芦丁单丙酸酯(Troxerutin monoester,TME) 和次产物曲克芦丁双丙酸酯(Troxerutin diester,TDE)。通过调节二元有机溶剂的组成,发现在正庚烷和吡啶二元体系中,细胞表现出更高的催化活性和操作稳定性。在最佳条件下曲克芦丁的转化率可达到94%,单酯收率约为81.1%,该方法的产率明显高于此前报道的化学法或酶促法[57]。
然而,由于微生物具有不同的底物特异性,因此针对不同的合成目标,基于全细胞的生物转化法需要筛选得到具有高催化效率的菌株。为提高曲克芦丁双酯衍生物的转化率,该团队还利用菌株的受体偏好性,成功建立了可控的全细胞高效合成方法,在P. stutzeri GIM 1.273细胞的催化下,曲克芦丁双酯衍生物作为酰基化的主产物,其产率被提升至60%[62]。
总体上,能对槲皮素3-O-糖苷进行酰基化修饰的全细胞生物催化剂来源广泛,包括细菌和真菌。全细胞生物转化以微生物作为反应器,可实现酶的重复利用,催化级联反应,还可简化体外酶促催化过程中固定化酶的分离纯化步骤[64],为工业化生产槲皮素3-O-糖苷酯提供便捷、经济的途径。此外,全细胞生物转化过程中细胞膜为酶提供了天然的保护屏障,可阻止酶蛋白在非水溶剂中的构象变化[65]。通过调节有机溶剂的组成,还可进一步改善全细胞催化剂的催化活性和操作稳定性。此外,微生物的受体偏好性还将为多位点酰基化衍生物的合成提供新途径。
3 酰基化修饰对槲皮素3-O-糖苷活性的影响亲脂分子的引入可以显著改善槲皮素3-O-糖苷的理化性质。例如,在异槲皮苷的6′′-OH中引入酰基,可提高其热稳定性和耐光性。其中,对香豆酰异槲皮苷在所合成的芳香酰衍生物中最为稳定[66]。此外,选择性酰化也可以影响槲皮素3-O-糖苷的生物学效应(表 5)。
表 5 酰基化对槲皮素3-O-糖苷的生物活性的影响Table 5 Effects of acylation on the biological activities of Q3Gs
| Acyl donor | Biological property | References |
| Q3G: isoquercitrin | ||
| ??Ethyl butyrate, caproate, caprylate, decanoate, laurate, palmitate, stearate, oleate | ↑ Inhibition of xanthine oxidase ↑ Anticancer ↑ Antioxidant (ABTS radical) ↓ Antioxidant (DPPH and superoxide radicals) | [22] |
| ??Stearic acid, oleic acid, linoleic acid, linolenic acid, eicosapentaenoic acid and decosahexaenoic acid | ↑ Antioxidant (fish oil and LDL oxidation) | [76] |
| ??Oleic, stearic, linoleic, linolenic, eicosapentaenoic and docosahexaenoic acids | ↑ Inhibition of tyrosinase ↓ Antioxidant (DPPH radical, FRAP and ORAC assays) | [32] |
| ??Linolenic, eicosapentaenoic and docosahexaenoic acids | ↑ Anticancer ↑ Antioxidant (lipid hydroperoxides) ↑ Anti-inflammatory | [77] |
| ??Stearic, oleic, linoleic, linolenic, eicosapentaenoic and docosahexaenoic acids | ↑ Anticancer | [78] |
| ??Eicosapentaenoic acid | ↑ Anti-inflammatory | [79] |
| Q3G: rutin | ||
| ??Lauric and palmitic acids | ↑ Antioxidant (LDL-oxidation) ↓ Antioxidant (DPPH radical, Fe3+ reducing power and iron chelating) | [68] |
| ??Vinyl acetate | ↑ Antioxidant (ORAC method) ↓ Cytotoxicity | [33] |
| ??Capric acid, caprylic acid, caproic acid, lauric acid, palmitic, linoleic acid and trifluoroacetic acid, butyric acid, myristic acid stearic acid | ↑ Antioxidant (DPPH radical, β-carotene linoleate) | [24] |
| ??Oleic, linolenic and linoleic acids, ethyl linoleate | ↑ Antiangiogenic ↑ Anticancer | [25] |
| ??Palmitic, oleic, linoleic, linolenic, arachidonic, erucic | ↑ Antioxidant ↑ Inhibition of sarco/endoplasmic reticulum Ca2+-ATPase | [73] |
| ??Butyric, capric, caprylic, decanoic, lauric, myristic, palmitic, stearic, oleic, linoleic, linolenic, arachidonic and erucic acids | ↑ Inhibition of serine proteases trypsin, thrombin, elastase and urokinase | [80] |
| Q3G: troxerutin | ||
| ??Vinyl propionate | ↑ Antioxidant (erythrocyte hemolysis) ↓ Antioxidant (DPPH, ABTS, and ORAC assays) | [62] |
| ??Fatty acid vinyl esters | ↓ Antioxidant (DPPH free radical scavenging and potassium ferricyanide reduction methods) | [57] |
| *DPPH: 2, 2-diphenyl-l-picrylhydrazyl; LDL: low-density lipoprotein; FRAP: ferric reducing antioxidant power; ORAC: oxygen radical absorbance capacity; ABTS: 2, 2-azino-bis-3-ethylbenzothiazoline-6-sulphonic; Acid↑: increased activity; ↓: decreased activity. | ||
表选项
3.1 对抗氧化活性的影响亲脂程度将影响槲皮素3-O-糖苷到达自由基攻击部位的能力,从而调节其与蛋白质、酶和特定细胞的相互作用关系,进而影响槲皮素3-O-糖苷的抗氧化活性。研究表明,脂肪酸酰化能够增加芦丁亲脂性和生物利用度,使其更易接近氧化损伤活性部位,从而更加有效地抑制生物体中的脂质氧化过程[67]。
酰基化槲皮素3-O-糖苷的抗氧化活性通常取决于酰基链的长度。在链长为C4到C18的芦丁酯衍生物中,芦丁棕榈酸酯、芦丁硬脂酸酯和芦丁亚麻酸酯对脂质过氧化的抑制作用最强,其抑制作用与二羟色胺相当[24]。多个研究团队也报道,芦丁的中、长链脂肪酸衍生物比芦丁或短链脂肪酸衍生物更能有效地防止脂质过氧化[24-25, 68-69]。异槲皮苷酯的抗氧化活性也表现出相同的趋势[22]。但曲克芦丁的酰化修饰则可能降低其抗氧化活性,且随着脂肪酸链长的增加,其抗氧化活性呈下降趋势[57]。曲克芦丁及其酯类抗氧化活性的差异可能与其自由基清除能力以及在细胞膜表面的分布情况有关。在水相反应体系中,曲克芦丁酯的亲脂性末端更容易发生聚集,降低了分布均匀性,从而导致其抗自由基活性降低[62]。对于相同链长的曲克芦丁酯,酰基供体的饱和程度也可能会影响其抗氧化能力[68, 70]。
除了酰基链的长度,槲皮素3-O-糖苷酯的抗氧化活性也与脂肪酸的性质存在一定的关系。Vavríková等[30]制备了一系列异槲皮苷单羧酸酯和双羧酸酯,与异槲皮苷相比,大多数异槲皮苷衍生物均可更好地抑制微粒体脂质的过氧化,其中丁酸酯和己酸酯的活性最高。除乙酸酯外,其他单羧酸衍生物的抗脂过氧化物活性随脂肪链的增加而降低,但异槲皮苷的二元羧酸酯则呈现相反的趋势。
对于芳香酰衍生物,其抗氧化活性可能受到芳环部分在水-脂相界面的空间排布的影响[71]。与上述异槲皮苷酯相比[30],含芳环的衍生物具有相似的DPPH自由基清除能力,但福林酚试剂(Folin-ciocalteau reagent,FCR) 的还原能力较弱。另一方面,部分芳香酯衍生物的ABTS清除能力显著提高[31]。
酰基化槲皮素3-O-糖苷的抗氧化活性不仅取决于亲脂程度还与反应环境有紧密联系。对于不同的抗氧化模型,反应介质对待测化合物的溶解度、分布、排列等方面均产生影响,因此,不同的测定方法中其活性结果也可能存在差异。在相同浓度下,高极性的抗氧化剂易溶解在水相中,均匀地分布使其能够与自由基更充分接触,从而有效地发挥抗氧化活性。在DPPH实验中,芦丁酯的活性优于香草酯,而在亲脂性介质中,香草酯的活性则优于芦丁酯[36]。
3.2 对肌浆/内质网Ca2+-ATP酶抑制活性的影响研究表明,亲脂性黄酮衍生物对肌浆网和细胞膜Ca2+-ATP酶等转运酶具有很强的抑制作用[72]。芦丁的选择性脂化可以增加其与膜蛋白肌浆/内质网Ca2+-ATP酶1 (Skeletal muscle sarco/ endoplasmic reticulum Ca2+-ATPase,isoform 1,SERCA1) 的亲和力,从而调节SERCA1的活性。与芦丁相比,经脂肪酸(C16–C22) 酰化后的芦丁衍生物可引起SERCA1蛋白发生浓度依赖型的活性下降,使酶的跨膜区域发生显著的构象改变。此外,研究还发现芦丁衍生物经过氧亚硝酸盐处理后,具有拟合作用,即在低浓度时酶抑制活性下降,在高浓度时则可进一步抑制酶活性[73]。
3.3 对酪氨酸酶抑制活性的影响酪氨酸酶参与了植物组织的酶促褐变、昆虫角质层的形成以及人类黑色素的形成[74]。因此,酪氨酸酶与皮肤疾病息息相关,如色素沉着、黑色素瘤等[75]。目前为止,黄酮类化合物已被鉴定为酪氨酸酶的天然抑制剂。Ziaullah等[32]以L-3, 4-二羟基苯丙氨酸(L-DOPA) 为底物,合成了6种异槲皮苷的长链饱和脂肪酸酯、单不饱和脂肪酸酯和多不饱和脂肪酸酯。其中异槲皮苷的α-亚麻酸酯抑制活性最强,其次分别是亚油酸酯、硬脂酸酯和油酸酯。从构效关系可以看出,异槲皮苷酯(C8–C14)的酪氨酸酶抑制效果随着双键或链长的增加先增大,然后增大到最大值(C12),再减小(C13和C14)。尽管双键是芦丁酯酪氨酸酶抑制活性的关键,但当酰基链长超过一定的范围后,则可能阻碍分子进入酶的催化中心。
3.4 对蛋白酶抑制活性的影响多酚类化合物还对多种生物酶具有潜在的抑制活性,包括丝氨酸蛋白酶、胰蛋白酶、凝血酶、弹性酶和尿激酶等。酰基化可能是提高多酚类化合物丝氨酸蛋白酶抑制活性的新途径。在芦丁骨架上引入的酰基可能与丝氨酸酶的疏水区发生相互作用,从而抑制酶的活性。Viskupicova等[80]研究表明芦丁及其不饱和脂肪酸酯均在微摩尔范围内表现出较强的蛋白酶抑制作用,其中、长链脂肪酸衍生物的效果较短链脂肪酸衍生物稍差。
3.5 对抗增殖和细胞保护活性的影响黄酮类化合物也对癌细胞展现出细胞毒性[81-82]。在肿瘤生长的晚期,该类化合物可以通过抑制DNA合成和血管生成,从而诱导肿瘤细胞凋亡[83]。Salem等[22]观察到,与异槲皮苷相比,异槲皮苷酯(C8–C16)对Caco-2癌细胞表现出剂量依赖型的抗增殖活性;他们认为,化合物在生物系统中的活性不仅取决于亲脂性还取决于化学结构,这将显著影响化合物与膜受体之间的亲和力。此外,Mellou等[25]还研究了芦丁脂肪酸酯的对人K562淋巴母瘤细胞的血管生成活性,结果显示芦丁酯显著降低了血管内皮生长因子(Vascular endothelial growth factor,VEGF) 的分泌量。但单独使用芦丁或不饱和脂肪酸孵育细胞时,VEGF的释放未发生显著变化[84]。
4 总结与展望槲皮素3-O-糖苷是自然界中常见的活性分子,具有复杂的分子结构。选择性酶促酰化是改善这类化合物理化性质、药理活性、药代动力学等性质的有效手段之一。最初的研究主要以蛋白酶、酯酶和酰基转移酶为生物催化剂制备黄酮糖苷酯。在不断地探索中,固定化脂肪酶逐渐被认为是酰化过程中最有力的工具酶,尤其是来源于南极假丝酵母的脂肪酶CAL-B。然而,酶法合成槲皮素3-O-糖苷酯的反应性能受到多个因素的影响,包括酶的性质、反应介质、底物结构,反应条件等。因此,为了高效地合成目标化合物,需要综合考虑上述因素。除了体外酶促酰化法,全细胞生物转化法也被应用于槲皮素3-O-糖苷酯的合成,这种方法可以大幅降低制备成本。且微生物细胞是天然的绿色催化剂,这对酰基化槲皮素3-O-糖苷类产品在食品、医药和化妆品等领域的可持续生产具有极大的优势。
尽管目前针对槲皮素3-O-糖苷的酰基化已经被广泛研究,但在高效催化方面仍存在待解决的问题。目前,已报道超声辅助、微波辅助、熔融技术、微流控技术等[85-88]均可显著促进酰化反应的正向进行并极大地缩短反应时间。此外,酶法催化的反应介质也是近些年来的一大研究热点,传统的有机介质在一定程度上会降低酶的活性与稳定性,而有机溶剂的污染性也往往给商业化大规模生产带来影响。从无溶剂体系[89]到离子液体[39, 90]的应用,体外酶促合成的反应性能正在逐步被优化。这些技术将为槲皮素3-O-糖苷酯的高效合成提供便捷途径。
尽管,目前关于槲皮素3-O-糖苷酯的研究已经较为深入,但其酰化修饰位点仍然有限。总体上,目前普遍认为PCL是可催化槲皮素苷元的有效工具酶,而Subtilisin和CAL-B则主要识别槲皮素3-O-糖苷中糖基上的羟基。随着计算机模拟技术对酶蛋白和底物之间催化机制的深入探索,定向进化将成为改变生物酶位点选择性的便捷途径。相信在不久的将来,组合催化技术的结合将进一步加强酶在药物发现领域的作用。
参考文献
| [1] | Shibano M, Kakutani K, Taniguchi M, et al. Antioxidant constituents in the dayflower (Commelina communis L.) and their α-glucosidase- inhibitory activity. J Nat Med, 2008, 62(3): 349-353. DOI:10.1007/s11418-008-0244-1 |
| [2] | Regasini LO, Vellosa JC, Silva DH, et al. Flavonols from Pterogyne nitens and their evaluation as myeloperoxidase inhibitors. Phytochem, 2008, 69(8): 1739-1744. DOI:10.1016/j.phytochem.2008.01.006 |
| [3] | Masuoka N, Isobe T, Kubo I. Antioxidants from Rabdosia japonica. Phytother Res, 2006, 20(3): 206-213. DOI:10.1002/ptr.1835 |
| [4] | Orfali Gd, Duarte AC, Bonadio V, et al. Review of anticancer mechanisms of isoquercitin. J Clin Oncol, 2016, 9(2): 189-199. |
| [5] | Rha CS, Jeong HW, Park S, et al. Antioxidative, anti-inflammatory, and anticancer effects of purified flavonol glycosides and aglycones in green tea. Antioxid, 2019, 8(8): 278-293. DOI:10.3390/antiox8080278 |
| [6] | Vinayagam R, Xu B. Antidiabetic properties of dietary flavonoids: a cellular mechanism review. Nutr Metab, 2015, 12(1): 60-80. DOI:10.1186/s12986-015-0057-7 |
| [7] | Makino T, Kanemaru M, Okuyama S, et al. Anti-allergic effects of enzymatically modified isoquercitrin (α-oligoglucosyl quercetin 3-O-glucoside), quercetin 3-O-glucoside, α-oligoglucosyl rutin, and quercetin, when administered orally to mice. J Nat Med, 2013, 67(4): 881-886. DOI:10.1007/s11418-013-0760-5 |
| [8] | Wong G, He S, Siragam V, et al. Antiviral activity of quercetin-3-β-O-D-glucoside against Zika virus infection. Virol Sin, 2017, 32(6): 545-547. DOI:10.1007/s12250-017-4057-9 |
| [9] | Cazarolli LH, Zanatta L, Alberton EH, et al. Flavonoids: prospective drug candidates. Mini-Rev Med Chem, 2008, 8(13): 1429-1440. DOI:10.2174/138955708786369564 |
| [10] | Bontpart T, Cheynier V, Ageorges A, et al. BAHD or SCPL acyltransferase? what a dilemma for acylation in the world of plant phenolic compounds. New Phytol, 2015, 208(3): 695-707. DOI:10.1111/nph.13498 |
| [11] | Suzuki H, Nakayamaa T, Nagaeb S, et al. cDNA cloning and functional characterization of flavonol 3-O-glucoside-6″-O-malonyltransferases from flowers of Verbena hybrida and Lamium purpureum. J Mol Catal B: Enzym, 2004, 28: 87-93. DOI:10.1016/j.molcatb.2004.01.005 |
| [12] | Kim DH, Kim SK, Kim JH, et al. Molecular characterization of flavonoid malonyltransferase from Oryza sativa. Plant Physiol Biochem, 2009, 47: 991-997. DOI:10.1016/j.plaphy.2009.08.004 |
| [13] | Suzuki H, Nakayama T, Yonekura-Sakakibara K, et al. cDNA cloning, heterologous expressions, and functional characterization of malonyl-coenzyme A: anthocyanidin 3-O-glucoside-6″-O-malonyltransferase from dahlia flowers. Plant Physiol, 2002, 130(4): 2142-2151. DOI:10.1104/pp.010447 |
| [14] | Suzuki H, Nakayama T, Yamaguchi M, et al. cDNA cloning and characterization of two Dendranthema×morifolium anthocyanin malonyltransferases with different functional activities. Plant Sci, 2004, 166(1): 89-96. DOI:10.1016/j.plantsci.2003.08.010 |
| [15] | Taguchi G, Shitchi Y, Shirasawa S, et al. Molecular cloning, characterization, and downregulation of an acyltransferase that catalyzes the malonylation of flavonoid and naphthol glucosides in tobacco cells. Plant J, 2005, 42(4): 481-491. DOI:10.1111/j.1365-313X.2005.02387.x |
| [16] | Luo J, Nishiyama Y, Fuell C, et al. Convergent evolution in the BAHD family of acyl transferases: identification and characterization of anthocyanin acyl transferases from Arabidopsis thaliana. Plant J, 2007, 50(4): 678-695. DOI:10.1111/j.1365-313X.2007.03079.x |
| [17] | Kaffarnik F, Heller W, Hertkorn N, et al. Flavonol 3-O-glycoside hydroxycinnamoyltransferases from Scots pine (Pinus sylvestris L.). FEBS J, 2005, 272(6): 1415-1424. DOI:10.1111/j.1742-4658.2005.04574.x |
| [18] | Tohge T, Zhang Y, Peterek S, et al. Ectopic expression of snapdragon transcription factors facilitates the identification of genes encoding enzymes of anthocyanin decoration in tomato. Plant J, 2015, 83(4): 686-704. DOI:10.1111/tpj.12920 |
| [19] | Schmid RD, Verger R. Lipases: interfacial enzymes with attractive applications. Angew Chem Int Ed, 1998, 37(12): 1608-1633. DOI:10.1002/(SICI)1521-3773(19980703)37:12<1608::AID-ANIE1608>3.0.CO;2-V |
| [20] | Kapoor M, Gupta MN. Lipase promiscuity and its biochemical applications. Process Biochem, 2012, 47(4): 555-569. DOI:10.1016/j.procbio.2012.01.011 |
| [21] | Hidalgo A and Bornscheuer UT. Directed evolution of lipases and esterases for organic synthesis. 1st ed. New York: Taylor and Francis Press, 2006: 159-175. |
| [22] | Salem JH, Humeau C, Chevalot I, et al. Effect of acyl donor chain length on isoquercitrin acylation and biological activities of corresponding esters. Process Biochem, 2010, 45(3): 382-389. DOI:10.1016/j.procbio.2009.10.012 |
| [23] | Ishihara K, Nishimura Y, Kubo T, et al. Enzyme-catalyzed acylation of plant polyphenols for interpretation of their functions. Plant Biotechnol, 2002, 19(3): 211-214. DOI:10.5511/plantbiotechnology.19.211 |
| [24] | Viskupicova J, Danihelova M, Ondrejovic M, et al. Lipophilic rutin derivatives for antioxidant protection of oil-based foods. Food Chem, 2010, 123(1): 45-50. DOI:10.1016/j.foodchem.2010.03.125 |
| [25] | Mellou F, Loutrari H, Stamatis H, et al. Enzymatic esterification of flavonoids with unsaturated fatty acids: effect of the novel esters on vascular endothelial growth factor release from K562 cells. Process Biochem, 2006, 41(9): 2029-2034. DOI:10.1016/j.procbio.2006.05.002 |
| [26] | Danieli B, Luisetti M, Sampognaro G, et al. Regioselective acylation of polyhydroxylated natural compounds catalyzed by Canada Antarctica lipase B (Novozym 435) in organic solvents. J Mol Catal B: Enzym, 1997, 3: 193-201. DOI:10.1016/S1381-1177(96)00055-0 |
| [27] | Viskupicova J, Sturdík E, Ondrejovic M. Enzymatic transformation of flavonoids. Acta Chim Slovaca, 2009, 2(1): 88-106. |
| [28] | Kyriakou E, Primikyri A, Charisiadis P, et al. Unexpected enzyme-catalyzed regioselective acylation of flavonoid aglycones and rapid product screening. Org Biomol Chem, 2012, 10(9): 1739-1742. DOI:10.1039/c2ob06784f |
| [29] | Chebil L, Anthoni J, Humeau C, et al. Enzymatic acylation of flavonoids: effect of the nature of the substrate, origin of lipase, and operating conditions on conversion yield and regioselectivity. J Agric Food Chem, 2007, 55(23): 9496-9502. DOI:10.1021/jf071943j |
| [30] | Vavrikova E, Langschwager F, Jezova KL, et al. Isoquercitrin esters with mono- or dicarboxylic acids: enzymatic preparation and properties. Int J Mol Sci, 2016, 17(6): 899-911. DOI:10.3390/ijms17060899 |
| [31] | Hermankova VE, Krenkova A, Petraskova L, et al. Synthesis and antiradical activity of isoquercitrin esters with aromatic acids and their homologues. Int J Mol Sci, 2017, 18(5): 1074-1088. DOI:10.3390/ijms18051074 |
| [32] | Bhullar KS, Warnakulasuriya SN, Rupasinghe HPV, et al. Biocatalytic synthesis, structural elucidation, antioxidant capacity and tyrosinase inhibition activity of long chain fatty acid acylated derivatives of phloridzin and isoquercitrin. Bioorg Med Chem, 2013, 21(3): 684-692. DOI:10.1016/j.bmc.2012.11.034 |
| [33] | Mecenas AS, Adao Malafaia CR, Sangenito LS, et al. Rutin derivatives obtained by transesterification reactions catalyzed by Novozym 435: antioxidant properties and absence of toxicity in mammalian cells. PLoS ONE, 2018, 13(9): 1-19. |
| [34] | Razak NN, Annuar MS. Enzymatic synthesis of flavonoid ester: elucidation of its kinetic mechanism and equilibrium thermodynamic behavior. Ind Eng Chem Res, 2015, 54(21): 5604-5612. DOI:10.1021/acs.iecr.5b00996 |
| [35] | Lue B, Guo Z, Glasius M, et al. Scalable preparation of high purity rutin fatty acid esters. J Am Oil Chem Soc, 2009, 87(1): 55-61. |
| [36] | Mbatia B, Kaki SS, Mattiasson B, et al. Enzymatic synthesis of lipophilic rutin and vanillyl esters from fish byproducts. J Agric Food Chem, 2011, 59(13): 7021-7027. DOI:10.1021/jf200867r |
| [37] | 王炼, 郑明明, 黄清, 等. α-亚麻酸芦丁酯的酶法合成工艺研究. 中国油料作物学报, 2013, 35(6): 717-722. Wang L, Zheng MM, Huang Q, et al. Biocatalysis synthesis of rutin esters of α-linolenic acid. Chin J Oil Crop Sci, 2013, 35(6): 717-722 (in Chinese). |
| [38] | Passicos E, Santarelli X, Coulon D. Regioselective acylation of flavonoids catalyzed by immobilized Candida antarctica lipase under reduced pressure. Biotechnol Lett, 2004, 26(13): 1073-1076. DOI:10.1023/B:BILE.0000032967.23282.15 |
| [39] | Katsoura MH, Polydera AC, Tsironis L, et al. Use of ionic liquids as media for the biocatalytic preparation of flavonoid derivatives with antioxidant potency. J Biotechnol, 2006, 123(4): 491-503. DOI:10.1016/j.jbiotec.2005.12.022 |
| [40] | Ardhaoui M, Falcimaigne A, Ognier S, et al. Effect of acyl donor chain length and substitutions pattern on the enzymatic acylation of flavonoids. J Biotechnol, 2004, 110(3): 265-271. DOI:10.1016/j.jbiotec.2004.03.003 |
| [41] | Ardhaoui M, Falcimaigne A, Engasser JM, et al. Acylation of natural flavonoids using lipase of candida antarctica as biocatalyst. J Mol Catal B: Enzym, 2004, 29: 63-67. DOI:10.1016/j.molcatb.2004.02.013 |
| [42] | Kontogianni A, Skouridou V, Sereti V, et al. Lipase-catalyzed esterification of rutin and naringin with fatty acids of medium carbon chain. J Mol Catal B: Enzym, 2003, 21: 59-62. DOI:10.1016/S1381-1177(02)00139-X |
| [43] | Kontogiannia A, Skouridoua V, Seretia V, et al. Regioselective acylation of flavonoids catalyzed by lipase in low toxicity media. Eur J Lipid Sci Technol, 2001, 103(10): 655-660. DOI:10.1002/1438-9312(200110)103:10<655::AID-EJLT655>3.0.CO;2-X |
| [44] | Vaisali C, Belur PD, Regupathi I. Lipase mediated synthesis of rutin fatty ester: study of its process parameters and solvent polarity. Food Chem, 2017, 232: 278-285. DOI:10.1016/j.foodchem.2017.03.168 |
| [45] | Chebil L, Humeau C, Falcimaigne A, et al. Enzymatic acylation of flavonoids. Process Biochem, 2006, 41(11): 2237-2251. DOI:10.1016/j.procbio.2006.05.027 |
| [46] | Degueil CM, Jeso B, Drouillard S. Enzymatic reactions in organic synthesis: 2-ester interchange of vinyl esters. Tetrahedron Lett, 1987, 28(9): 953-954. DOI:10.1016/S0040-4039(00)95884-2 |
| [47] | McCabe RW, Taylor A. An investigation of the acyl-binding site of Candida antarctica lipase B. Enzyme Microb Technol, 2004, 35(5): 393-398. DOI:10.1016/j.enzmictec.2004.04.019 |
| [48] | Patti A, Piattelli M, Nicolosi G. Use of Mucor miehei lipase in the preparation of long chain 3-O-acylcatechins. J Mol Catal B: Enzym, 2000, 10: 577-582. DOI:10.1016/S1381-1177(00)00140-5 |
| [49] | Danieli B, Bellis P, Carrea G, et al. Enzyme-mediated regioselective acylations of flavonoid disaccharide monoglycosides. Helv Chim Acta, 1990, 73(7): 1837-1844. DOI:10.1002/hlca.19900730705 |
| [50] | Viskupicova J, Ondrejovic M, Maliar T. Enzyme-mediated preparation of flavonoid esters and their applications. Biochem, 2012, 10: 263-278. |
| [51] | Danieli B, Bellis P, Carrea G, et al. Enzyme-mediated acylation of flavonoid monoglycosides. Heterocycles, 1989, 29(11): 2061-2064. DOI:10.3987/COM-89-5120 |
| [52] | Danieli B, Bertario A, Carrea G, et al. Chemo-enzymatic synthesis of 6″-O-(3-arylprop-2- enoyl) derivatives of the flavonol glucoside isoquercitrin. Helv Chim Acta, 1993, 76(8): 2981-2991. DOI:10.1002/hlca.19930760823 |
| [53] | Xiao YM, Wu Q, Wu WB, et al. Controllable regioselective acylation of rutin catalyzed by enzymes in non-aqueous solvents. Biotechnol Lett, 2005, 27(20): 1591-1595. DOI:10.1007/s10529-005-2513-3 |
| [54] | Xiao YM, Mao P, Zhao Z, et al. Regioselective enzymatic acylation of troxerutin in nonaqueous medium. Chin Chem Lett, 2010, 21(1): 59-62. DOI:10.1016/j.cclet.2009.08.017 |
| [55] | Xiao Y, Yang L, Mao P, et al. Ultrasound-promoted enzymatic synthesis of troxerutin esters in nonaqueous solvents. Ultrason Sonochem, 2011, 18(1): 303-309. DOI:10.1016/j.ultsonch.2010.06.010 |
| [56] | Xiao YM, Zhu XL, Yang LR, et al. Enzymatic synthesis of novel N-heterocycle-containing troxerutin derivatives. J Mol Catal B: Enzym, 2013, 97: 297-302. DOI:10.1016/j.molcatb.2013.09.005 |
| [57] | Xiao YM, Li M, Mao P, et al. Enzymatic synthesis, antioxidant ability and oil-water distribution coefficient of troxerutin fatty acid esters. Grain & Oil Sci Technol, 2019, 2(3): 78-84. |
| [58] | Kodelia G, Athanasiou K, Kolisis FN. Enzymatic synthesis of butyryl-rutin ester in organic solvents and its cytogenetic effects in mammalian cells in culture. Appl Biochem Biotechnol, 1994, 44(3): 205-212. DOI:10.1007/BF02779657 |
| [59] | Biely P, Cziszarova M, Wong KK, et al. Enzymatic acylation of flavonoid glycosides by a carbohydrate esterase of family 16. Biotechnol Lett, 2014, 36(11): 2249-2255. DOI:10.1007/s10529-014-1599-x |
| [60] | Cha HJ, Park JB, Park S. Esterification of secondary alcohols and multi-hydroxyl compounds by Candida antarctica lipase B and subtilisin. Biotechnol Bioprocess Eng, 2019, 24(1): 41-47. DOI:10.1007/s12257-018-0379-1 |
| [61] | Xin X, Li XF, Xiao XL, et al. Facile and efficient acylation of bioflavonoids using whole-cell biocatalysts in organic solvents. ACS Sustain Chem Eng, 2017, 5(11): 10662-10672. DOI:10.1021/acssuschemeng.7b02628 |
| [62] | Xin X, Zhang M, Li X, et al. Biocatalytic synthesis of acylated derivatives of troxerutin: their bioavailability and antioxidant properties in vitro. Microb Cell Fact, 2018, 17(1): 130-141. DOI:10.1186/s12934-018-0976-x |
| [63] | Duarte SH, Hernandez GL, Canet A, et al. Enzymatic biodiesel synthesis from yeast oil using immobilized recombinant Rhizopus oryzae lipase. Bioresour Technol, 2015, 183: 175-180. DOI:10.1016/j.biortech.2015.01.133 |
| [64] | Xu P, Xu Y, Li XF, et al. Enhancing asymmetric reduction of 3-chloropropiophenone with immobilized Acetobacter sp. CCTCC M209061 cells by using deep eutectic solvents as cosolvents. ACS Sustain Chem Eng, 2015, 3(4): 718-724. DOI:10.1021/acssuschemeng.5b00025 |
| [65] | Li XF, Zhu Z, Zhao GL, et al. A novel biocatalytic approach to acetylation of 1-β-D- arabinofuranosylcytosine by Aspergillus oryzae whole cell in organic solvents. Appl Microbiol Biotechnol, 2012, 93(1): 143-150. DOI:10.1007/s00253-011-3444-7 |
| [66] | Ishihara K, Nakajima N. Structural aspects of acylated plant pigments: stabilization of flavonoid glucosides and interpretation of their functions. J Mol Catal B: Enzym, 2003, 23(2/6): 411-417. |
| [67] | Maliar JV. Rutin fatty acid esters: from synthesis to biological health effects and application. J Food Nutr Res, 2017, 56(3): 232-243. |
| [68] | Lue B, Nielsen NS, Jacobsen C, et al. Antioxidant properties of modified rutin esters by DPPH, reducing power, iron chelation and human low density lipoprotein assays. Food Chem, 2010, 123(2): 221-230. DOI:10.1016/j.foodchem.2010.04.009 |
| [69] | S?rensen AM, Petersen LK, de Diego S, et al. The antioxidative effect of lipophilized rutin and dihydrocaffeic acid in fish oil enriched milk. Eur J Lipid Sci Technol, 2012, 114(4): 434-445. DOI:10.1002/ejlt.201100354 |
| [70] | Araujo ME, Franco YE, Messias MC, et al. Biocatalytic synthesis of flavonoid esters by lipases and their biological benefits. Planta Med, 2017, 83: 7-22. |
| [71] | Pyszkova M, Biler M, Biedermann D, et al. Flavonolignan 2, 3-dehydroderivatives: preparation, antiradical and cytoprotective activity. Free Radic Biol Med, 2016, 90: 114-125. DOI:10.1016/j.freeradbiomed.2015.11.014 |
| [72] | Augustyniak A, Bartosz G, Cipak A, et al. Natural and synthetic antioxidants: an updated overview. Free Radic Res, 2010, 44(10): 1216-1262. DOI:10.3109/10715762.2010.508495 |
| [73] | Viskupicova J, Majekova M, Horakova L. Inhibition of the sarco/endoplasmic reticulum Ca2+-ATPase (SERCA1) by rutin derivatives. J Muscle Res Cell Motil, 2015, 36(2): 183-194. DOI:10.1007/s10974-014-9402-0 |
| [74] | Si YX, Yin SJ, Park D, et al. Tyrosinase inhibition by isophthalic acid: kinetics and computational simulation. Int J Biol Macromol, 2011, 48(4): 700-704. DOI:10.1016/j.ijbiomac.2011.02.015 |
| [75] | Khan MT. Novel tyrosinase inhibitors from natural resources-their computational studies. Curr Med Chem, 2012, 19(14): 2262-2272. DOI:10.2174/092986712800229041 |
| [76] | Warnakulasuriya SN, Ziaullah, Rupasinghe HP. Long chain fatty acid acylated derivatives of quercetin-3-O-glucoside as antioxidants to prevent lipid oxidation. Biomolecules, 2014, 4(4): 980-993. DOI:10.3390/biom4040980 |
| [77] | Warnakulasuriya SN, Ziaullah, Rupasinghe HP. Long chain fatty acid esters of quercetin-3- O-glucoside attenuate H2O2-induced acute cytotoxicity in human lung fibroblasts and primary hepatocytes. Molecules, 2016, 21(4): 452-471. DOI:10.3390/molecules21040452 |
| [78] | Warnakulasuriya SN, Ziaullah, Rupasinghe HP. Novel long chain fatty acid derivatives of quercetin-3-O-glucoside reduce cytotoxicity induced by cigarette smoke toxicants in human fetal lung fibroblasts. Eur J Pharmacol, 2016, 781: 128-138. DOI:10.1016/j.ejphar.2016.04.011 |
| [79] | Sekhon LS, Ziaullah Z, Rupasinghe HP, et al. Novel quercetin-3-O-glucoside eicosapentaenoic acid ester ameliorates inflammation and hyperlipidemia. Inflammopharmacology, 2015, 23(4): 1731-1785. |
| [80] | Viskupicova J, Danihelova M, Majekova M, et al. Polyphenol fatty acid esters as serine protease inhibitors: a quantum-chemical QSAR analysis. J Enzyme Inhib Med Chem, 2012, 27(6): 800-809. DOI:10.3109/14756366.2010.616860 |
| [81] | Plochmann K, Korte G, Koutsilieri E, et al. Structure-activity relationships of flavonoid-induced cytotoxicity on human leukemia cells. Arch Biochem Biophys, 2007, 460(1): 1-9. DOI:10.1016/j.abb.2007.02.003 |
| [82] | Susanti D, Sirat HM, Ahmad F, et al. Antioxidant and cytotoxic flavonoids from the flowers of Melastoma malabathricum L. Food Chem, 2007, 103(3): 710-716. DOI:10.1016/j.foodchem.2006.09.011 |
| [83] | Ravishankar D, Rajora AK, Greco F, et al. Flavonoids as prospective compounds for anti-cancer therapy. Int J Biochem Cell Biol, 2013, 45(12): 2821-2831. DOI:10.1016/j.biocel.2013.10.004 |
| [84] | Matsubara K, Ishihara K, Mizushina Y, et al. Anti-angiogenic activity of quercetin and its derivatives. Lett Drug Des Discov, 2004, 1(4): 329-333. DOI:10.2174/1570180043398533 |
| [85] | Youn SH, Kim HJ, Kim TH, et al. Lipase-catalyzed acylation of naringin with palmitic acid in highly concentrated homogeneous solutions. J Mol Catal B: Enzym, 2007, 46(1/4): 26-31. |
| [86] | Du L, Jiang Z, Xu L, et al. Microfluidic reactor for lipase-catalyzed regioselective synthesis of neohesperidin ester derivatives and their antimicrobial activity research. Carbohydr Res, 2018, 455: 32-38. DOI:10.1016/j.carres.2017.11.008 |
| [87] | Ziaullah, Rupasinghe HP. Sonochemical enzyme-catalyzed regioselective acylation of flavonoid glycosides. Bioorg Chem, 2016, 65: 17-25. DOI:10.1016/j.bioorg.2016.01.005 |
| [88] | Ziaullah, Rupasinghe HP. An efficient microwave-assisted enzyme-catalyzed regioselective synthesis of long chain acylated derivatives of flavonoid glycosides. Tetrahedron Lett, 2013, 54(15): 1933-1937. DOI:10.1016/j.tetlet.2013.01.103 |
| [89] | Foresti ML, Pedernera M, Bucala V, et al. Multiple effects of water on solvent-free enzymatic esterifications. Enzyme Microb Technol, 2007, 41(1/2): 62-70. |
| [90] | Lue BM, Guo Z, Xu XB. Effect of room temperature ionic liquid structure on the enzymatic acylation of flavonoids. Process Biochem, 2010, 45(8): 1375-1382. DOI:10.1016/j.procbio.2010.05.024 |
