

山东大学 微生物技术国家重点实验室,山东 青岛 266237
收稿日期:2021-03-29;接收日期:2021-05-24
基金项目:国家重点研发计划(No. 2019YFA0905700),国家****科学基金(No. 21625602),国家自然科学基金(No. 21838002) 资助
作者简介:汤亚杰??山东大学微生物技术国家重点实验室****、博士生导师,国家重点研发计划“合成生物学”重点专项首席科学家,主要从事天然产物生物智造领域的科学研究。主持的科研项目“天然产物生物制造的理论与方法”获2016年湖北省自然科学一等奖,“工业微生物发酵关键技术及产业化”获2014年湖北省科技进步一等奖。2014年入选全国杰出专业技术人才,2014年入选国家“****”科技创新领军人才,2016年获得国家****科学基金资助,2017年获得中国化工学会侯德榜化工科技创新奖。应邀出任学术期刊Bioprocess and Biosystems Engineering副主编.
摘要:鬼臼毒素(Podophyllotoxin,PTOX) 是来源于中药八角莲、山荷叶和桃儿七等鬼臼属植物的芳基四氢萘类木脂素。其化学半合成衍生物依托泊苷和替尼泊苷被用于多种癌症的临床治疗。作为天然产物来源新药创制的典型代表,鬼臼毒素目前依赖天然提取,供求矛盾日渐突出。生物合成具有不受资源限制、反应条件友好等优势,是鬼臼毒素及其衍生物生产的新方式。文中总结了鬼臼毒素在植物中的生物合成途径的研究进展,阐述了合成途径中关键酶的功能及其亚细胞定位,进而介绍了以模式植物烟草为底盘的鬼臼毒素合成生物学研究。最后总结了利用微生物对鬼臼毒素进行异源表达及生物转化的研究进展,以期为利用微生物细胞工厂高效合成鬼臼毒素及其衍生物提供参考。
关键词:鬼臼毒素生物合成生物转化微生物细胞工厂
Research progress in biosynthesis of podophyllotoxin and its derivatives
Zhen Meng, Tingting Yao, Wei Zhao, Hongmei Li, Ya-Jie Tang


State Key Laboratory of Microbial Technology, Shandong University, Qingdao 266237, Shandong, China
Received: March 29, 2021; Accepted: May 24, 2021
Supported by: National Key Research and Development Program of China (No. 2019YFA0905700), National Natural Science Foundation of China for Distinguished Young Scholars (No. 21625602), National Natural Science Foundation of China (No. 21838002)
Corresponding author: Ya-Jie Tang. Tel/Fax: +86-532-58632365; E-mail: yajietang@sdu.edu.cn.
Abstract: Podophyllotoxin (PTOX) is an aryl-tetralin lignan of plant origin found in some species of Podophyllum such as Dysosma versipellis, Diphylleia sinensis, and Sinopodophyllum hexandrum. Etoposide and teniposide are produced semisynthetically from PTOX and used clinically to treat several forms of cancer. As a typical representative of new drug discovery from natural products, the production of PTOX solely depends on extraction from plants, resulting in severe contradiction between supply and demand. With the advantages of unconstrained resources and eco-friendly reaction conditions, biosynthesis method has become a trend in the production of PTOX and its derivatives. In this review, we summarize the research progress of PTOX biosynthesis in plants and expound the functions of the key enzymes as well as their subcellular location. The synthetic biology for production of PTOX intermediates in a tobacco chassis is also introduced. Finally, the heterologous expression and biotransformation of PTOX in microorganisms is summarized, which sets the foundation for the efficient microbial production of PTOX using cell factories.
Keywords: podophyllotoxinbiosynthesisbiotransformationmicrobial cell factory
鬼臼毒素(Podophyllotoxin,PTOX) (图 1) 作为中药八角莲、山荷叶和桃儿七等鬼臼属植物的主药效成分,是含有5个环(A–E) 和4个连续手性中心(C1–C4) 的芳基四氢萘类木脂素[1]。早在《本草纲目》等20余部药典中记载用于痈疖肿毒、气管炎等治疗。药理学实验表明,鬼臼毒素具有强烈的微管或DNA损伤能力,具有广谱高效的抗肿瘤作用。自20世纪80–90年代美国FDA批准治疗小细胞肺癌鬼臼类药物“依托泊苷” (VP-16)[2]、“替尼泊苷” (VM-26)[3]和依托泊苷磷酸酯(Etopophos) 上市以来,相继研发了铵盐化依托泊苷(NK611)[4]、酯基全氟苯依托泊苷(F11782)[5]、对硝基苯胺4′-去甲基表鬼臼毒素(GL-331)[6]、烷氨基4′-去甲基表鬼臼毒素(TOP-53、NPF)[7-8]、二氟吡喃葡萄糖4′-去甲基表鬼臼毒素(Adva-27a)[9]、氨基吡嗪苯4′-去甲基表鬼臼毒素(QS-ZYX-1-61)[10]、脱氧鬼臼毒素(DPT)[11]、多胺4′-去甲基表鬼臼毒素(F14512)[12]和酯基二恶茂烷4′-去甲基表鬼臼毒素(CAP 7.1)[13]等10种针对肺癌、白血病、淋巴癌、乳腺癌、睾丸癌、神经胶质瘤等人类多发性癌症的鬼臼类抗肿瘤药物进入临床Ⅰ–Ⅲ期研究(图 1)。目前全球仍有61种器官靶向性强、活性提升和成药性好的新一代鬼臼类抗肿瘤候选药物正在研发中,如肝癌靶向的具有毫摩尔低毒性的5-氟苯并恶唑/噻唑-4′-去甲基表鬼臼毒素(5F-Bo/Bth-DMEP)[14]、低毒性5-氟苯并恶唑/噻唑替尼泊苷(5F-Bo/Bth-VM-26)[15],具有纳摩尔广谱抗肿瘤活性的氨基吲哚/吲唑鬼臼毒素(6-IA/5-ID-PTOX)[16] (图 1)。
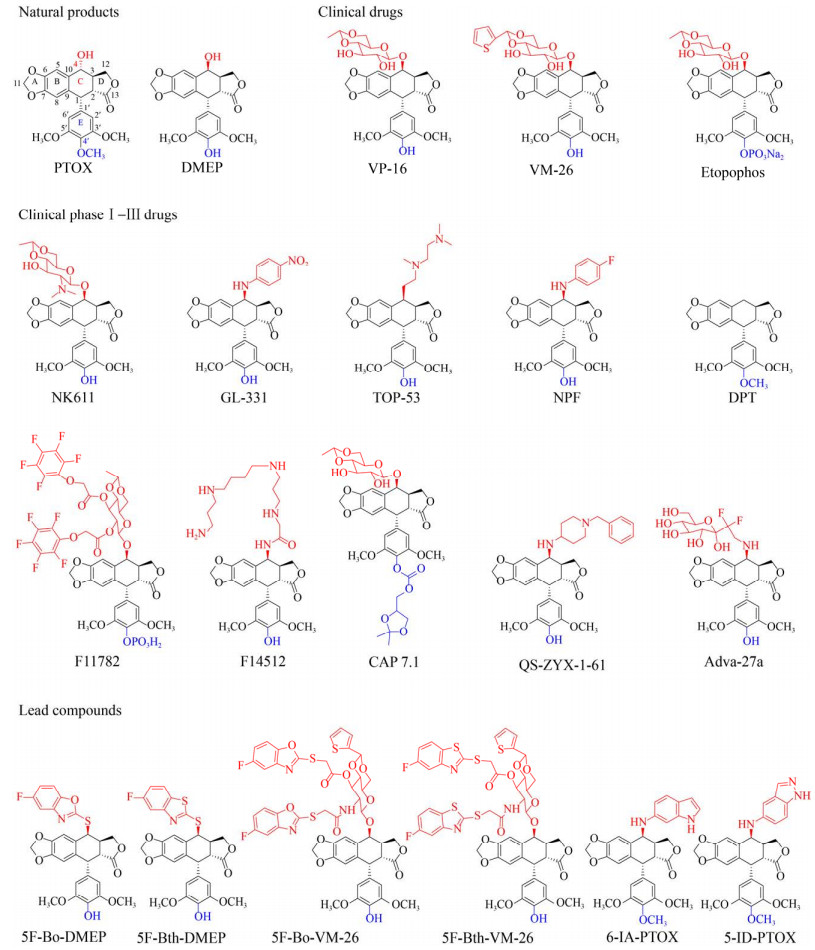 |
| 图 1 鬼臼毒素及其衍生物的化学结构 Fig. 1 Chemical structures of podophyllotoxin and its derivatives. |
| 图选项 |
国际上鬼臼类新药研发十分活跃,对合成前体鬼臼毒素的需求日益增强。目前鬼臼毒素主要依赖天然提取,导致野生鬼臼类植物成为国家珍稀濒危保护植物[17],并且存在资源受限、不可持续等问题。而对结构复杂的天然产物,化学合成往往选择性差、路线复杂、产率低[18]。基于合成生物学原理,设计和构建天然产物人工合成生物系统高效生产珍稀植物的活性成分,不仅保护药用植物资源及环境,也为药物开发提供了新途径。美国加州大学伯克利分校的Keasling教授利用酵母细胞发酵生产抗疟疾一线药物青蒿素前体青蒿酸(产量达25 g/L)[19];麻省理工学院Stephanopoulos教授在大肠杆菌中重构肿瘤特效药紫杉醇的重要中间体紫杉二烯的合成途径(产量达1 g/L)[20]。Keasling和Stephanopoulos教授利用合成生物学生产天然产物的成功,为通过合成生物学实现鬼臼毒素高效生产树立了典范。近年来,随着鬼臼毒素生物合成途径逐渐阐明,鬼臼毒素合成生物学研究取得了长足发展,近期在烟草中实现了(-)-脱氧鬼臼毒素毫克级的合成[21-22]。本文将从鬼臼毒素生物合成途径中关键酶的功能及其亚细胞定位、在模式植物和微生物中的代谢工程以及微生物生物转化等方面进行总结,为采用微生物细胞工厂高效合成鬼臼毒素及其衍生物奠定基础,以期待实现鬼臼类药物智能化生产。
1 鬼臼毒素生物合成途径天然产物的高效生物合成以天然产物生物合成规律的深度认识为基础。目前植物中的鬼臼毒素生物合成途径可分为5部分:(1) 在维管植物中高度保守的苯丙烷途径合成木脂素前体松柏醇(Coniferyl alcohol)[23],此处不再赘述;(2) 松柏醇到罗汉松脂酚(Matairesinol);(3) 罗汉松脂酚到脱氧鬼臼毒素;(4) 脱氧鬼臼毒素到4′-去甲基表鬼臼毒素(4′-demethylepipodophyllotoxin, DMEP);(5) 鬼臼毒素糖基化修饰(图 2)。
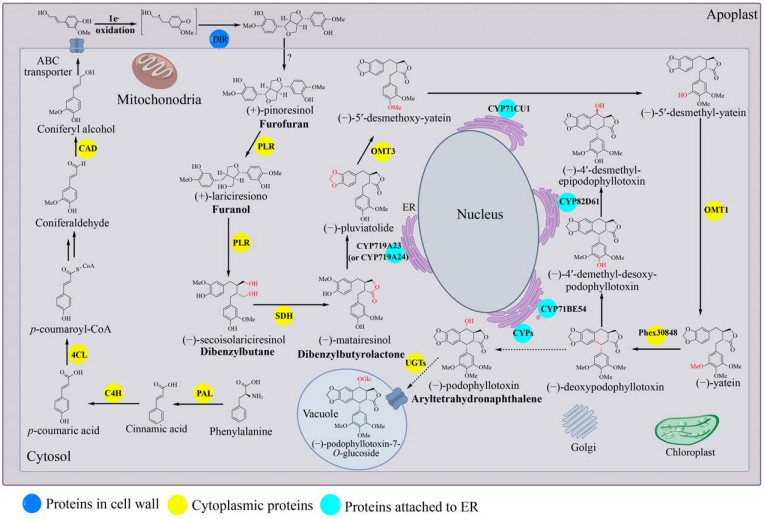 |
| 图 2 鬼臼毒素生物合成途径及关键酶的细胞定位示意图 Fig. 2 The proposed podophyllotoxin biosynthetic pathway and schematic view of the proposed cellular localization. |
| 图选项 |
1.1 松柏醇到罗汉松脂酚苯丙氨酸在细胞质中经脱氨、羟化等反应生成的松柏醇,由ABC转运蛋白将其从细胞质跨过质膜运输到细胞壁[24-25]。在此,Dirigent蛋白(Dirigent protein,DIR) 催化两分子松柏醇偶联生成(+)-松脂酚(Pinoresinol)。松脂酚-落叶松脂醇还原酶(Pinoresinol-lariciresinol reductase,PLR) 在细胞质中催化(+)-松脂酚两步还原,经过(+)-落叶松脂醇(Lariciresinol) 生成(-)-开环异落叶松脂醇(Secoisolariciresinol);进而由开环异落叶松脂醇脱氢酶(Secoisolariciresinol dehydrogenase,SDH)催化生成(-)-罗汉松脂酚。
1.1.1 Dirigent蛋白Dirigent (DIR)蛋白如何精确地控制木质素单体(Monolignol) 自由基偶联的区域特异性和立体选择性,是木质素单体合成鬼臼毒素的关键。1997年,Davin等[26]首次阐明了连翘Forsythia suspensa中DIR蛋白的功能。DIR蛋白本身缺乏氧化中心,两分子松柏醇需被非特异性氧化酶(如漆酶) 或非酶氧化剂氧化后,才能被DIR蛋白二聚体立体选择性催化分子间的自由基偶联得到(+)-松脂酚。在DIR蛋白不存在的情况下,二聚木脂素的生成速率没有明显的改变,但发生外消旋偶联,得到比例为2:4:1的(±)-松脂酚、(±)-去氢双松柏醇(Dehydrodiconiferyl alcohols) 和(±)-愈创木酚基甘油8-O-4松柏醇醚(Guaiacylglycerol 8-O-4 coniferyl alcoholethers),所以DIR蛋白的立体选择性对于鬼臼毒素的生物合成是至关重要的。不同植物来源的DIRs蛋白的立体选择性不同,如来自五味子Schisandra chinensis的ScDIR[27]、金钟连翘Frullania intermedia的psd-Fi1[28]以及豌豆Pisum sativum的PsDRR206[29]可催化形成(+)-松脂酚;来自拟南芥Arabidopsis thaliana的AtDIR5和AtDIR6可以催化生成(-)-松脂酚[27]。为了揭示DIR蛋白的立体选择性机制,Kim等[30]获得了分辨率为1.95 ?的PsDRR206蛋白晶体结构。将其与合成(-)-松脂酚的AtDIR6晶体结构比对分析,发现了合成(+)-松脂酚的PsDRR206在最长的loop环上有6个独有的保守氨基酸残基可能与DIR蛋白控制立体选择性有关,但需进一步的定点突变验证。
作为鬼臼毒素生物合成的限速步骤,DIRs蛋白的亚细胞定位至关重要。Burlat等[31]采用组织印迹、原位杂交和免疫标记技术检测了连翘不同器官的组织特异性DIRs基因表达和相关定向位点定位,共定位信号表明DIRs蛋白主要位于植物细胞壁内。Gang等[28]对DIRs蛋白的分子鉴定表明DIR是N-端带有信号肽的糖蛋白。通过TMHMM对DIRs跨膜螺旋预测分析表明,DIRs具有一个跨膜螺旋[32]。以上因素致使DIRs很难在微生物中高效表达,也是利用微生物底盘细胞高效生产鬼臼毒素的难点。但是,也有数据表明木质素单体二聚化可以发生在细胞内,如拟南芥原生质体实验[33]。并且随着基因测序的发展,细菌基因组中也发现了大量DIRs基因,开发细菌来源的DIRs功能元件将是构建生产鬼臼毒素微生物底盘细胞的一个新选择[34]。
1.1.2 松脂酚- 落叶松脂醇还原酶1996年,Dinkova-Kostova等[35]在F. intermedia中鉴定了松脂酚-落叶松脂醇还原酶(PLR),其催化的连续两步还原反应是木脂素代谢进入呋喃(Furano)、二苯基丁烷(Dibenzylbutane)、二苯基丁内酯(Dibenzylbutyrolactone) 和芳基四氢萘(Aryltetrahydronaphthalene) 等8-8′偶联木脂素的关键节点。目前在鬼臼属植物中鉴定了两个PLRs: 来自桃儿七Podophyllum hexandrum的PhPLR[36]和八角莲Podophyllum pleianthum的PpPLR1[37]。两者都可催化(+)-松脂酚还原生成(+)-落叶松脂醇,并进一步还原生成(-)-开环异落叶松脂醇,显示了较强的对映选择性。而蓝花亚麻Linum perenne中的PLR-Lp1催化(±)-松脂酚还原生成(±)-落叶松脂醇,并还原生成(±)-开环异落叶松脂醇[38]。值得注意的是,人类肠道细菌迟缓埃格特菌Eggerthella lenta[39]和粪肠球菌Enterococcus fecalis[40]可以将(+)-松脂酚转化为(+)-落叶松脂醇,暗示细菌中有类似PLRs的酶存在。
Min等[41]于2003年获得了来自红崖柏木Thuja plicata的TpPLR1蛋白晶体结构。TpPLR1以二聚体的形式存在,N端存在保守的GXXGXXG NADPH结合域,C端为底物结合域,在两个结合域的中间存在催化“cleft”。将底物分别为(-)-pinoresinol和(+)-pinoresinol的TpPLR1和TpPLR2的蛋白结构进行比对,发现两者底物结合位点的3个残基是不同的(TpPLR1: F164, V268, L272; TpPLR2: L164, G268, F272),推测这些残基可能与底物对映选择性有关。根据TMHMM预测,PLR缺乏跨膜螺旋或信号肽[42],植物特异性定位工具Plant-mPloc表明PLR定位于细胞质[43]。
1.1.3 开环异落叶松脂醇脱氢酶来源于鬼臼属的NAD+依赖型开环异落叶松脂醇脱氢酶(SDH) 催化(-)-开环异落叶松脂醇生成(-)-罗汉松脂酚,具有对映体选择性[44]。与鬼臼属植物中(-)-罗汉松脂酚的形成相反,在其他植物中,尤其是百里香科植物中,发现了相反的木脂素对映体[45]。来源于盾叶鬼臼Podophyllum peltatum的SDH蛋白晶体(1.6 ?) 结构分析表明它是一个四聚体。基于辅因子-(-)-罗汉松脂酚-SDH三元复合物中(-)-罗汉松脂酚的位置,以(-)-开环异落叶松脂醇为底物可以进行三元复合物晶体结构的模拟,相同条件下,以(+)-开环异落叶松脂醇为底物无法进行晶体结构的模拟,解释了鬼臼属植物中SDH的对映选择性[46]。2015年,Arneaud等从分离自P. peltatum根状茎的内生真菌Phialocephala podophylli中克隆到SDH,并在体外成功催化(-)-开环异落叶松脂醇生成(-)-罗汉松脂酚[47]。
SDH最初被认为结合到叶绿体上[43]。然而,叶绿体定位工具ChloroP和PCLR表明SDH未定位于叶绿体,且定位工具MultiLoc2-LowRes和LocTree3进一步证实SDH位于细胞质中[32]。
1.2 罗汉松脂酚到脱氧鬼臼毒素基于对P. hexandrum和P. peltatum转录组的分析,Marques等[48]鉴定了两个细胞色素P450酶(Cytochrome P450s,CYPs):P. hexandrum中的CYP719A23和P. peltatum中的CYP719A24。它们都可以催化(-)-罗汉松脂酚为(-)-pluviatolide。Lau等[49]通过对数据库中P. hexandrum的转录组分析,挖掘了鬼臼毒素生物合成途径下游的候选合成酶:4个O-甲基转移酶(OMT1-4)、12个CYPs和1个2-酮戊二酸/Fe(Ⅱ)-依赖性双加氧酶(2-ODD)。将上述候选酶分别与CYP719A23在烟草叶中共表达,发现只有OMT3可催化(-)-pluviatolide的C-4′羟基甲基化生成(-)-5′-去甲氧基亚太因(5′-desmethoxy-yatein)。进一步通过对P. hexandrum不同愈伤时间叶片的转录组分析确定了CYP71CU1催化(-)-5′-去甲氧基亚太因C-5′羟化生成(-)-5′-去甲基亚太因(5′-desmethyl- yatein),甲基转移酶OMT1进一步催化C-5′羟基甲基化生成(-)-亚太因。最后,2-酮戊二酸/Fe(Ⅱ)-依赖性双加氧酶Phex30848催化(-)-亚太因C-1和C-9的闭环生成(-)-脱氧鬼臼毒素。Sakakibara等[50]根据峨参Anthriscus sylvestris喂养示踪实验提出了合成脱氧鬼臼毒素的不同的路线:从(-)-罗汉松脂酚到(-)-北美乔柏素(Thujaplicatin),再到(-)-5′-O-甲基北美乔柏素(5′-O-methyl-thujaplicatin),进一步到4′, 5′-O, O-双甲基北美乔柏素(4′, 5′-O, O- dimethyl-thujaplicatin),最后闭环形成亚甲基双氧桥生成(-)-亚太因。
值得注意的是,根据Plant-mPloc和MultiLoc2的分析,途径中的CYP719A23、CYP71CU1、CYP71BE54和CYP82D61都含有一个靶向肽和1–2个跨膜螺旋,可能位于内质网(Endoplasmic reticulum,ER) 膜上[32]。
1.3 脱氧鬼臼毒素到4′-去甲基表鬼臼毒素Lau等[49]为确定鬼臼毒素生物合成的最后步骤,将挖掘得到的6个CYPs候选基因分别与途径上游已经确定的5个基因(从CYP719A23到Phex30848) 在烟草叶片中共表达。共表达CYP71BE54的烟草叶可消耗(-)-脱氧鬼臼毒素,合成(-)-4′-去甲基脱氧鬼臼毒素(4′-desmethyldesoxypodophyllotoxin);CYP82D61能够催化(-)-4′-去甲基脱氧鬼臼毒素生成(-)-4′-去甲基表鬼臼毒素(4′- desmethylepipodophyllotoxin)。虽然Lau等未能完全破译鬼臼毒素的合成基因,但P. hexandrum的细胞悬浮液可以将脱氧鬼臼毒素转化为鬼臼毒素[51],其中催化脱氧鬼臼毒素转化为鬼臼毒素的酶仍待被鉴定,此步骤也成为了研究鬼臼毒素生物合成途径的瓶颈之一。
1.4 鬼臼毒素糖基化修饰木脂素大多以糖基化的形式存在于植物中,2001年,Zhao等[52]在桃儿七中分离得到4个鬼臼毒素糖苷天然产物:异鬼臼毒素7′-O-β-D-吡喃葡萄糖基-(1→6)-β-D-吡喃葡萄糖苷(Ispodophyllotoxin 7′-O-β-D-glucopyranosyl-(1→6)- β-D-glucopyranoside)、4′-去甲基-鬼臼苦素-7′- O-β-D-吡喃葡萄糖苷(4′-demethyl-picropodop- hyllotoxin 7′-O-β-D-glucopyranoside)、4′-去甲基-鬼臼毒素-7′-O-β-D-吡喃葡萄糖苷(4′-demethyl- podophyllotoxin4′-O-β-D-glucopyrano-side)和鬼臼毒素-7′-O-β-D-吡喃葡萄糖苷(Podophyllotoxin 7′-O-β-D-glucopyranoside)。大部分木脂素由UDP-依赖的糖基转移酶(UDP-dependent- glycosyltransferases,UGTs) 催化生成木脂素糖苷。由于P. hexandrum的测序并不完整,所以目前负责糖基化的酶仍然是未知的。亚麻Linum nodiflorum L.的粗酶液中检测到UDP-葡萄糖依赖的葡萄糖基转移酶催化鬼臼毒素7-O-β-糖基化反应,推测鬼臼毒素生物合成的最后一步是C7的羟基糖基化,以葡萄糖苷的形式储存在液泡中[53],但其编码的基因还未鉴定。目前,笔者课题组[54]基于底物混杂性对糖基转移酶进行了定向挖掘,通过点突变揭示了活性结构中关键残基,基于关键残基保守性分析,筛选到催化4′-去甲基表鬼臼毒素糖基化的高效糖基转移酶,为鬼臼毒素糖基转移酶的挖掘提供了借鉴。
2 鬼臼毒素细胞工厂构建基于合成生物学的原理,设计和创建人工细胞工厂生产植物源天然产物,不仅能有效控制原料供给,还能保护自然资源及环境,是新药开发的有效途径。随着鬼臼毒素生物合成途径的逐步阐明,目前已经在烟草中实现了(-)-脱氧鬼臼毒素毫克级的合成。同时鬼臼毒素部分生物合成途经已在大肠杆菌Escherichia coli和酿酒酵母Saccharomyces cerevisiae中实现高效表达,获得了不同的鬼臼毒素中间体。
2.1 在烟草中合成毫克级脱氧鬼臼毒素植物底盘细胞与微生物底盘细胞相比,具有表达植物天然产物所需的代谢前体及亚细胞区室等优势。目前,完整的植物源天然产物的生物合成途径已可以在异源宿主(通常是酵母) 中实现,如青蒿酸[19]、苄基异喹啉[55]和大麻素[56]等。Schultz等[22]在解析鬼臼毒素生物合成途径的基础上,在烟草植物中实现了(-)-脱氧鬼臼毒素毫克级合成和4′-去甲基表鬼臼毒素及4′-去甲基-5′-去甲氧基表鬼臼毒素的全合成。通过共表达松柏醇合成途径的PAL、C4H、4CL、HCT、C3H、CCoA-OMT、CCR和CAD,强化了松柏醇的供应;进一步增加表达脱氧鬼臼毒素合成途径的DIR、PLR、SDH、CYP719A23、OMT3、CYP71CU1、OMT1和2-ODD,合成得到4.3 mg/g叶片干重的(-)-脱氧鬼臼毒素,而且还可检测到4′-去甲基表鬼臼毒素。最后增加表达4′-去甲基表鬼臼毒素合成途径的CYP71BE54和CYP82D61,没有生成4′-去甲基表鬼臼毒素而生成4′-去甲基-5′-去甲氧基表鬼臼毒素。
2.2 在大肠杆菌中合成罗汉松脂酚袁其朋课题组[57]首次在大肠杆菌中设计了松柏醇人工合成途径并利用微生物共培养技术提高了松柏醇的产量。Jansen等[58]最初在大肠杆菌中通过改造L-酪氨酸(L-tyrosine) 的合成途径构建了对香豆醇(p-coumaryl alcohol) 人工途径。袁其朋课题组基于此途径选用RgTAL、At4CL1、LlCCR和ScADH6重建了对香豆醇生物合成途径,显著提高了对香豆醇的产量((501.8±41.4) mg/L)。通过引入羟化酶HpaBC和甲基转移酶,将合成途径扩展到松柏醇[57]。通过添加莽草酸途径中4个关键基因(tyrAfbr、ppsA、tktA和aroGfbr) 过量生产酪氨酸,进一步提高了松柏醇的产量[59]。HpaBC的杂泛性导致酪氨酸形成不稳定的副产物,导致碳源的损失,因此设计了微生物共培养减小HpaBC对酪氨酸的影响以提高松柏醇的产量((124.9±5.1) mg/L)[57]。
Kuo等[60]在大肠杆菌中克隆表达了来源于P. pleianthum的PLR和SDH,体外生化反应结果显示:当单独表达PLR和SDH时,由松脂酚到罗汉松脂酚转化率仅为17.7%;当融合表达PLR-SDH时,转化率为49.8%;当融合表达SDH-PLR时只产生开环异落叶松脂醇。体内实验表明:在不添加辅因子的情况下,含有PLR-SDH融合基因的大肠杆菌可以将松脂酚完全转化为罗汉松脂酚。
2.3 在酵母中合成对香豆酸对香豆酸(p-coumaric acid) 是松柏醇的生物合成前体,也是鬼臼毒素合成途径中重要的中间体。Rodriguez等[61]通过失活苯丙酮酸脱羧酶ARO10和丙酮酸脱羧酶PDC5,过表达DAHP合酶、分支酸变位酶、五功能arom酶Aro1p和分支酸合酶-黄素还原酶Aro2p得到了对香豆酸高产的酿酒酵母。通过提高苯丙氨酸的添加量以及PAL蛋白的活性使对香豆酸的产量达(1.93±0.26) g/L。Eichenberger等[62]在酿酒酵母中构建共表达AtPAL2、AmC4H和ScCPR1合成对香豆酸。酿酒酵母中的ScADH6具有广泛的底物耐受性[63],可作为候选肉桂醇脱氢酶(Cinnamyl alcohol- dehydrogenase,CAD) 催化松柏醇的生成(图 2),如果继续在酿酒酵母中表达鬼臼毒素途径其他下游的基因,有望实现松柏醇乃至鬼臼毒素的合成。
3 微生物转化法合成鬼臼毒素衍生物对天然活性先导化合物进行分子结构修饰是新药研发的一个重要途径。与化学修饰相比,微生物生物转化法具有立体和区域选择性高、反应条件温和、操作步骤简单等优点。笔者课题组首次采用绿脓杆菌Pseudomonas aeruginosa CCTCC AB93066对鬼臼毒素进行转化,得到鬼臼苦素(Picropodophyllin)和水溶性提高并具有抑制黑色素瘤活性的鬼臼酸(Podophyllic acid)[64] (图 3A);利用梭状芽孢杆菌Bacillus fusiformis CICC 20463对4′-去甲基表鬼臼毒素进行转化,使其D环开环发生水解反应得到水溶性提高的4′-去甲基表鬼臼酸(4′-demethylepipodophyllic acid)[65] (图 3B)。本课题组首次建立了串联生物转化法,实现了对鬼臼毒素进行定向修饰:藤仓赤霉Gibberella fujikuroi SH-f13将鬼臼毒素转化为4′-去甲基表鬼毒素,进而被链格孢菌Alternaria alternata S-f6转化为4′-去甲基表鬼臼毒酮(4′-demethylpodophyllotoxone);最后,A. alternata S-f6将川芎嗪(Tetramethylpyrazine) 和4′-去甲基表鬼臼毒酮定向合成4-(2, 3, 5, 6- tetramethylpyr-azine-1)-4′-demethylepip-odophyllotoxin[66] (图 3C)。本课题组从山荷叶D. sinensis Li中分离得到产紫青霉菌Penicillium purpurogenum Y.J. Tang,将2-巯基-1, 3, 4-噻二唑(2-mercapto- 1, 3, 4-thiadiazole)或3-巯基-1, 2, 4-三氮唑(3-mercapto-1, 2, 4-triazole) 与4′-去甲基表鬼毒素定向合成4β-(1, 2, 4-triazole-3-yl)sulfanyl-4-deoxy- 4′-demethylepipodophyllotoxin或4β-(1, 3, 4-thiad- iazole-2-yl)sulfanyl-4-deoxy-4′-demethylepipodoph- yllotoxin,与鬼臼毒素定向合成4β-(1, 2, 4-triazole- 3-yl)sulfanyl-4-deoxy-podophyllo-toxin或4β-(1, 3, 4- thiadiazole-2-yl)sulfanyl-4-deoxy-podophyllotoxin[67] (图 3D)。除此之外,Guo等[68]发现青霉菌Penicillium mclini 3.156能够将底物鬼臼毒素转化为鬼臼苦素,其转化率为8.4% (图 3A)。
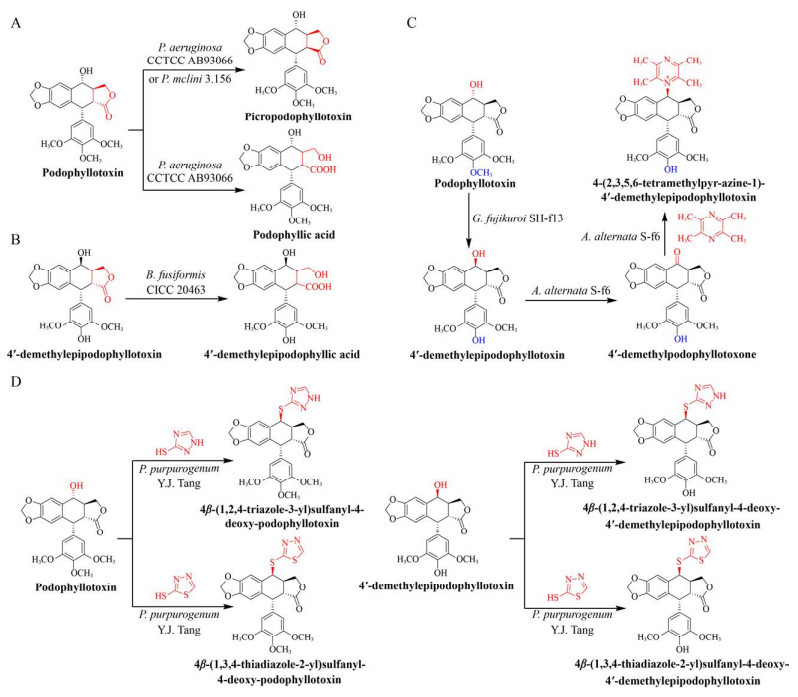 |
| 图 3 微生物转化法合成鬼臼毒素衍生物 Fig. 3 Synthesis of podophyllotoxin derivatives by microbial transformation. |
| 图选项 |
通过生物转化不仅可以获得新的衍生物,同时也提供了催化类型多样的天然酶库,如Kumano等[69]通过对芝麻素的生物转化在Sinomonas sp. no. 22中鉴定出对芝麻素具有显著降解能力的新酶SesA,可以催化芝麻素开环并将其亚甲基转移到四氢叶酸上。除了从自然界挖掘新的酶,对已知功能的酶进化改造,“变找为造”从而“为我所用”也有助于天然产物代谢途径的重构和新的衍生物的挖掘。
4 总结与展望鬼臼毒素从被发现至今已有一个多世纪,因其具有广谱高效的抗肿瘤、抗病毒、抗菌和免疫抑制等活性[70-71]而一直备受关注。目前植物提取是鬼臼毒素的主要来源,而鬼臼属植物一般为多年生草本药用植物,长生长周期和低产量导致鬼臼毒素供应不足,需开发有效策略扩大鬼臼毒素的来源满足鬼臼类药物的创制。除此之外,鬼臼毒素半合成衍生物依托泊苷和替尼泊苷作为重要的抗肿瘤药物,由于存在毒副作用大、耐药性和生物利用度低等问题,在临床治疗中受到严重限制,亟需开发新型鬼臼类药物。
鬼臼毒素的合成生物学研究为鬼臼毒素乃至鬼臼类药物的开发及生产提供一种新策略。基于现阶段已阐明的鬼臼毒素生物合成途径,目前以模式植物烟草为底盘的(-)-脱氧鬼臼毒素异源表达有了极大的进展,以酵母、大肠杆菌等模式微生物合成生物学研究也已开始起步。目前已发现多种可以产生鬼臼毒素的内生真菌[72],这为鬼臼毒素异源表达宿主的选择或底盘细胞的构建提供了更多的选择。虽然内生真菌中的鬼臼毒素合成基因簇还未见报道,植物内的鬼臼毒素的生物合成途径也尚未完全阐明,微生物与植物中鬼臼毒素的生物合成机制是否相同,还需要进一步探索。不过随着基因测序工具不断进步,测序成本以“超摩尔速度”直线下降,为生物元件开发和途径解析奠定了基础。但要想实现鬼臼毒素的高效制备,无论是烟草或酵母,都需要克服巨大的技术障碍。近年来随着人工智能技术的发展,为生物元件的设计和优化提供了崭新的手段,基于合成生物学原理,通过计算机深度学习智能设计鬼臼毒素的生物合成途径,筛选合适的底盘细胞,能够克服或规避某些技术难题,使鬼臼毒素智能化生产成为可能。
鬼臼毒素作为天然产物来源新药创制的典型代表,目前有多个鬼臼类抗肿瘤药物进入临床,但大多通过化学合成得到,还无法实现生物合成。“逆向生物合成”的设计方法近年来被广泛应用于天然先导化合物的研究,采用逆向逻辑思维,从抗肿瘤鬼臼类药物分子结构出发,将鬼臼类药物结构反向分解为生物系统中可得且可被拼接或转化的结构模块,综合考虑其生物合成的催化反应类型,选择合适的反应元件和底盘细胞进行高效制造。该策略可绕过天然产物生物合成途径解析,靶向地寻找或改造生物合成元件,加快药物开发,是未来开发药物的新趋势。基于合成生物学策略,利用逆向思维理性设计和优化鬼臼类药物生物合成途径,构建鬼臼类药物高效合成的细胞工厂,有望成为植物来源鬼臼毒素乃至木脂素类化合物药物开发以及生产的有效手段。
参考文献
| [1] | Canel C, Moraes RM, Dayan FE, et al. Podophyllotoxin. Phytochemistry, 2000, 54(2): 115-120. DOI:10.1016/S0031-9422(00)00094-7 |
| [2] | Wu CC, Li TK, Farh L, et al. Structural basis of type Ⅱ topoisomerase inhibition by the anticancer drug etoposide. Science, 2011, 333(6041): 459-462. DOI:10.1126/science.1204117 |
| [3] | Tepper CG, Studzinski GP. Teniposide induces nuclear but not mitochondrial DNA degradation. Cancer Res, 1992, 52(12): 3384-3390. |
| [4] | Pagani O, Zucchetti M, Sessa C, et al. Clinical and pharmacokinetic study of oral NK611, a new podophyllotoxin derivative. Cancer Chemother Pharmacol, 1996, 38(6): 541-547. DOI:10.1007/s002800050524 |
| [5] | Perrin D, Van Hille B, Barret JM, et al. F 11782, a novel epipodophylloid non-intercalating dual catalytic inhibitor of topoisomerases Ⅰ and Ⅱ with an original mechanism of action. Biochem Pharmacol, 2000, 59(7): 807-819. DOI:10.1016/S0006-2952(99)00382-2 |
| [6] | Kuo ML, Shen SC, Yang CH, et al. Bcl-2 prevents topoisomerase Ⅱ inhibitor GL331-induced apoptosis is mediated by down-regulation of poly(ADP-ribose)polymerase activity. Oncogene, 1998, 17(17): 2225-2234. DOI:10.1038/sj.onc.1202133 |
| [7] | Utsugi T, Shibata J, Sugimoto Y, et al. Antitumor activity of a novel podophyllotoxin derivative (TOP-53) against lung cancer and lung metastatic cancer. Cancer Res, 1996, 56(12): 2809-2814. |
| [8] | Kamal A, Laxman N, Ramesh G. Facile and efficient one-pot synthesis of 4 beta-arylaminopodophyllotoxins: synthesis of DNA topoisomerase Ⅱ inhibitors (NPF and W-68). Bioorg Med Chem Lett, 2000, 10(18): 2059-2062. DOI:10.1016/S0960-894X(00)00407-8 |
| [9] | Merzouki A, Buschmann MD, Jean M, et al. Adva-27a, a novel podophyllotoxin derivative found to be effective against multidrug resistant human cancer cells. Anticancer Res, 2012, 32(10): 4423-4432. |
| [10] | Chen MC, Pan SL, Shi Q, et al. QS-ZYX-1-61 induces apoptosis through topoisomerase Ⅱ in human non-small-cell lung cancer A549 cells. Cancer Sci, 2012, 103(1): 80-87. DOI:10.1111/j.1349-7006.2011.02103.x |
| [11] | Gamage CDB, Park SY, Yang Y, et al. Deoxypodophyllotoxin exerts anti-cancer effects on colorectal cancer cells through induction of apoptosis and suppression of tumorigenesis. Int J Mol Sci, 2019, 20(11): E2612. DOI:10.3390/ijms20112612 |
| [12] | Barret JM, Kruczynski A, Vispé S, et al. F14512, a potent antitumor agent targeting topoisomerase Ⅱ vectored into cancer cells via the polyamine transport system. Cancer Res, 2008, 68(23): 9845-9853. DOI:10.1158/0008-5472.CAN-08-2748 |
| [13] | Keilholz U, Rohde L, Mehlitz P, et al. First-in-man dose escalation and pharmacokinetic study of CAP7.1, a novel prodrug of etoposide, in adults with refractory solid tumours. Eur J Cancer, 2017, 80: 14-25. DOI:10.1016/j.ejca.2017.03.032 |
| [14] | Zhang QY, Zhao W, Tang YJ. Discover the leading compound of 4β-S-(5-fluorobenzoxazole)-4-deoxy- 4'-demethylepipodophyllotoxin with millimolar- potency toxicity by modifying the molecule structure of 4'-demethylepipodophyllotoxin. Eur J Med Chem, 2018, 158: 951-964. DOI:10.1016/j.ejmech.2018.09.022 |
| [15] | Cheng J, Zhao W, Yao H, et al. Discovery of 4, 6-O-thenylidene-β-d-glucopyranoside-(2″-acetamido, 3″-acetyl-di-S-5-fluorobenzothizole/5-fluorobenzoxazole)-4'-demethylepipodophyllotoxin as potential less toxic antitumor candidate drugs by reducing DNA damage and less inhibition of PI3K. J Med Chem, 2020, 63(6): 2877-2893. DOI:10.1021/acs.jmedchem.9b01354 |
| [16] | Zhao W, He L, Xiang TL, et al. Discover 4β-NH-(6-aminoindole)-4-desoxy-podophyllotoxin with nanomolar-potency antitumor activity by improving the tubulin binding affinity on the basis of a potential binding site nearby colchicine domain. Eur J Med Chem, 2019, 170: 73-86. DOI:10.1016/j.ejmech.2019.03.006 |
| [17] | Nadeem M, Palni LMS, Purohit AN, et al. Propagation and conservation of Podophyllum hexandrum Royle: an important medicinal herb. Biol Conserv, 2000, 92(1): 121-129. DOI:10.1016/S0006-3207(99)00059-2 |
| [18] | Robert C, Andrews, Simon J, et al. Asymmetric total synthesis of (-)-podophyllotoxin. J Am Chem Soc, 1988, 110(23): 7854-7858. DOI:10.1021/ja00231a041 |
| [19] | Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-532. DOI:10.1038/nature12051 |
| [20] | Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70-74. DOI:10.1126/science.1191652 |
| [21] | Davey SG. Engineering etoposide. Nat Rev Chem, 2020, 4(2): 63. DOI:10.1038/s41570-020-0166-3 |
| [22] | Schultz BJ, Kim SY, Lau W, et al. Total biosynthesis for milligram-scale production of etoposide intermediates in a plant chassis. J Am Chem Soc, 2019, 141(49): 19231-19235. DOI:10.1021/jacs.9b10717 |
| [23] | Federolf K, Alfermann AW, Fuss E. Aryltetralin-lignan formation in two different cell suspension cultures of Linum album: deoxypodophyllotoxin 6-hydroxylase, a key enzyme for the formation of 6-methoxypodophyllotoxin. Phytochemistry, 2007, 68(10): 1397-1406. DOI:10.1016/j.phytochem.2007.02.031 |
| [24] | Miao YC, Liu CJ. ATP-binding cassette-like transporters are involved in the transport of lignin precursors across plasma and vacuolar membranes. Proc Natl Acad Sci USA, 2010, 107(52): 22728-22733. DOI:10.1073/pnas.1007747108 |
| [25] | Tsuyama T, Kawai R, Shitan N, et al. Proton-dependent coniferin transport, a common major transport event in differentiating xylem tissue of woody plants. Plant Physiol, 2013, 162(2): 918-926. DOI:10.1104/pp.113.214957 |
| [26] | Davin LB, Wang HB, Crowell AL, et al. Stereoselective bimolecular phenoxy radical coupling by an auxiliary (dirigent) protein without an active center. Science, 1997, 275(5298): 362-366. DOI:10.1126/science.275.5298.362 |
| [27] | Kim KW, Moinuddin SG, Atwell KM, et al. Opposite stereoselectivities of dirigent proteins in Arabidopsis and Schizandra species. J Biol Chem, 2012, 287(41): 33957-33972. DOI:10.1074/jbc.M112.387423 |
| [28] | Gang DR, Costa MA, Fujita M, et al. Regiochemical control of monolignol radical coupling: a new paradigm for lignin and lignan biosynthesis. Chem Biol, 1999, 6(3): 143-151. DOI:10.1016/S1074-5521(99)89006-1 |
| [29] | Seneviratne HK, Dalisay DS, Kim KW, et al. Non-host disease resistance response in pea (Pisum sativum) pods: biochemical function of DRR206 and phytoalexin pathway localization. Phytochemistry, 2015, 113: 140-148. DOI:10.1016/j.phytochem.2014.10.013 |
| [30] | Kim KW, Smith CA, Daily MD, et al. Trimeric structure of (+)-pinoresinol-forming dirigent protein at 1.95 ? resolution with three isolated active sites. J Biol Chem, 2015, 290(3): 1308-1318. DOI:10.1074/jbc.M114.611780 |
| [31] | Burlat V, Kwon M, Davin LB, et al. Dirigent proteins and dirigent sites in lignifying tissues. Phytochemistry, 2001, 57(6): 883-897. DOI:10.1016/S0031-9422(01)00117-0 |
| [32] | Seegers CLC, Setroikromo R, Quax WJ. Natural Products and Cancer Drug Discovery. London: InTech, 2017, 287-306. |
| [33] | Dima O, Morreel K, Vanholme B, et al. Small glycosylated lignin oligomers are stored in Arabidopsis leaf vacuoles. Plant Cell, 2015, 27(3): 695-710. DOI:10.1105/tpc.114.134643 |
| [34] | Dabravolski SA. The resurgence of dirigent story: time for a bacterial chapter. Curr Microbiol, 2020, 77(4): 517-521. DOI:10.1007/s00284-019-01809-2 |
| [35] | Dinkova-Kostova AT, Gang DR, Davin LB, et al. (+)-Pinoresinol/(+)-lariciresinol reductase from Forsythia intermedia: protein purification, cDNA cloning, heterologous expression and comparison to isoflavone reductase. J Biol Chem, 1996, 271(46): 29473-29482. DOI:10.1074/jbc.271.46.29473 |
| [36] | Wankhede DP, Biswas DK, Rajkumar S, et al. Expressed sequence tags and molecular cloning and characterization of gene encoding pinoresinol/ lariciresinol reductase from Podophyllum hexandrum. Protoplasma, 2013, 250(6): 1239-1249. DOI:10.1007/s00709-013-0505-z |
| [37] | Markulin L, Corbin C, Renouard S, et al. Pinoresinol-lariciresinol reductases, key to the lignan synthesis in plants. Planta, 2019, 249(6): 1695-1714. DOI:10.1007/s00425-019-03137-y |
| [38] | Hemmati S, Schmidt TJ, Fuss E. (+)-pinoresinol/(-)-lariciresinol reductase from Linum perenne Himmelszelt involved in the biosynthesis of justicidin B. FEBS Lett, 2007, 581(4): 603-610. DOI:10.1016/j.febslet.2007.01.018 |
| [39] | Clavel T, Borrmann D, Braune A, et al. Occurrence and activity of human intestinal bacteria involved in the conversion of dietary lignans. Anaerobe, 2006, 12(3): 140-147. DOI:10.1016/j.anaerobe.2005.11.002 |
| [40] | Xie LH, Akao T, Hamasaki K, et al. Biotransformation of pinoresinol diglucoside to mammalian lignans by human intestinal microflora, and isolation of Enterococcus faecalis strain PDG-1 responsible for the transformation of (+)-pinoresinol to (+)-lariciresinol. Chem Pharm Bull (Tokyo), 2003, 51(5): 508-515. DOI:10.1248/cpb.51.508 |
| [41] | Min T, Kasahara H, Bedgar DL, et al. Crystal structures of pinoresinol-lariciresinol and phenylcoumaran benzylic ether reductases and their relationship to isoflavone reductases. J Biol Chem, 2003, 278(50): 50714-50723. DOI:10.1074/jbc.M308493200 |
| [42] | Petersen TN, Brunak S, Von Heijne G, et al. SignalP 4.0: discriminating signal peptides from transmembrane regions. Nat Methods, 2011, 8(10): 785-786. DOI:10.1038/nmeth.1701 |
| [43] | Chou KC, Shen HB. Plant-mPLoc: a top-down strategy to augment the power for predicting plant protein subcellular localization. PLoS ONE, 2010, 5(6): e11335. DOI:10.1371/journal.pone.0011335 |
| [44] | Xia ZQ, Costa MA, Pelissier HC, et al. Secoisolariciresinol dehydrogenase purification, cloning, and functional expression. implications for human health protection. J Biol Chem, 2001, 276(16): 12614-12623. DOI:10.1074/jbc.M008622200 |
| [45] | Umezawa T. Diversity in lignan biosynthesis. Phytochem Rev, 2003, 2(3): 371-390. DOI:10.1023/B:PHYT.0000045487.02836.32 |
| [46] | Youn B, Moinuddin SGA, Davin LB, et al. Crystal structures of apo-form and binary/ternary complexes of Podophyllum secoisolariciresinol dehydrogenase, an enzyme involved in formation of health-protecting and plant defense lignans. J Biol Chem, 2005, 280(13): 12917-12926. DOI:10.1074/jbc.M413266200 |
| [47] | Arneaud SL, Porter JR. Investigation and expression of the secoisolariciresinol dehydrogenase gene involved in podophyllotoxin biosynthesis. Mol Biotechnol, 2015, 57(11/12): 961-973. |
| [48] | Marques JV, Kim KW, Lee C, et al. Next generation sequencing in predicting gene function in podophyllotoxin biosynthesis. J Biol Chem, 2013, 288(1): 466-479. DOI:10.1074/jbc.M112.400689 |
| [49] | Lau W, Sattely ES. Six enzymes from mayapple that complete the biosynthetic pathway to the etoposide aglycone. Science, 2015, 349(6253): 1224-1228. DOI:10.1126/science.aac7202 |
| [50] | Sakakibara N, Suzuki S, Umezawa T, et al. Biosynthesis of yatein in Anthriscus sylvestris. Org Biomol Chem, 2003, 1(14): 2474-2485. DOI:10.1039/b304411d |
| [51] | Uden W, Bouma AS, Bracht Waker JF, et al. The production of podophyllotoxin and its 5-methoxy derivative through bioconversion of cyclodextrin-complexed desoxypodophyllotoxin by plant cell cultures. Plant Cell Tiss Organ Cult, 1995, 42(1): 73-79. DOI:10.1007/BF00037684 |
| [52] | Zhao C, Huang J, Nagatsu A, et al. Two new podophyllotoxin glucosides from Sinopodophyllum emodi (Wall.) Ying. Chem Pharm Bull (Tokyo), 2001, 49(6): 773-775. DOI:10.1248/cpb.49.773 |
| [53] | Berim A, Ebel R, Schneider B, et al. UDP-glucose: (6-methoxy) podophyllotoxin 7-O-glucosyltransferase from suspension cultures of Linum nodiflorum. Phytochemistry, 2008, 69(2): 374-381. DOI:10.1016/j.phytochem.2007.07.030 |
| [54] | Jia KZ, Zhu LW, Qu X, et al. Enzymatic O-glycosylation of etoposide aglycone by exploration of the substrate promiscuity for glycosyltransferases. ACS Synth Biol, 2019, 8(12): 2718-2725. DOI:10.1021/acssynbio.9b00318 |
| [55] | Galanie S, Thodey K, Trenchard IJ, et al. Complete biosynthesis of opioids in yeast. Science, 2015, 349(6252): 1095-1100. DOI:10.1126/science.aac9373 |
| [56] | Luo X, Reiter MA, d'Espaux L, et al. Complete biosynthesis of cannabinoids and their unnatural analogues in yeast. Nature, 2019, 567(7746): 123-126. DOI:10.1038/s41586-019-0978-9 |
| [57] | Chen Z, Sun X, Li Y, et al. Metabolic engineering of Escherichia coli for microbial synthesis of monolignols. Metab Eng, 2017, 39: 102-109. DOI:10.1016/j.ymben.2016.10.021 |
| [58] | Jansen F, Gillessen B, Mueller F, et al. Metabolic engineering for p-coumaryl alcohol production in Escherichia coli by introducing an artificial phenylpropanoid pathway. Biotechnol Appl Biochem, 2014, 61(6): 646-654. DOI:10.1002/bab.1222 |
| [59] | Huang Q, Lin Y, Yan Y. Caffeic acid production enhancement by engineering a phenylalanine over-producing Escherichia coli strain. Biotechnol Bioeng, 2013, 110(12): 3188-3196. DOI:10.1002/bit.24988 |
| [60] | Kuo HJ, Wei ZY, Lu PC, et al. Bioconversion of pinoresinol into matairesinol by use of recombinant Escherichia coli. Appl Environ Microbiol, 2014, 80(9): 2687-2692. DOI:10.1128/AEM.03397-13 |
| [61] | Rodriguez A, Kildegaard KR, Li M, et al. Establishment of a yeast platform strain for production of p-coumaric acid through metabolic engineering of aromatic amino acid biosynthesis. Metab Eng, 2015, 31: 181-188. DOI:10.1016/j.ymben.2015.08.003 |
| [62] | Eichenberger M, Lehka BJ, Folly C, et al. Metabolic engineering of Saccharomyces cerevisiae for de novo production of dihydrochalcones with known antioxidant, antidiabetic, and sweet tasting properties. Metab Eng, 2017, 39: 80-89. DOI:10.1016/j.ymben.2016.10.019 |
| [63] | Zhang K, Sawaya MR, Eisenberg DS, et al. Expanding metabolism for biosynthesis of nonnatural alcohols. Proc Natl Acad Sci USA, 2008, 105(52): 20653-20658. DOI:10.1073/pnas.0807157106 |
| [64] | Tang YJ, Li Y, Zhong JJ. Novel biotransformation process of podophyllotoxin to produce podophyllic acid and picropodophyllotoxin by Pseudomonas aeruginosa CCTCC AB93066. part Ⅰ: process development. Bioprocess Biosyst Eng, 2009, 32(5): 663-671. DOI:10.1007/s00449-008-0290-9 |
| [65] | Tang YJ, Xu XL, Zhong JJ. A novel biotransformation process of 4'-demethylepipodophyllotoxin to 4'-demethylepipodophyllic acid by Bacillus fusiformis CICC 20463, Part Ⅱ: process optimization. Bioprocess Biosyst Eng, 2010, 33(2): 237-246. DOI:10.1007/s00449-009-0317-x |
| [66] | Tang YJ, Zhao W, Li HM. Novel tandem biotransformation process for the biosynthesis of a novel compound, 4-(2, 3, 5, 6-tetramethylpyrazine-1)- 4'-demethylepipodophyllotoxin. Appl Environ Microbiol, 2011, 77(9): 3023-3034. DOI:10.1128/AEM.03047-10 |
| [67] | Bai JK, Zhao W, Li HM, et al. Novel biotransformation process of podophyllotoxin to 4 β-sulfur-substituted Podophyllum derivates with anti-tumor activity by Penicillium purpurogenum Y.J. Tang. Curr Med Chem, 2012, 19(6): 927-936. DOI:10.2174/092986712799034914 |
| [68] | Guo HZ, Guo DA, Fei XY, et al. Biotransformation of podophyllotoxin to picropodophyllin by microbes. J Asian Nat Prod Res, 1998, 1(2): 99-102. DOI:10.1080/10286029808039850 |
| [69] | Kumano T, Fujiki E, Hashimoto Y, et al. Discovery of a sesamin-metabolizing microorganism and a new enzyme. Proc Natl Acad Sci USA, 2016, 113(32): 9087-9092. DOI:10.1073/pnas.1605050113 |
| [70] | Guerrero E, Abad A, Montenegro G, et al. Analgesic and anti-inflammatory activity of podophyllotoxin derivatives. Pharm Biol, 2013, 51(5): 566-572. DOI:10.3109/13880209.2012.749921 |
| [71] | King LS, Sullivan M. The similarity of the effect of podophyllin and colchicine and their use in the treatment of condylomata acuminata. Science, 1946, 104(2698): 244. DOI:10.1126/science.104.2698.244 |
| [72] | Biswas D, Biswas P, Nandy S, et al. Endophytes producing podophyllotoxin from Podophyllum sp. and other plants: a review on isolation, extraction and bottlenecks. S AFR J BOT, 2020, 134: 303-313. DOI:10.1016/j.sajb.2020.02.038 |
