

1. 江南大学 未来食品科学中心,江苏 无锡 214122;
2. 江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122
收稿日期:2020-08-27;接收日期:2020-10-15
基金项目:国家自然科学基金(No. 21808084),国家重点研发计划(No. 2018YFA0900300) 资助
作者简介:刘龙??江南大学教授、博士生导师,江南大学产业技术研究院院长,国家优秀青年基金获得者,教育部同等级青年人才,科技部中青年科技创新领军人才。任期刊Systems Microbiology and Biomanufacturing的执行主编及Microbial Cell Factories等5本英文期刊编委。长期主要从事模式工业微生物枯草芽孢杆菌底盘细胞的理性设计、复杂基因线路构建与动态代谢工程研究。带领科研团队创建了系列代谢调控和过程优化控制新技术,并实现了系列重要功能营养品和大宗化学品的工业化生产。成果发表在Nature Chemical Biology、Nucleic Acids Research、Nature Communications等期刊。获国家技术发明二等奖、第四届“闵恩泽能源化工奖”杰出贡献奖等10余项国家省部级奖励.
摘要:作为一种食品安全级的典型工业模式微生物,枯草芽孢杆菌Bacillus subtilis由于具有非致病性、胞外分泌蛋白能力强以及无明显的密码子偏爱性等特点,现已被广泛应用于代谢工程领域。近年来,随着分子生物学和基因工程技术等的迅速发展,多种研究策略和工具被用于构建枯草芽孢杆菌底盘细胞进行生物制品的高效合成。文中从启动子工程、基因编辑、基因回路、辅因子工程以及途径酶组装等方面介绍枯草芽孢杆菌在代谢工程领域的研究历程,并总结其在生物制品生产中的相关应用,最后对其未来的研究方向进行展望。
关键词:枯草芽孢杆菌代谢工程基因编辑基因回路
Strategies and tools for metabolic engineering in Bacillus subtilis
Xueqin Lü1,2, Yaokang Wu1,2, Lu Lin1,2, Xianhao Xu1,2, Wenwen Yu1,2, Shixiu Cui1,2, Li Jianghua1,2, Guocheng Du1,2, Long Liu1,2


1. Science Center for Future Foods, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: August 27, 2020; Accepted: October 15, 2020
Supported by: National Natural Science Foundation of China (No. 21808084), Key Research and Development Program of China (No. 2018YFA0900300)
Corresponding author: Long Liu. Tel/Fax: +86-510-85918312; E-mail: longliu@jiangnan.edu.cn.
Abstract: As a typical food safety industrial model strain, Bacillus subtilis has been widely used in the field of metabolic engineering due to its non-pathogenicity, strong ability of extracellular protein secretion and no obvious codon preference. In recent years, with the rapid development of molecular biology and genetic engineering technology, a variety of research strategies and tools have been used to construct B. subtilis chassis cells for efficient synthesis of biological products. This review introduces the research progress of B. subtilis from the aspects of promoter engineering, gene editing, genetic circuit, cofactor engineering and pathway enzyme assembly. Then, we also summarized the application of B. subtilis in the production of biological products. Finally, the future research directions of B. subtilis are prospected.
Keywords: Bacillus subtilismetabolic engineeringgene editinggene circuit
代谢工程旨在构建稳定高效的细胞工厂,并以廉价且可持续的生物质资源为原料,生产获得包括化学品、药品、生物燃料、生物材料等在内的各种产品[1]。常被用于构建细胞工厂的微生物包括酿酒酵母、大肠杆菌、谷氨酸棒杆菌、枯草芽孢杆菌等。其中,枯草芽孢杆菌因为可以自发形成感受态,早在1958年便被开发出了简单高效的化学转化法,自此之后它便一直被作为革兰氏阳性菌的模式微生物进行研究,很多非常实用的数据库如枯草芽孢杆菌转录调控数据库DBTBS[2]和枯草芽孢杆菌百科SubtiWiki[3]等也先后建立起来。枯草芽孢杆菌具有清晰的遗传背景和完备的基因操作工具,且又被美国食品和药物管理局(Food and Drug Adminisration,FDA)认证为食品安全微生物,因此其在代谢工程领域有着非常广泛的应用[4-5](图 1)。本文将从启动子工程、基因编辑、基因回路、辅因子工程以及途径酶组装等方面介绍枯草芽孢杆菌在代谢工程领域的研究历程,并总结其在生物产品生产中的相关应用,最后对其未来的研究方向进行展望,希望可以为相关领域的研究者提供参考。
 |
| 图 1 枯草芽孢杆菌的研究历史及其在代谢工程领域的应用 Fig. 1 Research history of B. subtilis and its application in metabolic engineering. |
| 图选项 |
1 启动子工程代谢工程可以通过改变遗传调控元器件的表达强度达到优化代谢途径的目的,进而实现目的产物的高效合成。遗传调控元器件主要包括启动子、核糖体结合位点、终止子以及其他一些调控基因表达的元件。启动子是指一段能使基因进行转录的DNA序列,包括核心启动子区(?35区、?10区) 和调控区域。在转录起始时,启动子与RNA聚合酶、调控基因转录的转录因子产生相互作用,进而控制基因转录的起始时间和程度(图 2A)。通过启动子调控关键基因的表达强度是控制碳通量流向目的产物合成途径的一种常见且较为重要的调控策略。
为了表征枯草芽孢杆菌内源启动子的强度,Yang等[6]通过检测绿色荧光蛋白的强度,确定了枯草芽孢杆菌114个内源启动子的表达水平,同时根据调控蛋白表达时期的不同,将启动子分为指数阶段、对数中期和早期平稳阶段、滞后对数和平稳阶段以及平稳阶段4种类型。该研究成果不仅加深了我们对启动子调控策略的理解,同时也为研究者如何选用合适的启动子提供了较好的参考。然而,不少研究发现天然启动子的表达强度有时难以满足实际的需求。为进一步增强启动子的转录水平,Zhou等[7]以内源启动子Pylb为出发启动子,通过优化?35区和?10区核心区域、上游的调控序列以及?16位的序列,使得半乳糖苷酶的活性提高了26倍;Han等[8]通过多轮突变Psrfa启动子中?35区和?10区之间的碱基序列进行启动子文库构建,最终获得突变启动子PBH4。相较于起始启动子,PBH4的转录活性提高近3倍。Lu等[9]新开发的基于CRISPR辅助寡核苷酸退火的启动子改组策略(CRISPR-assisted oligonucleotide annealing based promoter shuffling,OAPS) 能够产生高比例的正向启动子突变体,利用该策略,最终使BLA淀粉酶的表达量比对照组(启动子为P43启动子) 提高了260倍。此外,核心区域的碱基序列对启动子的转录强度也具有明显的影响,这种影响主要归因于RNA聚合酶与启动子结合能力的强弱。
天然启动子往往还存在渗漏表达的情况,在细胞生长阶段,启动子的渗漏表达,即使少量的渗漏表达,也会使外源蛋白过早表达,进而容易抑制细胞的生长。为了解决这类问题,研究者通常在启动子中加入新的调控位点,构建双重启动子以实现降低甚至消除渗漏表达的目的。比如,刘刚等[10]将噬菌体的启动子φ105整合在枯草芽孢杆菌的基因组上,通过突变cts-52使启动子仅受到温度的诱导,再把目的基因插入到lacZ-cat盒中,使lacZ-cat受到噬菌体启动子的控制(图 2B)。Zhang等[11]将启动子PfadBA与λ噬菌体启动子和乳糖操纵子进行杂合,获得受转录因子FadR严谨调控的新启动子,并利用不同杂合启动子对脂肪酸乙酯途径的合成模块进行调控,最终使脂肪酸乙酯的产量提高了3倍。另外,对启动子的结构进行改造使其受到更严谨的调控是消除渗漏表达的另一种方法,但由于该法需要对启动子本身的结构特点具有清晰的了解,因此该类方法的应用受到了限制。此外,通过反义RNA抑制mRNA的表达也可以实现消除基因渗漏表达的目的。比如,Castillo-Hair等[12]利用反义启动子P3消除了受木糖诱导的启动子Pxyl的渗漏(图 2C)。虽然使用反义转录消除启动子的渗漏表达,无需明确启动子的结构特点,但需要对反义启动子[13-14] (反向转录目的基因的启动子) 的活性进行优化。
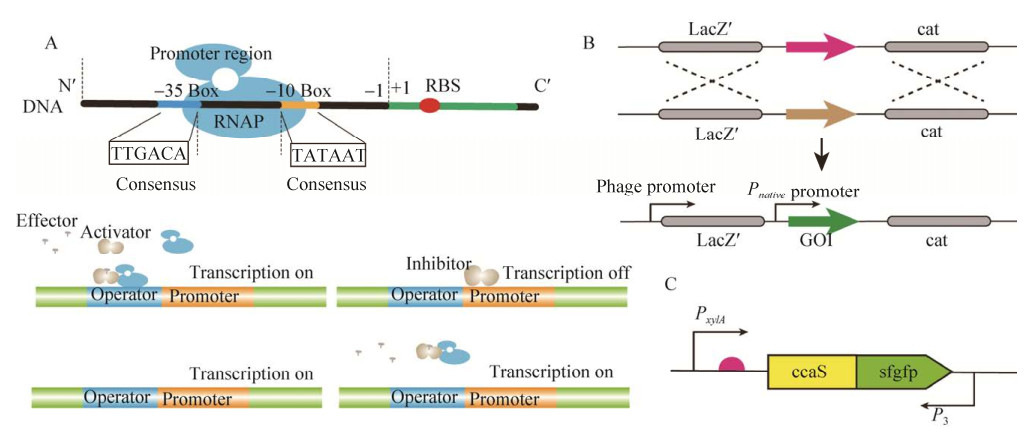 |
| 图 2 启动子的结构与调控 Fig. 2 Structure and regulation of promoter. (A) The structure of promoter and the mechanism of regulating gene expression. (B) The schematic representation of the double crossover recombination events. (C) Gene expression regulated by antisense promoters. |
| 图选项 |
为了增强启动子的特异性以及降低启动子之间的影响,不少研究者构建了合成启动子。比如,基于?35区、?10区、?16区和上游调控序列,Liu等[15]构建了枯草芽孢杆菌的第一个合成启动子文库,进一步通过统计模型分析,串联双启动子设计出重组启动子盒,其强度是组成型启动子P43的2.77倍;Wu等[16]将启动子PgamA中转录因子GamR的结合位点gamO2插入到Pveg启动子中,构建了能够响应胞内6-磷酸氨基葡萄糖的合成启动子。合成启动子能够在复杂的代谢环境中,使启动子仅受到目标代谢物的调控,即可实现更精准的表达。
核糖体结合位点(Ribosome binding site,RBS) 在RNA翻译成蛋白的过程中发挥着重要作用。在枯草芽孢杆菌中,Jiang等[17]通过RBS calculator预测对枯草芽孢杆菌的RBS进行优化,结合5′UTR突变,使几丁二糖脱乙酰酶(Diacetylchitobiose deacetylase,Dac) 的表达提高82倍,达到1 548.1 U/mL。
2 基因编辑系统因为在微生物菌株的代谢改造中会涉及大量的基因修饰,如基因敲除、基因敲入和基因突变等,所以高效可重复的基因编辑工具对代谢工程来说是必需的。为了实现对于枯草芽孢杆菌基因组的连续可重复性编辑,很多基因编辑系统被构建出来,按照其作用原理主要可以被分为3类,分别是基于反向筛选标记的基因编辑系统、基于位点特异性重组(Site-specific recombination,SSR) 的基因编辑系统和基于CRISPR的基因编辑系统。
2.1 基于反向筛选标记的基因编辑系统基于反向筛选标记的基因编辑系统主要利用了枯草芽孢杆菌自身较强的同源重组能力,直接使用双链DNA片段来对其基因组进行编辑。如图 3A所示,其实现过程如下:首先通过DNA片段两侧同源臂与基因组之间的双交换将所需的修饰引入基因组上,这一过程通常会使用抗性基因作为筛选标记来获取阳性克隆;为了实现对基因组的连续编辑,必须将上一步所使用的抗性基因从基因组上去除,因此会在抗性基因两端加入一对同向重复序列诱导基因组发生单交换;为了能够快速获得正确的克隆,会将反向筛选标记与抗性基因一起置于同向重复序列之间,利用其条件性致死作用,筛选发生单交换后抗性基因和反向筛选标记都被除去的克隆。目前枯草芽孢杆菌中报道的反向筛选标记基因主要包括upp[18]、mazF[19]、hewl[20]和manP[21]等。然而,使用此方法时,除了要表达抗性基因外,还要表达反向筛选标记基因,而反向筛选标记基因一般还需要使用严谨的诱导型启动子表达,因此通常还要表达相应的阻遏蛋白。这就使得基因编辑时所需的辅助片段非常大,这对于DNA片段的构建是非常不利的,同时还会降低该片段在转化枯草芽孢杆菌时的效率。
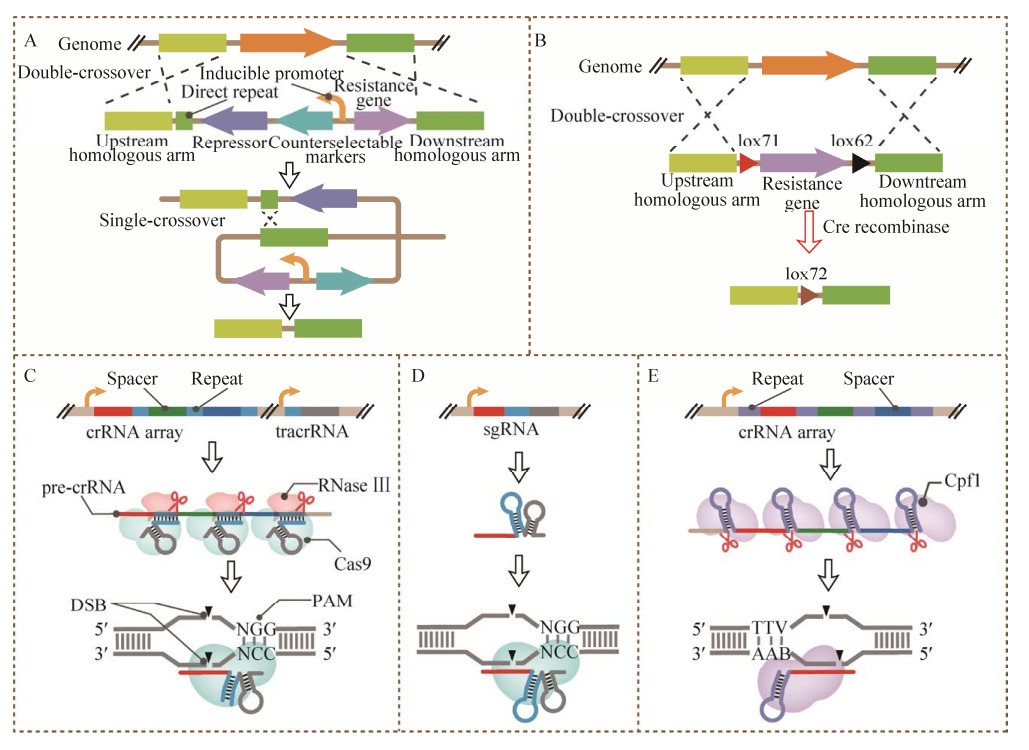 |
| 图 3 枯草芽孢杆菌的基因编辑系统 Fig. 3 Gene editing system of B. subtilis. (A) Genome editing system based on counter-selectable marker. (B) Genome editing system based on site-specific recombination. (C) Genome editing using CRISPR/Cas9 guided by crRNA array and tracrRNA. (D) Genome editing using CRISPR/Cas9 guided by sgRNA. (D) Genome editing using CRISPR/Cpf1 guided by crRNA array. |
| 图选项 |
2.2 基于位点特异性重组的基因编辑系统基于位点特异性重组的基因编辑系统同样使用含有同源臂的DNA片段将所需修饰引入到枯草芽孢杆菌的基因组上,一般也会使用抗性基因进行阳性克隆的筛选,但是抗性基因的消除过程则主要依赖于位点特异性重组酶。在该酶的作用下,两个反向的特异性识别位点之间的DNA片段会发生180°的旋转,而两个同向的识别位点之间的片段则会被消除,因此可以不再使用反向筛选标记基因。比如常用的Cre/lox系统[22],其基因编辑原理如图 3B所示:在抗性基因两端加入了2个同向的可以被Cre酶识别的重组位点lox71和lox62,这样完成基因编辑后通过诱导Cre酶表达,便可将lox71和lox62之间的抗性基因去除,并形成新的重组位点lox72。虽然lox72位点间发生重组的效率远低于其他lox位点之间重组效率,但是lox72之间仍有一定的几率发生重组(约为lox71和lox62的10%)[22]。因此,若基因组上残留有过多的lox72位点,那么稍有不慎就会发生不可知的DNA片段倒置乃至缺失。
2.3 基于CRISPR的基因编辑系统CRISPR是成簇的规律间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats),它是细菌和古菌抵御外来病毒入侵的一种获得性免疫系统,可以识别并切割特定的DNA或RNA序列。根据发挥切割作用的效应蛋白的组成可以将其分为2类(Class),根据具体的响应模式又可将其分为6种型(Type)[23]:第1类CRISPR系统的效应蛋白组成较为复杂,是由多个亚基组成的蛋白复合体,因此不太适合被用作构建基因编辑系统;而第2类CRISPR系统的效应蛋白的组成则简单得多,都是具有多结构域的单一蛋白,因此目前基于CRISPR的基因编辑系统绝大部分都是由第2类CRISPR系统改造而来的。其中应用最为广泛的则属第2类第Ⅱ型的CRISPR/Cas9系统[24],其作用原理如图 3C所示:首先包含特异性靶点信息的间隔重复(Spacers-repeats) 序列被转录为前体CRISPR RNA (pre-CRISPR RNA,pre-crRNA);然后反式激活RNA (trans-activating crRNA,tracrRNA) 会和pre-crRNA中的重复序列发生互补配对,并引导RNA酶Ⅲ (Ribonuclease Ⅲ,RNase Ⅲ) 对pre-crRNA进行切割,形成成熟的crRNA;之后tracrRNA: crRNA二聚体与Cas9蛋白形成的三元复合体可以识别位于前间区序列邻近基序(Protospacer adjacent motif,PAM) 5′端的目标靶点并对DNA的磷酸二酯键进行切割,产生具有平末端的双链断裂(Double strand break,DSB);最后通过导入特定的同源修复模板,便可以在修复该双链断裂的同时将所需的修饰引入到基因组上,同时将原本的识别靶点进行删除或突变使得该位点不再被切割;由于双链断裂是致死的,可以像抗性基因一样直接用来筛选阳性克隆,而且无需再使用和去除抗性基因。实际应用中为了进一步对该系统进行简化,并避免tracrRNA及RNase Ⅲ对基因编辑的影响,常常会将crRNA与tracrRNA进行嵌合得到单一引导RNA (Single guide RNA,sgRNA),这样只需要表达一个Cas9和一个sgRNA便可以对选定的DNA位点进行切割(图 3D)。
枯草芽孢杆菌中已经有很多利用CRISPR/Cas9构建的基因编辑系统,如表 1所示,既可以将Cas9和sgRNA放置于同一质粒上,也可以将其分开放置于两个质粒上,甚至可以将它们整合到基因组上。由于Cas9蛋白自身的长度超过4 000 bp,加上为了提高转化效率,基因编辑所需的同源模板也常会被放置于质粒上,所以单质粒的系统质粒非常大,因此,质粒的构建上可能存在难度。对于基因组整合来说,为了实现基因组的连续可重复编辑,完成一轮编辑后需要将所使用的sgRNA和同源模板去除掉,然后再导入下一轮基因编辑所需的sgRNA和同源模板,因此基因组整合的方式不太利于连续的基因编辑,但是该方式在其他方面具有较好的应用,如预防噬菌体感染。因此总体而言,目前最佳的解决方案应该是双质粒系统,在基因编辑过程中Cas9的表达载体可以一直保留,每轮基因编辑只需要转化另外一个含有不同sgRNA和同源模板的质粒即可。
表 1 枯草芽孢杆菌中基于CRISPR的基因编辑系统Table 1 Gene editing system based on CRISPR in B. subtilis
| Classification | Effector | Application (efficient) | Reference |
| Single plasmid system | Cas9 | Single gene inactivation (33%–55%) | [25] |
| Cas9 | Knocking out of a 25.1 kb fragment (89%) and a 4.1 kb fragment (97%) | [26] | |
| Cas9 | Single point mutation (100%) and single gene knock-out (100%) | [27] | |
| Cas9 | Single gene editing (76%) | [28] | |
| Cas9 | Single gene editing (97%) | [29] | |
| dCas9-AID | Base editor: three points mutation (100%) and four points mutation (100%) | [30] | |
| Genome integration | Cas9 | Single gene knock-out (100%), double genes knock-out (85%), and single gene knock-in (69%) | [31] |
| Cas9 | Prevent phage SPP1 infection | [32] | |
| Double plasmid system | Cas9 | Single point mutation (68%), single gene knock-out (100%), and single gene knock-in (97%) | [33] |
| nCas9 | Three points mutation (65%), single gene knock-out (80%), and single gene knock-in (90%) | [34] | |
| Cpf1 | Double genes knock-out (100%), six points mutation (100%), and single gene knock-in (100%) | [35] |
表选项
除了CRISPR/Cas9以外,在枯草芽孢杆菌中也开发了基于第2类第Ⅴ型CRISPR/Cpf1 (也称CRISPR/Cas12a) 的基因编辑系统。如图 3E所示,Cpf1不仅可以像Cas9一样对DNA进行切割产生双链断裂,也可以对pre-crRNA进行加工产生成熟的crRNA,而且这一过程并不需要tracrRNA的参与,最后在crRNA与Cpf1形成的二元复合物的作用下完成对目标靶点的识别和切割。因此,Cpf1更加适合于多个基因的同时编辑。Wu等[35]在枯草芽孢杆菌中构建了一个基于CRISPR/Cpf1的双质粒基因编辑系统,分别将Cpf1和crRNA放置到2个载体上,同时,为了提高同源重组的效率,来自格氏嗜盐碱杆菌Natronobacterium gregoryi的Argonaute (NgAgo)蛋白也被放置于Cpf1载体上。通过设计包含多个靶向序列的crRNA阵列,该系统可以一次性完成双基因敲除、6个位点的突变以及单个基因的敲入;而且他们还设计了一种crRNA阵列的构建方法SOMACA (Synthetic oligos mediated assembly of crRNA array),可以直接利用不超过59 bp的核苷酸得到任何需要的crRNA阵列,这大大降低了构建crRNA阵列的时间成本和经济成本。
基于CRISPR的单碱基编辑器由于不依赖于双链断裂和同源模板,近年来受到了人们的广泛关注[36]。通过将胞嘧啶脱氨酶与DNA酶活力失活的Cas蛋白突变体dCas9或dCpf1进行融合,然后借助Cas蛋白的特异性DNA识别作用将胞嘧啶脱氨酶靶向到基因组的特定位点,便可利用脱氨作用直接将胞嘧啶转化为胸腺嘧啶。最近由单质粒组成的单碱基编辑器在枯草芽孢杆菌也被开发了出来,其中dCas9和来自八目鳗的诱导激活胞嘧啶脱氨酶(Activation-induced cytidine deaminase,AID) 构成的融合蛋白dCas9-AID由IPTG诱导型启动子Pgrac驱动表达,所需的sgRNA可以通过Golden Gate组装到质粒上,利用该系统可分别以100%和50%的效率实现对于3个和4个位点的同时编辑[30]。
当然,上述基于CRISPR的基因编辑系统也存在一些问题需要解决。首先是潜在的脱靶效应,即Cas蛋白可能会结合到与目标靶点序列相近的位点。这一问题在经典的基于双链断裂的系统中一般不会有影响,因为在枯草芽孢杆菌等原核生物中,这些不存在同源模板处的双链断裂是一定会致死的,所以只有提供了同源模板的选定位点才能发生有效的基因编辑。但是不依赖于双链断裂的单碱基编辑系统则很有可能会受到这一问题的影响。解决脱靶效应可从以下两个方面入手:一是通过软件算法来优化引导RNA的设计,尽量避免其与非特异性位点的结合[37];二是对Cas蛋白进行突变,降低其对不完全匹配序列的容忍度[38]。另外一个问题是目前枯草芽孢杆菌中构建的基于CRISPR的基因编辑系统在进行基因敲入时相对大肠杆菌效率比较低,这可能还是受限于枯草芽孢杆菌的同源重组效率,而各式各样的CRISPR则为我们提供了潜在的解决方案。比如最近报道的同样也属于第2类第Ⅴ型的CRISPR相关的转座酶系统,可以在Cas12K蛋白和转座酶TnsBC及TniQ形成的复合体的作用下以很高的效率将外源DNA片段敲入到基因组的特定位点[39],将来利用这一系统很有可能在枯草芽孢杆菌中构建一套便捷高效的基因敲入工具。
3 基于基因回路的动态调控策略传统的代谢工程策略,例如强化产物合成途径和敲除竞争途径,容易造成胞内代谢流失衡以及中间代谢物积累,导致难以实现目的产物的高效合成[40]。随着合成生物学的发展,新兴的动态调控策略则能够动态平衡胞内代谢流,从而使微生物细胞工厂高得率、高转化率和高生产强度地生产目的产物[41-42]。基因回路是动态控制胞内代谢流的核心装置。一个标准的基因回路由信号输入、能够响应或传递信号的调控元件以及信号输出组成。基因回路可以根据输入的信号强弱,在调控元件的作用下,输出相应的信号,从而实现对胞内代谢流的实时监测和调控[43](图 4)。其中,输入的信号可以为胞外的环境扰动(光照、温度和pH等)、胞内的产物或中间代谢物浓度以及细胞密度等;输出的信号大多为荧光强度、抗生素抗性以及目的基因的表达量等[44]。调控元件是基因回路行使功能的核心元件,目前常用的调控元件分为两大类:核糖开关和转录因子,它们能够接收特定的信号分子、控制和调节输出信号的强弱[45]。
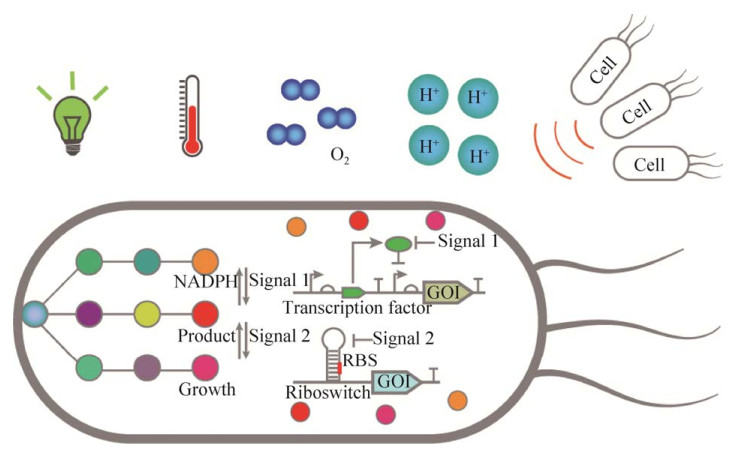 |
| 图 4 基于基因回路的代谢流动态控制 Fig. 4 Dynamic control of metabolic flow based on gene circuit. |
| 图选项 |
3.1 响应发酵环境变化的基因回路在发酵过程中,发酵参数的变化将直接影响目的产物的产量与得率,因此,可以通过控制和改变发酵参数,激活或抑制胞内转录因子的活性,从而调控相关基因的表达水平,进而改变菌株的生长与生产状况。目前已经有多个研究表明,基于发酵参数的基因回路在胞内代谢流动态调控中的应用可以促进相应化合物的高效合成[46-47]。相对于传统的化学诱导剂,由于光信号低毒、廉价且具有即时性,已被广泛地应用于基因回路的构建。例如,Castillo-Hair等[12]通过将来源于集胞藻Synechocystis PCC6803的光诱导系统CcaSR导入到枯草芽孢杆菌中,使枯草芽孢杆菌获得响应光信号的能力。CcaSR系统包含响应光信号的CcaS激酶和效应蛋白CcaR。其中,CcaS通过共价结合线性四吡咯发色团藻蓝蛋白(PCB) 获得响应光信号的能力,PCB能够被绿光(535 nm) 诱导使CcaS激酶处于激发态,CcaS激酶活化CcaR蛋白,CcaR调控下游基因的转录。而激发态的PCB能够被红光(672 nm) 诱导重新返回无活性的基态,从而解除CcaR蛋白的调控效果,达到动态调节胞内目的基因表达水平的效果。进一步优化CcaSR系统中PCB、CcaS和CcaR模块的表达强度,使基于CcaSR系统的基因回路在枯草芽孢杆菌中的动态范围达到70倍[12]。
3.2 响应胞内代谢物的基因回路微生物体内存在复杂的调控网络以调控胞内代谢流的走向。随着组学技术的发展,胞内的代谢与调控网络逐渐被揭示,而大量响应不同代谢物的转录调控因子也成功被挖掘出来,并建立了RegulonDB、Sigmol和TRANSFAC等[48-49]相应的数据库。这些转录因子可以作为基因回路的核心元件,被用以构建能够响应不同代谢物的基因回路进行代谢网络的动态调控。例如,Wu等[16]基于响应6-磷酸氨基葡萄糖(GlcN6P) 的转录因子GamR,构建了一系列具有不同动态范围的GlcN6P响应双功能基因回路,并通过此基因回路动态激活枯草芽孢杆菌中乙酰氨基葡萄糖(GlcNAc) 的合成途径,同时动态抑制GlcNAc的竞争途径,最终构建了依赖于胞内GlcN6P浓度的反馈回路,使GlcNAc在15 L发酵罐上的产量由81.7 g/L提高至131.6 g/L。
除了转录因子,核糖开关也被广泛应用于基因回路的构建。随着指数富集的配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX) 的发展,目前已成功筛选出多种能够响应不同化合物的RNA/DNA适配体,这些RNA适配体被设计和构建成为可以响应相应化合物的人工核糖开关[50]。比如,Deng等[51]基于响应凝血酶的DNA适配体构建了凝血酶激活型基因回路,同时基于响应凝血酶的RNA适配体构建了凝血酶抑制型基因回路,从而获得了可以响应胞内凝血酶浓度的双功能基因回路,进一步利用该基因回路,动态上调了枯草芽孢杆菌中2′-岩藻糖基乳糖合成途径基因的表达水平,并动态下调了竞争途径基因的表达水平,最终使2′-岩藻糖基乳糖产量提高了27.3倍,达到674 mg/L。
3.3 响应细胞密度的基因回路响应细胞密度的基因回路——群体感应系统(Quorum sensing,QS) 是微生物为维持自身种群数量而调控胞内相关基因表达的转录调控系统,这些基因包括生长必需基因、形态分化基因和一些次级代谢产物合成的相关基因等。相对于上述的两种动态调控策略,群体响应系统不依赖于外界信号以及胞内的代谢物浓度,仅受到由自身分泌的自诱导物调控[52]。目前研究得最深入的群体响应系统是费氏弧菌Vibrio fischeri的LuxI-LuxR系统:菌株在生长过程中,LuxI不断地合成自诱导物酰基高丝氨基内酯(N-Acyl-homoserine- lactones,AHLs),当菌群生长到一定密度时,胞外的AHL积累并达到浓度阈值,激活LuxR蛋白,LuxR进一步调控下游基因的表达。Corrêa等通过将LuxI-LuxR系统引入到枯草芽孢杆菌中,并用其调控维生素B12合成途径相关基因的表达,结果显示,与组成型表达维生素B12合成途径的相关基因相比,LuxI-LuxR系统使维生素B12的合成与细胞的生长相耦合,最终维生素B12的产量也得到了相应的提高[53]。枯草芽孢杆菌自身也存在群体响应系统Phr60-Rap60-Spo0A。相对于外源群体响应系统,内源群体响应系统能够避免外源蛋白导入对细胞造成的代谢负担。Cui等[54]通过重构枯草芽孢杆菌自身的群体响应系统构建了响应细胞密度的双功能基因回路,并利用其动态上调维生素K2合成途径相关基因的表达,同时下调竞争途径相关基因的表达,最终使维生素K2的产量提高了40倍,达到360 mg/L。
4 辅因子工程酶是细胞生长代谢过程中不可或缺的催化元件,酶的丰度和活性共同决定了物质合成途径中的代谢流通量。过表达基因可以在一定程度上提高酶的丰度,但当基因表达量达到一定阈值后,酶的丰度与活性却无法呈正相关性,即随着酶丰度的提高,酶的催化效率却不会随之增加[55]。同时,大量的基因过表达会给细胞自身代谢带来负担,其中一个重要的原因就是忽视了辅因子在代谢途径中的关键作用[56]。辅因子是能结合特定蛋白并使其能够实现正常催化活性的一类物质,包括NADP (H)、NAD (H)、ATP/ADP、GTP/GDP等。辅因子工程,指的是基于分子生物学、代谢工程等技术,通过改造、重构胞内辅因子的生成途径,调节辅因子的胞内浓度与存在形态,平衡胞内氧化还原平衡、调控能量供给,进而影响关键酶的催化活性与效率,最终实现代谢通量最高效、最大值地流向目标代谢途径的一种代谢工程策略[4]。辅因子工程主要包括增强辅因子生产途径、平衡辅因子作用形态、重构辅因子生产途径等改造策略(图 5)。
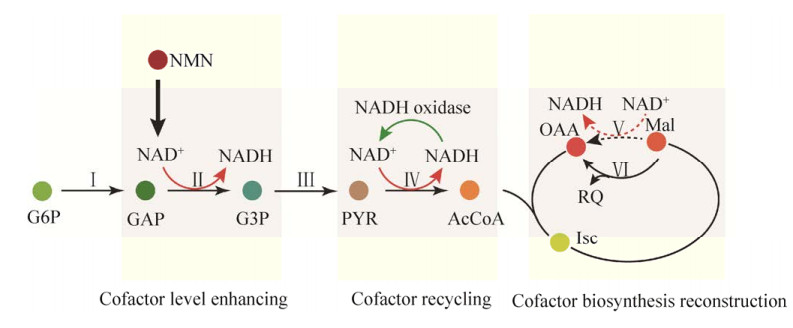 |
| 图 5 辅因子工程的三大策略 Fig. 5 Three strategies of cofactor engineering. G6P: Glucose 6-phosphate; GAP: Glyceraldehyde 3-phosphate; G3P: 3-phosphoglycerate; PYR: Pyruvate; AcCoA: Acetyl-CoA; Isc: isocitric acid; Mal: Malate; OAA: Oxaloacetic acid; NMN: beta-nicotinamide mononucleotide; RQ: Reduced quinone. Step Ⅰincludes: pgi (glucose-6-phosphate isomerase); pfkA (6-phosphofructokinase); fbaA (fructose-bisphosphate aldolase); Step Ⅱ includes: gapB (glyceraldehyde 3-phosphate dehydrogenase); pgk (phosphoglycerate kinase); Step Ⅲ includes: pgm (2, 3-bisphosphoglycerate- independent phosphoglycerate mutase); eno (enolase); pyk (pyruvate kinase); Step Ⅳ includes: pdhA (pyruvate dehydrogenase E1 component subunit alpha); acoC (pyruvate dehydrogenase E2 component); Step Ⅴ includes: endogenous malate dehydrogenase; Step Ⅵ includes: BmqO (malate dehydrogenase). |
| 图选项 |
4.1 增强辅因子生产途径辅因子供给不足是限制代谢流通量的主要因素之一,强化胞内辅因子的合成途径,增加所需辅因子浓度可以较好地解除代谢流通量瓶颈限制。GMP、GDP、GTP等辅因子是细胞DNA复制、转录过程中不可或缺的鸟苷核苷类物质,这类辅因子在细胞内可以通过生化反应实现相互转化,且GTP可以与ATP相互转化,并为许多生化反应提供能量。在枯草芽孢杆菌发酵产岩藻糖基寡糖的过程中,GTP不仅提供了能量,而且还充当了影响代谢合成效率的关键底物——GDP-l-岩藻糖合成代谢的GDP供体。基于此,Deng等[57]对GMP、GTP、GDP生产途径进行了针对性的改造:强化表达鸟苷酸激酶、核苷二磷酸激酶、黄嘌呤磷酸核糖基转移酶,用以提高胞内GTP的浓度,最终使GDP-L-岩藻糖的浓度提高了3.97倍。
4.2 辅因子平衡胞内辅因子浓度的相对平衡是实现酶催化效率最大值的另一重要条件。单方面强化某一辅因子的供给途径虽能有效地解除代谢流通量限制,但会因某一种辅因子浓度过高而造成细胞内环境稳态失衡。NADP (H)、NAD (H) 是胞内具有代表性的一类辅因子,它们的相对浓度比决定着胞内的氧化还原状态,而氧化还原平衡是实现发酵过程最大化理论得率的一个重要前提条件。当氧化力与还原力平衡时,目标产物理论得率较高;当氧化力与还原力失衡时,多余的氧化力或还原力则会被用于副产物合成、菌体生长等过程,以重新实现胞内的氧化还原平衡状态。当NADH的浓度较高时,细胞的呼吸耗氧量较高,细胞处于过氧化状态,底物消耗加快,经济效益降低。以枯草芽孢杆菌为出发菌株发酵生产N-乙酰氨基葡萄糖时,GlcNAc的合成代谢会导致NADH的过剩,而过剩的NADH会被利用于NADH依赖性副产物2, 3-丁二醇等物质的合成[58]。基于此,Gu等[58]首先在细胞内过表达NADH氧化酶来实现胞内氧化还原平衡,NADH氧化酶是以O2为电子受体,能够将NADH氧化为NAD+和水,然而,当使用强组成型启动子P43表达NADH氧化酶时,由于氧化酶表达量过多,胞内无法实现氧化还原平衡,GlcNAc的发酵产量仅为0.86 g/L,因此,进一步利用启动子工程对NADH氧化酶进行调节,使得GlcNAc的发酵产量最终达到了12.46 g/L。
4.3 重构辅因子生成途径表达NADH氧化还原酶是平衡胞内氧化还原力的常用手段之一,但非代谢偶联表达NADH氧化还原酶会导致细胞内能量的紊乱、损耗,进而影响菌株的生长代谢,无法实现发酵高产量、高得率、高生产强度的相对统一。重构辅因子生成途径能有效避免非代谢偶联表达NADH氧化还原酶所造成的胞内代谢紊乱。研究者发现表达不会产生额外NADP (H)、NAD (H) 等辅因子的同工酶来代替部分内源性酶的催化效果,可以在保证菌株正常生长代谢的同时,实现辅因子的相对平衡,比如,在产GlcNAc的工程菌中重构还原力代谢途,引入蜡样芽孢杆菌Bacillus cereus来源的丙酮酸铁氧还蛋白氧化还原酶PorAB、苹果酸脱氢酶BmqO以及海沼甲烷球菌Methanococcus maripaludis KA1来源的甘油醛-3-磷酸脱氢酶GoR,分别实现丙酮酸到乙酰辅酶A、苹果酸到草酰乙酸和甘油醛-3-磷酸到3-磷酸甘油酸的催化过程,避免NADH的过剩,进而实现胞内氧化还原平衡,最终使GlcNAc的发酵产量提高了4.06倍[58]。
尽管许多研究已运用辅因子工程策略对目标产物代谢合成进行优化,但我们对细胞内复杂的辅因子平衡调节机制仍知之甚少。且随着合成生物学的发展,构建非宿主代谢物合成途径已成为解决资源可持续问题的有效手段[59],但重构代谢途径中的酶催化往往需要特定的辅因子,宿主会存在辅因子供给不足或缺少适合辅因子等代谢瓶颈限制。因此,揭示辅因子的合成、分布、运输和调节机制是建立更加高效的辅因子工程策略的必要条件。
5 途径酶组装通过外源引入合成途径进行高附加值目标产物的生物合成已成为代谢工程领域的一项基础性策略,然而,目标产物结构复杂性的提高决定了产物合成途径所涉及的途径酶种类和数量也随之增加,进而容易造成宿主细胞代谢失衡,甚至出现中间代谢产物对宿主细胞产生毒害作用等系列问题[60-61]。为了研究上述问题,研究者提出了途径酶组装策略,该策略指的是在空间上将途径酶进行组装使其形成多酶复合体,提高途径酶和代谢物的局部浓度,从而提高途径酶的催化效率,避免中间产物的累积,同时还可以降低中间产物与宿主细胞其他组分的交叉反应,甚至可以通过调控关键酶的化学计量比对生物合成途径进行精准调控[62-63]。伴随着合成生物学的快速发展,途径酶组装策略因在代谢通量调控方面的独特优势,目前已成为代谢工程领域的研究热点之一。常用的途径酶组装策略主要有无支架酶组装[64-65]、DNA支架[66-67]、RNA支架[68]、蛋白支架[69](图 6A)、真核细胞的物理隔区[70]以及细菌微区室[71](图 6B) 等策略。
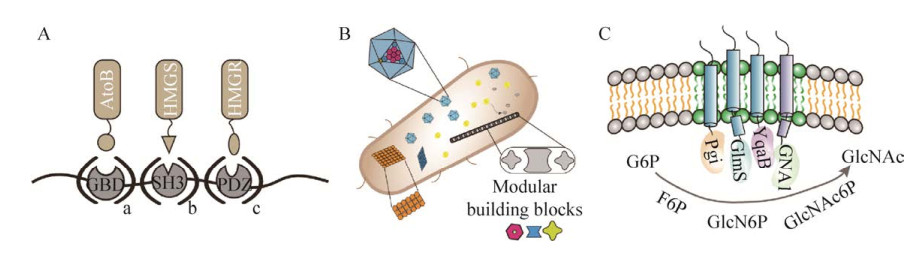 |
| 图 6 酶组装策略 Fig. 6 Enzyme assembly strategy. (A) Using protein scaffolds to assemble enzymes. (B) Enzyme assembly using cell microchambers. (C) Using functional membrane domains for protein assembly. |
| 图选项 |
迄今为止,在枯草芽孢杆菌中进行途径酶组装的相关研究还不多,较为经典的一项研究便是DNA支架在枯草芽孢杆菌中的有效应用。Liu等[72]通过利用锌指蛋白ADB3和ADB2的特异性结合特性将N-乙酰氨基葡萄糖(GlcNAc) 合成途径中的2个关键酶——氨基葡萄糖合酶(GlmS) 和氨基葡萄糖-6-磷酸乙酰化酶(GNA1) 共定位在DNA支架上,并将两者的化学计量比和酶催化效率之间的相关性进行了分析和研究,发现GlmS和GNA1的共定位和化学计量比调控显著提高了N-乙酰氨基葡萄糖的产量,产量由1.83 g/L增至4.55 g/L。另外,考虑到已报道的支架结构都是通过质粒外源引入的,容易加重细胞代谢负担或者引起代谢过程不稳定,为了避免上述问题,Lv等[73]尝试着通过活体单分子技术发掘可用于途径酶组装的细胞自身结构类物质,最终发现枯草芽孢杆菌质膜上的功能膜微域(Functional membrane microdomains,FMMs) 具有较好的时空稳定性,可以用作组装途径酶的内源性空间支架。之后,以枯草芽孢杆菌合成GlcNAc为例,利用SPFH (Stomatin-prohibitin-flotillin-HflC/K) 结构域将GlcNAc合成所需的途径酶依次锚定在FMMs上获取FMMs-多酶复合物系统(图 6C),结合动力学模型和代谢动力学分析,发现该系统可以形成一条较完整的底物通道,最终显著提高GlcNAc的产量[73]。在此基础上,对该系统,特别是FMMs进行了理性改造,发现FMMs在细胞质膜上的占比提高,可以有效增加途径酶的固定效果,增强代谢流,从而提高产物的合成量,同时还可以提升细胞的耐受性[74]。
6 枯草芽孢杆菌底盘细胞的应用天然化合物及其衍生物在食品添加剂、功能营养品等产品的开发过程中扮演者重要的角色,然而,目前商业用的天然化合物主要依赖于植物提取,提取率低,无法满足市场需求。通过在微生物底盘细胞中重构与优化天然化合物的生物合成途径,可以实现目标化合物的从头合成,为结构复杂的植物天然化合物的规模化制备提供了新策略。目前,选择枯草芽孢杆菌作为底盘细胞合成各类天然化合物已受到诸多研究者的青睐。迄今为止,通过基因编辑等代谢工程研究策略和技术手段获取的各类枯草芽孢杆菌底盘细胞已经成功地合成了众多具有高价值的产品,如鲨肌醇(Scyllo-inositol,SI)[75-76]、角鲨烯(Squalene)[77]、紫穗槐二烯[78]、N-乙酰氨基葡萄糖[58, 79-81]、透明质酸[82]、硫酸软骨素[83]、七烯甲萘醌[54, 84]、核黄素[85-86]等(图 7)。
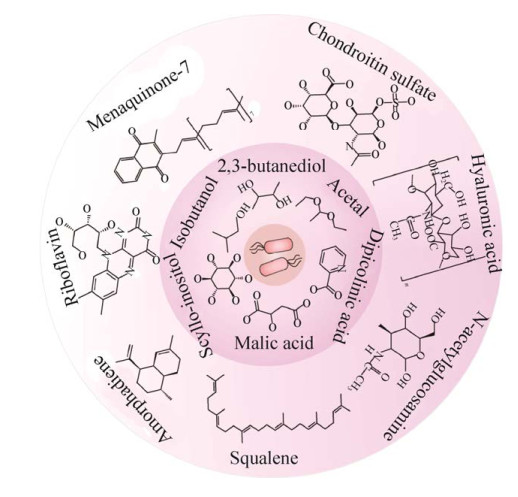 |
| 图 7 枯草芽孢杆菌底盘细胞生产的典型天然化合物 Fig. 7 Typical bio-chemicals produced by B. subtilis chassis cell. |
| 图选项 |
其中,鲨肌醇是一种稀有的肌醇立体异构体,被认为是阿尔茨海默氏病的有效治疗剂。Tanaka等[75, 87-88]以枯草芽孢杆菌为出发菌株,开发出了由肌肉肌醇(Myo-inositol,MI) 转化生成鲨肌醇的细胞工厂。第一代SI细胞工厂通过敲除iolR、iolX和iolI三个基因,并引入错义突变iolE41构建的细胞工厂,但该工程菌株只能将一半的MI转换成SI;进一步过表达肌醇-2-脱氢酶IolG和鞘氨醇-2-脱氢酶IolW而构建的第二代SI细胞工厂,可以将10 g/L的MI完全转化成等量的SI[88]。然而,与葡萄糖相比,选择MI作为原料势必具有更低的商业价值。为了使枯草芽孢杆菌可以利用葡萄糖直接合成SI,Michon等[76]将来源于结核分枝杆菌的编码肌醇-1-磷酸合酶(MI1PS) 的基因ino1引入枯草芽孢杆菌中,使6-磷酸葡萄糖(G6P) 可以转化为MI1P,MI1P在肌醇单磷酸酶(IMP) 的作用下被磷酸化为MI,随后被异构化为SI,进一步敲除编码嘌呤转运蛋白基因pbuE以助于提高细胞内MI1PS催化所需辅因子NAD+和NADH的浓度,同时过表达葡萄糖转运蛋白GlcP和葡萄糖激酶GlcK提高G6P的浓度,最终可以将20 g/L葡萄糖转化生成2 g/L鲨肌醇。
作为一种无环的类异戊二烯,角鲨烯是合成许多生物活性三萜类化合物的重要中间体,具有抗氧化、增强免疫系统等多种生理活性,被广泛作为添加剂用于食品和个人护理行业。角鲨烯是在角鲨烯合酶(Squalene synthase,SQS) 的作用下,将两分子焦磷酸法呢酯(Farnesyl pyrophosphate,FPP) 催化形成角鲨烯焦磷酸酯(Presqualene pyrophosphate,PSPP),随后在辅因子NADPH的作用下,经碳骨架重排形成角鲨烯。最近,Song等[77]将来不同来源的4种SQS (BaSQS、BmSQS、PgSQS和ScSQS) 引入至枯草芽孢杆菌168中,并上调MEP途径中的8个基因dxs、ispD、ispF、ispH、ispC、ispE、ispG和ispA,结合培养温度和提取工艺的优化,分批补料发酵结果显示,枯草芽孢杆菌中的角鲨烯产量高达2 g/L。
除了用于众多天然产物的合成外,枯草芽孢杆菌还被用于各种工业酶的开发,如β-环糊精糖基转移酶[25, 89]、α-淀粉酶[90-91]、L-天冬酰胺酶[92]、纳豆激酶[93]、氨肽酶[94]等。其中,β-环糊精是一种通过β-环糊精糖基转移酶(β-CGTase) 催化的环状低聚糖,被广泛用于医药辅料和食品添加剂行业。Zhang等[25]采用CRISPR-Cas9编辑系统,构建了包含靶标特异性的sgRNA、Cas9和同源修复模板的多合一敲除质粒,用于敲除枯草芽孢杆菌ATCC 6051a中与孢子形成相关的5个基因(srfC、spoⅡAC、nprE、aprE、amyE),获得的突变株ATCC 6051a BS5在高密度发酵过程中,孢子萌发率大幅度降低,能够稳定地产生重组蛋白,胞外分泌的β-环糊精糖基转移酶(β-CGTase) 活性达到277.8 U/mL。此外,研究者还开发了双启动子PHpaⅡ-PamyQ'表达系统,使报告蛋白β-CGTase在枯草芽孢杆菌CCTCC M 2016536中的胞外表达量达到571.2 U/mL[89]。
碱性淀粉酶在淀粉和纺织工业中在高pH条件下具有水解淀粉的潜在应用,可作为自动洗碗机和洗衣店洗涤剂的成分。其中,α-淀粉酶能够水解淀粉和各种其他类型的寡糖中的α-1, 4-糖苷键,已广泛用于食品、造纸和纺织工业。Ying等[90]通过比较枯草芽孢杆菌中4种不同启动子(Pgrac、PxylA、P43和Phag) 的表达强度和3种信号肽(SPEpr、SPYncM和SPamyQ) 的分泌效率,发现采用启动子PxylA 和信号肽SPamyQ表达α-淀粉酶时,大约90%的α-淀粉酶可以分泌到培养基中,有效提高了α-淀粉酶在枯草芽孢杆菌中的胞外分泌能力。除了启动子和信号肽这两类遗传元件外,伴侣蛋白、二硫键的形成以及折叠质量也会影响淀粉酶的产生速率和数量[95]。例如,Chen等[91]通过过表达Sec分泌途径中的脂蛋白PrsA和分子伴侣DnaK可以有效提高α-淀粉酶(AmyL和AmyS) 的分泌效率,在7.5 L发酵罐中分批补料发酵中,重组枯草芽孢杆菌1A237分泌的AmyL和AmyS可分别达到1 352 U/mL和2 300 U/mL。由此可见,枯草芽孢杆菌作为底盘细胞用于生产工业酶制剂也具有很大的应用前景。
7 总结与展望枯草芽孢杆菌作为GRAS菌株,在食品、医药、养殖等行业有着极大的应用市场与前景。利用代谢工程技术对细胞进行目的性改造,构建高鲁棒性的底盘细胞是提升其工业化应用潜能与范围的有效策略之一。基于CRISPR基因编辑系统,利用启动子工程、酶工程、辅因子工程、动态调控等策略可以实现底盘细胞高产量、高得率、高生产强度的相对统一。然而当前底盘细胞的设计与构建过程仍较为烦琐,且经过复杂的测试步骤后也较难获得具有普适性的代谢规律。因此,如何提高设计-构建-测试-总结这一循环的效率已成为亟待解决的难题之一。合成生物学、系统生物学及多学科的交叉结合将成为解决这一难题的突破口。一方面,人工智能、机器学习与多组学学科的交叉结合对注释基因功能、解析调控机制、揭示生命规律提供了保证;另一方面,通过定向进化、计算工具或从头合成非天然的酶或调控蛋白也为构建高版本底盘细胞带来了新的机遇。
参考文献
| [1] | Choi KR, Jang WD, Yang D, et al. Systems metabolic engineering strategies: integrating systems and synthetic biology with metabolic engineering. Trends Biotechnol, 2019, 37(8): 817-837. DOI:10.1016/j.tibtech.2019.01.003 |
| [2] | Sierro N, Makita Y, De Hoon M, et al. DBTBS: a database of transcriptional regulation in Bacillus subtilis containing upstream intergenic conservation information. Nucleic Acids Res, 2008, 36(D1): D93-D96. |
| [3] | Zhu BY, Stülke J. SubtiWiki in 2018: from genes and proteins to functional network annotation of the model organism Bacillus subtilis. Nucleic Acids Res, 2018, 46(D1): D743-D748. DOI:10.1093/nar/gkx908 |
| [4] | Gu Y, Xu XH, Wu YK, et al. Advances and prospects of Bacillus subtilis cellular factories: from rational design to industrial applications. Metab Eng, 2018, 50: 109-121. DOI:10.1016/j.ymben.2018.05.006 |
| [5] | Xiang MJ, Kang Q, Zhang DW. Advances on systems metabolic engineering of Bacillus subtilis as a chassis cell. Synth Syst Biotechnol, 2020, 5(4): 245-251. DOI:10.1016/j.synbio.2020.07.005 |
| [6] | Yang S, Du GC, Chen J, et al. Characterization and application of endogenous phase-dependent promoters in Bacillus subtilis. Appl Microbiol Biotechnol, 2017, 101(10): 4151-4161. DOI:10.1007/s00253-017-8142-7 |
| [7] | Zhou CY, Ye B, Cheng S, et al. Promoter engineering enables overproduction of foreign proteins from a single copy expression cassette in Bacillus subtilis. Microb Cell Fact, 2019, 18: 111. DOI:10.1186/s12934-019-1159-0 |
| [8] | Han LC, Cui WJ, Suo FY, et al. Development of a novel strategy for robust synthetic bacterial promoters based on a stepwise evolution targeting the spacer region of the core promoter in Bacillus subtilis. Microb Cell Fact, 2019, 18: 96. DOI:10.1186/s12934-019-1148-3 |
| [9] | Lu ZH, Yang SH, Yuan X, et al. CRISPR-assisted multi-dimensional regulation for fine-tuning gene expression in Bacillus subtilis. Nucleic Acids Res, 2019, 47(7): e40. DOI:10.1093/nar/gkz072 |
| [10] | 刘刚, 张燕, 邢苗. 双启动子对重组溶源性枯草杆菌中外源蛋白表达的增强作用. 生物工程学报, 2006, 22(2): 191-197. Liu G, Zhang Y, Xing M. Dual promoters enhance heterologous enzyme production from bacterial phage based recombinant Bacillus subtilis. Chin J Biotech, 2006, 22(2): 191-197 (in Chinese). DOI:10.3321/j.issn:1000-3061.2006.02.004 |
| [11] | Zhang F, Carothers JM, Keasling JD. Design of a dynamic sensor-regulator system for production of chemicals and fuels derived from fatty acids. Nat Biotechnol, 2012, 30(4): 354-359. DOI:10.1038/nbt.2149 |
| [12] | Castillo-Hair SM, Baerman EA, Fujita M, et al. Optogenetic control of Bacillus subtilis gene expression. Nat Commun, 2019, 10: 3099. DOI:10.1038/s41467-019-10906-6 |
| [13] | Lin SD, Zhan L, Luo W, et al. Characteristics of antisense transcript promoters and the regulation of their activity. Int J Mol Sci, 2016, 17: 9. |
| [14] | Brophy JAN, Voigt CA. Antisense transcription as a tool to tune gene expression. Mol Syst Biol, 2016, 12: 854. DOI:10.15252/msb.20156540 |
| [15] | Liu DY, Mao ZT, Guo JX, et al. Construction, model-based analysis, and characterization of a promoter library for fine-tuned gene expression in Bacillus subtilis. ACS Synth Biol, 2018, 7(7): 1785-1797. DOI:10.1021/acssynbio.8b00115 |
| [16] | Wu YK, Chen TC, Liu YF, et al. Design of a programmable biosensor-CRISPRi genetic circuits for dynamic and autonomous dual-control of metabolic flux in Bacillus subtilis. Nucleic Acids Res, 2020, 48(2): 996-1009. DOI:10.1093/nar/gkz1123 |
| [17] | Jiang Z, Niu TF, Lv XQ, et al. Secretory expression fine-tuning and directed evolution of diacetylchitobiose deacetylase by Bacillus subtilis. Appl Environ Microbiol, 2019, 85(17): e01076-19. DOI:10.1128/AEM.01076-19 |
| [18] | Fabret C, Ehrlich SD, Noirot P. A new mutation delivery system for genome-scale approaches in Bacillus subtilis. Mol Microbiol, 2002, 46(1): 25-36. DOI:10.1046/j.1365-2958.2002.03140.x |
| [19] | Zhang XZ, Yan X, Cui ZL, et al. mazF, a novel counter-selectable marker for unmarked chromosomal manipulation in Bacillus subtilis. Nucleic Acids Res, 2006, 34(9): e71. DOI:10.1093/nar/gkl358 |
| [20] | Wang Y, Weng J, Waseem R, et al. Bacillus subtilis genome editing using ssDNA with short homology regions. Nucleic Acids Res, 2012, 40(12): e91. DOI:10.1093/nar/gks248 |
| [21] | Wenzel M, Altenbuchner J. Development of a markerless gene deletion system for Bacillus subtilis based on the mannose phosphoenolpyruvate-dependent phosphotransferase system. Microbiology, 2015, 161(10): 1942-1949. DOI:10.1099/mic.0.000150 |
| [22] | Yan X, Yu HJ, Hong Q, et al. Cre/lox system and PCR-based genome engineering in Bacillus subtilis. Appl Environ Microbiol, 2008, 74(17): 5556-5562. DOI:10.1128/AEM.01156-08 |
| [23] | Makarova KS, Wolf YI, Iranzo J, et al. Evolutionary classification of CRISPR-Cas systems: a burst of class 2 and derived variants. Nat Rev Microbiol, 2020, 18(2): 67-83. DOI:10.1038/s41579-019-0299-x |
| [24] | Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 2012, 337(6096): 816-821. DOI:10.1126/science.1225829 |
| [25] | Zhang K, Duan XG, Wu J. Multigene disruption in undomesticated Bacillus subtilis ATCC 6051a using the CRISPR/Cas9 system. Sci Rep, 2016, 6: 27943. DOI:10.1038/srep27943 |
| [26] | Altenbuchner J. Editing of the Bacillus subtilis genome by the CRISPR-Cas9 system. Appl Environ Microbiol, 2016, 82(17): 5421-5427. DOI:10.1128/AEM.01453-16 |
| [27] | Burby PE, Simmons LA. CRISPR/Cas9 editing of the Bacillus subtilis genome. Bio Protoc, 2017, 7(8): e2272. |
| [28] | Price MA, Cruz R, Baxter S, et al. CRISPR-Cas9 in situ engineering of subtilisin E in Bacillus subtilis. PLoS ONE, 2019, 14(1): e0210121. DOI:10.1371/journal.pone.0210121 |
| [29] | Toymentseva AA, Altenbuchner J. New CRISPR-Cas9 vectors for genetic modifications of Bacillus species. FEMS Microbiol Lett, 2019, 366(1): fny284. |
| [30] | Yu SL, Price MA, Wang Y, et al. CRISPR-dCas9 mediated cytosine deaminase base editing in Bacillus subtilis. ACS Synth Biol, 2020, 9(7): 1781-1789. DOI:10.1021/acssynbio.0c00151 |
| [31] | Westbrook AW, Moo-Young M, Chou CP. Development of a CRISPR-Cas9 tool kit for comprehensive engineering of Bacillus subtilis. Appl Environ Microbiol, 2016, 82(16): 4876-4895. DOI:10.1128/AEM.01159-16 |
| [32] | Jakutyte-Giraitiene L, Gasiunas G. Design of a CRISPR-Cas system to increase resistance of Bacillus subtilis to bacteriophage SPP1. J Ind Microbiol Biotechno. |
| [33] | So Y, Park SY. Pae genomic deletion in Bacillus subtilis. Front Microbiol, 2017, 8: 1167. DOI:10.3389/fmicb.2017.01167 |
| [34] | Liu DY, Huang C, Guo JX, et al. Development and characterization of a CRISPR/Cas9n-based multiplex genome editing system for Bacillus subtilis. Biotechnol Biofuels, 2019, 12: 197. DOI:10.1186/s13068-019-1537-1 |
| [35] | Wu YK, Liu YF, Lv XQ, et al. CAMERS-B: CRISPR/Cpf1 Assisted multiple-genes editing and regulation system for Bacillus subtilis. Biotechnol Bioeng, 2020, 117(6): 1817-1825. DOI:10.1002/bit.27322 |
| [36] | Chen J, Yang B, Yang L. To BE or not to BE, that is the question. Nat Biotechnol, 2019, 37(5): 520-522. DOI:10.1038/s41587-019-0119-x |
| [37] | Guo H, Wang QL, Liu Q. In silico meets in vivo: Towards computational CRISPR-Based sgRNA design. Trends Biotechnol, 2017, 35(1): 12-21. DOI:10.1016/j.tibtech.2016.06.008 |
| [38] | Choi GCG, Zhou P, Yuen CTL, et al. Combinatorial mutagenesis en masse optimizes the genome editing activities of SpCas9. Nat Methods, 2019, 16(8): 722-730. DOI:10.1038/s41592-019-0473-0 |
| [39] | Strecker J, Ladha A, Gardner Z, et al. RNA-guided DNA insertion with CRISPR-associated transposases. Science, 2019, 364(6448): 48-53. |
| [40] | Lalwani MA, Zhao EM, Avalos JL. Current and future modalities of dynamic control in metabolic engineering. Curr Opin Biotechnol, 2018, 52: 56-65. DOI:10.1016/j.copbio.2018.02.007 |
| [41] | Xu XH, Liu YF, Du GC, et al. Microbial chassis development for natural product biosynthesis. Trends Biotechnol, 2020, 38(7): 779-796. DOI:10.1016/j.tibtech.2020.01.002 |
| [42] | Shen XL, Wang J, Li CY, et al. Dynamic gene expression engineering as a tool in pathway engineering. Curr Opin Biotechnol, 2019, 59: 122-129. DOI:10.1016/j.copbio.2019.03.019 |
| [43] | Hossain GS, Saini M, Miyake R, et al. Genetic biosensor design for natural product biosynthesis in microorganisms. Trends Biotechnol, 2020, 38(7): 797-810. DOI:10.1016/j.tibtech.2020.03.013 |
| [44] | Gao C, Xu P, Ye C, et al. Genetic circuit-assisted smart microbial engineering. Trends Microbiol, 2019, 27(12): 1011-1024. DOI:10.1016/j.tim.2019.07.005 |
| [45] | Xia PF, Ling H, Foo JL, et al. Synthetic genetic circuits for programmable biological functionalities. Biotechnol Adv, 2019, 37(6): 107393. DOI:10.1016/j.biotechadv.2019.04.015 |
| [46] | Zhao EM, Zhang YF, Mehl J, et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature, 2018, 555(7698): 683-687. DOI:10.1038/nature26141 |
| [47] | Richter F, Fonfara I, Bouazza B, et al. Engineering of temperature- and light-switchable Cas9 variants. Nucleic Acids Res, 2016, 44(20): gkw930.. |
| [48] | Gama-Castro S, Salgado H, Santos-Zavaleta A, et al. RegulonDB version 9.0: high-level integration of gene regulation, coexpression, motif clustering and beyond. Nucleic Acids Res, 2016, 44(D1): D133-D143. DOI:10.1093/nar/gkv1156 |
| [49] | Rajput A, Kaur K, Kumar M. SigMol: repertoire of quorum sensing signaling molecules in prokaryotes. Nucleic Acids Res, 2016, 44(D1): D634-D639. DOI:10.1093/nar/gkv1076 |
| [50] | Jang S, Jang S, Im DK, et al. Artificial caprolactam-specific riboswitch as an intracellular metabolite Sensor. ACS Synth Biol, 2019, 8(6): 1276-1283. DOI:10.1021/acssynbio.8b00452 |
| [51] | Deng JY, Chen CM, Gu Y, et al. Creating an in vivo bifunctional gene expression circuit through an aptamer-based regulatory mechanism for dynamic metabolic engineering in Bacillus subtilis. Metab Eng, 2019, 55: 179-190. DOI:10.1016/j.ymben.2019.07.008 |
| [52] | Gupta A, Reizman IMB, Reisch CR, et al. Dynamic regulation of metabolic flux in engineered bacteria using a pathway-independent quorum-sensing circuit. Nat Biotechnol, 2017, 35(3): 273-279. DOI:10.1038/nbt.3796 |
| [53] | Corrêa GG, Lins MRDCR, Silva BF, et al. A modular autoinduction device for control of gene expression in Bacillus subtilis. Metab Eng, 2020, 61: 326-334. DOI:10.1016/j.ymben.2020.03.012 |
| [54] | Cui SX, Lv XQ, Wu YK, et al. Engineering a bifunctional Phr60-Rap60-Spo0A quorum-sensing molecular switch for dynamic fine-tuning of menaquinone-7 synthesis in Bacillus subtilis. ACS Synth Biol, 2019, 8(8): 1826-1837. DOI:10.1021/acssynbio.9b00140 |
| [55] | Sander T, Farke N, Diehl C, et al. Allosteric feedback inhibition enables robust amino acid biosynthesis in E. coli by enforcing enzyme overabundance. Cell Syst,, 2019, 8(1): 66-75.e8. DOI:10.1016/j.cels.2018.12.005 |
| [56] | 陈修来, 刘佳, 罗秋玲, 等. 微生物辅因子平衡的代谢调控. 生物工程学报, 2017, 33(1): 16-26. Chen XL, Liu J, Luo QL, et al. Manipulation of cofactor balance in microorganisms. Chin J Biotech, 2017, 33(1): 16-26 (in Chinese). |
| [57] | Deng JY, Gu LY, Chen TC, et al. Engineering the substrate transport and cofactor regeneration systems for enhancing 2'-fucosyllactose synthesis in Bacillus subtilis. ACS Synth Biol, 2019, 8(10): 2418-2427. DOI:10.1021/acssynbio.9b00314 |
| [58] | Gu Y, Lv XQ, Liu YF, et al. Synthetic redesign of central carbon and redox metabolism for high yield production of N-acetylglucosamine in Bacillus subtilis. Metab Eng, 2019, 51: 59-69. DOI:10.1016/j.ymben.2018.10.002 |
| [59] | Chen RB, Yang S, Zhang L, et al. Advanced strategies for production of natural products in yeast. iScience, 2020, 23(3): 100879. DOI:10.1016/j.isci.2020.100879 |
| [60] | 尹雪, 梁晨, 冯玥, 等. 合成支架在代谢工程中的研究进展. 生物工程学报, 2019, 35(3): 363-374. Yin X, Liang C, Feng Y, et al. Research progress on synthetic scaffold in metabolic engineering—a review. Chin J Biotech, 2019, 35(3): 363-374 (in Chinese). |
| [61] | Lv XQ, Cui SX, Gu Y, et al. Enzyme assembly for compartmentalized metabolic flux control. Metabolites, 2020, 10(4): 125. DOI:10.3390/metabo10040125 |
| [62] | Conrado RJ, Varner JD, DeLisa MP. Engineering the spatial organization of metabolic enzymes: mimicking nature's synergy. Curr Opin Biotechnol, 2008, 19(5): 492-499. DOI:10.1016/j.copbio.2008.07.006 |
| [63] | Lee H, DeLoache WC, Dueber JE. Spatial organization of enzymes for metabolic engineering. Metab Eng, 2012, 14(3): 242-251. DOI:10.1016/j.ymben.2011.09.003 |
| [64] | Kang W, Ma T, Liu M, et al. Modular enzyme assembly for enhanced cascade biocatalysis and metabolic flux. Nat Commun, 2019, 10: 4248. DOI:10.1038/s41467-019-12247-w |
| [65] | Price JV, Chen L, Whitaker WB, et al. Scaffoldless engineered enzyme assembly for enhanced methanol utilization. Proc Natl Acad Sci USA, 2016, 113(45): 12691-12696. DOI:10.1073/pnas.1601797113 |
| [66] | Wilner OI, Weizmann Y, Gill R, et al. Enzyme cascades activated on topologically programmed DNA scaffolds. Nat Nanotechnol, 2009, 4(4): 249-254. DOI:10.1038/nnano.2009.50 |
| [67] | Müller J, Niemeyer CM. DNA-directed assembly of artificial multienzyme complexes. Biochem Biophys Res Commun, 2008, 377(1): 62-67. DOI:10.1016/j.bbrc.2008.09.078 |
| [68] | Sachdeva G, Garg A, Godding D, et al. In vivo co-localization of enzymes on RNA scaffolds increases metabolic production in a geometrically dependent manner. Nucleic Acids Res, 2014, 42(14): 9493-9503. DOI:10.1093/nar/gku617 |
| [69] | Dueber JE, Wu GC, Malmirchegini GR, et al. Synthetic protein scaffolds provide modular control over metabolic flux. Nat Biotechnol, 2009, 27(8): 753-759. DOI:10.1038/nbt.1557 |
| [70] | De Jesus MPRH, Nielsen AZ, Mellor SB, et al. Tat proteins as novel thylakoid membrane anchors organize a biosynthetic pathway in chloroplasts and increase product yield 5-fold. Metab Eng, 2017, 44: 108-116. DOI:10.1016/j.ymben.2017.09.014 |
| [71] | Young EJ, Burton R, Mahalik JP, et al. Engineering the bacterial microcompartment domain for molecular scaffolding applications. Front Microbiol, 2017, 8: 1441. DOI:10.3389/fmicb.2017.01441 |
| [72] | Liu YF, Zhu YQ, Ma WL, et al. Spatial modulation of key pathway enzymes by DNA-guided scaffold system and respiration chain engineering for improved N-acetylglucosamine production by Bacillus subtilis. Metab Eng, 2014, 24: 61-69. DOI:10.1016/j.ymben.2014.04.004 |
| [73] | Lv XQ, Wu YK, Tian RZ, et al. Synthetic metabolic channel by functional membrane microdomains for compartmentalized flux control. Metab Eng, 2020, 59: 106-118. DOI:10.1016/j.ymben.2020.02.003 |
| [74] | Lv XQ, Zhang C, Cui SX, et al. Assembly of pathway enzymes by engineering functional membrane microdomain components for improved N-acetylglucosamine synthesis in Bacillus subtilis. Metab Eng, 2020, 61: 96-105. DOI:10.1016/j.ymben.2020.05.011 |
| [75] | Tanaka K, Natsume A, Ishikawa S, et al. A new-generation of Bacillus subtilis cell factory for further elevated scyllo-inositol production. Microb Cell Fact, 2017, 16: 67. DOI:10.1186/s12934-017-0682-0 |
| [76] | Michon C, Kang C M, Karpenko S, et al. A bacterial cell factory converting glucose into scyllo-inositol, a therapeutic agent for Alzheimer's disease. Commun Biol, 2020, 3: 93. DOI:10.1038/s42003-020-0814-7 |
| [77] | Song YF, Guan Z, Van Merkerk R, et al. Production of squalene in Bacillus subtilis by squalene synthase screening and metabolic engineering. J Agric Food Chem, 2020, 68(15): 4447-4455. DOI:10.1021/acs.jafc.0c00375 |
| [78] | Zhou K, Zou RY, Zhang CQ, et al. Optimization of amorphadiene synthesis in Bacillus subtilis via transcriptional, translational, and media modulation. Biotechnol Bioeng, 2013, 110(9): 2556-2561. DOI:10.1002/bit.24900 |
| [79] | Liu YF, Liu L, Shin HD, et al. Pathway engineering of Bacillus subtilis for microbial production of N-acetylglucosamine. Metab Eng, 2013, 19: 107-115. DOI:10.1016/j.ymben.2013.07.002 |
| [80] | Liu YF, Link H, Liu L, et al. A dynamic pathway analysis approach reveals a limiting futile cycle in N-acetylglucosamine overproducing Bacillus subtilis. Nat Commun, 2016, 7: 11933. DOI:10.1038/ncomms11933 |
| [81] | Niu TF, Liu YF, Li JH, et al. Engineering a glucosamine-6-phosphate responsive glmS ribozyme switch enables dynamic control of metabolic flux in Bacillus subtilis for overproduction of N-acetylglucosamine. ACS Synth Biol, 2018, 7(10): 2423-2435. DOI:10.1021/acssynbio.8b00196 |
| [82] | Yang S, Wang Y, Wei CB, et al. A new sRNA-mediated posttranscriptional regulation system for Bacillus subtilis. Biotechnol Bioeng, 2018, 115(12): 2986-2995. DOI:10.1002/bit.26833 |
| [83] | Jin P, Zhang LP, Yuan PH, et al. Efficient biosynthesis of polysaccharides chondroitin and heparosan by metabolically engineered Bacillus subtilis. Carbohyd Polym, 2016, 140: 424-432. DOI:10.1016/j.carbpol.2015.12.065 |
| [84] | Cui SX, Xia HZ, Chen TC, et al. Cell membrane and electron transfer engineering for improved synthesis of menaquinone-7 in Bacillus subtilis. iScience, 2020, 23(3): 100918. DOI:10.1016/j.isci.2020.100918 |
| [85] | Shi SB, Chen T, Zhang ZG, et al. Transcriptome analysis guided metabolic engineering of Bacillus subtilis for riboflavin production. Metab Eng, 2009, 11(4/5): 243-252. |
| [86] | Shi T, Wang YC, Wang ZW, et al. Deregulation of purine pathway in Bacillus subtilis and its use in riboflavin biosynthesis. Microb Cell Fact, 2014, 13: 101. |
| [87] | Tanaka K, Tajima S, Takenaka S, et al. An improved Bacillus subtilis cell factory for producing scyllo-inositol, a promising therapeutic agent for Alzheimer's disease. Microb Cell Fact, 2013, 12: 124. DOI:10.1186/1475-2859-12-124 |
| [88] | Tanaka K, Takanaka S, Yoshida KI. A second-generation Bacillus cell factory for rare inositol production. Bioengineered, 2014, 5(5): 331-334. DOI:10.4161/bioe.29897 |
| [89] | Zhang K, Su LQ, Duan XG, et al. High-level extracellular protein production in Bacillus subtilis using an optimized dual-promoter expression system. Microb Cell Fact, 2017, 16: 32. DOI:10.1186/s12934-017-0649-1 |
| [90] | Ying Q, Zhang C, Guo F, et al. Secreted expression of a hyperthermophilic α-amylase gene from Thermococcus sp. HJ21 in Bacillus subtilis. J Molec Microbiol Biotechnol, 2012, 22(6): 392-398. DOI:10.1159/000346215 |
| [91] | Chen JQ, Fu G, Gai YM, et al. Combinatorial Sec pathway analysis for improved heterologous protein secretion in Bacillus subtilis: identification of bottlenecks by systematic gene overexpression. Microb Cell Fact, 2015, 14: 92. DOI:10.1186/s12934-015-0282-9 |
| [92] | Feng Y, Liu S, Jiao Y, et al. Enhanced extracellular production of L-asparaginase from Bacillus subtilis 168 by B. subtilis WB600 through a combined strategy. Appl Microbiol Biotechnol, 2017, 101(4): 1509-1520. DOI:10.1007/s00253-016-7816-x |
| [93] | Cui WJ, Suo FY, Cheng JT, et al. Stepwise modi?cations of genetic parts reinforce the secretory production of nattokinase in Bacillus subtilis. Microb Biotechnol, 2018, 11(5): 930-942. DOI:10.1111/1751-7915.13298 |
| [94] | Guan CR, Cui WJ, Cheng JT, et al. Development of an efficient autoinducible expression system by promoter engineering in Bacillus subtilis. Microb Cell Fact, 2016, 15: 66. DOI:10.1186/s12934-016-0464-0 |
| [95] | Yan SM, Wu G. Bottleneck in secretion of α-amylase in Bacillus subtilis. Microb Cell Fact, 2017, 16: 124. DOI:10.1186/s12934-017-0738-1 |
