

中国药科大学 生命科学与技术学院,江苏 南京 211198
收稿日期:2020-06-01;接收日期:2020-08-06;网络出版时间:2020-08-14
基金项目:国家自然科学基金(Nos. 81800512, 31800992, 31771298),江苏省自然科学基金(Nos. BK20180554, BK20180577) 资助
摘要:代谢综合征是一种全球性的慢性流行病,其发病机理由遗传与环境等因素共同决定。表观遗传修饰是在基因的核苷酸序列不发生改变的情况下,通过可遗传的变化调控基因表达。近年来研究发现,表观遗传修饰能够应答于环境因素、调控基因表达和信号转导进程。其中,染色质重塑复合物SWI/SNF (SWItch/Sucrose non fermentable, SWI/SNF) 关键亚基Baf60a,在维持机体能量代谢稳态过程中发挥着重要作用。文中重点阐述了生理和病理状态下,Baf60a维持机体脂质代谢、胆固醇代谢、尿素循环及代谢节律性稳态的分子机制。深入探讨以Baf60a为基点的能量代谢调控网络,有望为代谢综合征的改善和治疗提供潜在药物治疗靶点和扎实的研究依据。
关键词:代谢综合征Baf60a脂质代谢胆固醇代谢尿素代谢代谢节律性
Progress in the regulation of energy metabolic homeostasis by the SWI/SNF complex subunit Baf60a
Mengyi Xu, Shiyao Zhang, Wenxiang Zhang, Chang Liu, Siyu Chen


School of Life Science and Technology, China Pharmaceutical University, Nanjing 211198, Jiangsu, China
Received: June 1, 2020; Accepted: August 6, 2020; Published: August 14, 2020
Supported by: National Natural Science Foundation of China (Nos. 81800512, 31800992, 31771298), Natural Science Foundation of Jiangsu Province, China (Nos. BK20180554, BK20180577)
Corresponding author: Siyu Chen. Tel: +86-25-86185645; E-mail: siyuchen@cpu.edu.cn.
Abstract: Metabolic syndrome is a global chronic epidemic. Its pathogenesis is determined by genetic and environmental factors. Epigenetic modification is reported to regulate gene expression without altering its nucleotide sequences. In recent years, epigenetic modification is sensitively responded to environmental signals, further affecting the gene expression and signaling transduction. Among these regulators, chromatin remodeling SWI/SNF (SWItch/Sucrose non fermentable, SWI/SNF) complex subunit Baf60a plays an important role in maintaining energy homeostasis in mammals. In this paper, we described the pathophysiological roles of Baf60a in maintaining the balance of energy metabolism, including lipid metabolism, cholesterol metabolism, urea metabolism, as well as their rhythmicity. Therefore, in-depth understanding of Baf60a-orchestrated transcriptional network of energy metabolism will provide potential therapeutic targets and reliable theoretical supports for the treatment of metabolic syndrome.
Keywords: metabolic syndromeBaf60alipid metabolismcholesterol metabolismurea metabolismmetabolic rhythmicity
随着城市化进程的加快,人类衍生出了诸多不良的生活方式,包括高热量、高钠盐、高蛋白及高脂等不合理的饮食习惯,运动量少、长期久坐等不健康的行为习惯等[1],这些不良的生活方式导致代谢综合征的发病率逐年攀升。代谢综合征的高发为现代医疗卫生系统带来了巨大的挑战,如何预防和治疗代谢综合征及其并发症,现已成为世界范围内亟需解决的公共卫生问题[1-3]。代谢综合征是一种代谢成分异常聚集的病理状态,其临床表现主要有肥胖、高血糖、高血压、血脂异常等[4]。目前认为,代谢综合征的发病是多基因和多种环境因素共同作用的结果[2]。然而,其内在发病机制尚未完全阐明。
染色质是生物遗传物质的载体,人类染色质是由约6×109 bp的DNA、组蛋白、非组蛋白及少量的RNA组成的线性复合物,而细胞核的直径只有5–8 μm,故染色质DNA要压缩近万倍,才能形成一种高度浓缩的结构装进细胞核内[5]。核小体阻止DNA结合蛋白的进入[6],在不改变DNA序列的情况下调控DNA的表达,主要是通过表观遗传学的方式进行修饰来实现的[7-8],核小体会短暂地解组装,呈现出一种疏松状态,这种状态有利于转录因子及其他调控蛋白结合到基因启动子的特定靶位点上。染色质重塑作为表观遗传学调控的最常见的方式,控制着基因表达的基本水平[9]。染色质重塑复合物是代谢稳态的关键调节因子,一般受到环境信号的影响,在代谢信号通路的下游进行调控[10]。此外,染色质重塑复合物对于特定组织发育过程中的能量代谢起调控作用[11]。总的来说,染色质重塑复合物能够感知环境信号,在维持能量代谢稳态及组织发育等方面发挥重要作用。
SWI/SNF染色质重塑复合物在染色质重塑过程中发挥着重要的作用,它依赖ATP水解产生的能量重新定位核小体,使转录因子更易到达染色质上的结合位点,从而调控基因表达[12-13]。大量研究已经证实,SWI/SNF染色质重塑复合物的许多亚基,对肿瘤的发病、干细胞的生长分化、发育及代谢进程具有重要的调控作用[14-19]。本文重点介绍在生理病理状态下,SWI/SNF染色质重塑复合物关键亚基Baf60a的生物学功能和作用机理。
1 SWI/SNF染色质重塑复合物亚基Baf60aSWI/SNF染色质重塑复合物由多种亚基构成,且在哺乳动物和酵母中是高度保守的[20]。它主要由2个ATP酶核心亚基(Brg1/Brm) 和一系列辅助亚基(Bafs) 组成,根据辅助亚基又将其分为两种主要类型:一是典型的包含相互排斥的Arid1a或Arid1b亚基的Baf复合物,二是以Arid2、Pbrm1和Brd7为特征亚基pBaf复合物[21-23]。最近,Alpsoy等还发现了第3种类型的SWI/SNF复合物,其不含上述特征亚基,有独特的亚基,因此被称为GBaf或非典型Baf复合物[24]。
迄今为止,被发现的SWI/SNF染色质重塑复合物亚基一共有29种,在哺乳动物中的SWI/SNF染色质重塑复合物主要由10–15种亚基组成,这些亚基有许多可能的组合,它们在各类生理条件下呈现表达差异性,对于基因转录和细胞生命活动的各方面都是至关重要的[25]。更有意思的是,同一个亚基的功能还具有组织特异性,导致在不同组织细胞中的亚基发挥着不一样的功能,如:Baf60亚基的各种变体,在不同的生理病理条件下及不同组织中,有着各自特定的功能[26]。
Baf60亚基是唯一的SWI/SNF核心复合物与转录因子之间的连接物,Baf60亚基可以通过识别特异性的转录因子,招募SWI/SNF核心复合物到染色质特定位置,使得转录因子及其他调控蛋白结合到基因启动子特定靶位点上,从而调控不同基因的表达[27]。如上文所述,由于其组织特异性,它能够在不同生理病理状态下,调节不同组织和细胞内的靶基因表达[28-30]。在过去许多针对Baf60亚基的研究中,大多数都集中于各种亚基在癌症发病机制和肿瘤抑制方面的作用[31-32]。但是,Meng等的最新研究表明:SWI/SNF染色质重塑复合物的Baf60亚基还在细胞营养感知方面起着关键的调节作用[33-36]。Baf60亚基有3种分型:Baf60a、Baf60b、Baf60c。研究发现,Baf60b亚基在免疫细胞中高表达,是粒细胞发育和实现功能的关键调节因子[37],而Baf60c亚基优先表达于骨骼肌、大脑和心脏,被确定为心脏和视网膜发育过程中的重要调节因子[33-35]。而Baf60a亚基不仅与肿瘤的发病和治疗有关,还在机体各种能量代谢中扮演着关键角色。在此,本文对Baf60a在代谢性疾病发病机制中的重要作用进行了综述,包括其对于机体脂质代谢的调控、胆固醇稳态的维持、尿素平衡的调节及代谢节律性维持等多个方面。
2 Baf60a调控脂质代谢近年来,肝脏脂质代谢紊乱导致的代谢综合征受到了广泛的关注。肝脏是人体内最大的代谢器官,它维系着机体的代谢稳态,包括调控血糖、分泌胆汁、维持体温等,更为关键的是,机体脂质的消化、吸收、运输、分解代谢和合成代谢,都与肝脏有着密切的关系[38-39]。非酒精性脂肪肝炎发展的早期主要是由于肝脏脂质的异位堆积,其特征是慢性炎症和肝脏损伤[40]。若持续性的异位堆积,脂肪肝会进一步演变成脂肪肝炎、肝纤维化,最终发展成肝硬化和肝癌[41-42]。
线粒体和过氧化物酶体都是脂肪酸β氧化分解的重要部位。有研究表明,过氧化物酶体增殖剂激活受体α (Peroxisome proliferator-activated receptor α,Pparα),是线粒体和过氧化物酶体脂肪酸β氧化过程的重要基因,在调控肝脏脂质代谢中起着关键作用[39, 43-46]。笔者课题组前期研究发现,禁食会诱导肝脏中Baf60a的高表达,继而可以激活肝脏脂肪酸氧化[45]。同时,腺病毒介导的Baf60a的过表达也刺激了小鼠的肝脏脂质体和线粒体的脂肪酸氧化,从而降低了甘油三酯的含量。接着,我们通过全基因组高通量共激活分析发现Baf60a可以将SWI/SNF染色质重塑复合物与过氧化物酶体增殖物激活受体γ共激活因子-α (Peroxisome proliferator-activated receptor γ coactivator-1α,Pgc-1α)连接起来,即Pgc-1α通过Baf60a将染色质重塑复合物募集到Pparα转录配体上,诱导线粒体脂肪酸β氧化基因的表达[45-47]。以上这些结果表明,Baf60a是脂肪酸β氧化过程中的关键调节因子,它能连接肝脏SWI/SNF染色质重塑复合物和脂肪酸β氧化过程。针对该途径进行治疗干预,可作为治疗肝脏脂肪异位堆积的新方法。
另一方面,Baf60a是人肝癌细胞HepG2细胞衰老的抑制因子[48]。棕榈酸处理HepG2细胞,导致Baf60a的表达降低,从而诱导脂质的积累,触发了HepG2细胞衰老。同时,小鼠经过高脂饮食喂养后,肝脏中Baf60a表达会显著降低,进而导致了小鼠肝脏脂质积累和细胞衰老[48]。所以,Baf60a对于肝脏脂肪堆积及细胞衰老有潜在的应用前景,能够用来预防不良饮食习惯引起的脂肪肝等肝脏代谢性疾病。
此外,Baf60a不仅对于肝脏脂质代谢有调控作用,在脂肪组织产热过程中也有重要地位。脂肪组织主要分为4种:白色脂肪、米色脂肪、褐色脂肪及粉色脂肪。研究发现,在妊娠和哺乳期,乳腺的白色脂肪细胞会转化为粉色脂肪细胞,能够产生和分泌乳汁[49]。白色脂肪作为机体过剩能量的主要储存形式,主要分布在皮下组织和内脏周围等[50]。褐色脂肪具有产热的功能,它可以高表达产热的关键基因,通过大量线粒体将能量以热量的形式释放[51]。在寒冷环境刺激下,白色脂肪细胞米色化形成米色脂肪,诱导产热基因的表达,随着温度回升,这种诱导消失[52-53]。
研究发现多种因素可以促进褐色脂肪活化产热或白色脂肪米色化产热[54-56]。Liu等最近研究表明,Baf60a在寒冷诱导的褐色脂肪产热过程中是必不可少的[57]。在寒冷环境和肾上腺激素的刺激下,Baf60a的缺失导致褐色脂肪中产热基因的染色质可及性受到抑制,从而削弱了寒冷环境下诱导的褐色脂肪产热作用[57]。但是,Baf60a并没有促进白色脂肪米色化,Baf60a的缺失反而增加了慢性寒冷刺激下白色脂肪的米色化[57]。这可能是因为寒冷环境刺激下,褐色脂肪燃烧产热会代偿性地引起白色脂肪米色化,从而维持机体体温和能量代谢平衡[58]。虽然褐色脂肪产热和米色脂肪产热基因转录调控有很多相似性,但是Baf60a对这些基因的调控是不同的。因此,针对脂肪组织的Baf60a进行调控,有望能够改善肥胖等脂代谢异常疾病。
饮酒、吸烟、熬夜等生活方式及某些营养素摄入过多或缺乏时,都可能造成脂肪代谢紊乱,进而导致高血脂和肥胖的产生,同时还会产生糖尿病等多种并发症[59]。Baf60a深度参与肝脏脂肪酸β氧化及褐脂产热过程。因此,它可能是治疗非酒精性脂肪肝,肝硬化等疾病的关键因子,有望用于改善肥胖和高血脂等代谢性疾病的临床症状。
3 Baf60a维持胆固醇稳态代谢综合征最主要的并发症之一就是心脑血管疾病[60]。血液中胆固醇、甘油三酯等含量过高,会导致血液粘稠度变高,增加心脏泵血负担。长此以往,胆固醇等会在血管壁上堆积,导致血管粥样病变、血管硬化,进而诱发一系列的心脑血管疾病[61]。
研究发现,肝脏中Baf60a是饮食敏感通路的关键组成部分,它负责调控肝脏中胆汁酸合成和肠道中胆固醇吸收基因的表达,将饮食胆固醇摄入与全身胆固醇稳态联系起来[36]。具体来说,在对小鼠进行西方饮食喂养后,肝脏中Baf60a的mRNA和蛋白水平显著升高。同时,在小鼠体内腺病毒介导的Baf60a的过表达,提高了小鼠血液中胆固醇水平。进一步研究表明,Baf60a与胆汁酸代谢基因car相互作用,形成一个前馈调节回路,刺激肝脏中car本身及其下游负责合成、修饰和运输胆汁酸的基因的表达,这有助于胆固醇分解代谢为胆汁酸,接着胆汁酸通过肝肠循环被有效地循环利用,从而促进肠道胆固醇的吸收。另外,小鼠肝脏细胞中的Baf60a特异性敲除,能够使肠道胆固醇吸收降低,保护小鼠免于饮食诱导的高胆固醇血症和动脉粥样硬化。
若对心脑血管疾病进行干预治疗,针对Baf60a的效应分子car及其下游负责合成胆汁酸的基因进行探究是更为有效的[62]。这样Baf60a可以继续发挥其促进脂质代谢作用,又能借助car来抑制胆固醇合成下游相关基因继而降低血液中胆固醇含量,这有望作为治疗高胆固醇血症,降低动脉粥样硬化风险的新途径。
4 Baf60a维持尿素稳态氨是机体正常代谢的产物,但氨也是一种有神经毒性的物质,若机体内氨大量堆积,将会导致骨骼肌线粒体功能障碍[63],高血氨症同时还会引发肝性脑病和肝纤维化等疾病[64-65]。正常情况下,机体内有较完整的氨解毒机制,其主要代谢途径是通过肝脏将机体内的氨转换为无毒的尿素,随后经肾脏随尿液排出。而在高脂饮食或高胆固醇饮食的影响下,机体会处于一种过度营养状态,这会损害尿素合成路径,并引起高血氨症[66-67]。
尿素的合成受营养信号的调控。例如,在饥饿环境刺激下,机体氨的代谢产物增加后,尿素合成量也会显著上升[67-68]。笔者课题组研究发现,在高脂喂养小鼠的肝脏中,Baf60a的含量出现了明显的上升趋势,而尿素合成的关键基因cps1却显著减少,而在肥胖患者体内,Baf60a的表达与尿素合成相关基因的变化趋势也是相反的[69]。另外,我们的研究表明,腺病毒介导的Baf60a在肝脏特异性过表达,能够抑制cps1,从而抑制尿素的合成,导致血清中氨的含量上升,并且能够激活肝星状细胞活化,而当Baf60a被抑制后,高脂喂养小鼠的尿素合成含量反而会增加,且抑制肝星状细胞的活化[69]。进一步的生物信息学分析显示,我们发现Baf60a能够和Y盒结合蛋白-1(Y box-binding protein-1, Yb-1)协同抑制cps1的转录,从而抑制尿素的合成[69]。
有意思的是,在饥饿24 h的小鼠肝脏中,Baf60a的表达量显著提高,但尿素合成相关的基因cps1和asl的表达量却显著上升,这与高脂饮食情况下Baf60a抑制尿素合成相关基因是相反的。我们认为,虽然Baf60a的表达在禁食和高脂喂养条件下都升高,但在这些条件下,尿素合成受到了相反的调节,即营养状态发生变化时,Baf60a可选择性地与Pgc-1α或Yb-1结合。当小鼠禁食24 h后,体内的Pgc-1α含量升高,Baf60a更易于和Pgc-1α结合,调控肝脏脂质代谢,而高脂喂养的小鼠,肝脏中的Baf60a则选择性地更多的与Yb-1结合,从而抑制尿素的生成。笔者课题组的研究结果提示,抑制肝脏中Baf60a与Yb-1的结合,可能是治疗高血氨症的一个研究方向。
此外,一些研究表明肝星状细胞的活化,会引起细胞外基质过度沉积,继而引发肝脏纤维化,因此控制星状细胞活化已成为治疗肝脏纤维化的重要靶点[70-71]。我们的研究发现,Baf60a的敲除能够抑制肝脏星状细胞活化,从而能够有效抑制肝脏纤维化[69]。考虑到目前临床上治疗肝纤维化的手段尚不多且效果十分有限。对Baf60a与肝星状细胞活化关系的深入研究,开发新的靶向Baf60a疗法将会为肝纤维化患者带来福音。
5 Baf60a调节代谢节律性地球的自转导致了昼夜的交替,地球上的生物为了适应这一点从而进化出了生物钟。生物钟是一种以大约24 h为周期的生物进程振荡模式,例如,哺乳动物的睡眠-觉醒、血压和心率、激素分泌、体温和能量代谢等[72-73],而这些都与人类的健康息息相关。生物钟在机体内营养和代谢等多个生理过程发挥着重要作用,能够调控多个代谢途径,从而使得机体处于正常生理水平[74]。流行病学研究显示,长期不规律的工作、倒班等工作习惯,会导致生物钟与外界环境的同步化作用失调,最终导致机体节律紊乱,这已经成为代谢综合征的一个关键风险因素[75]。
生物钟核心的调控机制是自我调节的转录-翻译的负反馈环路。第一条反馈环路由生物钟核心蛋白Bmal1和Clock组成的异源二聚体作为核心转录因子,激活下游的时钟基因per和cry的表达,当细胞质中的Per和Cry的蛋白浓度升至阈值时,它们会入核抑制Bmal1/Clock二聚体的活性,从而抑制其转录激活功能[76-77]。另一条反馈环路主要由Rev-erbα及Rorα组成,其中Rev-erbα蛋白能够抑制bmal1基因的转录,参与脂肪生成的调节,而Rorα蛋白能促进bmal1基因的转录,调节骨骼肌的脂肪生成和贮存[78]。由此可见,生物体内的生物钟和能量代谢过程是紧密整合的,它们只有协同运作才能保证机体的健康。
笔者课题组发现Baf60a其自身表达具有节律性,且在节律异常的小鼠中,Baf60a的节律性表达受到破坏[79]。此外,肝脏特异性敲除Baf60a,明显破坏了肝脏时钟基因的节律性表达,进一步研究发现,Pgc-1α和Baf60a可通过与Rorα的相互作用,激活肝脏生物钟核心基因bmal1的转录[79]。因此,Baf60a不仅能够影响时钟基因,还参与调控能量代谢基因的节律性。此外,Baf60a亦在心血管系统中发挥着重要的作用,其将生理节律与血管平滑肌细胞(Vascular smooth muscle cells,VSMCs) 的生理平衡联系起来[72]。我们的另一项研究发现,Baf60a还能够恢复由游离脂肪酸导致的VSMCs时钟基因振幅降低和细胞活化进程,从而维持VSMCs的正常生理功能,这一过程也是通过Baf60a与Rorα相互作用,协同激活bmal1的转录来实现的[80]。众所周知,代谢综合征最主要的并发症就是心脑血管疾病,Baf60a有望成为治疗由不健康的饮食和昼夜节律紊乱引起的心血管疾病的新药物靶点。
早在2009年,Gatfield等就已经发现Baf60a可能参与了生物钟调控,并与miR-122耦合,介导肝脏胆固醇和脂质代谢的调节[81]。笔者课题组也有研究发现肝脏中Baf60a的敲除,会导致糖异生、葡萄糖氧化、脂肪酸β-氧化和线粒体呼吸等关键代谢途径的相关基因的表达节律均受到破坏[79]。不仅如此,尿素的合成也受到了生物钟信号的调控,这很有可能是由Baf60a感知营养信号所介导的[69]。总而言之,哺乳动物的生物钟与能量代谢稳态之间存在紧密的联系,Baf60a亚基作为唯一的SWI/SNF染色质重塑复合物与转录因子之间的连接物,能够与不同的效应分子结合,在不同能量代谢途径中调控关键基因的节律性,最终调控能量代谢稳态。深度研究Baf60a在肝脏和心血管系统中对代谢节律性的调节作用,对于从时间生物学角度了解和治疗代谢性疾病的发生发展具有重大意义。
6 Baf60a其他相关研究Baf60a作为关键的SWI/SNF染色质重塑复合物亚基,在癌变过程中具有复杂的调控作用,对于不同的肿瘤的易感性和抑制具有不同的影响。p53是众所周知的抑癌基因,抑制Baf60a表达后,同时也抑制了p53导致的细胞凋亡和细胞周期阻滞,总的来说,SWI/SNF染色质重塑复合物Baf60a通过与p53的相互作用对肿瘤的生长起抑制作用[82]。但在不同的肿瘤细胞中,Baf60a又存在着其特有的功能。Baf60a被报道作为mir-233的靶点在乳腺癌和卵巢癌发病机制中发挥作用,mir-233通过抑制SWI/SNF染色质重塑复合物的形成,减少异常染色质重塑,从而改善非典型增殖性浆液性肿瘤和卵巢高级别浆液性肿瘤[83];另外,Baf60a在胃癌中的高表达,可以促进胃肿瘤细胞的体内外生长和迁移,而mir-490-3p可以通过直接靶向Baf60a,从而抑制胃肿瘤细胞的生长和迁移,反过来高甲基化的mir-490-3p激活Baf60a,促进胃部恶性肿瘤的发生[84];在前列腺癌中,Baf60a是抑制肿瘤的mir-99家族的直接靶点[85];同时还有研究发现,mir-100转录后,诱导Baf60a的下调,可抑制乳腺癌干细胞的自我更新[86-87]。
有研究发现,在肝癌组织中,Baf60a可能是通过激活mTOR信号通路,从而促进肝脏肿瘤细胞增殖[88]。还有研究发现,在胃部肿瘤组织中,Baf60a能够通过激活Wnt信号通路来促进肿瘤细胞增殖[89]。Baf60a在不同肿瘤组织中,影响着不同的信号通路,对于肿瘤的影响也可能起着双向不同的作用,我们猜测可能是因为不同肿瘤组织内部的能量代谢以及营养信号存在差异,导致Baf60a选择性地结合不同的效应分子,影响着不同的通路,从而发挥着不同的功能。
另一方面,有研究发现Baf60a通过和FxxFF基序结合,能够促进tmprss2基因表达雄激素受体辅因子,从而激活雄激素受体[90]。同时,还有研究者发现Baf60a是控制黑素细胞分化的关键性因子[28]。Baf60a还能够通过调控H3K27的甲基化,在早期去激活胚胎干细胞的分化,从而限制干细胞的多功能性[91]。关于Baf60a激活胚胎干细胞分化,是否同时也会对分化细胞的能量代谢产生影响,还需要进一步的研究。
7 总结与展望越来越多的证据表明,SWI/SNF染色质重塑复合物亚基Baf60a作为能量代谢组织器官中的媒介分子,将表观遗传修饰、生物钟和能量代谢进程偶联起来,它的失调在代谢综合征引起的全身代谢紊乱中起着重要的作用[92]。Baf60a不仅可以协同Rorα激活生物时钟关键基因bmal1,从而调控肝脏和VSMCs的代谢稳态和昼夜节律。同时,Baf60a还能够结合Pgc-1α、Yb-1等转录因子,在脂肪酸β氧化、尿素循环、胆固醇合成等代谢途径中起关键作用[36, 45, 69]。此外Baf60a还与细胞分化、肿瘤的发生与抑制等许多方面有关。同时,我们的研究结果也提示Baf60a影响糖代谢、脂代谢等途径中关键基因的节律性[79],总而言之,Baf60a是机体能量代谢和生物钟的重要整合子,深度参与了机体各方面能量代谢节律性稳态的调控(图 1)。
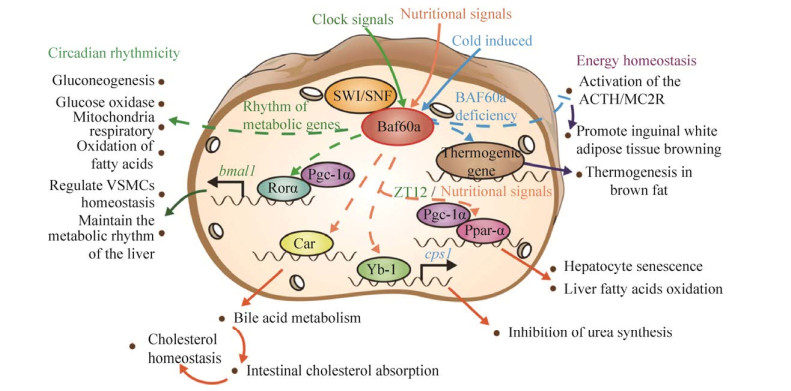 |
| 图 1 Baf60a受环境信号调控维持能量代谢稳态(Baf60a受时钟信号调控,影响许多代谢基因的节律性,同时还会协同Rorα激活生物时钟关键基因bmal1,从而调控肝脏和VSMCs的代谢稳态和昼夜节律。Baf60a受营养信号调控,影响胆汁酸的代谢通路以及尿素的合成。Baf60a在寒冷刺激下,促进褐色脂肪产热) Fig. 1 Baf60a is regulated by environment signals to maintain energy metabolism homeostasis. Baf60a is regulated by clock signals and affects the rhythmicity of many metabolic genes. Meanwhile, the key biological clock gene bmal1 is activated by Rorα and Baf60a to regulate the metabolic homeostasis and circadian rhythmicity of liver and VSMCs. Baf60a is regulated by nutritional signals and affects the metabolic pathways of bile acid metabolism and urea synthesis. Baf60a promotes brown fat thermogenesis when stimulated by cold environment. |
| 图选项 |
但是,对于Baf60a在代谢类疾病中的功能需要进一步研究,并且需要具体到某种特定代谢类疾病,如糖尿病、心血管疾病等。进一步探究Baf60a在整个机体代谢异常的过程和代谢综合征发病机制中扮演的角色和发挥的功能,有望为各类代谢性疾病以及相关并发症的发病机制提供新的见解,从分子层面针对Baf60a为基点的能量代谢调控网络进行调控,最终为这些代谢性疾病提供新的干预和治疗措施。
基于以上已知的研究,我们认为未来研究方向可以从以下几个角度考虑:(1) Baf60a在机体内分布广泛、功能繁多,且在不同组织、不同代谢通路都有不同的功能,需要寻找Baf60a更多的互作分子,研究的其他路径以及相关关键代谢基因的节律性,是否也受Baf60a的调控。由于Baf60a的这种特殊性,也需要开发特异性地靶向Baf60a及其效应分子的一系列小分子药物,可以治疗Baf60a相关的不同代谢性疾病引发的临床症状。(2) Baf60a广泛分布于体内各种关键的组织器官中,结合已有的转录组和蛋白组数据分析发现(图 2),其在扁桃体含量是最高的。目前已有的研究主要集中于Baf60a在肝脏及骨骼肌和脂肪组织中的调控作用,除了这3种组织外,其他组织器官也是代谢综合征发展的关键,接下来可能需要进一步研究Baf60a在其他组织中可能产生的调控作用。(3) 炎症反应与代谢综合征的发展密切相关,并且炎症与胰岛素抵抗、肥胖和高血压等症状相互促进,形成了一个恶性循环[93-95]。此前已经有研究表明,Baf60c将炎症反应与骨骼肌代谢包括糖酵解和胰岛素抵抗联系起来[33]。此外,Baf60b亚基也能够在免疫细胞中高表达,是调控粒细胞发育和发挥功能的关键调节因子[37]。Baf60a、Baf60b和Baf60c都属于Baf60亚基的不同亚型,在结构和功能上有许多相似之处,且Baf60a在免疫器官扁桃体又呈现高表达(图 2)。综合已有的关于Baf60a在代谢综合征代谢紊乱中可能发挥的作用,未来从炎症反应的角度研究Baf60a对于代谢综合征可能存在的影响也是十分必要的。(4) 从代谢角度看,Baf60a在肿瘤治疗中的可能应用(不论单向作用或双向作用) 都可能面临一个共同的难题:诱导代谢旁路的代偿作用抵消或对冲了靶向治疗作用。因此,若靶向Baf60a治疗肿瘤,会产生肿瘤耐药性和病情复发的风险。值得注意的是,Baf60a是一个位处上游的核因子,它需要通过与多种核转录因子协同发挥激活下游基因的功能,且这一过程具有肿瘤特异性。因此,后期研究需要更进一步揭示不同肿瘤组织内Baf60a的效应分子,包括其互作因子和下游输出基因,并以这些因子和通路(如:mTOR及Wnt等)为靶点[88-89],筛选和设计有效药物将有助于克服上述肿瘤耐药性,从而达到更好的治疗效果。(5) 本文介绍了饮食习惯、生活节律及寒冷环境等因素对Baf60a表观遗传调控能量代谢的影响。除此之外,机体能量代谢还与很多特殊环境因素有关,如:工作环境、空气污染、生活纬度等等[96-98]。这些因素是否影响Baf60a的作用及功能暂时还未有研究,但随着人们对于代谢综合征中能量代谢的深入了解,Baf60a对于能量代谢的调控研究也会越来越全面,与我们生活息息相关的更多其他环境因素对于Baf60a的影响也会被挖掘出来。这也为了解代谢综合征的发病机制提供更丰富的基础研究,同时也为寻找代谢综合征新的治疗靶点提供方向。
 |
| 图 2 转录组学联合蛋白质组学分析Baf60a的组织分布(转录组学数据来源于:122例个体样本32个不同组织的RNA序列。蛋白质组学数据来源于:29个健康人体组织的蛋白质组) Fig. 2 The tissue distribution of Baf60a was analyzed by transcriptomics combined with proteomics. Transcriptomics data were obtained from: RNA-seq of coding RNA from tissue samples of 122 human individuals representing 32 different tissues. Proteomics data were obtained from: a deep proteome abundance atlas of 29 healthy human tissues. |
| 图选项 |
参考文献
| [1] | Brand?o AD, Da Silva JH, Lima SMO, et al. Short and long term effect of treatment non-pharmacological and lifestyle in patients with metabolic syndrome. Diabetol Metab Syndr, 2020, 12: 16. DOI:10.1186/s13098-020-0522-y |
| [2] | Bozkurt B, Aguilar D, Deswal A, et al. Contributory risk and management of comorbidities of hypertension, obesity, diabetes mellitus, hyperlipidemia, and metabolic syndrome in chronic heart failure: a scientific statement from the American heart association. Circulation, 2016, 134(23): e535-e578. |
| [3] | Hudec M, Dankova P, Solc R, et al. Epigenetic regulation of circadian rhythm and its possible role in diabetes mellitus. Int J Mol Sci, 2020, 21(8): 3005. DOI:10.3390/ijms21083005 |
| [4] | Van Namen M, Prendergast L, Peiris C. Supervised lifestyle intervention for people with metabolic syndrome improves outcomes and reduces individual risk factors of metabolic syndrome: A systematic review and meta-analysis. Metabolism, 2019, 101: 153988. DOI:10.1016/j.metabol.2019.153988 |
| [5] | Ricketts MD, Han J, Szurgot MR, et al. Molecular basis for chromatin assembly and modification by multiprotein complexes. Prot Sci, 2019, 28(2): 329-343. DOI:10.1002/pro.3535 |
| [6] | Tsompana M, Buck MJ. Chromatin accessibility: a window into the genome. Epigenetics Chromatin, 2014, 7(1): 33. DOI:10.1186/1756-8935-7-33 |
| [7] | Moore LD, Le T, Fan GP. DNA methylation and its basic function. Neuropsychopharmacology, 2013, 38(1): 23-38. DOI:10.1038/npp.2012.112 |
| [8] | Leppert S, Matarazzo M. De novo DNMTs and DNA methylation: novel insights into disease pathogenesis and therapy from epigenomics. Curr Pharm Des, 2014, 20(11): 1812-1818. DOI:10.2174/13816128113199990534 |
| [9] | Ramachandran S, Henikoff S. Nucleosome dynamics during chromatin remodeling in vivo. Nucleus, 2016, 7(1): 20-26. DOI:10.1080/19491034.2016.1149666 |
| [10] | Zoncu Z, Efeyan A, Sabatini DM. mTOR: from growth signal integration to cancer, diabetes and ageing. Nat Rev Mol Cell Biol, 2011, 12(1): 21-35. DOI:10.1038/nrm3025 |
| [11] | Nargund AM, Pham C, Dong YY, et al. The SWI/SNF protein PBRM1 restrains VHL-loss-driven clear cell renal cell carcinoma. Cell Rep, 2017, 18(12): 2893-2906. DOI:10.1016/j.celrep.2017.02.074 |
| [12] | El Hadidy N, Uversky VN. Intrinsic disorder of the BAF complex: roles in chromatin remodeling and disease development. Int J Mol Sci, 2019, 20(21): 5260. DOI:10.3390/ijms20215260 |
| [13] | Torigoe SE, Patel A, Khuong MT, et al. ATP-dependent chromatin assembly is functionally distinct from chromatin remodeling. eLife, 2013, 2: e863. |
| [14] | Mittal P, Roberts CWM. The SWI/SNF complex in cancer-biology, biomarkers and therapy. Nat Rev Clin Oncol, 2020, 17(7): 435-448. DOI:10.1038/s41571-020-0357-3 |
| [15] | Trost T, Haines J, Dillon A, et al. Characterizing the role of SWI/SNF-related chromatin remodeling complexes in planarian regeneration and stem cell function. Stem Cell Res, 2018, 32: 91-103. DOI:10.1016/j.scr.2018.09.004 |
| [16] | Toto PC, Puri PL, Albini S. SWI/SNF-directed stem cell lineage specification: dynamic composition regulates specific stages of skeletal myogenesis. Cell Mol Life Sci, 2016, 73(20): 3887-3896. DOI:10.1007/s00018-016-2273-3 |
| [17] | Cotton P, Soulard A, Wésolowski-Louvel M, et al. The SWI/SNF KlSnf2 subunit controls the glucose signaling pathway to coordinate glycolysis and glucose transport in Kluyveromyces lactis. Eukaryot Cell, 2012, 11(11): 1382-1390. DOI:10.1128/EC.00210-12 |
| [18] | Wiley MM, Muthukumar V, Griffin TM, et al. SWI/SNF chromatin-remodeling enzymes Brahma-related gene 1 (BRG1) and Brahma (BRM) are dispensable in multiple models of postnatal angiogenesis but are required for vascular integrity in infant mice. J Am Heart Assoc, 2015, 4(4): e001972. |
| [19] | Jeon S, Seong RH. Anteroposterior limb skeletal patterning requires the bifunctional action of SWI/SNF chromatin remodeling complex in hedgehog pathway. PLoS Genet, 2016, 12(3): e1005915. DOI:10.1371/journal.pgen.1005915 |
| [20] | C?té J, Quinn J, Workman JL, et al. Stimulation of GAL4 derivative binding to nucleosomal DNA by the yeast SWI/SNF complex. Science, 1994, 265(5168): 53-60. DOI:10.1126/science.8016655 |
| [21] | Wang W, Xue Y, Zhou S, et al. Diversity and specialization of mammalian SWI/SNF complexes. Genes Dev, 1996, 10(17): 2117-2130. DOI:10.1101/gad.10.17.2117 |
| [22] | Wu JI, Lessard J, Crabtree GR. Understanding the words of chromatin regulation. Cell, 2009, 136(2): 200-206. DOI:10.1016/j.cell.2009.01.009 |
| [23] | Mashtalir N, D'Avino AR, Michel BC, et al. Modular organization and assembly of SWI/SNF family chromatin remodeling complexes. Cell, 2018, 175(5): 1272-1288. DOI:10.1016/j.cell.2018.09.032 |
| [24] | Alpsoy A, Dykhuizen E. Glioma tumor suppressor candidate region gene 1 (GLTSCR1) and its paralog GLTSCR1-like form SWI/SNF chromatin remodeling subcomplexes. J Biol Chem, 2018, 293(11): 3892-3903. DOI:10.1074/jbc.RA117.001065 |
| [25] | Kadoch C, Crabtree G. Mammalian SWI/SNF chromatin remodeling complexes and cancer: Mechanistic insights gained from human genomics. Sci Adv, 2015, 1(5): e1500447. DOI:10.1126/sciadv.1500447 |
| [26] | Puri PL, Mercola M. BAF60 A, B, and Cs of muscle determination and renewal. Genes Dev, 2012, 26(24): 2673-2683. DOI:10.1101/gad.207415.112 |
| [27] | Debril MB, Gelman L, Fayard E, et al. Transcription factors and nuclear receptors interact with the SWI/SNF complex through the BAF60c subunit. J Biol Chem, 2004, 279(16): 16677-16686. DOI:10.1074/jbc.M312288200 |
| [28] | Aras S, Saladi SV, Basuroy T, et al. BAF60A mediates interactions between the microphthalmia- associated transcription factor and the BRG1- containing SWI/SNF complex during melanocyte differentiation. J Cell Physiol, 2019, 234(7): 11780-11791. DOI:10.1002/jcp.27840 |
| [29] | Surabhi RM, Daly LD, Cattini PA. Evidence for evolutionary conservation of a physical linkage between the human BAF60b, a subunit of SWI/SNF complex, and thyroid hormone receptor interacting protein-1 genes on chromosome 17. Genome, 1999, 42(3): 545-549. |
| [30] | Yu XH, Zhang Y, Li TT, et al. Long non-coding RNA Linc-RAM enhances myogenic differentiation by interacting with MyoD. Nat Commun, 2017, 8: 14016. DOI:10.1038/ncomms14016 |
| [31] | Orlando KA, Nguyen V, Raab JR, et al. Remodeling the cancer epigenome: mutations in the SWI/SNF complex offer new therapeutic opportunities. Exp Rev Anticancer Therapy, 2019, 19(5): 375-391. DOI:10.1080/14737140.2019.1605905 |
| [32] | Wilson BG, Roberts CWM. SWI/SNF nucleosome remodellers and cancer. Nat Rev Cancer, 2011, 11(7): 481-492. DOI:10.1038/nrc3068 |
| [33] | Meng ZX, Wang L, Xiao YY, et al. The Baf60c/Deptor pathway links skeletal muscle inflammation to glucose homeostasis in obesity. Diabetes, 2014, 63(5): 1533-1545. DOI:10.2337/db13-1061 |
| [34] | Meng ZX, Gong JK, Chen ZM, et al. Glucose sensing by skeletal myocytes couples nutrient signaling to systemic homeostasis. Mol Cell, 2017, 66(3): 332-344. DOI:10.1016/j.molcel.2017.04.007 |
| [35] | Meng ZX, Li SM, Wang L, et al. Baf60c drives glycolytic metabolism in the muscle and improves systemic glucose homeostasis through Deptor- mediated Akt activation. Nat Med, 2013, 19(5): 640-645. DOI:10.1038/nm.3144 |
| [36] | Meng ZX, Wang L, Chang L, et al. A diet-sensitive BAF60a-mediated pathway links hepatic bile acid metabolism to cholesterol absorption and atherosclerosis. Cell Rep, 2015, 13(8): 1658-1669. DOI:10.1016/j.celrep.2015.10.033 |
| [37] | Witzel M, Petersheim D, Fan YX, et al. Chromatin-remodeling factor SMARCD2 regulates transcriptional networks controlling differentiation of neutrophil granulocytes. Nat Genet, 2017, 49(5): 742-752. DOI:10.1038/ng.3833 |
| [38] | Gogiashvili M, Edlund K, Gianmoena K, et al. Metabolic profiling of ob/ob mouse fatty liver using HR-MAS 1H-NMR combined with gene expression analysis reveals alterations in betaine metabolism and the transsulfuration pathway. Anal Bioanal Chem, 2017, 409(6): 1591-1606. DOI:10.1007/s00216-016-0100-1 |
| [39] | Li WT, Zhang WP, Chang MY, et al. Metabonomics reveals that triclocarban affects liver metabolism by affecting glucose metabolism, β-oxidation of fatty acids, and the TCA cycle in male mice. Toxicol Lett, 2018, 299: 76-85. DOI:10.1016/j.toxlet.2018.09.011 |
| [40] | Zhang JZ, Cai JJ, Yu Y, et al. Nonalcoholic fatty liver disease: an update on the diagnosis. Gene Express, 2019, 19(3): 187-198. DOI:10.3727/105221619X15553433838609 |
| [41] | Hagstr?m H, Nasr P, Ekstedt M, et al. Fibrosis stage but not NASH predicts mortality and time to development of severe liver disease in biopsy-proven NAFLD. J Hepatol, 2017, 67(6): 1265-1273. DOI:10.1016/j.jhep.2017.07.027 |
| [42] | Sheka AC, Adeyi O, Thompson J, et al. Nonalcoholic steatohepatitis: a review. JAMA, 2020, 323(12): 1175-1183. DOI:10.1001/jama.2020.2298 |
| [43] | Gulick T, Cresci S, Caira T, et al. The peroxisome proliferator-activated receptor regulates mitochondrial fatty acid oxidative enzyme gene expression. Proc Natl Acad Sci USA, 1994, 91(23): 11012-11016. DOI:10.1073/pnas.91.23.11012 |
| [44] | Chen JD, Chen JX, Fu HR, et al. Hypoxia exacerbates nonalcoholic fatty liver disease via the HIF-2α/PPARα pathway. Am J Physiol Endocrinol Metab, 2019, 317(4): E710-E722. DOI:10.1152/ajpendo.00052.2019 |
| [45] | Li SM, Liu C, Li N, et al. Genome-wide coactivation analysis of PGC-1α identifies BAF60a as a regulator of hepatic lipid metabolism. Cell Metab, 2008, 8(2): 105-117. DOI:10.1016/j.cmet.2008.06.013 |
| [46] | Aoyama T, Peters JM, Iritani N, et al. Altered constitutive expression of fatty acid-metabolizing enzymes in mice lacking the peroxisome proliferator-activated receptor α (PPARα). J Biol Chem, 1998, 273(10): 5678-5684. DOI:10.1074/jbc.273.10.5678 |
| [47] | Corton JC, Lapinskas PJ, Gonzalez FJ. Central role of PPARα in the mechanism of action of hepatocarcinogenic peroxisome proliferators. Mutat Res/Fund Mol Mechan Mutagen, 2000, 448(2): 139-151. DOI:10.1016/S0027-5107(99)00232-8 |
| [48] | Inoue C, Zhao C, Tsuduki Y, et al. SMARCD1 regulates senescence-associated lipid accumulation in hepatocytes. NPJ Ag Mech Dis, 2017, 3: 11. DOI:10.1038/s41514-017-0011-1 |
| [49] | Giordano A, Smorlesi A, Frontini A, et al. White, brown and pink adipocytes: the extraordinary plasticity of the adipose organ. Eur J Endocrinol, 2014, 170(5): R159-R171. DOI:10.1530/EJE-13-0945 |
| [50] | Luong Q, Huang J, Lee KY. Deciphering white adipose tissue heterogeneity. Biology (Basel), 2019, 8(2): 23. |
| [51] | Wu J, Bostr?m P, Sparks LM, et al. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell, 2012, 150(2): 366-376. DOI:10.1016/j.cell.2012.05.016 |
| [52] | Roh HC, Tsai LTY, Shao ML, et al. Warming induces significant reprogramming of beige, but not brown, adipocyte cellular identity. Cell Metab, 2018, 27(5): 1121-1137. e5. DOI:10.1016/j.cmet.2018.03.005 |
| [53] | Hepler C, Shao ML, Xia JY, et al. Directing visceral white adipocyte precursors to a thermogenic adipocyte fate improves insulin sensitivity in obese mice. eLife, 2017, 6: e27669. DOI:10.7554/eLife.27669 |
| [54] | Altshuler-Keylin S, Shinoda K, Hasegawa Y, et al. Beige adipocyte maintenance is regulated by autophagy-induced mitochondrial clearance. Cell Metab, 2016, 24(3): 402-419. DOI:10.1016/j.cmet.2016.08.002 |
| [55] | Modica S, Straub LG, Balaz M, et al. Bmp4 promotes a brown to white-like adipocyte shift. Cell Rep, 2016, 16(8): 2243-2258. DOI:10.1016/j.celrep.2016.07.048 |
| [56] | Shao ML, Ishibashi J, Kusminski CM, et al. Zfp423 maintains white adipocyte identity through suppression of the beige cell thermogenic gene program. Cell Metab, 2016, 23(6): 1167-1184. DOI:10.1016/j.cmet.2016.04.023 |
| [57] | Liu TY, Mi L, Xiong J, et al. BAF60a deficiency uncouples chromatin accessibility and cold sensitivity from white fat browning. Nat Commun, 2020, 11: 2379. DOI:10.1038/s41467-020-16148-1 |
| [58] | Schulz TJ, Huang P, Huang TL, et al. Brown-fat paucity due to impaired BMP signalling induces compensatory browning of white fat. Nature, 2013, 495(7441): 379-383. DOI:10.1038/nature11943 |
| [59] | Gall J, Frisdal E, Bittar R, et al. Association of cholesterol efflux capacity with clinical features of metabolic syndrome: relevance to atherosclerosis. J Am Heart Assoc, 2016, 5(12): e004808. |
| [60] | ?li? D, Marcinkiewicz A, Olejniczak D, et al. Hypercholesterolemia and prevention of cardiovascular diseases in the light of preventive medical examinations of employees in Poland. Int J Occup Med Environ Health, 2019, 32(6): 865-872. DOI:10.13075/ijomeh.1896.01446 |
| [61] | Dempsey JL, Wang DF, Siginir G, et al. Pharmacological activation of PXR and CAR downregulates distinct bile acid-metabolizing intestinal bacteria and alters bile acid homeostasis. Toxicol Sci, 2019, 168(1): 40-60. DOI:10.1093/toxsci/kfy271 |
| [62] | Lickteig AJ, Csanaky IL, Pratt-Hyatt M, et al. Activation of constitutive androstane receptor (CAR) in mice results in maintained biliary excretion of bile acids despite a marked decrease of bile acids in liver. Toxicol Sci, 2016, 151(2): 403-418. DOI:10.1093/toxsci/kfw054 |
| [63] | Davuluri G, Allawy A, Thapaliya S, et al. Hyperammonaemia-induced skeletal muscle mitochondrial dysfunction results in cataplerosis and oxidative stress. J Physiol, 2016, 594(24): 7341-7360. DOI:10.1113/JP272796 |
| [64] | Vive MGD, Anguelova GV, Duim S, et al. Metabolic encephalopathy caused by nitrous oxide ('laughing gas') induced hyperammonaemia. BMJ Case Rep, 2019, 12(11): e232163. DOI:10.1136/bcr-2019-232163 |
| [65] | Jia B, Yu ZJ, Duan ZF, et al. Hyperammonaemia induces hepatic injury with alteration of gene expression profiles. Liver Int, 2014, 34(5): 748-758. DOI:10.1111/liv.12365 |
| [66] | Jurc? AD, Jurc? M, Marius B, et al. Clinical and genetic diversity of congenital hyperammonemia. Roman J Morphol Embryol, 2018, 59(3): 945-948. |
| [67] | De Chiara F, Thomsen KL, Habtesion A, et al. Ammonia scavenging prevents progression of fibrosis in experimental nonalcoholic fatty liver disease. Hepatology, 2020, 71(3): 874-892. DOI:10.1002/hep.30890 |
| [68] | Soria LR, Marrone J, Calamita G, et al. Ammonia detoxification via ureagenesis in rat hepatocytes involves mitochondrial aquaporin-8 channels. Hepatology, 2013, 57(5): 2061-2071. DOI:10.1002/hep.26236 |
| [69] | Zhang WX, Dong ZW, Xu MY, et al. SWI/SNF complex subunit BAF60a represses hepatic ureagenesis through a crosstalk between YB-1 and PGC-1α. Mol Metab, 2020, 32: 85-96. DOI:10.1016/j.molmet.2019.12.007 |
| [70] | An P, Wei LL, Zhao SS, et al. Hepatocyte mitochondria-derived danger signals directly activate hepatic stellate cells and drive progression of liver fibrosis. Nat Commun, 2020, 11: 2362. DOI:10.1038/s41467-020-16092-0 |
| [71] | Gao JH, Wei B, De Assuncao TM, et al. Hepatic stellate cell autophagy inhibits extracellular vesicle release to attenuate liver fibrosis. J Hepatol, 2020. DOI:10.1016/j.jhep.2020.04.044 |
| [72] | Rensen SSM, Doevendans PAFM, Van Eys GJJM. Regulation and characteristics of vascular smooth muscle cell phenotypic diversity. Netherlands Heart J, 2007, 15(3): 100-108. DOI:10.1007/BF03085963 |
| [73] | Yang GR, Paschos G, Curtis AM, et al. Knitting up the raveled sleave of care. Sci Transl Med, 2013, 5(212): 212r. |
| [74] | Ray S, Reddy AB. Cross-talk between circadian clocks, sleep-wake cycles, and metabolic networks: dispelling the darkness. BioEssays, 2016, 38(4): 394-405. DOI:10.1002/bies.201500056 |
| [75] | Ging DL, Gong YY, Eckel-Mahan KL, et al. Central circadian clock regulates energy metabolism//Wu Q, Zheng R, Eds. Advances in Experimental Medicine and Biology. Singapore: Springer, 2018, 1090: 79-103. |
| [76] | Maury E, Ramsey KM, Bass J. Circadian rhythms and metabolic syndrome: from experimental genetics to human disease. Circ Res, 2010, 106(3): 447-462. DOI:10.1161/CIRCRESAHA.109.208355 |
| [77] | Wood PA, Yang XM, Hrushesky WJM. Clock genes and cancer. Integr Cancer Ther, 2009, 8(4): 303-308. DOI:10.1177/1534735409355292 |
| [78] | Preitner N, Damiola F, Luis-Lopez-Molina, et al. The orphan nuclear receptor REV-ERBα controls circadian transcription within the positive limb of the mammalian circadian oscillator. Cell, 2002, 110(2): 251-260. DOI:10.1016/S0092-8674(02)00825-5 |
| [79] | Tao WW, Chen SY, Shi GS, et al. SWItch/sucrose nonfermentable (SWI/SNF) complex subunit BAF60a integrates hepatic circadian clock and energy metabolism. Hepatology, 2011, 54(4): 1410-1420. DOI:10.1002/hep.24514 |
| [80] | Chen SY, Ding Y, Zhang Z, et al. Hyperlipidaemia impairs the circadian clock and physiological homeostasis of vascular smooth muscle cells via the suppression of Smarcd1. J Pathol, 2014, 233(2): 159-169. DOI:10.1002/path.4338 |
| [81] | Gatfield D, Le Martelot G, Vejnar CE, et al. Integration of microRNA miR-122 in hepatic circadian gene expression. Genes Dev, 2009, 23(11): 1313-1326. DOI:10.1101/gad.1781009 |
| [82] | Oh J, Sohn DH, Ko M, et al. BAF60a interacts with p53 to recruit the SWI/SNF complex. J Biol Chem, 2008, 283(18): 11924-11934. DOI:10.1074/jbc.M705401200 |
| [83] | Arts FA, Keogh L, Smyth P, et al. miR-223 potentially targets SWI/SNF complex protein SMARCD1 in atypical proliferative serous tumor and high-grade ovarian serous carcinoma. Human Pathol, 2017, 70: 98-104. DOI:10.1016/j.humpath.2017.10.008 |
| [84] | Shen J, Xiao ZG, Wu WKK, et al. Epigenetic silencing of miR-490-3p reactivates the chromatin remodeler SMARCD1 to promote Helicobacter pylori-induced gastric carcinogenesis. Cancer Res, 2015, 75(4): 754-765. DOI:10.1158/0008-5472.CAN-14-1301 |
| [85] | Sun DD, Lee YS, Malhotra A, et al. miR-99 family of MicroRNAs suppresses the expression of prostate-specific antigen and prostate cancer cell proliferation. Cancer Res, 2011, 71(4): 1313-1324. DOI:10.1158/0008-5472.CAN-10-1031 |
| [86] | Takebayashi K, Nasu K, Okamoto M, et al. hsa-miR-100-5p, an overexpressed miRNA in human ovarian endometriotic stromal cells, promotes invasion through attenuation of SMARCD1 expression. Reprod Biol Endocrinol, 2020, 18: 31. DOI:10.1186/s12958-020-00590-3 |
| [87] | Rane JK, Erb HHH, Nappo G, et al. Inhibition of the glucocorticoid receptor results in an enhanced miR-99a/100-mediated radiation response in stem-like cells from human prostate cancers. Oncotarget, 2016, 7(32): 51965-51980. DOI:10.18632/oncotarget.10207 |
| [88] | Zhou YJ, Xu Q, Lv T, et al. Enhanced SMARCD1, a subunit of the SWI/SNF complex, promotes liver cancer growth through the mTOR pathway. Clin Sci (Lond), 2020, 134(12): 1457-1472. DOI:10.1042/CS20200244 |
| [89] | Chen L, Fulcoli FG, Ferrentino R, et al. Transcriptional control in cardiac progenitors: Tbx1 interacts with the BAF chromatin remodeling complex and regulates Wnt5a. PLoS Genet, 2012, 8(3): e1002571. DOI:10.1371/journal.pgen.1002571 |
| [90] | Van De Wijngaart DJ, Dubbink HJ, Molier M, et al. Functional screening of FxxLF-like peptide motifs identifies SMARCD1/BAF60a as an androgen receptor cofactor that modulates TMPRSS2 expression. Mol Endocrinol, 2009, 23(11): 1776-1786. DOI:10.1210/me.2008-0280 |
| [91] | Alajem A, Biran A, Harikumar A, et al. Differential association of chromatin proteins identifies BAF60a/SMARCD1 as a regulator of embryonic stem cell differentiation. Cell Rep, 2015, 10(12): 2019-2031. DOI:10.1016/j.celrep.2015.02.064 |
| [92] | Wang RR, Pan R, Zhang WJ, et al. The SWI/SNF chromatin-remodeling factors BAF60a, b, and c in nutrient signaling and metabolic control. Protein Cell, 2018, 9(2): 207-215. DOI:10.1007/s13238-017-0442-2 |
| [93] | Doyle SL, Mongan AM, Donohoe CL, et al. Impact of visceral obesity and metabolic syndrome on the postoperative immune, inflammatory, and endocrine response following surgery for esophageal adenocarcinoma. Dis Esophagus, 2017, 30(6): 1-11. |
| [94] | Galmés S, Cifre M, Palou A, et al. A genetic score of predisposition to low-grade inflammation associated with obesity may contribute to discern population at risk for metabolic syndrome. Nutrients, 2019, 11(2): 298. DOI:10.3390/nu11020298 |
| [95] | Drummond JB, Barbosa IG, Dantzer R, et al. The effect of insulin-induced hypoglycemia on inflammatory markers: A systematic review. Brain Behavior Immun, 2018, 73: 41-50. DOI:10.1016/j.bbi.2018.05.003 |
| [96] | Jeong HS. The relationship between workplace environment and metabolic syndrome. Int J Occup Environ Med, 2018, 9(4): 176-183. DOI:10.15171/ijoem.2018.1346 |
| [97] | Wallwork RS, Colicino E, Zhong J, et al. Ambient fine particulate matter, outdoor temperature, and risk of metabolic syndrome. Am J Epidemiol, 2017, 185(1): 30-39. DOI:10.1093/aje/kww157 |
| [98] | Nikooyeh B, Abdollahi Z, Hajifaraji M, et al. Vitamin D status and cardiometabolic risk factors across latitudinal gradient in Iranian adults: National food and nutrition surveillance. Nutrit Health, 2017, 23(2): 87-94. DOI:10.1177/0260106017702918 |
