
 , 张名位2
, 张名位2

1. 长江大学 生命科学学院,湖北 荆州 434020;
2. 广东省农业科学院蚕业与农产品加工研究所 农业农村部功能食品重点实验室/广东省农产品加工重点实验室,广东 广州 510610
收稿日期:2020-06-21;接收日期:2020-08-25
基金项目:国家自然科学基金(No. 31801474), 广东省自然科学基金(No. 2018A030313025), 广州市科技计划(No. 201903010033), 国家重点研发计划(No. 2018YFD0401101-03), 广东省特支计划(No. 2019BT02N112), 广东省农业科学院院长基金(No. 201906), 广东省现代农业产业共性关键技术研发创新团队项目(No. 2019KJ117), 科技创新战略专项资金(高水平农科院建设) (Nos. 201602TD, R2017YJ-YB1005, R2018PY-QF002, R2018PY-JC002, R2018QD-080, R2019YJ-YB1001) 资助
摘要:为发展新型面粉改良酶制剂,利用大肠杆菌Escherichia coli原核表达了小麦静息巯基氧化酶(Wheat quiescin sulfhydryl oxidase,wQSOX)。将合成的wqsox基因构建至pMAL-c5x载体,并在大肠杆菌中进行表达,优化蛋白表达条件后对重组蛋白进行分离纯化及融合标签切除,获得的重组wQSOX蛋白用于酶学性质探究以及面包品质改良。结果表明,合成的截短wqsox基因包含1 359 bp,编码453个氨基酸,理论蛋白分子量51 kDa;构建的pMAL-c5x-wqsox重组质粒在E. coli Rosetta gamiB(DE3) 中可溶表达了重组蛋白MBP-wQSOX,其最佳表达条件为:诱导温度25 ℃,诱导剂IPTG浓度0.3 mmol/L,诱导时间6 h;利用Xa因子蛋白酶切除了MBP融合标签,亲和层析纯化得到了wQSOX;wQSOX可催化DTT、GSH和Cys氧化,并伴随着H2O2的生成,其中对DTT表现出最高的底物特异性;酶学性质研究发现,wQSOX最适反应温度和pH分别为50 ℃和10.0,在高温和碱性环境条件下表现出较好的稳定性;每克面粉中添加1.1 U wQSOX能够显著(P < 0.05) 提高26.4%的面包比容,降低20.5%的面包芯硬度和24.8%的咀嚼性,表现出了较好的改良面包加工品质能力。研究结果对丰富新型面粉改良酶制剂种类以及推动wQSOX在焙烤行业的应用奠定了理论基础。
关键词:小麦静息巯基氧化酶原核表达酶学性质面包品质
Expression and characterization of recombinant wheat quiescin sulfhydryl oxidase and its effect on bread quality
Nian Du1, Yuanyuan Deng2, Zhencheng Wei2, Yan Zhang2, Xiaojun Tang2, Ping Li2, Pengfei Zhou2, Guang Liu2

 , Mingwei Zhang2
, Mingwei Zhang2

1. College of Life Science, Yangtze University, Jingzhou 434020, Hubei, China;
2. Key Laboratory of Functional Foods, Ministry of Agriculture and Rural Affairs/Guangdong Key Laboratory of Agricultural Products Processing, Sericultural and Agri-Food Research Institute Guangdong Academy of Agricultural Sciences, Guangzhou 510610, Guangdong, China
Received: June 21, 2020; Accepted: August 25, 2020
Supported by: National Natural Science Foundation of China (No. 31801474), Natural Science Foundation of Guangdong Province (No. 2018A030313025), Guangzhou Science and Technology Plan Projects (No. 201903010033), National Key Research and Development Program of China (No. 2018YFD0401101-03), Guangdong Special Support Program (No. 2019BT02N112), Dean's Fund of Guangdong Academy of Agricultural Sciences (No. 201906), Guangdong Modern Agricultural Industry Generic Key Technology Research and Development Innovation Team Project (No. 2019KJ117), Special Fund for Scientific Innovation Strategy-Construction of High Level Academy of Agriculture Science (Nos. 201602TD, R2017YJ-YB1005, R2018PY-QF002, R2018PY-JC002, R2018QD-080, R2019YJ-YB1001)
Corresponding author: Guang Liu. Tel: +86-20-87236227; E-mail: liuguang@gdaas.cn;
Mingwei Zhang. Tel: +86-20-87236227; E-mail: mwzhh@vip.tom.com.
Abstract: Wheat quiescin sulfhydryl oxidase was expressed in Escherichia coli for developing a new biological flour improver. The synthesized wqsox gene was constructed into the vector pMAL-c5x and expressed in E. coli, then the expression conditions of recombinant protein was optimized. The MBP fusion label in recombinant protein was removed by protease digestion after affinity purification. Moreover, enzymatic properties of the purified wQSOX and its effect on bread quality were investigated. The synthesized wqsox gene contained 1 359 bp and encoded 453 amino acids with a deduced molecular weight of 51 kDa. The constructed recombinant vector pMAL-c5x-wqsox could successfully express soluble recombinant protein MBP-wQSOX in E. coli Rosetta gamiB(DE3), and the optimal induced expression conditions for recombinant protein were 25 ℃, 0.3 mmol/L IPTG and 6 h. MBP fusion tag was cut out by factor Xa protease and wQSOX was prepared after affinity purification. wQSOX could catalyze the oxidation of DTT, GSH and Cys, accompanying the production of H2O2, and exhibited the highest substrate specificity for DTT. Furthermore, enzymatic properties results demonstrated that the optimal temperature and pH for wQSOX catalyzing oxidation of DTT was 50 ℃ and 10.0, respectively, and wQSOX presented a good stability under high temperature and alkaline environment. The addition of wQSOX with 1.1 U/g flour significantly (P < 0.05) increased 26.4% specific volume of the bread, and reduced 20.5% hardness and 24.8% chewiness of bread crumb compared to the control, indicating a remarkable ability to improve the quality of bread.
Keywords: wheat quiescin sulfhydryl oxidaseprokaryotic expressionenzymatic characteristicsbread quality
近年来,随着安全、高效的酶制剂在面包等面制品中的广泛应用,新型面粉改良酶制剂的开发成为了研究热点,β-葡聚糖酶[1]、葡糖基转移酶B[2]和内质网氧化还原酶[3]等一系列新型面粉改良酶制剂的开发不仅丰富了我国酶制剂的种类,同时也有助于促进面粉改良酶制剂的复配。
静息巯基氧化酶(Quiescin sulfhydryl oxidase,QSOX) 是一种黄素(FAD) 依赖型巯基氧化酶家族蛋白[4],其同时包含了硫氧还蛋白结构域(Trx)、富含螺旋结构结构域(HRR) 和FAD结合结构域(Erv/ALR),是目前已知唯一能够直接催化未折叠蛋白或小分子底物二硫键交联的多结构域蛋白质[5]。QSOX催化巯基氧化过程中,通过辅基FAD辅助将电子传递给分子氧,并最终生成副产物过氧化氢完成整个催化反应循环[6]。
目前,有关QSOX的研究主要集中在催化机制、生理功能以及立体结构等方面,而在食品等工业领域中的应用研究尚未见报道。基于巯基氧化酶家族在面粉改良方面的应用价值[7],Liu等[8]的研究发现,仅含有FAD结合结构域(Erv/ALR) 的重组小麦内质网氧化还原酶(wEro1) 表现出了增强面团粘弹性,强化面筋网络结构以及提高面包、馒头等终端面制品品质的特性。相比于内质网氧化还原酶1 (Ero1),QSOX由于同时含有Erv/ALR结构域和Trx结构域,其催化巯基氧化效率上要比Ero1高出2–3个数量级[9],因此,理应具有比Ero1更高效的改良面制品品质的潜力。
基于此,本研究利用大肠杆菌原核表达体系重组表达小麦QSOX (wQSOX),优化重组蛋白表达条件,分离纯化后对重组wQSOX的酶学性质进行探究,并初步将wQSOX应用到面包品质改良研究。研究结果为丰富新型面粉改良酶制剂种类以及推动我国焙烤行业的发展奠定理论基础。
1 材料与方法1.1 主要材料与试剂pMAL-c5x和pET-28a质粒、表达菌株大肠杆菌Escherichia coli Rosetta-gamiB(DE3) 和BL21(DE3) 购于宝生物工程有限公司;wqsox基因合成由广州英赞生物科技有限公司完成。
质粒小提试剂盒购自北京聚合美生物科技有限公司;氨苄青霉素(Ampicillin,Amp)、硫酸卡那霉素(Kanamycin sulfate,Kan)、异丙基-β-D-硫代半乳糖苷(Isopropy-β-D-thiogalactoside,IPTG)、还原型谷胱甘肽(Glutathione,GSH)、L-半胱氨酸(L-cysteine,Cys)、二硫苏糖醇(Dithiothreitol,DTT)、黄素腺嘌呤二核苷酸钠盐(Flavin adenine dinucletide,FAD) 均购自上海源叶生物科技有限公司;Xa因子蛋白酶购自美国NEB公司;过氧化氢酶(牛肝) 购自上海瑞永生物科技有限公司;红牡丹高筋面粉购自广州市南方面粉股份有限公司。
1.2 主要仪器与设备美国Bio-Rad蛋白电泳仪,美国GE蛋白纯化仪,英国汉莎Oxygraph液相氧电极,北京凯奥NanoVue plus型微量紫外分光光度计,美的全自动面包机和烤箱,英国Stable Microsystem质构仪。
1.3 方法1.3.1 重组表达载体构建从NCBI上获得到了小麦qsox全长基因(GenBank登录号AK455480.1) 序列信息,其包含1 554 bp,编码518个氨基酸。其中,第1–27位氨基酸(N端) 序列为信号肽区,第481–518位氨基酸为跨膜区。在去除信号肽和跨膜区后得到了包含1 359 bp (82–1 440 bp),编码453个氨基酸的截短wqsox基因片段。利用全基因合成技术,制备得到了分别带有上、下游酶切位点NdeⅠ和BamHⅠ的截短wqsox基因片段,并连接至pMAL-c5x载体上,构建得到了pMAL-c5x-wqsox重组表达质粒。
1.3.2 重组wQSOX的诱导表达和可溶性分析测序正确的pMAL-c5x-wqsox重组质粒转化至Rosetta-gamiB(DE3) 感受态细胞中,并涂布至含Kan (终浓度50 μg/mL) 和Amp (终浓度100 μg/mL) 的LB固体平板培养基上。37 ℃恒温培养过夜后,挑取形态饱满的单克隆菌接种到5 mL含有相同浓度Kan和Amp的LB液体培养基中,37 ℃、200 r/min培养12 h后按1︰100比例转接到新鲜LB液体培养基中,相同条件下继续培养菌液至OD600达到0.5–0.6后,向液体培养基中加入终浓度为0.1 mmol/L的IPTG诱导剂,随后相同条件下继续培养3 h后收集菌液用于蛋白表达分析,以不加诱导剂组为对照。
向离心收集的菌体中加入20 mmol/L Tris-HCl缓冲液(含0.5 mol/L NaCl,pH 8.0),冰浴条件下超声破碎细胞,超声功率200 W,占空比0.5︰0.5,超声时间10 min。菌液破碎后于4 ℃、12 000 r/min离心10 min,分别收集上清液和沉淀用于蛋白的可溶性分析。蛋白的重组表达和可溶性分析采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE) 鉴定。
1.3.3 wQSOX的表达条件优化将含有重组质粒pMAL-c5x-wqsox的工程菌Rosetta-gamiB(DE3) 接种至含Kan和Amp双抗(终浓度同上) LB液体培养基中诱导目的蛋白表达,分析表达温度(37 ℃、25 ℃、18 ℃)、IPTG浓度(0.1、0.2、0.3、0.5、1.0 mmol/L) 以及诱导时间(2、4、6、8、10 h) 对重组蛋白表达水平的影响。定时收集菌液样品,使用SDS-PAGE分析目的蛋白表达情况,确定最优表达条件。
1.3.4 重组wQSOX的分离纯化将诱导收集的菌体按照每克菌体加入5 mL缓冲液A (20 mmol/L Tris,0.5 mol/L NaCl,10 mmol/L咪唑,pH 8.0) 重悬,按照1.3.2方法冰浴超声至菌液澄清,菌体破碎后,4 ℃、12 000 r/min离心20 min收集上清液,并进一步使用0.45 μm滤膜对上清液进行过滤,除去可能堵塞层析柱的细小颗粒。
过滤后的上清液载入到使用缓冲液A预平衡的Ni-NTA亲和层析柱中,用缓冲液A洗脱未与柱子结合的蛋白,随后按照梯度洗脱方式用缓冲液B (20 mmol/L Tris,0.5 mol/L NaCl,500 mmol/L咪唑,pH 8.0) 洗脱目的蛋白,洗脱速度2 mL/min,收集各洗脱峰流出液,进行SDS-PAGE分析。并用微量紫外分光光度计在280 nm处测定蛋白浓度。
合并收集重组目的蛋白,超滤浓缩后加入10倍摩尔量FAD[10],4 ℃孵育过夜后使用20 mmol/L Tris-HCl (pH 8.0) 预平衡的HiPrep 26/10脱盐柱处理,收集去除多余FAD的wQSOX。由于重组蛋白N-末端带有MBP融合标签,因此,命名为MBP-wQSOX。蛋白浓度使用微量紫外分光光度计测定(εMBP-wQSOX=1.55 mL/(mg·cm))。
1.3.5 MBP融合标签的去除使用Xa因子蛋白酶对重组MBP-wQSOX进行MBP融合标签切除。将纯化后的重组MBP- wQSOX加入到酶切缓冲液(20 mmol/L Tris-HCl,100 mmol/L NaCl,2 mmol/L CaCl2,pH 8.0) 中,按照1 μg Xa因子蛋白酶切50 μg MBP融合标签加入适量蛋白酶,23 ℃条件下酶切6 h后对酶切产物进行分离。使用Amylose Resin亲和层析对酶切产物进行纯化,分别收集洗脱组分进行SDS-PAGE分析,合并收集去除MBP标签的重组蛋白wQSOX。
1.3.6 wQSOX的活性检测及H2O2生成验证wQSOX氧化DTT的过程中会消耗溶液氧,并伴随过氧化氢的生成,参照Gross等[11]方法,使用液相氧电极测定wQSOX氧化DTT的巯基氧化活性。取10 μL重组wQSOX (终浓度为5 μmol/L) 加入到980 μL 20 mmol/L,pH 8.0的Tris-HCl缓冲液中,待溶液氧浓度基线平稳后,加入10 μL 1 mol/L DTT启动反应,记录氧浓度变化,反应在25 ℃条件下进行。wQSOX酶活定义为:在以DTT为底物,缓冲液pH 8.0,反应温度为25 ℃条件下,反应10 min内,1 min消耗1 μmol溶液氧所需的酶量为1 U。反应10 min后待溶液氧浓度保持平稳时,向反应体系中加入60 U过氧化氢酶,继续观察溶液氧浓度变化,验证H2O2的生成。
1.3.7 底物特异性分析选择不同还原剂GSH、Cys和DTT考察wQSOX氧化小分子还原剂的底物特异性。反应按照1.3.6所述方法执行,各小分子还原剂的终浓度为10 mmol/L,记录溶液氧含量变化。
1.3.8 重组wQSOX的酶学特性分析以DTT为底物,测定重组wQSOX巯基氧化活性的酶学特性,包括最适反应温度和温度稳定性,最适反应pH和pH稳定性。
将重组wQSOX加入到Tris-HCl缓冲液(pH 10.0) 中,在不同温度(20–80 ℃) 条件下测定酶最适反应温度;将重组蛋白置于不同温度下(20–80 ℃) 孵育1 h后,在最适条件下测定其残留酶活性,得到酶的温度稳定性。
选择磷酸盐缓冲液(20 mmol/L,pH 6.0–8.0)、醋酸钠-氢氧化钠缓冲液(20 mmol/L,pH 8.0–11.0) 于25 ℃条件下探究酶的最适反应pH;将重组蛋白置于不同pH缓冲液(pH 6.0–11.0) 中孵育1 h后,在最适条件下测定其残留酶活性,得到酶的pH稳定性。
1.3.9 面包的制作及其质量评估面包制作参考Kim等[12]的方法并稍做修改。面包配方由100 g高筋面粉、1.6 g氯化钠、6 g蔗糖、3 g调和油、1 g活性干酵母和55 g蒸馏水组成。具体制作过程为将这些原料按顺序加入到面包机中,100 r/min搅拌18 min后制得面团,将面团分成50 g每份,用手揉圆后放入模具中,置于30 ℃、80%相对湿度条件下醒发1 h后,放入预热好的烤箱中烘烤10 min,上火和下火温度分别为170 ℃和180 ℃,烤箱中放入盛水容器,防止面包表面过干。焙烤结束后,将面包放在25 ℃、45%相对湿度条件下冷却1 h,随后对面包的物理参数包括质量、体积[13]、高度、直径进行测定。酶处理组中,每克面粉添加重组wQSOX的量为1.1 U,随蒸馏水加入到体系中,其余处理过程与对照组相同。
随后,将面包切片至2 cm厚,选用直径为36 mm的P36R探头对面包芯进行质构测定,质构测定的参数如下:探头测前速度和测试速度为1 mm/s,测后速度为5 mm/s,面包芯压缩比为50%,两次压缩间隔时间10 s。测定结束后,得到面包的硬度、咀嚼度和弹性3个参数。
1.3.10 统计学分析所有数据均为3次试验的平均值,使用SPSS 20.0进行显著性分析。
2 结果与分析2.1 重组蛋白的表达与可溶性分析将构建的重组质粒pMAL-c5x-wqsox转化到大肠杆菌Rosetta-gamiB(DE3) 感受态细胞进行蛋白表达分析,结果如图 1所示。比较条带1和条带2可得,电泳胶上约90 kDa位置出现了明显的蛋白表达条带,表明加入诱导剂IPTG成功诱导了重组蛋白的表达。表达的重组wQSOX理论蛋白质分子质量约为51 kDa,表达过程中N-末端带有MBP融合标签,因此,重组表达的MBP-wQSOX理论分子量约为94 kDa,这与电泳图谱上蛋白条带表观分子量相符。此外,条带3和条带4分别为重组菌破碎上清液和沉淀的电泳条带,由图可见,上清液和沉淀都有目的蛋白,且上清液中目的蛋白浓度较沉淀中高,说明重组MBP-wQSOX总体呈可溶性表达。
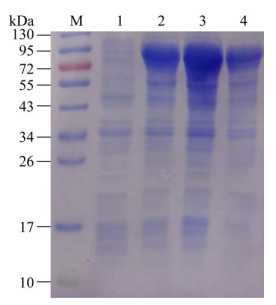 |
| 图 1 重组MBP-wQSOX的表达和可溶性分析 Fig. 1 Expression and soluble analysis of recombinant wQSOX by SDS-PAGE. M: protein marker; lane 1: recombinant bacteria before inducing; lane 2: recombinant bacteria after inducing; lane 3: supernatant of recombinant bacteria lysate; lane 4: precipitate of recombinant bacteria lysate. |
| 图选项 |
2.2 表达条件优化MBP-wQSOX的表达条件优化结果如图 2所示。首先对诱导温度进行分析,由图 2A可见,重组菌在37 ℃和25 ℃条件下诱导时均能高效地产生目的蛋白,而18 ℃对重组蛋白的表达不利。尽管37 ℃和25 ℃两个温度都能够诱导表达可溶的目的蛋白,但后续活性检测发现,37 ℃条件下表达的可溶蛋白未检测到巯基氧化活性,而25 ℃条件下目的蛋白可溶性良好,酶学活性强。因此,重组蛋白最适表达温度为25 ℃。
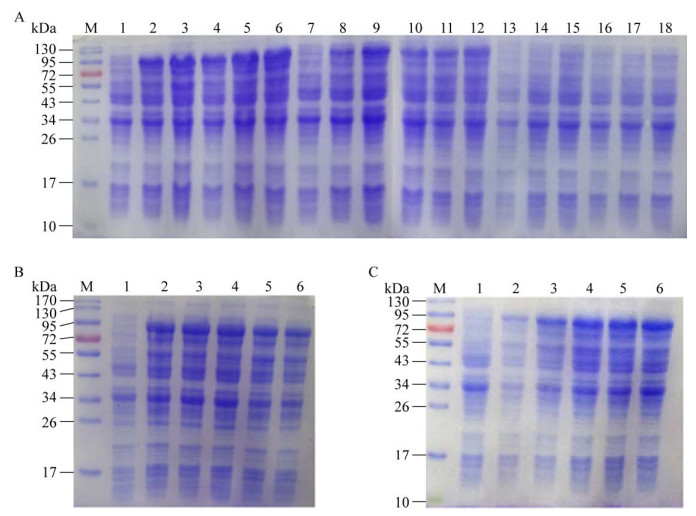 |
| 图 2 重组MBP-wQSOX表达条件优化 Fig. 2 Optimization of expression conditions for recombinant MBP-wQSOX. (A) Optimization of expression temperature. M: protein marker; lane 1, 7, 13: recombinant bacteria before inducing; lane 2–6: the recombinant bacteria collected after 2, 4, 6, 8 and 10 h were induced at 37 ℃; lane 8–12: the recombinant bacteria collected after 2, 4, 6, 8 and 10 h were induced at 25 ℃; lane 14–18: the recombinant bacteria collected after 2, 4, 6, 8 and 10 h were induced at 18 ℃. (B) Optimization of IPTG concentration. M: protein marker; lane 1: recombinant bacteria before inducing; lane 2–6: the recombinant bacteria were respectively added with 0.1, 0.2, 0.3, 0.5 and 1 mmol/L IPTG and collected after induction at 25 ℃ for 10 h. (C) Optimization of expression time. M: protein marker; lane 1: recombinant bacteria before inducing; lane 2–6: the recombinant bacteria collected at 25 ℃ and 0.3 mmol/L IPTG were induced for 2, 4, 6, 8 and 10 h, respectively. |
| 图选项 |
随后,在25 ℃条件下探究了IPTG浓度对重组蛋白表达影响,由图 2B可知,随着IPTG浓度的增大,目的蛋白表达量呈先增加后降低的趋势,IPTG浓度为0.3 mmol/L时有最大表达量,此条件即为最适诱导剂浓度。
在确定最适表达温度和最适诱导剂浓度基础上,进一步对表达时间进行了优化,结果如图 2C所示。目的蛋白随诱导时间的增加其表达量增大,当诱导超过6 h后,目的蛋白表达量无明显变化,即诱导时间6 h为重组蛋白最适表达时间。因此,优化得到重组蛋白最适表达条件为25 ℃、0.3 mmol/L IPTG,诱导时间6 h。
2.3 重组蛋白的分离纯化和MBP标签切除重组蛋白MBP-wQSOX,同时带有MBP和6×His融合标签,采用Ni-NTA亲和层析对MBP-wQSOX进行分离纯化。如图 3条带1所示,使用含500 mmol/L咪唑的洗脱液洗脱出来的组分含有目的蛋白,表明利用Ni-NTA亲和层析能够有效纯化目的蛋白。
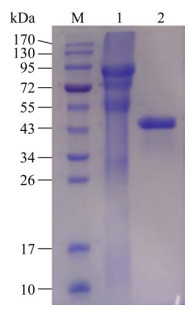 |
| 图 3 MBP-wQSOX的亲和纯化和MBP标签切除分析 Fig. 3 Affinity purification of MBP-wQSOX and its MBP-tag excision. M: protein marker; lane 1: MBP-wQSOX after Ni-NTA affinity chromatography; lane 2: collected wQSOX after affinity chromatography by using MBP column. |
| 图选项 |
由于重组MBP-wQSOX带有的MBP融合标签分子量较大(约42 kDa),为了不影响酶学活性测定,使用Xa因子蛋白酶进行切标签处理并进行Amylose Resin亲和层析,收集未与层析柱结合的穿透峰进行电泳分析,结果如图 3条带2所示,发现经过酶切后重组蛋白分子量显著降低,目的蛋白在凝胶上呈单条带迁移,其表观分子质量约为50.0 kDa,这与wQSOX理论蛋白质分子量51.0 kDa接近。因此,通过酶切纯化后获得了纯度较高的重组wQSOX,可用于后续的酶学活性测定。
2.4 重组wQSOX巯基氧化活性验证wQSOX催化DTT氧化,发挥巯基氧化活性将消耗溶液氧并生成过氧化氢。因此,检测溶液氧浓度变化可表征wQSOX巯基氧化活性。如图 4A所示,wQSOX或DTT单独存在时,溶液氧浓度变化较小,而当两者混合后,溶液氧浓度急剧下降,反映wQSOX能够催化氧化DTT,即表现出了巯基氧化活性,该条件下计算得到wQSOX的比酶活性为1.1 U/mg。
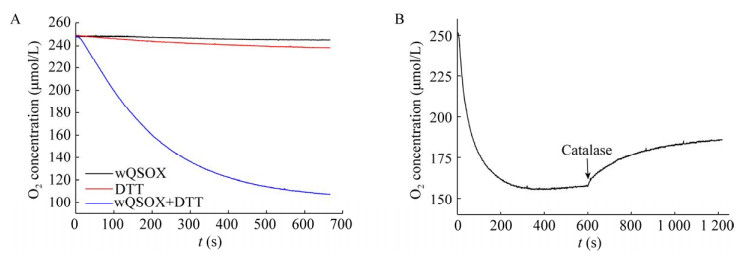 |
| 图 4 重组wQSOX的巯基氧化活性检测 Fig. 4 Detection of sulfhydryl oxidation activity of recombinant wQSOX. (A) Oxygen consumption of wQSOX catalyzing the oxidation of DTT. (B) Detection of H2O2 produced by wQSOX catalyzing the oxidation of DTT. |
| 图选项 |
为了验证溶液中有过氧化氢生成,当wQSOX催化DTT氧化过程中溶液氧浓度下降至平稳后,向溶液中加入过氧化氢酶,结果发现,过氧化氢酶添加后溶液氧浓度迅速增加(图 4B),这主要是由于wQSOX催化反应生成的过氧化氢在过氧化氢酶作用下分解出了氧气,引起了溶液氧浓度的回升,也即从侧面验证了溶液中有过氧化氢生成。
这些结果表明,重组wQSOX具有显著巯基氧化活性,催化DTT氧化过程中生成了过氧化氢。
2.5 重组wQSOX底物特异性分析选择3种不同的小分子巯基还原剂DTT、GSH和Cys作为底物,探究wQSOX的底物特异性。结果表明,3种底物的加入都能引起溶液氧下降,表明这3种小分子都能够作为底物被wQSOX催化氧化(图 5)。然而,相比于另外两组底物,DTT组在单位时间内溶液氧浓度变化更大,说明wQSOX催化DTT氧化效率较另外两种底物更高。因此,底物特异性试验结果可知,wQSOX的最适小分子巯基还原底物为DTT。
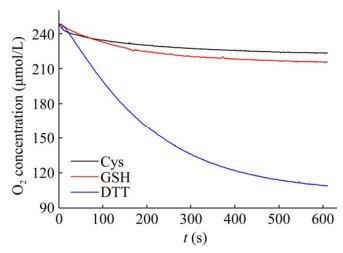 |
| 图 5 重组wQSOX的底物特异性 Fig. 5 Substrate specificity of recombinant wQSOX. |
| 图选项 |
2.6 重组wQSOX的酶学特性以DTT为底物,进一步探究了wQSOX的酶学特性,测定了酶的最适反应温度和温度稳定性以及最适反应pH和pH稳定性,结果如图 6所示。
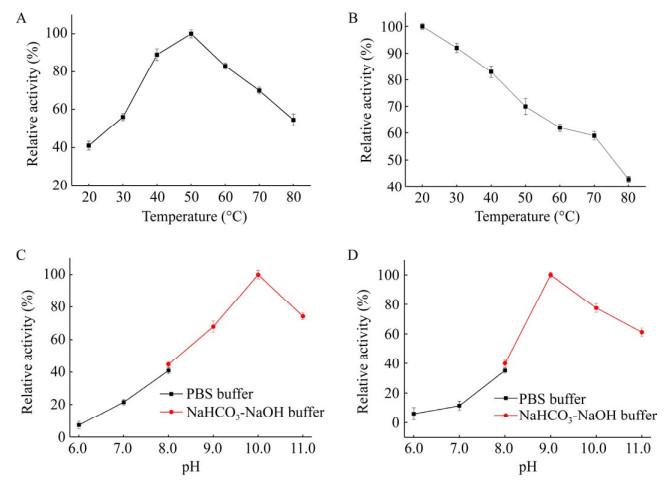 |
| 图 6 重组wQSOX的酶学性质测定 Fig. 6 Enzymatic properties of recombinant wQSOX. (A) Oxygen consumption activity of wQSOX measured from 20 ℃ to 80 ℃, with activity at 50 ℃ normalized to 100%. (B) Thermal stability of wQSOX which was incubated in 20 mmol/L Tris-HCl buffer (pH 8.0) at different temperatures (20-80 ℃) for 1 h. (C) Oxygen consumption activity of wQSOX measured at different pH values (pH 6.0-11.0), with activity at pH 10.0 normalized to 100%. (D) The pH stability of wQSOX which was incubated at 25 ℃ for 1 h in 20 mmol/L PBS buffer (pH 6.0-8.0), and 20 mmol/L NaHCO3-NaOH buffer (pH 8.0-11.0). |
| 图选项 |
wQSOX最适反应温度为50 ℃ (图 6A),50 ℃孵育1 h后,保留约70%的最大酶活性,且80 ℃孵育1 h后,仍保留40%以上最大酶活性(图 6B),说明wQSOX具有较好的温度稳定性。
由图 6C可见,酶的最适反应pH为10.0,说明wQSOX更倾向于在碱性环境中发挥催化活性。
pH稳定性实验结果表明,酶在pH 9.0孵育1 h后其残留活性基本无损失,且在pH 9.0-11.0范围内孵育1 h后仍保留60%以上最大活性;相反,在pH 7.0以下条件孵育1 h后其残留活性低于20%,说明碱性环境中酶的稳定性更佳。
2.7 重组wQSOX对面包品质影响在明确wQSOX酶学特性的基础上,将wQSOX应用于面包品质改良,结果如表 1所示。由表可得,相比于对照组,每克面粉中添加1.1 U wQSOX的试验组面包其比容和高径比增大,分别提高了26.4%和7.1%,比容的增加说明面包的品质得到了改善。
表 1 wQSOX对面包品质影响Table 1 Effect of wQSOX on qualities of bread
| Groups | SV (cm3/g) | HD | Hardness (g) | Chewiness (g) | Springiness |
| Control | 1.487±0.01a | 0.763±0.06a | 2 383.3±113.71a | 1 735.67±86.31a | 0.904±0.02a |
| wQSOX | 1.880±0.07b | 0.817±0.03a | 1 894.8±73.73b | 1 305.23±43.47b | 0.923±0.01a |
| Improvement rate (%) | 26.4 | 7.1 | 20.5 | 24.8 | 2.1 |
| Notes: the additive amount of wQSOX was 1.1 U/g flour, the improvement rate indicated the increased value of data from bread with wQSOX treatment compared with the control group; SV and HD represent specific loaf volume and height/diameter, respectively; The different letters in the same column indicate significant difference (P < 0.05). | |||||
表选项
为了进一步表征面包品质,使用TPA对面包芯进行了质构特性分析。由表 1可见,添加wQSOX显著(P < 0.05) 降低了面包芯20.5%的硬度和24.8%的咀嚼性,提高了2.1%的面包芯弹性。硬度和咀嚼型指标与面包品质成反比,而弹性则成正比,说明wQSOX能够显著提高面包品质。
3 讨论使用大肠杆菌原核表达含有多对二硫键的蛋白质是基因工程领域的难点[14]。大肠杆菌细胞质是还原环境,不利于二硫键的生成,容易导致重组蛋白错误折叠产生包涵体。本研究wQSOX含有14个Cys,包含至少3对二硫键,前期构建的pET-28a-wqsox和pMAL-c5x-wqsox重组载体在大肠杆菌BL21(DE3) 中表达分别得到无活性的包涵体蛋白和无活性的可溶蛋白。研究表明,大肠杆菌细胞周质的氧化环境有助于促进含二硫键的蛋白重组表达[15]。张丹萍等[16]通过使用Rosetta- gami(DE3) 成功表达了富含二硫键的人类胰岛素生长因子-1。因此,本研究选择能够促进二硫键生成及稀有密码子表达的宿主菌Rosetta-gamiB(DE3) 进行重组蛋白表达,结果得到了可溶的具有生物活性的重组MBP-wQSOX。
QSOX在生物体细胞内主要功能是催化新生肽链的二硫键折叠[17-18],为了便于体外考察其生物活性,常使用小分子巯基还原剂作为其反应底物。本研究选择了3种小分子巯基还原底物DTT、GSH、Cys用于检测wQSOX底物特异性,发现wQSOX催化DTT氧化的反应效率最高,即为最适的小分子底物,该结果与Aya Okuda等[19]报道的大豆静息巯基氧化酶(rGmQSOX1) 的底物特异性一致,这可能是因为所选3种小分子巯基还原底物的氧化还原电位值不同,其中DTT的电位值为-330 mV[20],远低于GSH (-240 mV) 和Cys (-241 mV)[21],因此,DTT在打断QSOX催化活性位点二硫键上具有更强的还原能力,从而更易引发QSOX的巯基氧化活性。
一直以来,QSOX在催化机制、生理功能和晶体结构等方面的研究较多[22-23],但其酶学性质很少被研究,为了便于QSOX的工业应用,本研究探究了wQSOX的酶学性质,发现酶的最适反应温度为50 ℃,80 ℃孵育1 h仍保留40%以上最大酶活性,说明wQSOX属于中温酶,且具有较好的温度稳定性。研究报道,牛奶巴氏杀菌过程中加入巯基氧化酶有助于提高牛奶的保质期[24],因此,wQSOX具有提高牛奶品质的潜力。此外,酶的最适反应pH为10.0,在pH 9.0–11.0范围内孵育1 h后仍保留一半以上最大酶活性,说明wQSOX在碱性环境有利于其发生反应以及维持稳定,这与酶的催化活性位点半胱氨酸在碱性环境下性质更活跃有关[25]。目前,一些碱性蛋白酶、碱性脂肪酶等在洗涤工业中的应用前景相继被报道[26-28],可以推测wQSOX作为一种耐温耐碱的酶制剂在生物催化等工业领域具有广阔的应用前景。
目前,wQSOX在食品加工领域的应用尚未见报道,本研究证明了wQSOX改善面包加工品质能力,添加0.1%的wQSOX能够显著(P < 0.05) 提高26%面包比容,降低面包芯20%硬度和25%的咀嚼性,因此,wQSOX具有发展成为新型面粉改良酶制剂的潜力。Liu等[8]报道了巯基氧化酶wEro1具有改善面包品质能力,酶的作用可提高面包8.2%比容,降低16.2%面包芯硬度。相比于wEro1,wQSOX在改善面包加工品质性能方面更加优越,其主要原因应与wQSOX同时含有Trx结构域和FAD结合结构域有关,不需要通过中间蛋白就能够直接催化二硫键交联,这也是同等条件下wQSOX催化DTT酶活性(1.1 IU/mg) 高于wEro1 (0.25 IU/mg) 的原因。
wQSOX改善面包加工品质能力可能与其能够直接催化和/或通过巯基氧化反应副产物过氧化氢氧化面筋蛋白交联有关[29-30],促进了面筋网络的强化,从而提高面团的持气能力,最终帮助面包焙烤过程中能够充分膨胀,达到改善面包比容和面包芯质构的目的。有关wQSOX改善面筋强度的相关机理仍有待进一步探究。
参考文献
| [1] | Li Z, Dong Y, Xiao X, et al. Mechanism by which β-glucanase improves the quality of fermented barley flour-based food products. Food Chem, 2019, 311: 126026. |
| [2] | Li D, Zhao YK, Fei T, et al. Effects of Streptococcus thermophilus GtfB enzyme on dough rheology, bread quality and starch digestibility. Food Hydrocolloids, 2019, 96: 134-139. DOI:10.1016/j.foodhyd.2019.05.009 |
| [3] | 胡松青, 李旺, 陈煜, 等. 小麦内质网氧化还原酶在毕赤酵母中的表达. 华南理工大学学报(自然科学版), 2019, 47(8): 57-63. Hu SQ, Li W, Chen Y, et al. Expression of wheat endoplasmic reticulum oxidoreductin 1 in Pichia pastoris. J South China Univ Technol (Nat Sci Ed), 2019, 47(8): 57-63 (in Chinese). |
| [4] | Faccio G, Nivala O, Kruus K, et al. Sulfhydryl oxidases: sources, properties, production and applications. Appl Microbiol Biotechnol, 2011, 91(4): 957-966. DOI:10.1007/s00253-011-3440-y |
| [5] | Rudolf J, Pringle MA, Bulleid NJ. Proteolytic processing of QSOX1A ensures efficient secretion of a potent disulfide catalyst. Biochem J, 2013, 454(2): 181-190. DOI:10.1042/BJ20130360 |
| [6] | Nivala O, Mattinen ML, Faccio G, et al. Discovery of novel secreted fungal sulfhydryl oxidases with a plate test screen. Appl Microbiol Biotechnol, 2013, 97(21): 9429-9437. DOI:10.1007/s00253-013-4753-9 |
| [7] | 王建伟, 温成志, 刘全伟. 巯基氧化酶在国产面包粉中应用的初探. 粮食加工, 2010, 35(3): 30-32. Wang JW, Wen CZ, Liu QW. Sulfhydryl oxidase in the application of domestic bread flour. Grain Process, 2010, 35(3): 30-32 (in Chinese). |
| [8] | Liu G, Wang JJ, Hou Y, et al. Improvements of modified wheat protein disulfide isomerases with chaperone activity only on the processing quality of flour. Food Biopro Technol, 2017, 10(3): 568-581. DOI:10.1007/s11947-016-1840-9 |
| [9] | Zheng WY, Chu YY, Yin Q, et al. Crucial effect of the first CXXC motif of human QSOX 1b on the activity to different substrates. J Biochem, 2011, 149(3): 293-300. DOI:10.1093/jb/mvq143 |
| [10] | 胡薇. 巯基氧化酶及其相关探针研究[D]. 上海: 华东理工大学, 2011. Hu W. Investigation of sulfhydryl oxidase and their probes[D]. Shanghai: East China University of Science and Technology, 2011 (in Chinese). |
| [11] | Gross E, Kastner DB, Kaiser CA, et al. Structure of ero1p, source of disulfide bonds for oxidative protein folding in the cell. Cell, 2004, 117(5): 601-610. DOI:10.1016/S0092-8674(04)00418-0 |
| [12] | Kim JH, Maeda T, Morita N. Effect of fungal α-amylase on the dough properties and bread quality of wheat flour substituted with polished flours. Food Res Int, 2006, 39(1): 117-126. DOI:10.1016/j.foodres.2005.06.008 |
| [13] | 武建锋, 吴瑞阁, 刘洋, 等. 馒头和面包的比容测定方法探讨. 粮食科技与经济, 2019, 44(02): 46-48. Wu JF, Wu RG, Liu Y, et al. Discussion on the Method of Measuring the Specific Volume of Steamed Bread and Bread. Food Tech Economy, 2019, 44(02): 46-48 (in Chinese). |
| [14] | 王彦婷, 黄智刚, 郭西英, 等. 多二硫键蛋白在大肠杆菌中的表达研究. 生命科学研究, 2015, 19(3): 258-264. Wang YT, Huang ZG, Guo XY, et al. Research on the expression of proteins with multiple disulfide bonds in E. coli. Life Sci Res, 2015, 19(3): 258-264 (in Chinese). |
| [15] | 张真, 汪燕, 马振刚. 提高大肠杆菌重组蛋白可溶性表达方法研究进展. 广东蚕业, 2019, 53(7): 37-40. Zhang Z, Wang Y, Ma ZG. Advances in improving the soluble expression of Escherichia Coli recombinant protein. Guangdong Seric, 2019, 53(7): 37-40 (in Chinese). |
| [16] | 张丹萍. 大肠杆菌和无细胞蛋白合成系统中的可溶性表达策略[D]. 杭州: 浙江大学, 2011. Zhang DP. The soluble expression strategy in E. coli and cell-free protein biosynthesis system[D]. Hangzhou: Zhejiang University, 2011 (in Chinese). |
| [17] | Kodali VK, Thorpe C. Oxidative protein folding and the quiescin-sulfhydryl oxidase family of flavoproteins. Antioxid Redox Signal, 2010, 13(8): 1217-1230. DOI:10.1089/ars.2010.3098 |
| [18] | Heckler EJ, Rancy PC, Kodali VK, et al. Generating disulfides with the quiescin-sulfhydryl oxidases. Biochim Biophys Acta Mol Cell Res, 2008, 1783(4): 567-577. DOI:10.1016/j.bbamcr.2007.10.002 |
| [19] | Okuda A, Matsusaki M, Higashino Y, et al. Disulfide bond formation activity of soybean quiescin sulfhydryl oxidase. FEBS J, 2014, 281(23): 5341-5355. DOI:10.1111/febs.13079 |
| [20] | Liu G, Wang JJ, Hou Y, et al. Characterization of wheat endoplasmic reticulum oxidoreductin 1 and its application in Chinese steamed bread. Food Chem, 2018, 256: 31-39. DOI:10.1016/j.foodchem.2018.02.080 |
| [21] | K?nig J, Baier M, Horling F, et al. The plant-specific function of 2-Cys peroxiredoxin- mediated detoxification of peroxides in the redox-hierarchy of photosynthetic electron flux. Proc Natl Acad Sci USA, 2002, 99(8): 5738-5743. DOI:10.1073/pnas.072644999 |
| [22] | Alon A, Grossman I, Gat Y, et al. The dynamic disulphide relay of quiescin sulfhydryl oxidase. Nature, 2012, 488(7411): 414-418. DOI:10.1038/nature11267 |
| [23] | Hanavan PD, Borges CR, Katchman BA, et al. Ebselen inhibits QSOX1 enzymatic activity and suppresses invasion of pancreatic and renal cancer cell lines. Oncotarget, 2015, 6(21): 18418-18428. DOI:10.18632/oncotarget.4099 |
| [24] | Swaisgood HE, Janolino VG, Skudder PJ. Continuous treatment of ultrahigh-temperature sterilized milk using immobilized sulfhydryl oxidase. Methods Enzymol, 1987, 136: 423-431. |
| [25] | Faccio G, Kruus K, Buchert J, et al. Production and characterisation of AoSOX2 from Aspergillus oryzae, a novel flavin-dependent sulfhydryl oxidase with good pH and temperature stability. Appl Microbiol Biotechnol, 2011, 90(3): 941-949. DOI:10.1007/s00253-011-3129-2 |
| [26] | 李林. 用碱性蛋白酶和脂肪酶优化洗衣粉配方的研究. 日用化学品科学, 2015, 38(8): 45-48, 56. Li L. Optimization of the detergent formulation by using alkaline protease and lipase. Daily Chem Sci, 2015, 38(8): 45-48, 56 (in Chinese). |
| [27] | 郑毅, 施巧琴, 吴松刚. 碱性脂肪酶与表面活性剂相互作用的研究. 工业微生物, 2000, 30(2): 4-7. Zheng Y, Shi QQ, Wu SG. Effects of surfactants on alkaline lipase. Ind Microbiol, 2000, 30(2): 4-7 (in Chinese). |
| [28] | Amid M, Manap MYABD, Zohdi NK. Purification and characterization of alkaline-thermostable protease enzyme from Pitaya (Hylocereus polyrhizus) waste: a potential low cost of the enzyme. Biomed Res Int, 2014, 2014: 259238. |
| [29] | Steffolani ME, Ribotta PD, Pérez GT, et al. Effect of glucose oxidase, transglutaminase, and pentosanase on wheat proteins: Relationship with dough properties and bread-making quality. J Cereal Sci, 2010, 51(3): 366-373. |
| [30] | Bonet A, Rosell CM, Caballero PA, et al. Glucose oxidase effect on dough rheology and bread quality: A study from macroscopic to molecular level. Food Chem, 2006, 99(2): 408-415. |
