
 , 郑展望1,3
, 郑展望1,3

1. 浙江农林大学 环境与资源学院,浙江 杭州 310000;
2. 浙江农林大学 农业与食品科学学院,浙江 杭州 310000;
3. 浙江双良商达环保有限公司,浙江 杭州 310000
收稿日期:2020-06-01;接收日期:2020-08-28;网络出版时间:2020-09-15
基金项目:浙江省科技计划(No. 2020C2009) 资助
摘要:为有效解决餐厨废水中的高油脂对下游处理工艺的严重影响,本研究以筛选获得的一株高效的油脂降解菌株嗜糖气单胞菌Aeromonas allosaccarophila CY-01为研究对象,以壳聚糖为载体材料,对其进行固定化包埋制备壳聚糖-气单胞菌小球(CH-CY01);探究CH-CY01小球的油脂降解效率以及性能影响评估。研究结果表明,经壳聚糖固定后的菌株CY-01其细胞的生长活性几乎不受影响,对大豆油脂的最大降解率为89.7%;相比于未固定的细胞,CH-CY01在0.5% NaCl的盐度条件下对油脂的降解效率显著提高了20%;在浓度为1 mg/L的表面活性剂(十二烷基苯磺酸钠) 存在条件下,CH-CY01对油脂的降解效率显著提高了40%。以餐饮高油脂污水为处理对象,结果显示经添加1% (V/V) 的CH-CY01小球处理7 d后,超过80%以上的固态油脂被降解,明显高于未固定的CY-01。综上所述,经壳聚糖固定包埋的CH-CY01小球显著提高了菌株的生存能力和油脂降解效率,对于高油脂餐饮污水的高效处理具有较大的应用潜力。
关键词:壳聚糖气单胞菌固定化油脂污水污水处理
Aeromonas immobilized on chitosan for treating high-oil wastewater from kitchens
Jin Qu1, Yinyan Chen3, Ruojin Zhao1, Yiyi Li3, Peng Jin2

 , Zhanwang Zheng1,3
, Zhanwang Zheng1,3

1. School of Environmental and Resource, Zhejiang A & F University, Hangzhou 310000, Zhejiang, China;
2. College of Agricultural and Food Sciences, Zhejiang A & F University, Hangzhou 310000, Zhejiang, China;
3. Zhejiang Shuangliang Sunda Environment Co., Ltd, Hangzhou 310000, Zhejiang, China
Received: June 1, 2020; Accepted: August 28, 2020; Published: September 15, 2020
Supported by: Key Research and Development Program Project of Zhejiang Province, China (No. 2020C02009)
Corresponding author: Peng Jin. Tel/Fax: +86-571-88218710; E-mail: jinpeng@zafu.edu.cn;
Zhanwang Zheng. Tel/Fax: +86-571-88218710; E-mail: zhengzw@zafu.edu.cn.
Abstract: To effectively solve the serious impact of high oil in the kitchen wastewater on the downstream treatment process, an excellent oil-degrading strain Aeromonas allosaccarophila CY-01 was immobilized to prepare Chitosan-Aeromonas pellets (CH-CY01) by using chitosan as a carrier. Oil degradation condition and efficiency of CH-CY01 pellets were assessed. The growth of immobilized CH-CY01 was almost unaffected, and the maximum degradation rate of soybean oil was 89.7%. Especially at 0.5% NaCl concentration, oil degradation efficiency of CH-CY01 was increased by 20% compared with free cells. In the presence of a surfactant (sodium dodecylbenzene sulfonate) at 1 mg/L, the degradation efficiency of oil by CH-CY01 was increased by 40%. Moreover, using the high-oil catering wastewater as the substrate, more than 80% of the solid oil was degraded with 1% (V/V) CH-CY01 pellets treatment for 7 days, significantly higher than that of free cells. In summary, immobilized CH-CY01 significantly improved the efficiency of oil degradation.
Keywords: chitosanAeromonasimmobilizationoil sewagesewage treatment
餐厨废水中污染物种类繁杂,且大多处于胶体物质形式,较小部分悬浮在废水中,其中包含多种多样的动植物油,浊度大、盐分高、COD和BOD5浓度大,属于高浓度有机废水[1],致使其中富余的油脂不易被降解。国内外对于处理厨余垃圾的研究主要围绕固液分离处理处置技术与资源化利用等方面展开,然而有关餐饮及生活污水中高油脂深化处理鲜有报道。国内对餐饮生活污水的处理大多数采取分散式就地处理及集中纳管收集处理,而其中含有的高油脂污染物一直以来都是生活污水处理的难点问题:例如油脂易结块导致管道淤塞和生化池的堵塞;油脂易氧化产生臭味等。因此当前餐厨废水中油脂的处理方法主要以物理和化学方法为主,其中物理分离包括重力分离技术、粗粒化分离技术、膜分离技术等,化学分离包括絮凝沉淀分离技术、电解分离技术、酸化分离技术等[2]。然而这些方式油脂的去除虽较明显,但对于运维管理成本太高,难以满足当前的环境治理需求。因此近年来微生物降解处理技术[3]在污水处理中占据越来越重要的作用和显现无可比拟的优势,例如,操作简单、处理效率高以及绿色环保等。
近年来,针对生活污水中的油脂微生物降解报道了大量研究,主要是聚焦在从环境中筛选分离对油脂有较高降解效率的微生物菌株和脂肪酶。例如,张忠祥[4]筛选了一株高效石油降解菌株B11,该菌株的7 d油脂降解率可达53.6%,并研究了磁场强度对B11的油脂降解效率的影响,结果表明,当外加磁场为0.025 T时,达到最大油脂去除率约为66.1%。卢永昌等[5]通过富集培养从下水道污泥中分离出一株高效油脂降解菌LYC46-2,分析该菌的油脂降解性能和影响因素, 结果表明:在pH为7.0–10.0、温度为30–35 ℃、200 r/min条件下培养3 d,对体积分数为6%的花生调和油的降解率达59.7%。尽管这些分离鉴定的油脂高效降解微生物已报道了很多,但大多数是在实验室条件下对菌株的性能进行表征[6-7]。而在实际含油脂污水的处理过程中效果通常只能持续很短的时间,主要是由于连续污水处理系统中的不断进水和冲刷,营养物质的缺失,有毒的污染物,和其他微生物物种间的竞争环境[8],导致这些高活性的油脂降解菌群的定殖培养难以长效维持。因此,尽管已经筛选出许多在废水处理中具有潜在应用前景的优秀菌株,但如何在开放和无人值守的生化系统中提高菌株的高效定殖和长期稳定高效的应用研究较少。
细胞固定化[9]是指将微生物细胞固定在一定区域内或者载体表面,从而截留住微生物,同时载体可以允许其底物和产物自由进出,目前已广泛应用于工业微生物发酵和生物催化过程生产中,效果显著[10]。固定化可以重复利用微生物细胞并作为细胞种子存储库,维持其在环境中长效稳定作用,有利于在生物过程[11]中保持细胞高密度和活性低损耗;特别是包埋固定化载体材料为细胞在恶劣环境(如高盐度、pH、有机溶剂等)下的生存能力和稳定性提供了一定的保护屏障,能够显著提高细胞在有害环境中的生产活力和作用效率。目前在污水处理上已有报道将亲水性合成聚合物(如聚丙烯酸酯、丙烯酰胺、聚氨酯、聚乙烯醇和树脂) 和天然聚合物(如藻酸盐、卡拉胶和琼脂) 用于微藻和活性污泥的固定化[12],它们表现出良好的生物相容性和物理性能。例如固定化烃类降解菌和产氢菌在原油污染海水处理和废水发酵方面表现出优异的性能[13-14]。马茜岚等[15]采用硫酸纤维素钠/聚二甲基二烯丙基氯化铵微胶囊体系固定混合产氢菌群,有效增强了菌群对温度的适应,氢气产量比游离细胞增长30%以上,菌体浓度提高2倍达到3.2 g/L。连续15批培养,氢气产量较游离细胞增长30%以上,氢气产率保持在1.73–1.81 mol H2/mol葡萄糖,平均产氢速率提高了198.6%。然而,在高油脂的餐饮废水处理上,现有的生物处理技术通常是直接投加菌液,时效性难以保证。因此,为了更稳定高效地处理餐饮污水中的油脂,实现油脂降解菌种的固定化包埋技术,是一项非常重要及迫切的技术需求。
壳聚糖[16]因具有固定操作简单、生物相容性好、多孔结构好、亲水性强、机械力学性能好等优点,可作为细胞包埋固定的基质并维持稳定的活性,促进细胞粘附与增殖,被广泛应用于工业微生物的固定基质。本研究采用壳聚糖作为载体材料对油脂降解菌株嗜糖气单胞菌Aeromonas allosaccarophila CY-01进行包埋固定化,对壳聚糖包埋固定菌株CY-01的CH-CY01小球的稳定性和生化性能进行了评估,包括包埋体系对细胞生长和油脂降解能力的影响分析,以及一些有害因子对CY-01菌株的活性效率影响。在此基础上将CH-CY01小球应用于餐饮污水处理的实际效果评估。本研究工作旨在为生活污水特别是餐饮污水中高油脂的绿色治理提供新的思路和方式,具有一定的理论意义和应用潜力。
1 材料与方法1.1 材料1.1.1 样品来源由浙江农林大学食堂污水井含油活性污泥中筛选出的异常嗜糖气单胞菌Aeromonas allosaccarophila CY-01,目前保藏于中国典型培养物保藏中心,保藏编号为CCTCCM2017543。
1.1.2 培养基LB液体培养基(g/L):蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g,pH 7.2–7.4,琼脂糖15.0 g (固体)。
发酵培养基(g/L):(NH4)2SO4 0.5 g,K2PO4 0.3 g,NaCl 0.5 g,MgSO4·7H2O 0.2 g,酵母粉0.5 g,大豆油2.0 g,pH 7.2,121 ℃湿热灭菌20 min。
1.1.3 主要试剂及仪器四氯化碳(优级纯),正己烷(优级纯),红外分光测油仪,紫外可见分光光度计,扫描电镜。
1.2 方法1.2.1 油脂含量和细胞生长量的测定方法油脂含量的测定方法:向50 mL容量瓶中移入大豆油溶液标样(0.1 g/L) 25 mL,用正己烷稀释至标线,在波长190–600 nm之间,用1 cm石英比色皿测得吸收光谱图得到最大吸收峰值。向8个50 mL容量瓶中,分别加入2、3、4、5、6、7、8、10 mL标准油使用溶液,用正己烷稀释至标线,采用紫外分光光度法于最大波长处测定其吸光度,并绘制标准曲线,计算出线性方程和相关系数。从待测水样中萃取油品,经无水硫酸钠脱水后过滤,在最大吸收波长处,用1 cm石英比色皿,以正己烷为参比测定其吸光度,根据线性方程计算出水样的油含量。
细胞生长量(OD600)的具体测定方法为:使用紫外分光光度计,在波长600 nm处用1 cm的石英比色皿定时测定培养液或餐厨废水中的吸光度值。
1.2.2 壳聚糖-气单胞菌小球(CH-CY01)的制备取-80 ℃冷藏保存的CY-01菌种放在无菌操作台中于室温下解冻,将解冻后的菌种用划线法接种于固体种子培养基上,在30 ℃条件下于生化培养箱中培养24 h。配置种子培养液置于115 ℃灭菌30 min,灭菌完成后冷却备用。挑取固体培养基上培养好的除油菌CY-01落接种于种子培养液中,30 ℃、200 r/min振荡培养24 h。取培养好的500 mL菌液放入离心管中,3 500 r/min离心5 min,用无菌水清洗离心后收获的菌体,并将菌体用生理盐水制备成40 mL菌悬液。将4%的壳聚糖溶解于100 mL 1% (V/V) 的乙酸溶液中,取20 mL混合溶液与10 mL悬浮菌液充分混匀,用10 mL针头将混合液逐滴加入到0.25 mol/L的NaOH溶液中,交联4 h得到固定化壳聚糖气单胞菌小球。收集新制备的小球,用无菌水清洗2遍后置于新鲜培养基中备用。
1.2.3 CH-CY01小球的电镜分析对固定化CH-CY01小球和壳聚糖小球(未包埋菌体) 进行扫描电镜分析[17]。具体方法如下:用生理盐水清洗固定化CH-CY01小球与壳聚糖小球2–3次,每次清洗时间15 min,加入pH 6.8、浓度为2.5%的戊二醛溶液,4 ℃条件下将其固定2–4 h。使用磷酸缓冲液对两种固定化小球进行多次冲洗,加入1%的锇酸,充分摇匀后固定4–6 h。再用磷酸缓冲溶液对上述固定化小球进行3次冲洗,用5种梯度浓度(30%、50%、70%、85%、95%) 的乙醇溶液脱水处理一次,用100%的乙醇脱水处理两次,每次脱水处理时间为15–20 min。用乙酸异戊酯置换100%的乙醇2–3次,每次20 min。将处理后的固定化CH-CY01小球与壳聚糖小球放入临界点干燥样品室,进行二氧化碳临界点干燥。使用离子溅射仪喷金镀膜后在3.0 kV下进行扫描电镜(Scanning electronic microscopy,SEM) 观察。
1.2.4 不同因子对降解效率影响本次实验以大豆油脂作为菌株CY-01的唯一碳源,为菌体的生长提供物质基础。针对农村生活污水的特性,选取温度、初始pH值、盐度、底物浓度、表面活性剂5个因子进行性能表征实验。温度设置为16 ℃、20 ℃、25 ℃、30 ℃和37 ℃;初始pH值为5.0、6.0、7.0、8.0、9.0;通过改变NaCl的投加量来控制盐度值,初始盐度百分比含量分别为:0.1%、0.5%、1%、2.5%和5%;油脂浓度(大豆油) 分别为:1、2、5、8、10 g/L;选用十二烷基苯磺酸钠作为表面活性剂,初始浓度值分别为:1、2、5、8、10 mg/L。以发酵培养基为基础设计单因素对照实验,未包埋的菌株作为对照,转速为200 r/min培养120 h,并在固定的时间点取样分别测定细胞生长量OD600值和油脂残余含量。
1.3 餐饮污水固化油脂的应用处理以农家乐含有固态油脂的污水为处理对象,固化油脂含量约20%。向开放式反应器中通入含油脂的污水,按1%的接种量接入油脂降解菌培养液(CH-CY01含等量的菌体) 接入反应器中进行试验,水力停留时间设置为24 h,采用OIL-460型红外分光测油仪进行油脂定量分析试验,定时检测油脂的残余量。
2 结果与分析2.1 大豆油标准曲线根据朗伯-比尔吸收定律可知,大豆油的吸光度与其浓度成正比。通过测定已知浓度的样品吸光度值(OD246) 所得标准曲线如图 1所示,其线性回归方程为:y=1.840 9x+0.01,相关系数R2为:0.990 1。
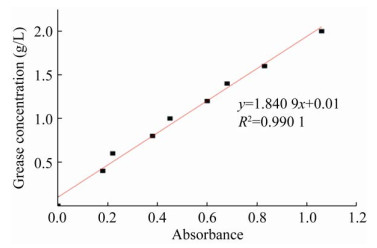 |
| 图 1 大豆油的标准曲线 Fig. 1 The curve of concentration for standard sample soybean oil. |
| 图选项 |
2.2 CH-CY01小球表征2.2.1 CH-CY01小球电镜表征通过壳聚糖固定包埋制备的小球如图 2 所示:小球呈球形,大小比较均一,直径约为7–10 mm大小,小球机械韧度较好,具有一定的弹性。进一步通过扫描电镜分析壳聚糖小球的表面结构,以及菌株CY-01在其表体的生长情况。结果如图 2A所示,观察发现对照组壳聚糖小球呈现多孔微结构状态,具有密切的互连性。相反,CH-CY01小球(图 2B) 表面结构显示簇生较为致密的菌体细胞,且大量细胞往外扩增生长的趋势,主要原因是包埋于壳聚糖小球内部的CY-01菌体实现了繁殖复苏,并且生长于小球外表面,形成了很好的定殖效果。以上电镜结果表明,CY-01菌株被壳聚糖包埋固定于在小球中,且能进行繁殖与定殖,证明了壳聚糖适合于CY-01菌株的固定化包埋及生长繁殖。
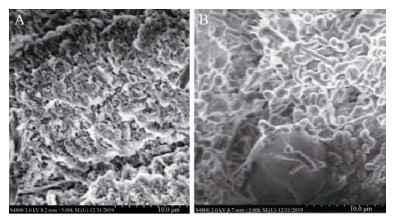 |
| 图 2 壳聚糖固定化小球电镜扫描图像 Fig. 2 SEM images of the chitosan immobilized cell beads. (A) The surface of chitosan beads without strain. (B) The surface of chitosan-embedded strain beads. |
| 图选项 |
2.2.2 壳聚糖固定化包埋对细胞活性的影响为了进一步考察CH-CY01壳聚糖小球对菌株的细胞生长及油脂降解效率的影响,在30 ℃条件下对CY-01的游离态菌株和固定化小球在模拟餐厨油污水中的生长代谢进行分析。结果如图 3A所示,在起始24 h游离态菌株的生长速率明显高于固定化小球菌体浓度,游离态菌株呈指数增长趋势,36 h时的最大OD600值为1.91。而固定化除油小球的生长趋势较慢,在6–36 h为适应期,36–48 h呈指数增长趋势,在48 h达到最大菌体浓度值约为2.13,生长速率稍低于游离态菌株。分析原因可能有两个方面,首先,与游离态菌株相比,固定化小球嵌入的菌体获得营养物质的机会较少,导致其生长受到一定的限制,并且由于营养物质消耗较慢而具有较长的对数期[18],这也有助于节省用于微生物代谢的碳源;第二,可能更多的菌株在壳聚糖载体表面富集生长,而这更有利于处在开放体系中的微生物富集与定殖[19],显著提高对油脂的降解。以油脂降解率和化学需氧量(COD) 为指标考察CY-01的降解性能(图 3B),游离态菌株在12 h后COD浓度出现明显变化,总的COD去除率为69.2%,最大油脂降解率为70.3%。而固定化除油小球在36 h以后的降解速率骤增,COD去除率为87.5%,总的油脂去除率为89.1%。这些结果表明,虽然固定后的菌体生长速率比游离态菌株慢,但固定后的菌株代谢活性更高,除油效率也更高。除了在材料表面有大量的菌株附着生长外,包埋材料对营养物质的吸附和富集作用也可能是有效去除油脂的主要机理[20]。
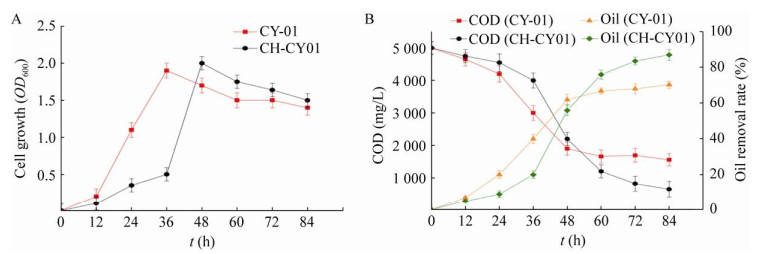 |
| 图 3 细胞生长和降解性能评价 Fig. 3 Evaluation of cell growth and degradation performance. (A) The cell growth of suspended free cell strain and chitosan-immobilized strain. (B) The COD degradation of suspended free cell strain and immobilized strain. |
| 图选项 |
2.3 影响因子对CH-CY01小球活性的影响评估2.3.1 pH图 4为CY-01游离态菌株和固定化除油小球在不同pH条件下的进行除油实验。实验数据显示,当pH为5.0、6.0、7.0、8.0和9.0时,游离态菌株油脂去除率分别为67.1%、71.8%、72.5%、63.3%和51.4%;固定化除油小球的油脂去除率分别为87.5%、88.1%、89.4%、84.0%和83.3%。结果表明,在不同酸碱环境下,二者菌体的生长及油脂降解趋势基本保持一致,但固定化除油小球的菌体浓度及油脂降解效率明显高于游离态菌株。酸性条件下两者的除油效率更高,当pH为7.0时,达到油脂降解率峰值,但碱性条件下,菌体的生长及油脂降解效率总体呈现下降趋势,表明菌株CY-01具有良好的耐酸性,对碱性条件的耐受性较差。这表示壳聚糖载体不仅可以保护CY-01菌体免受外界酸碱性的影响,也能在适宜条件下提高菌体的降解油脂效率。
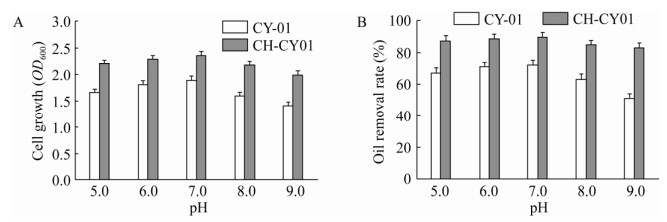 |
| 图 4 不同pH条件下的菌体浓度及除油率 Fig. 4 Analysis of cell growth and oil removal rate under different pH conditions. (A) The effect of pH on cell growth. (B) The effect of pH on oil degreasing efficiency. |
| 图选项 |
2.3.2 温度温度对微生物的影响主要表现在对酶促反应速率、细胞膜的流动性和物质溶解度的影响,从而抑制微生物的生长代谢和除油性能。如图 5所示,菌株CY-01在温度16–37 ℃都有不同水平的生长,而且对油脂也有一定的降解效果。菌体生长量随着温度升高而增加,当温度为16 ℃、20 ℃、25 ℃、30 ℃和37 ℃时,游离态菌株的油脂去除率分别为61.3%、64.7%、67.2%、70.1%和72.8%,CH-CY01小球的除油率分别为76.4%、80.1%、82.9%、86.3%和89.7%,当温度为37 ℃时,菌体OD600均达到最大值,其油脂降解率也达到最高,而CH-CY01小球的油脂降解效率和OD600总体明显高于游离态菌株。结果表明,微生物正常生长离不开适宜的温度,温度较低会抑制菌体内活性,导致其除油能力下降;反之,温度过高会导致菌体内的蛋白质变性失活。由于壳聚糖本身是一种多孔网状天然高分子粉粒材料,耐热性好,其分子的羟基和氨基可形成活泼界面,对蛋白质有显著亲合力[21],使微生物间的结合强度高,热稳定性好,使得CH-CY01小球降解性能显著提升。
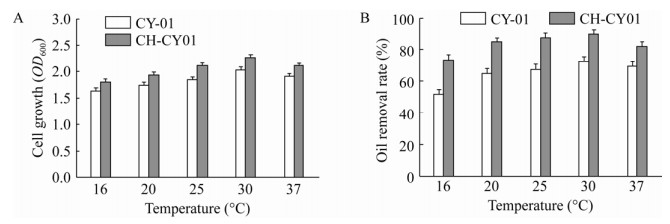 |
| 图 5 不同温度条件下的菌体浓度及除油率 Fig. 5 Analysis of cell growth and oil removal rate under different temperature conditions. (A) The effect of temperature on cell growth. (B) The effect of temperature on degreasing efficiency. |
| 图选项 |
2.3.3 盐度传统生物法处理餐厨废水往往易遭受餐饮污水中高盐的抑制影响,导致微生物代谢活性及降解效率显著降低,甚至微生物的死亡及流失。本次试验针对在治理餐厨污水过程中盐度对微生物的影响设计实验,分别考察了在不同盐度条件下,游离态菌株和CH-CY01小球的细胞生长及降解效率。结果如图 6所示,所有接种物保持相同的初始油脂浓度,经过72 h的摇床培养后,数据显示,盐度低于1%时,CY-01受盐度影响较小,CH-CY01小球菌体密度略高于游离态菌株,但其油脂降解效率明显高于游离态菌株,分析原因可能是包埋材料壳聚糖为CY-01提供较为稳定的环境,能够长效维持细胞活性;当盐度达到1%后,两者菌体密度及降解率均呈现下降趋势,但总体上,CH-CY01小球的效果仍优于游离态菌株,可能由于在高盐度环境下,引发渗透效应,导致细胞失水而失活,而经固定化的菌株CY-01在壳聚糖的缓冲作用下,在一定程度上减缓了细胞受高盐度的影响。
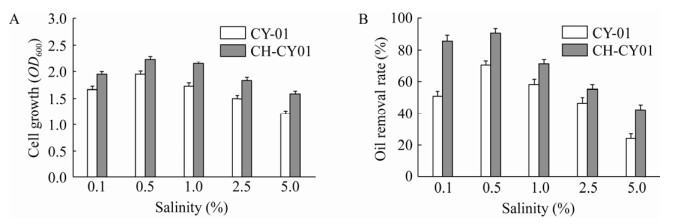 |
| 图 6 不同盐度条件下的菌体浓度及除油率 Fig. 6 Analysis of cell concentration and oil removal rate under different salinity conditions. (A) The effect of salinity on cell growth. (B) The effect of salinity on degreasing efficiency. |
| 图选项 |
2.3.4 油脂浓度对于不同浓度的油脂,不同种类的菌株耐受能力相差甚大。如图 7所示,CH-CY01小球和游离态菌株均以油脂浓度5 g/L为临界点,当油脂浓度小于5 g/L时,菌体密度及油脂降解率随着底物浓度的增大而攀升,在油脂浓度为5 g/L时到达峰值,之后随着油脂浓度的增大,降解率持续走低。分析原因可能是当油脂浓度较小时,菌体由于碳源供给不足,生长发育受到抑制,从而导致油脂降解率较低;但当碳源含量远高于菌体需求时,菌体的生长和代谢趋于稳定,碳源已经不是限定因素,反之过高的碳源会阻碍菌体生长,又因为油脂密度小,不溶于水,降低了水体中溶解氧含量,故底物浓度为8 g/L后,降解率呈下降趋势。实验结果显示,在高浓度的油脂存在条件下,CH-CY01小球的降解效率及菌体密度显著高于游离态菌株,主要是经壳聚糖包埋固定后的除油菌CY-01更能维持细胞的代谢活性,削弱高浓度油脂对菌体生长的抑制。
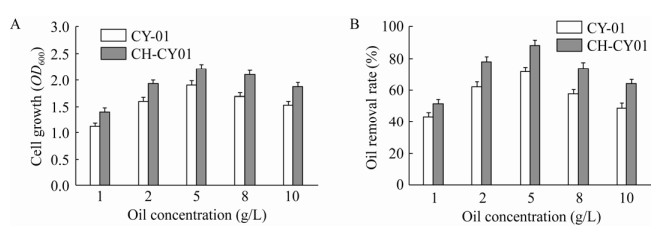 |
| 图 7 不同油脂浓度条件下的菌体浓度及除油率 Fig. 7 Analysis of cell concentration and oil removal rate under different oil concentration conditions. (A) The effect of oil concentration on cell growth. (B) The effect of oil concentration on degreasing efficiency. |
| 图选项 |
2.3.5 表面活性剂表面活性剂是一类加入很少量就能使表面张力降低的有机化合物,具有分散、润湿、渗透、增溶、乳化、起泡、润滑、杀菌等诸多性能,被广泛应用到各个领域[22]。而在餐饮污水中常含有大量的洗涤剂等,这对于微生物有较大的毒害作用。因此,为了进一步考察废水中表面活性剂对CH-CY01小球及其菌体活性的影响,采用不同浓度的表面活性剂进行评估。结果如图 8所示,浓度为1、2、5、8、10 mg/L时,游离态菌株的菌体OD600分别为1.103、1.001、0.574、0.402和0.095,对应的油脂降解率值分别为20.5%、16.2%、7.1%、3.0%和1.2%;而CH-CY01小球的菌体生长OD600则达到1.308、1.251、1.114、0.901和0.605,其对应的除油率分别为65.3%、56.5%、51.2%、43.4%和34.6%。这一结果表明经过固定化包埋的菌株在表面活性剂存在的情况下能显著提高细胞的生存活力和油脂降解效率。高浓度的表面活性剂会对菌株的细胞膜有毒害作用[23],抑制其正常生长甚至导致细胞大量死亡,导致其油脂降解能力显著下降,原因可能是:(1) 通过与细胞膜中液态成分的相互作用迫使细胞膜溶解;(2) 过高的表面活性剂分子会导致细胞内功能蛋白变性易失活[24]。而壳聚糖作为固定化载体材料,可以更有效地对细胞进行保护,同时能作为种子库持续提供新的细胞进行繁殖和维持降解活性,为微生物提供较为稳定的生长环境。
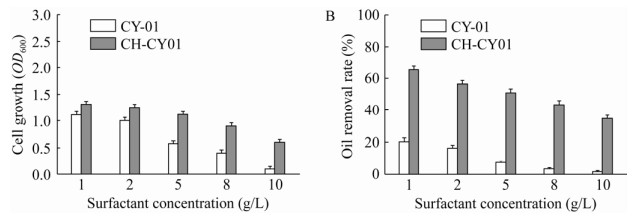 |
| 图 8 不同表面活性剂条件下的菌体浓度及除油率 Fig. 8 Analysis of cell concentration and oil removal rate under different surfactant conditions. (A) The effect of surfactant concentration on cell growth. (B) The effect of surfactant concentration on degreasing effect. |
| 图选项 |
2.4 餐饮固化油脂污水应用处理污水处理中生态系统的建立主要依赖于附着在包埋表面的微生物进入生物膜,这与废水处理的有效性密切相关。同时,水体的连续冲击和环境因素的剧烈波动往往会对系统中的微生物造成严重的危害。因此,为了考察CH-CY01小球直接应用于餐饮难降解的固化高油脂污水的处理效果,选取浙江省德清县武康镇城山村鸡山坞未经处理的含固块油脂的农家乐废水进行对照实验,分别向未经处理的含固块油脂废水的开放式生物反应器内(图 9A) 投加游离态CY-01和CH-CY01进行处理。数据显示,接种CY-01游离态菌株的开放式生物反应器中,其最大油脂降解率约为38.3%,细胞丰度约为4.47×103 CFU/mL (图 9B);而接种CH-CY01小球的开放式生物反应器在试验后期的油脂降解率能够稳定维持在80%以上,细胞丰度为7.30×103 CFU/mL (图 9C)。这一发现表明CH-CY01小球在开放生物反应器系统中能够维持较高的菌群,这对固块油脂的去除非常有利。CH-CY01小球细胞丰度的增加可能是由于以下原因:(1) 固定化材料的亲水表面为微生物定殖提供了牢固的附着;(2) 嵌入壳聚糖的菌株是CY-01菌群的种子存储库能持续提供微生物。以上结果表明,壳聚糖是一种优良的固定化材料,可作为微生物高效的嵌入介质和粘附基质,为含油污水处理提供了一种低成本且高效的生化处理选择。
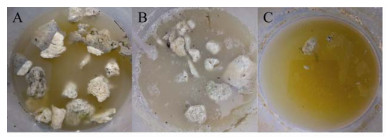 |
| 图 9 开放式生物反应器内油脂降解前后对比图 Fig. 9 Determination of the oil degradation performance of CH-CY01 pelletsin an open bioreactor. (A) Untreated oily wastewater. (B) Treated with suspended free cell strain. (C) Treated with chitosan immobilized strain. |
| 图选项 |
3 结论本研究基于实验室筛选出的一株高效降解油脂菌株嗜糖气单胞菌Aeromonas allosaccarophila CY-01,采用生物兼容性好的壳聚糖材料对其进行包埋固定化。结果表明,经壳聚糖包埋固定菌株CY-01对细胞活性和除油能力没有影响,CH-CY01小球在高盐度或表面活性剂的条件下比游离态菌株更有效。在开放式生物反应器中连续处理含固块油脂的污水7 d,CH-CY01小球能够持久且高效地降解油脂。综上所述,壳聚糖能为微生物提供较为稳定的生长环境,长效维持细胞活性,同时能作为种子库持续释放新的细胞进行繁殖和维持降解活性,有利于微生物在开放体系中的富集与定殖,显著提高对油脂的降解。以壳聚糖为载体材料固定菌株,可以为菌株提供生态位保护,进行更高效的污水处理,为餐厨废水中油脂去除提供了一种新的思路与方法。
参考文献
| [1] | 代晋国, 宋乾武, 王红雨, 等. 我国垃圾渗滤液处理存在问题及对策分析. 环境工程, 2011, 29(S1): 185-188. Dai JG, Song QW, Wang HY, et al. Problems in leachate treatment in China and countermeasures. Environ Eng, 2011, 29(S1): 185-188 (in Chinese). |
| [2] | 曹书翰, 陈立功, 刘先杰, 等. 餐厨垃圾油水分离技术与方法研究. 环境卫生工程, 2012, 20(2): 39-42. Cao SH, Chen LG, Liu XJ, et al. Oil-water separation technology and method of food waste. Environ Sanitat Eng, 2012, 20(2): 39-42 (in Chinese). DOI:10.3969/j.issn.1005-8206.2012.02.015 |
| [3] | Ashraf S, Naveed M, Afzal M, et al. Bioremediation of tannery effluent by Cr- and salt-tolerant bacterial strains. Environmental Monitoring and Assessment, 2018, 190(12): 716.1-716.11. |
| [4] | 张忠祥. 高效石油降解菌的筛选及其磁场强化除油效能的研究[D]. 哈尔滨: 哈尔滨工程大学, 2014. Zhang ZX. Studys on screening of high effective oil-degrading bacteria and enhancing its oil removal efficiency by meganetic field[D]. Harbin: Harbin Engineering University, 2014 (in Chinese). |
| [5] | 卢永昌, 张继龙, 张建栋, 等. 餐饮高浓度含油废水降解菌筛选及降解特性研究. 工业水处理, 2019, 39(12): 64-68, 100. Lu YC, Zhang JL, Zhang JD, et al. Bacterial screening for degradation of high concentration oily wastewater in catering industry and its degradation characteristics. Ind Water Treatm, 2019, 39(12): 64-68, 100 (in Chinese). |
| [6] | Chen YY, Jin P, Cui ZW, et al. Identification and characterization of Janthinobacterium svalbardensis F19, a novel low-C/N-tolerant denitrifying bacterium. Appl Sci, 2019, 9(9): 1937. DOI:10.3390/app9091937 |
| [7] | Yang L, Ren YX, Liang X, et al. Nitrogen removal characteristics of a heterotrophic nitrifier Acinetobacter junii YB and its potential application for the treatment of high-strength nitrogenous wastewater. Bioresour Technol, 2015, 193: 227-233. DOI:10.1016/j.biortech.2015.05.075 |
| [8] | Kim YC, Gao C, Zheng Y, et al. Arbuscular mycorrhizal fungal community response to warming and nitrogen addition in a semiarid steppe ecosystem. Mycorrhiza, 2015, 25(4): 267-276. DOI:10.1007/s00572-014-0608-1 |
| [9] | 张书祥, 房伟. 包埋法固定化真菌漆酶及其应用研究. 生物学杂志, 2005, 22(6): 44-45, 24. Zhang SX, Fang W. Immobilization of fungal laccase in alginate gel and its application. J Biol, 2005, 22(6): 44-45, 24 (in Chinese). DOI:10.3969/j.issn.2095-1736.2005.06.014 |
| [10] | Asgher M, Shahid M, Kamal S, et al. Recent trends and valorization of immobilization strategies and ligninolytic enzymes by industrial biotechnology. J Molecular Catalysis B: Enzymatic, 2014, 101: 56-66. DOI:10.1016/j.molcatb.2013.12.016 |
| [11] | E? I, Vieira JDG, Amaral AC. Principles, techniques, and applications of biocatalyst immobilization for industrial application. Appl Microbiol Biotechnol, 2015, 99(5): 2065-2082. DOI:10.1007/s00253-015-6390-y |
| [12] | Chang IS, Kim CI, Nam BU. The influence of poly-vinyl-alcohol (PVA) characteristics on the physical stability of encapsulated immobilization media for advanced wastewater treatment. Process Biochem, 2005, 40(9): 3050-2054. DOI:10.1016/j.procbio.2005.02.009 |
| [13] | Gentili AR, Cubitto MA, Ferrero M, et al. Bioremediation of crude oil polluted seawater by a hydrocarbon-degrading bacterial strain immobilized on chitin and chitosan flakes. Int Biodeterior Biodegrad, 2006, 57(4): 222-228. DOI:10.1016/j.ibiod.2006.02.009 |
| [14] | Singh L, Siddiqui MF, Ahmad A, et al. Application of polyethylene glycol immobilized Clostridium sp. LS2 for continuous hydrogen production from palm oil mill effluent in upflow anaerobic sludge blanket reactor. Biochem Eng J, 2013, 70: 158-165. DOI:10.1016/j.bej.2012.10.010 |
| [15] | 马茜岚, 林东强, 姚善泾. 微胶囊固定化混合菌群发酵产氢-构建一种虚拟"细胞工厂"的尝试. 生物工程学报, 2010, 26(10): 1444-1450. Ma QL, Lin DQ, Yao SJ. Immobilization of mixed bacteria by microcapsulation for hydrogen production-a trial of pseudo "Cell Factory". Chin J Biotech, 2010, 26(10): 1444-1450 (in Chinese). |
| [16] | Khondee N, Tathong S, Pinyakong O, et al. Airlift bioreactor containing chitosan-immobilized Sphingobium sp. P2 for treatment of lubricants in wastewater. Journal of Hazardous Materials, 2012, 213/214(30): 466-473. |
| [17] | Hu M, Kurisawa M, Deng R, et al. Cell immobilization in gelatin-hydroxyphenylpropionic acid hydrogel fibers. Biomaterials, 2009, 30(21): 3523-3531. DOI:10.1016/j.biomaterials.2009.03.004 |
| [18] | 简耀先, 何慧, 李娇. SBR工艺除总氮总结. 氮肥技术, 2019, 40(3): 46-48. Jian YX, He H, Li J. Summary of total nitrogen removal with SBR process. Nitrogen Fertilizer Technol, 2019, 40(3): 46-48 (in Chinese). |
| [19] | Fareed A, Zaffar H, Rashid A, et al. Biodegradation of N-methylated carbamates by free and immobilized cells of newly isolated strain Enterobacter cloacae strain TA7. Bioremediation J, 2017, 21(3/4): 119-127. |
| [20] | De-Bashan LE, Bashan Y. Immobilized microalgae for removing pollutants: review of practical aspects. Bioresour Technol, 2009, 101(6): 1611-1627. |
| [21] | 夏文水, 谭丽. 壳聚糖固定化酶研究进展. 食品与机械, 2007, 23(6): 7-10, 30. Xia WS, Tan L. Advances in immobilization of enzyme on chitosan and its deriritives. Food Mach, 2007, 23(6): 7-10, 30 (in Chinese). |
| [22] | 张学佳, 纪巍, 康志军, 等. 烷基苯磺酸钠在环境中自然降解的研究进展. 石化技术与应用, 2008, 26(5): 486-491. Zhang XJ, Ji W, Kang ZJ, et al. Research progress on natural degradation of linear alkyl benzene sulphonate in environment. Petrochem Technol Appl, 2008, 26(5): 486-491 (in Chinese). |
| [23] | 徐娜娜. 石油污染土壤中固定化微生物降解性能研究[D]. 青岛: 中国石油大学(华东), 2011. Xu NN. Study on the oil degradation ability of immobilized microorganisms in oil-contaminated soil[D]. Qingdao: China University of Petroleum (East China), 2011 (in Chinese). |
| [24] | 王宝辉, 张学佳, 纪巍, 等. 表面活性剂环境危害性分析. 化工进展, 2007, 26(9): 1263-1268. Wang BH, Zhang XJ, Ji W, et al. Hazard analysis of surfactants in ecosystem. Chem Ind Eng Progr, 2007, 26(9): 1263-1268 (in Chinese). |
