

华东理工大学 生物反应器工程国家重点实验室,上海 200237
收稿日期:2020-05-01;接收日期:2020-05-27;网络出版时间:2020-06-08
基金项目:国家自然科学基金(No. 21776083),国家重点研发计划(No. 2017YFB0309302),中央高校基本科研业务费项目(No. 22221818014),“111”计划(No. B18022)资助
摘要:聚羟基脂肪酸酯(Polyhydroxyalkanoates,PHAs)是一种具有优质生物相容性的可降解生物基材料,其理化性质优越,具备替代石油基塑料的潜力。P(3HB-co-LA)是PHAs的一种,融合了聚乳酸(Polylactic acid,PLA)和聚3-羟基丁酸(poly(3-hydroxybutyrate),P(3HB))共同的优点,具有更好的韧性和透明度。文中首先在大肠杆菌MG1655中通过质粒表达外源基因phaA、phaB、phaCm和pctth,发酵生产出乳酸含量为23.8 mol%的P(3HB-co-LA),在此基础上缺失dld基因得到菌株WXJ01-03,其合成的聚合物中乳酸组分含量提升至37.2 mol%。当硫酯酶基因ydiI和yciA基因继续被敲除后,生产的共聚物中乳酸组分进一步提升至42.3 mol%和41.1 mol%。最后将3个基因dld、yciA和ydiI同时缺失得到重组菌株WXJ03-03,并通过该重组菌株获得了乳酸组分含量为46.1 mol%的共聚物。通过比较不同碳源的发酵结果得知,木糖有利于提高共聚物中乳酸组分含量。上述实验结果表明,在木糖发酵中短链硫酯酶基因缺失阻碍了大肠杆菌胞内的LA-CoA被降解,可有效提高聚合物中乳酸组分的摩尔百分比。
关键词:聚羟基脂肪酸酯聚羟基丁酸乳酸酯大肠杆菌木糖发酵硫酯酶
Effect of short-chain thioesterase deficiency on P(3HB-co-LA) biosynthesis in Escherichia coli
Xiangju Wei, Ju Wu, Pengye Guo, Shengmin Zhou, Hui Wu


State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China
Received: May 1, 2020; Accepted: May 27, 2020; Published: June 8, 2020
Supported by: National Natural Science Foundation of China (No. 21776083), National Key Research and Development Program of China (No. 2017YFB0309302), the Fundamental Research Funds for the Central Universities (No. 22221818014), the 111 Project (No. B18022)
Corresponding author: Hui Wu. Tel: +86-21-64253701; Fax: +86-21-64252250; E-mail: hwu@ecust.edu.cn.
Abstract: Polyhydroxyalkanoates (PHAs) have obtained much attention in biomaterial fields due to their similar physicochemical properties to those of the petroleum-derived plastics. Poly(3-hydroxybutyrate-co-lactate) [P(3HB-co-LA)] is one member of the PHAs family, and has better toughness and transparency compared to existing polylactic acid (PLA) and poly[(R)-3-hydroxybutyrate] [P(3HB)]. First, we confirmed the one-step biosynthesis of P(LA-co-3HB) with the lactate fraction of 23.8 mol% by introducing P(3HB-co-LA) production module into Escherichia coli MG1655. Then, the lactate fraction was increased to 37.2 mol% in the dld deficient strain WXJ01-03. The genes encoding the thioesterases, ydiI and yciA, were further knocked out, and the lactate fraction in the P(3HB-co-LA) was improved to 42.3 mol% and 41.1 mol% respectively. Strain WXJ03-03 with dld, ydiI and yciA deficient was used for the production of the LA-enriched polymer, and the lactate fraction was improved to 46.1 mol%. Notably, the lactate fraction in P(3HB-co-LA) from xylose was remarkably higher than from glucose, indicating xylose as a potent carbon source for P(3HB-co-LA) production. Therefore, the deficiency of thioesterase may be considered as an effective strategy to improve the lactate fraction in P(3HB-co-LA) in xylose fermentation.
Keywords: polyhydroxyalkanoatesP(3HB-co-LA)Escherichia colixylose fermentationthioesterase
塑料制品由于其出色的性能在现代社会扮演着越来越重要的角色[1],然而市场上绝大多数塑料制品都是由石油衍生而来的[2],具有难以降解的特性,废弃塑料的大量堆积对生态环境造成沉重的负担[3]。聚羟基脂肪酸酯是一种可以通过微生物发酵的方式在微生物体内以小颗粒的形式储存的生物材料[4],不仅具有与化学塑料类似的物理化学性质,还具有良好的生物相容性和自然降解性,是一种理想的化学塑料的替代品[3]。聚3-羟基丁酸乳酸酯(P(3HB-co-LA))是属于PHAs的一种共聚物,在PHA合酶的作用下将3-羟基丁酰辅酶A(3HB-CoA)和乳酰辅酶A(LA-CoA)聚合而成,PLA和P(3HB)分别是以乳酸和3-羟基丁酸为单体聚合而成的生物聚酯。PLA具有坚硬透明的特点,P(3HB)是不透明且易碎的,P(3HB-co-LA)兼具了二者共同的优点,具有更优的弹性和透明度[5-6],而且共聚物的性质会根据共聚物中单体成分变化而有所变化,因此应用范围也更加广泛[7]。
由于无法找到对LA-CoA有活性的天然PHA合酶,因此Taguchi等[8]科学家通过饱和突变的方法成功筛选到可以聚合3HB-CoA和LA-CoA两种单体的PHA合酶突变体Pseudomonas sp. 61-3 (PhaC1PsST/QK),但是产物中乳酸含量仅有6 mol%。当乳酸含量较低时,共聚物呈现出不透明状,随着乳酸组分的提高,共聚物的透明度增加且脆性下降,从而具有更好的韧性和延长率,当乳酸组分达到33 mol%时,延长率可增加4倍,几乎达到市场上聚乙烯塑料的水平[9]。
为了进一步提高共聚物中乳酸组分含量,近年来科学家们主要从关键酶进化、底盘细胞改造、发酵过程优化几种途径研究。为了增加Pctcp对乳酸以及PhaC1ps6-19对乳酰辅酶A的催化活性,韩国科学家Yang等[10]通过易错PCR突变和定点饱和突变的方法进行酶的进化,最终在添加3HB的情况下利用葡萄糖发酵生产出乳酸组分含量为49 mol%、聚合物含量为53.5 wt%的P(3HB-co-LA)。Jung等[11]利用基因工程手段敲除基因ackA、adhE和ppc间接增加胞内乳酰辅酶A和乳酸的合成量,同时替换乳酸脱氢酶和乙酰辅酶A合成酶的启动子,合成的共聚物P(3HB-co-LA)中乳酸组分含量达到70 mol%,聚合物占菌体干重为46 wt%。Park等[12]尝试利用丰富而廉价的蔗糖为碳源发酵生产P(3HB-co-LA),在罗尔斯通氏菌Ralstonia eutropha中引入来自产琥珀酸曼氏杆菌Mannheimia succiniciproducens的sacC基因构建蔗糖利用途径,引入大肠杆菌Escherichia coli的ldhA保证乳酸的合成,发酵生产的P(3HB-co-LA)中乳酸组分含量为21.5 mol%,聚合物占菌体干重为19.5 wt%。
Yamada等[7]通过缺失丙酮酸甲酸裂解酶(PFL)且上调乳酸脱氢酶(LDH),减少丙酮酸到乙酰辅酶A的流量且增加胞内乳酸的积累量[13],在厌氧条件下发酵生产P(3HB-co-LA),使乳酸组分含量提高至47%,但聚合物含量较少。Nduko等[14]研究了木糖作为碳源对高乳酸组分P(3HB-co-LA)生产的作用,选用进化后的PHA合酶[phaC1 Ps(ST/FS/QK)]在重组大肠杆菌中进行发酵,在葡萄糖为碳源时获得的聚合物P(3HB-co-LA)中乳酸组分为47 mol%,当碳源换成木糖时,乳酸组分便提高至60 mol%。
在提高乳酸组分的研究中,改造底盘细胞的目的一般是为了增加胞内乳酸的积累,然后在外源基因pctth作用下转化为乳酰辅酶A,乳酰辅酶A作为P(3HB-co-LA)的直接前体可以增加共聚物中乳酸组分含量。然而有文献[15]提出,在合成P(3HB-co-LA)的大肠杆菌体内乳酰辅酶A的含量处于检测值以下的水平,推测大肠杆菌体内具有某种降解乳酰辅酶A作用的酶使其刚合成即被部分降解,因此仅增加胞内乳酸积累仍具有一定的局限性。通过进一步文献调研发现大肠杆菌内源性硫酯酶YciA和YdiI对于广泛的短链脂肪酰辅酶A具有一定的降解作用[16-18]。因此本研究区别于以往增加胞内乳酸积累的方法,提出了一种新的大肠杆菌改造策略,即敲除大肠杆菌内源性的可降解乳酰辅酶A的硫酯酶,阻止胞内乳酰辅酶A的降解,使之更多地走向聚合物的合成途径,具体代谢途径见图 1。
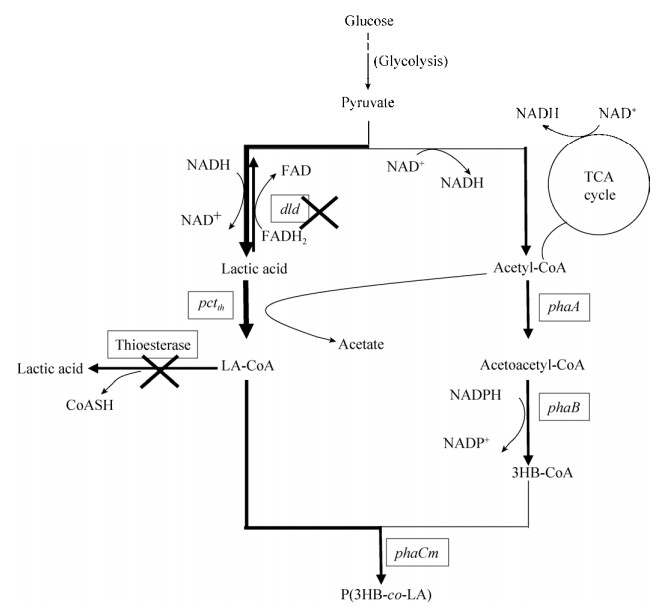 |
| 图 1 基因工程大肠杆菌合成P(3HB-co-LA) Fig. 1 Biosynthesis of P(3HB-co-LA) by genetically engineered E. coli. |
| 图选项 |
1 材料与方法1.1 菌株和质粒本研究所用到的菌株和质粒见表 1,构建菌株所用到的引物见表 2。
表 1 菌株和质粒Table 1 Strains and plasmids
| Strains and plasmids | Description | Source |
| Plasmids | ||
| pTrc99a | Cloning vector, trc promoter, AmpR | Our laboratory |
| pBAD-Ptrc | Cloning vector, trc promoter, ChlR | Our laboratory |
| pTrc99aABC | pTrc99a containing phaA, phaB and phaCm gene, trc promoter, AmpR | Our laboratory |
| pBAD-Ptrc-pctth | pBAD33-Ptrc containing pctth gene, trc promoter, AmpR | Our laboratory |
| Strains | ||
| MG1655 | Wild-type | Our laboratory |
| WXJ01 | MG1655Δdld | Our laboratory |
| WXJ02 | MG1655Δdld ΔydiI | This study |
| WXJ021 | MG1655Δdld ΔyciA | This study |
| WXJ03 | MG1655Δdld ΔyciA ΔydiI | This study |
| MG1655-03 | MG1655 carrying pTrc99aABC and pBAD-Ptrc-pctth | This study |
| WXJ01-03 | WXJ01 carrying pTrc99aABC and pBAD-Ptrc-pctth | This study |
| WXJ02-03 | WXJ02 carrying pTrc99aABC and pBAD-Ptrc-pctth | This study |
| WXJ021-03 | WXJ021 carrying pTrc99aABC and pBAD-Ptrc-pctth | This study |
| WXJ03-03 | WXJ03 carrying pTrc99aABC and pBAD-Ptrc-pctth | This study |
表选项
表 2 文中所用引物Table 2 Primers used in this study
| Primer name | Primer sequence(5′–3′) | Size (bp) |
| yciA-KO-F | AAATCATAGTAGCATCGCGCCTGTGATTTTCCTTTTAAGTCGGTTTTACCCGT CTTGAGCGATTGTGTAG | 70 |
| yciA-KO-R | AAATTCAGTAAGCAGAAAGTCAAAAGCCTCCGACCGGAGGCTTTTGACTAG ATGTAACGCACTGAGAAGC | 70 |
| ydiI-KO-F | GAAGGCACGGGGGTACGCCATCCTGTGCAGGCTTTACTGGAGATTATTAAC GTCTTGAGCGATTGTGTAG | 70 |
| ydiI-KO-R | TGCAGATAATGACCAAAAGCAATATGCGTCACACTTTTCTGGTGACAACGGA TGTAACGCACTGAGAAGC | 70 |
| yciA-jd-F | ATGGTCGAAGCTGAATCTGGCCTGG | 25 |
| yciA-jd-R | CGCGCATTAAGCCGTAATCAGCCGC | 25 |
| ydiI-jd-F | CTGTACCGAAGTTACCGCCTTGCCG | 25 |
| ydiI-jd-R | ATTAAGTCAGGATCAATGCACGCCC | 25 |
表选项
1.2 重组菌株改造底盘细胞的基因敲除是根据λ-red重组系统介导的PCR产物一步法敲除原理[19]进行的。在改造菌株MG1655Δdld的基础上分别将E. coli MG1655内源性的硫酯酶基因ydiI和yciA由含有FRT位点的kan基因代替,分别获得改造菌株MG1655Δdld ΔydiI和MG1655Δdld ΔyciA,再利用同样的方法在MG1655Δdld ΔydiI的基础上敲除基因yciA获得改造菌株MG1655Δdld ΔyciA ΔydiI,并将MG1655Δdld、MG1655Δdld ΔydiI、MG1655Δdld ΔyciA和MG1655Δdld ΔydiI ΔyciA分别命名为WXJ01、WXJ02、WXJ021和WXJ03。
1.3 培养基与培养方法LB培养基:每升含酵母提取物5 g,蛋白胨10 g和氯化钠10 g。
二级种子培养基:M9培养基中添加木糖或葡萄糖10 g/L,酵母提取物2 g/L,Na2HPO4·12H2O 15.1 g/L,KH2PO4 3.0 g/L,NaCl 0.5 g/L,NH4Cl 1.0 g/L,MgSO4·7H2O 0.5 g/L,CaCl2 0.011 g/L,1% (W/V)维生素B1 0.2 mL/L。
发酵培养基:M9培养基中添加木糖或葡萄糖20 g/L,酵母提取物2 g/L,Na2HPO4·12H2O 15.1 g/L,KH2PO4 3.0 g/L,NaCl 0.5 g/L,NH4Cl 1.0 g/L,MgSO4·7H2O 0.5 g/L,CaCl2 0.011 g/L,1% (W/V)维生素B1 0.2 mL/L。
一级种子培养方法:将单菌落接种到含有100 mg/L氨苄青霉素和34 mg/L氯霉素的3 mL LB的试管中,在37 ℃培养12 h。
二级种子培养方法:将一级种子接种到50 mL含有100 mg/L的氨苄青霉素和34 mg/L的氯霉素的二级种子培养基中30 ℃培养12 h。
发酵培养方法:将二级种子接种到含有100 mg/L氨苄青霉素和34 mg/L氯霉素的发酵培养基中,30 ℃培养60 h。
1.4 分析方法1.4.1 碳源、乳酸和乙酸分析本研究涉及到的碳源及代谢中间物如乳酸和乙酸,经过适当的稀释和过滤后通过岛津公司生产的LC-20A高效液相色谱进行检测,色谱柱为HPX-87X,流动相为5 mmol/L H2SO4,柱温为65 ℃,流速为0.6 mL/min。
1.4.2 聚合物及单体成分分析本研究生成的聚合物需要先进行预处理。
首先是酯化反应:向提前冷冻干燥的已知重量(约15 mg)的菌体中加入1.5 mL氯仿和1.5 mL的酯化液(由15%硫酸、85%甲醇、1 g/L苯甲酸配制而成)在100 ℃下酯化4 h。然后冷却后加入0.75 mL去离子水振荡萃取,低温低速离心取下层有机相过滤后进行气相色谱检测。气相色谱采用岛津GC-2014型号,检测器是火焰化离子检测器,以高纯氮为载气,氢气为燃气,空气为助燃气,进样器为AOC-20S型自动化进样器。具体程序为:首先在54 ℃保留4 min,然后以5 ℃/min的速率升温至80 ℃,以10 ℃/min的程序升温至125 ℃,再以30 ℃/min的速率升温至180 ℃,最后以20 ℃/min的速率升温至220 ℃并保留5 min。
2 结果与分析2.1 硫酯酶缺失菌株构建在本研究中,通过表达P(3HB-co-LA)合成所需要的基因来构建重组大肠杆菌,如表 1所示,即在大肠杆菌中引入3HB-CoA合成所需的β-酮硫解酶(phaA) (来自罗尔斯通氏菌Ralstonia eutropha)和乙酰乙酰CoA还原酶(phaB) (来自罗尔斯通氏菌Ralstonia eutropha),聚合物合成所需的突变后的PHA合成酶(phaCm) (来自荧光假单胞菌Pseudomonas fluorescens strain 2P24)以及合成LA-CoA所需的突变的丙酸CoA转移酶(pctth) (来自丙酸梭菌Clostridium propionicum)[20]。通过文献[5]调研发现,对于同一套合成P(3HB-co-LA)的基因,以谷氨酸棒杆菌作为底盘细胞,合成的P(3HB-co-LA)中乳酸组分含量最高可达96.8 mol%,远高于以大肠杆菌作为底盘细胞所合成的共聚物,日本研究者Taguchi等[15]通过实验证明,相比于谷氨酸棒杆菌,大肠杆菌体内存在一种可以降解LA-CoA的酶,使之脱去CoA重新生成乳酸,降低了胞内LA-CoA水平,使得大肠杆菌合成的P(3HB-co-LA)中乳酸组分低于谷氨酸棒杆菌,但具体降解机制不清楚。
前期有研究者报道[21-22],大肠杆菌体内的硫酯酶对于各种代谢途径中的酰基辅酶A类中间体具有降解作用,但是对于具体降解某一种特定的酰基辅酶A中间体的硫酯酶却没有具体研究,大肠杆菌体内的硫酯酶种类很多,由于大多数都具有广泛的底物特异性,所以很难预测某种硫酯酶对于具体的酰基辅酶A中间体的生理作用。Lin等[23]在大肠杆菌中建立了一个人工途径用于四羟基香豆素的合成,在合成过程中需要中间体水杨酸酰基辅酶A,为了防止该中间体被硫酯酶所降解,确定了大肠杆菌内源性的一种相关硫酯酶并将其敲除,最终使四羟基香豆素的产量得到提升。YciA是大肠杆菌内源性的硫酯酶,Gonzalez等[16]通过体外比活性检测得出,该硫酯酶对于碳四脂肪酰辅酶A具有较好的降解作用,对于乙酰辅酶A也具有一定的降解作用。YdiI对于广泛的酰基CoA均具有较高的活性[18]。
为实现提高P(3HB-co-LA)中乳酸组分的目的,首先选用缺失D-乳酸脱氢酶基因(dld)的改造菌株WXJ01,防止发酵后期乳酸合成丙酮酸[24]。然后在WXJ01菌株的基础上分别敲除ydiI和yciA,获得改造菌株WXJ02 (图 2)和WXJ021(图 3),在WXJ02菌株的基础上敲除yciA,获得改造菌株WXJ03 (图 4)。在图 2–4中,泳道C均表示以未敲除目标基因为模板通过验证引物进行的PCR扩增结果,片段大小依次为1 011 bp、999 bp和999 bp,当待敲除基因被kan基因替换后,片段大小均会增加至2 180 bp。
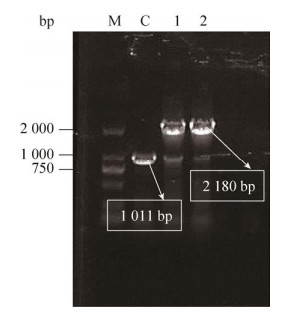 |
| 图 2 ydiI基因敲除菌落PCR验证电泳图 Fig. 2 Colonies PCR validation of the ydiI knockout. M: DL 2000 marker, C: WXJ01, 1–2: WXJ02. |
| 图选项 |
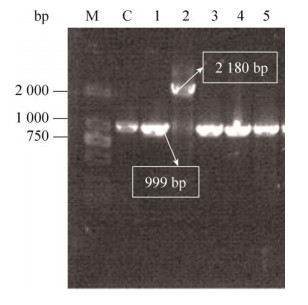 |
| 图 3 yciA基因敲除菌落PCR验证电泳图 Fig. 3 Colonies PCR validation of the yciA knockout. M: DL 2000 marker, C: WXJ01, 1–5: WXJ021. |
| 图选项 |
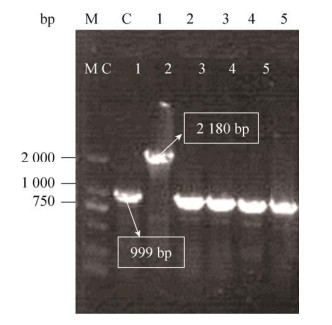 |
| 图 4 硫酯酶双敲除菌落PCR验证电泳图 Fig. 4 Colonies PCR validation of the MG1655Δdld ΔydiI ΔyciA. M: DL 2000 marker, C: WXJ02, 1–5: WXJ03. |
| 图选项 |
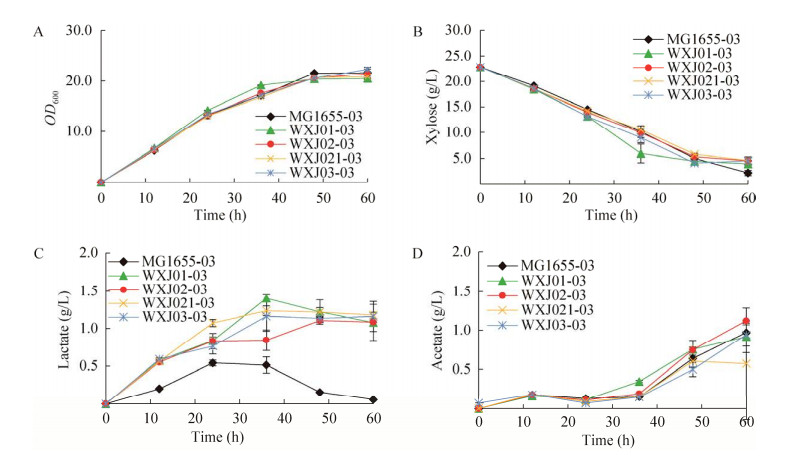
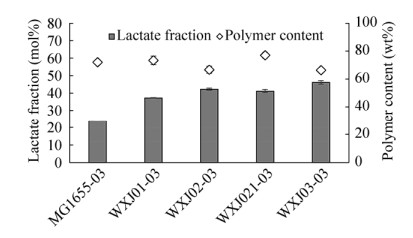
2.2 硫酯酶缺失菌株木糖发酵将pTrc99aABC和pBAD-Ptrc-pctth双质粒转化进入底盘细胞MG1655、WXJ01、WXJ02、WXJ021和WXJ03中,获得的重组菌株依次命名为MG1655-03、WXJ01-03、WXJ02-03、WXJ021-03和WXJ03-03。将上述重组菌株经过一级种子和二级种子培养后,接种到M9发酵培养基中发酵,添加0.1 mmol/L IPTG诱导质粒的表达。发酵60 h后检测聚合物生产情况。由于木糖是一种性价比较高的碳源,同时是一种非粮碳源,是自然界第二大丰富的糖类[25],已有研究证明木糖发酵有利于胞内乳酸的积累[26],因此本研究选用木糖发酵生产P(3HB-co-LA)。具体结果见图 5和图 6。
 |
| 图 5 不同重组菌株木糖发酵的生长和代谢 Fig. 5 The growth and metabolism of different recombinant strains in xylose. |
| 图选项 |
 |
| 图 6 不同重组菌株木糖发酵的聚合物生产 Fig. 6 The production of P(3HB-co-LA) of different recombinant strains in xylose. |
| 图选项 |
图 5A表示菌株的生长状况,从生长趋势以及最终生长OD值来看,5种重组菌株没有表现出明显差别,说明基因dld以及硫酯酶基因yciA和ydiI的缺失没有对菌株的生长造成负面影响。图 5B表示发酵过程中木糖的消耗情况,MG1655-03、WXJ01-03、WXJ02-0、WXJ021-03和WXJ03-03重组菌株剩余的木糖分别为2.2 g/L、4.0 g/L、4.5 g/L、4.6 g/L和4.5 g/L,说明dld基因的缺失可以在不影响菌株生长的前提下减少木糖的消耗量,硫酯酶基因缺失后进一步减少了耗糖量。可能因为缺失dld基因后降低了大肠杆菌木糖代谢中乳酸反向通过丙酮酸进入TCA循环,使菌体的碳源利用率得到提高。图 5C表示发酵过程中乳酸的分泌量,当大肠杆菌缺失基因dld时,菌株WXJ01-03、WXJ02-03、WXJ021-03、WXJ03-03的乳酸含量明显比野生型菌株MG1655-03 (乳酸含量最高为0.5 g/L)高,缺失dld后胞内积累的乳酸不会由D-乳酸脱氢酶催化生成丙酮酸,从而增加了胞内的乳酸积累量。没有缺失硫酯酶基因的菌株WXJ01-03的乳酸水平在36 h达到最高(图 5C),硫酯酶基因的缺失阻碍了部分乳酰辅酶A转化为乳酸,从而导致了发酵液中乳酸含量的降低。图 5D表示发酵过程中乙酸的代谢变化情况,5种重组菌株的乙酸含量并没有明显区别,发酵过程中乙酸始终处于上升趋势,存在一定的溢流代谢,最高乙酸含量均在0.9 g/L左右。
图 6表示5种不同重组菌株的聚合物产量以及乳酸组分在聚合物中所占的比例情况。各突变株中聚合物占菌体干重的比例没有明显变化,聚合物中乳酸组分含量有了明显的提升,其中重组菌株WXJ01-03的乳酸含量为37.2 mol%,比MG1655-03菌株的乳酸含量(23.8 mol%)提高了56%,说明dld的缺失可以使大肠杆菌胞内乳酸含量增加,进而增加聚合物中乳酸组分含量。Nduko等[27]利用木糖发酵生产P(3HB-co-LA)时,发现缺失dld基因的重组菌株以相同的耗糖量可以生产更高得率的聚合物,dld基因的缺失对利用木糖生产乳酸基聚合物具有促进作用。
在WXJ01-03的基础上,分别进一步缺失ydiI和yciA得到重组菌株WXJ02-03和WXJ021-03,他们发酵合成的聚合物中乳酸含量分别为42.3 mol%和41.1 mol%,相对于没有缺失硫酯酶的菌株WXJ01-03分别提高了14%和10%,当两种硫酯酶都缺失后,重组菌株WXJ03-03的乳酸含量达到了最高值46.1 mol%,比WXJ01-03菌株提高了24%,比野生型菌株MG1655-03菌株生产的聚合物中乳酸组分含量提高了94%。说明硫酯酶基因的缺失减少了胞内乳酰辅酶A被降解,从而更多地走向共聚物P(3HB-co-LA)的合成方向,而且双硫酯酶缺失后,这种作用更加明显。YdiI和YciA都是对短链脂肪酰辅酶A具有降解作用的酶,文中通过实验间接证明两种酶对乳酰辅酶A可能具有降解作用,但对于3HB-CoA是否有作用目前不能确定。因为大肠杆菌体内积累的3HB-CoA水平远高于LA-CoA水平[15],即使部分3HB-CoA被硫酯酶降解,也可能在合成聚合物的过程中影响不会很大,所以单从聚合物产物中3HB的含量无法判断硫酯酶是否降解了3HB-CoA。
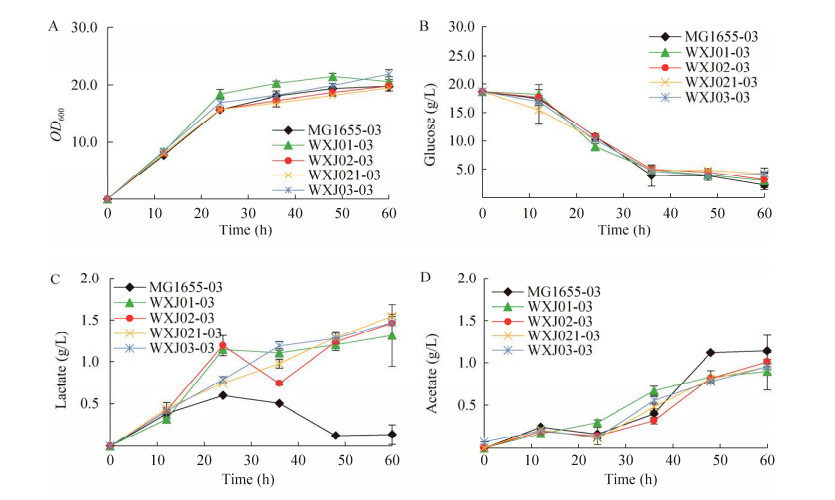
2.3 硫酯酶缺失菌株葡萄糖发酵为比较硫酯酶缺失菌株利用不同碳源的发酵结果,本研究将同样的重组菌株在相同的条件下进行葡萄糖发酵,结果见图 7和图 8。
 |
| 图 7 不同重组菌株葡萄糖发酵的生长和代谢 Fig. 7 The growth and metabolism of different recombinant strains in glucose. |
| 图选项 |
 |
| 图 8 不同重组菌株葡萄糖发酵的聚合物生产 Fig. 8 The production of P(3HB-co-LA) of different recombinant strains in glucose. |
| 图选项 |
图 7A展示了重组菌株的生长状况,5种菌株的最终生长OD值均在20左右,与木糖发酵的生长状况类似,且基因的缺失同样没有影响菌株的生长。图 7B表示葡萄糖的消耗情况,与木糖发酵过程相比,葡萄糖的消耗在前期经历了约12 h的延迟期。图 7C表示发酵过程中乳酸变化情况,在发酵过程中,MG1655-03重组菌株的乳酸含量在24 h达到最高值为0.6 g/L,敲除dld基因之后,重组菌株WXJ01-03的胞外分泌的乳酸含量明显提高,最高达到了1.3 g/L,是野生型乳酸含量的2.2倍,当继续敲除硫酯酶之后,代谢过程中分泌的乳酸含量继续增加,其中WXJ02-03、WXJ021-03和WXJ03-03重组菌株乳酸含量最高都达到1.5 g/L,比WXJ01-03菌株提高了15%。图 7D表示菌体生长过程中乙酸积累情况,由图中看出,代谢过程中乙酸含量始终处于上升趋势,即在碳源充足的情况下,存在一定的溢流代谢,乙酸含量最高在1.0 g/L左右,与木糖发酵乙酸的积累量和趋势相似。
在葡萄糖发酵中不同的重组菌株聚合物的生产情况以及聚合物中乳酸含量如图 8所示。野生型菌株MG1655-03生产的聚合物中,乳酸组分含量为18 mol%,当缺失dld之后,WXJ01-03菌株生产的聚合物中乳酸含量提高至26.7 mol%,但是相对于重组菌株WXJ01-03,当继续缺失硫酯酶基因时,菌株WXJ02-03、WXJ021-03和WXJ03-03生产的聚合物中乳酸组分含量没有明显的提高,这一现象与在木糖发酵中不同,以葡萄糖为碳源发酵合成的聚合物P(3HB-co-LA)中乳酸含量低于以木糖为碳源的发酵。
聚合物合成结果显示,在葡萄糖发酵中共聚物P(3HB-co-LA)的乳酸组分含量变化较小,但利用木糖发酵聚合物中乳酸含量变化显著,且共聚物中乳酸组分含量较高,主要原因可能是不同碳源对细胞代谢的影响差异性非常大;综合发酵过程的代谢情况以及聚合物生产情况分析,木糖发酵更有利于高乳酸组分含量的P(3HB-co-LA)的生产。
3 小结本研究通过表达外源基因phaA、phaB供应3HB-CoA的合成,表达外源基因pctth供应LA-CoA的合成,最终在phaCm作用下合成共聚物P(3HB-co-LA),在MG1655-03重组菌株利用木糖合成的共聚物中乳酸组分含量为23.8 mol%,在缺失dld基因的菌株WXJ01-03中获得共聚物中乳酸组分含量为37.2 mol%。为了进一步增加共聚物中乳酸组分含量,本研究从防止LA-CoA被降解的角度出发,将具有短链脂肪酰辅酶A降解作用的酶YdiI和YciA分别在MG1655中敲除,在此基础上转入带有共聚物合成相关基因的质粒,获得重组菌株WXJ02-03和WXJ021-03,这两种菌产生的共聚物中乳酸含量有了明显提升,分别为42.3 mol%和41.1 mol%。最后为了考察双硫酯酶基因缺失对聚合物合成的影响,将ydiI和yciA均敲除掉,获得的菌株WXJ03-03合成的共聚物达到了最高乳酸组分含量,为46.1 mol%。Nduko等[14]选用大肠杆菌JW0885 (pflA-)为底盘细胞,以20 g/L木糖为碳源进行发酵获得乳酸组分为34 mol%的P(3HB-co-LA),聚合物占菌体干重为61%,与本研究结果相比具有一定的劣势。当Nduko等[27]选择BW25113菌株并缺失基因pflA和dld以20 g/L木糖为碳源进行发酵时,获得乳酸组分为73 mol%的共聚物,但总的聚合物占菌体含量仅有58 wt%,低于本研究的结果,且基因缺失后菌体的生长受到抑制,菌体干重仅为亲本菌株的51%,本研究中基因缺失不会对菌株生长造成抑制现象,具有一定的优势。本研究还探索了硫酯酶缺失菌株利用不同碳源发酵对聚合物生产的影响,发现相比于葡萄糖,木糖在提高共聚物中乳酸组分方面具有一定的优势。在木糖发酵中硫酯酶的缺失对于共聚物P(3HB-co-LA)中乳酸组分的提高具有重要作用,此结果为微生物合成乳酸基聚合物提供了一个新的代谢工程改造思路。
参考文献
| [1] | Philip S, Keshavarz T, Roy I. Polyhydroxyalkanoates: biodegradable polymers with a range of applications. J Chem Technol Biotechnol, 2007, 82(3): 233-247. DOI:10.1002/jctb.1667 |
| [2] | Kaur L, Khajuria R, Parihar L, et al. Polyhydroxyalkanoates: biosynthesis to commercial production-A review. J Microbiol Biotechnol Food Sci, 2017, 6(4): 1098-1106. |
| [3] | Anderson AJ, Dawes EA. Occurrence, metabolism, metabolic role, and industrial uses of bacterial polyhydroxyalkanoates. Microbiol Rev, 1991, 54(4): 450-472. |
| [4] | Chen GQ, Wu Q, Xi JZ, et al. Microbial production of biopolyesters-polyhydroxyalkanoates. Progr Nat Sci, 2000, 10(11): 847-850. |
| [5] | Song YY, Matsumoto K, Yamada M, et al. Engineered Corynebacterium glutamicum as an endotoxin-free platform strain for lactate-based polyester production. Appl Microbiol Biotechnol, 2012, 93(5): 1917-1925. DOI:10.1007/s00253-011-3718-0 |
| [6] | Yamada M, Matsumoto K, Shimizu K, et al. Adjustable mutations in lactate(LA)-polymerizing enzyme for the microbial production of LA-based polyesters with tailor-made monomer composition. Biomacromolecules, 2010, 11(3): 815-819. DOI:10.1021/bm901437z |
| [7] | Yamada M, Matsumoto K, Uramoto S, et al. Lactate fraction dependent mechanical properties of semitransparent poly(lactate-co-3-hydroxybutyrate)s produced by control of lactyl-CoA monomer fluxes in recombinant Escherichia coli. J Biotechnol, 2011, 154(4): 255-260. DOI:10.1016/j.jbiotec.2011.05.011 |
| [8] | Taguchi S, Yamada M, Matsumoto K, et al. A microbial factory for lactate-based polyesters using a lactate-polymerizing enzyme. Proc Natl Acad Sci USA, 2008, 105(45): 17323-17327. DOI:10.1073/pnas.0805653105 |
| [9] | Ishii D, Takisawa K, Matsumoto K, et al. Effect of monomeric composition on the thermal, mechanical and crystalline properties of poly[(R)-lactate-co-(R)- 3-hydroxybutyrate]. Polymer, 2017, 122: 169-173. DOI:10.1016/j.polymer.2017.06.039 |
| [10] | Yang TH, Kim TW, Kang HO, et al. Biosynthesis of polylactic acid and its copolymers using evolved propionate CoA transferase and PHA synthase. Biotechnol Bioeng, 2010, 105(1): 150-160. DOI:10.1002/bit.22547 |
| [11] | Jung YK, Kim TY, Park SJ, et al. Metabolic engineering of Escherichia coli for the production of polylactic acid and its copolymers. Biotechnol Bioeng, 2010, 105(1): 161-171. DOI:10.1002/bit.22548 |
| [12] | Park SJ, Jang YA, Noh W, et al. Metabolic engineering of Ralstonia eutropha for the production of polyhydroxyalkanoates from sucrose. Biotechnol Bioeng, 2015, 112(3): 638-643. DOI:10.1002/bit.25469 |
| [13] | Zhou SD, Causey TB, Hasona A, et al. Production of optically pure D-lactic acid in mineral salts medium by metabolically engineered Escherichia coli W3110. Appl Environ Microbiol, 2003, 69(1): 399-407. DOI:10.1128/AEM.69.1.399-407.2003 |
| [14] | Nduko JM, Matsumoto K, Ooi T, et al. Effectiveness of xylose utilization for high yield production of lactate-enriched P(lactate-co-3-hydroxybutyrate) using a lactate-overproducing strain of Escherichia coli and an evolved lactate-polymerizing enzyme. Metabol Eng, 2013, 15: 159-166. DOI:10.1016/j.ymben.2012.11.007 |
| [15] | Matsumoto K, Iijima M, Hori C, et al. In vitro analysis of D-lactyl-CoA-polymerizing polyhydroxyalkanoate synthase in polylactate and poly(lactate-co-3-hydroxybutyrate) syntheses. Biomacromolecules, 2018, 19(7): 2889-2895. DOI:10.1021/acs.biomac.8b00454 |
| [16] | Clomburg JM, Vick JE, Blankschien MD, et al. A synthetic biology approach to engineer a functional reversal of the β-oxidation cycle. ACS Synth Biol, 2012, 1(11): 541-554. DOI:10.1021/sb3000782 |
| [17] | Guevara-Martínez M, Perez-Zabaleta M, Gustavsson M, et al. The role of the acyl-CoA thioesterase "YciA" in the production of (R)-3-hydroxybutyrate by recombinant Escherichia coli. Appl Microbiol Biotechnol, 2019, 103(9): 3693-3704. DOI:10.1007/s00253-019-09707-0 |
| [18] | Wu R, Latham JA, Chen DQ, et al. Structure and catalysis in the Escherichia coli hotdog-fold thioesterase paralogs YdiI and YbdB. Biochemistry, 2014, 53(29): 4788-4805. DOI:10.1021/bi500334v |
| [19] | Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12): 6640-6645. DOI:10.1073/pnas.120163297 |
| [20] | Lu JX, Li ZM, Ye Q, et al. Effect of reducing the activity of respiratory chain on biosynthesis of poly (3-hydroxybutyrate-co-lactate) in Escherichia coli. Chin J Biotech, 2019, 35(1): 66-76 (in Chinese). 陆静娴, 李志敏, 叶勤, 等. 弱化呼吸链水平对代谢工程大肠杆菌聚羟基丁酸乳酸酯合成的影响. 生物工程学报, 2019, 35(1): 66-76. |
| [21] | Beuerle T, Pichersky E. Enzymatic synthesis and purification of aromatic coenzyme A esters. Anal Biochem, 2002, 302(2): 305-312. DOI:10.1006/abio.2001.5574 |
| [22] | Watts KT, Lee PC, Schmidt-Dannert C. Exploring recombinant flavonoid biosynthesis in metabolically engineered Escherichia coli. ChemBioChem, 2004, 5(4): 500-507. DOI:10.1002/cbic.200300783 |
| [23] | Lin YH, Shen XL, Yuan QP, et al. Microbial biosynthesis of the anticoagulant precursor 4-hydroxycoumarin. Nat Commun, 2013, 4: 2603. DOI:10.1038/ncomms3603 |
| [24] | Choi SY, Park SJ, Kim WJ, et al. One-step fermentative production of poly(lactate-co-glycolate) from carbohydrates in Escherichia coli. Nat Biotechnol, 2016, 34(4): 435-440. DOI:10.1038/nbt.3485 |
| [25] | Lopes MSG, Rocha RCS, Zanotto SP, et al. Screening of bacteria to produce polyhydroxyalkanoates from xylose. World J Microbiol Biotechnol, 2009, 25(10): 1751-1756. DOI:10.1007/s11274-009-0072-9 |
| [26] | Adsul MG, Singhvi MS, Gaikaiwari SA, et al. Development of biocatalysts for production of commodity chemicals from lignocellulosic biomass. Bioresour Technol, 2011, 102(6): 4304-4312. DOI:10.1016/j.biortech.2011.01.002 |
| [27] | Nduko JM, Matsumoto K, Ooi T, et al. Enhanced production of poly(lactate-co-3-hydroxybutyrate) from xylose in engineered Escherichia coli overexpressing a galactitol transporter. Appl Microbiol Biotechnol, 2014, 98(6): 2453-2460. DOI:10.1007/s00253-013-5401-0 |
