

中国医学科学院 北京协和医学院 输血研究所,四川 成都 610052
收稿日期:2019-05-13;接收日期:2019-08-13
基金项目:中国医学科学院医学与健康科技创新工程(No. 2016-I2M-1-018),中国医学科学院医学与健康科技创新工程(No. 2017-I2M-3-021)资助
摘要:为了进一步提高伤口敷料的止血性能,文中在生物相容性良好的壳聚糖溶液中引入含有多种生长因子的人源性富血小板血浆(Human platelet-rich plasma,hPRP),并加入不同体积比例(1:1、1:3、3:1、1:0)的丝素蛋白溶液以提高材料的多孔性与止血性,通过冷冻干燥法制备不同配比的hPRP-壳聚糖/丝素蛋白敷料,并将纯壳聚糖敷料作为对照组,研究hPRP和丝素蛋白对敷料的止血性能的影响以及丝素蛋白对PRP中生长因子控制释放的影响。结果表明,在壳聚糖敷料中引入hPRP对敷料的止血性有所提高,但对敷料的多孔结构及吸水率无明显改善,若在hPRP-壳聚糖溶液中按照体积比为1:1的比例加入丝素蛋白溶液,会得到具有较为均匀的多孔结构的敷料,敷料的孔隙率与吸水率分别可达到86.83%±3.84%与1 474%±114%,且该比例的敷料在快速止血性能上表现优异。此外,加入丝素蛋白与壳聚糖比例为1:1的PRP敷料能有效减少PRP中生长因子在初始阶段的爆裂释放。因此,含hPRP的壳聚糖/丝素蛋白复合敷料有望成为一种能快速止血且能促进伤口愈合的新型伤口敷料。
关键词:富血小板血浆壳聚糖丝素蛋白止血性生长因子
Preparation and characterization of a hemostatic porous platelet-rich plasma chitosan/silk fibroin wound dressing
Dingding Han, Zeng He, Rui Zhong, Xuejun Zhang, Hong Wang


Institute of Blood Transfusion, Peking Union Medical Collage, Chinese Academy of Medical Science, Chengdu 610052, Sichuan, China
Received: May 13, 2019; Accepted: August 13, 2019
Supported by: CAMS Innovation Fund for Medical Sciences (CIFMS) (No. 2016-I2M-1-018), CAMS Innovation Fund for Medical Sciences (CIFMS) (No. 2017-I2M-3-021)
Corresponding author: Hong Wang. Tel/Fax: +86-28-61648511; E-mail: smile9918@126.com.
Abstract: In order to further improve the hemostatic performance of wound dressings, human platelet-rich plasma (PRP) containing various growth factors was introduced into chitosan solution. The silk fibroin solutions with different volume ratios (1:1, 1:3, 3:1 and 1:0) were added to improve the porosity and hemostasis of materials. The hPRP-chitosan/silk wound dressings with different ratios was prepared by freeze-drying and pure chitosan dressing was considered as the control group to study the effects of PRP and silk fibroin in different proportions on the hemostasis properties and the growth factors burst release. The hemostasis of chitosan dressing was improved by introducing PRP, but the porous structure and water absorption were not significantly improved. If silk fibroin solution was added in the ratio of 1:1, the more uniform porous structure and better hemostatic performance could be obtained. The porosity and water absorption could reach 86.83%±3.84% and 1 474%±114% respectively. In addition, the dressings with ratio of 1:1 had positive effects on reducing the burst release of growth factors on initial stage. Therefore, PRP-chitosan/silk fibroin composite dressing can become a kind of wound dressing that can achieve rapid hemostasis and promote wound healing.
Keywords: platelet-rich plasmachitosansilk fibroinhemostasisgrowth factor
壳聚糖是一种具有良好的生物相容性的天然材料,被广泛用于制备伤口止血敷料,但单一的壳聚糖敷料在力学性能与吸湿性能上表现出了一定的局限性[1],因此复合壳聚糖敷料成为了新的研究热点。血小板作为血液三大成分之一,含有多种生长因子,例如IGF-1 (Insulin-like growth factor-1,促生长因子)、PDGF-BB (Platelet derived growth factor-BB,血小板衍生因子-BB)、VEGF (Vascular endothelial growth factor,血管内皮生长因子)等,研究发现这些生长因子对于伤口的止血性与愈合性有极为重要的作用。近年来,有文献报道将人源性PRP引入到壳聚糖中制备PRP-壳聚糖复合材料从而提高敷料的止血性与促伤口愈合性[2-3],但PRP-壳聚糖伤口敷料也存在一定问题,例如与创面的贴合性较差、PRP中的生长因子的释放速度太快从而失去活性过快导致敷料后期的促伤口愈合与抗菌性受到一定限制[4-5],所以研究者通过制备壳聚糖与其他物质的复合基材来提高敷料性能并控制PRP中的生长因子释放速度,以保证PRP中的生长因子可持续释放并保持其活性,提高伤口愈合性能。
蚕丝是人类最早利用的天然纤维之一,具有良好的生物相容性、较小的炎症反应、遇水柔软且较强的透氧渗水性[6],再加上有研究发现丝素蛋白度具有调控生长因子释放的作用[7],这些特点使丝素蛋白成为医用敷料的研究热点之一,但单一丝素蛋白材料稳定性差、止血效果不理想[8],因此研究者将丝素蛋白与其他材料复合后克服这些缺点,比如由丝素蛋白与聚丙交酯乙交酯(Poly(lactic-co-glycolic) acid,PLGA) (1:2)的混合膜可作为慢性伤口止血材料[9]。本研究首次将丝素蛋白加入到hPRP-壳聚糖敷料中,通过调节丝蛋白溶液的混合比例来提高hPRP-壳聚糖材料的多孔结构、吸湿性、止血性,并实现生长因子释放的调控,制备得到新型的hPRP-壳聚糖/丝蛋白医用敷料。
1 材料与方法1.1 材料与仪器1.1.1 材料壳聚糖(低分子量级)购于美国ALDRICH公司;蚕茧购于杭州润蚨蚕丝制品有限公司;冰醋酸(分析纯级)购于科龙化工有限公司;氯化钙(分析纯级)与无水乙醇(分析纯级)购于西陇化工有限公司;戊巴比妥钠购于美国Sigma公司;SPF级雄性SD大鼠15只,体重220–250 g,实验动物由四川省实验动物专业委员会养殖场(许可证号:SCXK[川]2015-030)提供,在中国医学科学院输血研究所动物实验室进行饲养及实验,实验符合动物伦理学要求。
1.1.2 仪器全自动血细胞分析仪(深圳迈瑞生物医疗电子股份有限公司,型号BC-3000)、磁力搅拌器(巩义市予华仪器有限公司,型号DH-101S)、真空冷冻干燥机(德国Christ公司,型号ALPHAl-4 LSC plus)、扫描电子显微镜(荷兰FEI公司,型号Quanta 250)、电子天平(常熟市双杰测试仪器厂,型号JJ223BC)、酶标仪(美国Biotek公司,型号:Eon)、离心机(美国Thermo Scientific公司,型号:SORVALL)。
1.2 方法1.2.1 PRP的制备与活化浓缩血小板由德阳血站提供符合国家献血标准的健康献血者,按《血站技术操作规程》[10]采集全血400 mL,采用富血小板血浆法制备浓缩血小板(PC,每袋60–70 mL),质量均符合《全血及成分血质量要求》 (GB 18469-2012)[11]。每例PC取20 mL在3 000 r/min条件下离心10 min,取上层清液作为贫血小板血浆(PPP),根据全自动细胞计数仪测定的结果将PC用PPP调节至血小板浓度为500×109个/L,制备得到富血小板血浆(PRP)。将0.1 mol/L的CaCl2溶液按照1:10 (V/V)的比例加入到PRP中,激活PRP。
1.2.2 丝素蛋白溶液的制备将0.5% Na2CO3溶液煮沸后,将蚕茧按质量体积比1:50 (g:mL)放入0.5% Na2CO3溶液中,煮沸30 min,重复2次后用去离子水将脱胶后的蚕丝冲洗3次,放入37 ℃烘箱烘干。准确称取烘干后的蚕丝4 g,将称取的蚕丝撕碎后逐步加入到100 mL三元溶剂(CaCl2:H2O:C2H5OH的摩尔比为1:8:2),整个过程要控温在75 ℃的条件下进行,直至蚕丝完全溶解后冷却至室温。将冷却后的蛋白溶液倒入预处理过的透析袋(截留分子量8–14 kDa),用去离子水透析3 d后,收集透析袋中的全部溶液后用纱布滤去残渣后,放入试剂瓶中,在4 ℃条件下保存。
1.2.3 hPRP-壳聚糖/丝素蛋白多孔敷料的制备将壳聚糖溶解在2%的醋酸溶液中,制成浓度为4%的壳聚糖-乙酸溶液,整个过程不断搅拌,待完全溶解后,在4 ℃条件下保存。将壳聚糖溶液与丝蛋白溶液按不同体积比例(比例分别是1:1、3:1、1:3、1:0)混匀后,加入混合液体积比10%的PRP到混合液中(分别记作PRP/CS-SK-1:1、PRP/CS-SK-3:1、PRP/CS-SK- 1:3、PRP/CS-SK-1:0),超声脱气20 min后,放入4 ℃静置至无明显气泡。将无气泡的溶液加入到24孔板中,制备直径大小一致的敷料。将孔板放入到?70 ℃冰箱冻结12 h后再放入冷冻干燥仪中冻干36 h,制备得到多孔PRP/壳聚糖-丝素蛋白敷料。另将4%壳聚糖溶液单独作为原液,按照上述方法冷冻干燥后得到纯壳聚糖敷料,记作CS,作为对照组。
1.2.4 孔隙率测定在量筒中加入一定体积的无水乙醇,体积记为V1,将直径为1.2 cm、厚度为1 cm的敷料投入其中,静置5 min,使敷料被无水乙醇完全浸透且表面无明显气泡,此时的总体积记为V2;取出支架,量筒中剩余的无水乙醇体积记为V3。敷料的孔隙率P%按下列公式计算:P%=(V1–V3)/ (V2–V3)×100%[12],每组样本平行测试3次,取平均值。
1.2.5 吸水膨胀率测定将敷料切成合适的大小,使每个敷料的重量均在40 mg左右,称质量记为m0,浸没在37 ℃的0.01 mol/L PBS (pH 7.4)中1 h,取出后称质量,记为m1,吸水率W%就按下列公式计算:W%= (m1–m0)/m0×100%[12],每组样本平行测试3次,取平均值。
1.2.6 扫描电镜(SEM)分析将敷料切成约1 cm×1 cm,厚约5 mm,横截面朝上,用导电双面胶将敷料粘在金属托架上,喷金后在20 kV的加速电压下观察支架结构。
1.2.7 体外全血凝血测定抽取新鲜抗凝全血5 mL,加入0.5 mL的0.1 mol/L氯化钙溶液,充分混匀备用。每组取5个样品,将样品剪成规格为1.5 cm×1.5 cm,厚度为1 cm后,分别放入不同试管中,于37 ℃保温。取已准备好的抗凝人全血1 mL加入试管,使敷料充分浸润血液,将试管放入恒温37 ℃摇床振荡,每组的5个样品分别于1 min、2 min、5 min、10 min和15 min从恒温摇床取出后放入新的试管,向新试管中加入10 mL去离子水并保持5 min,将敷料中未凝固的红细胞洗出来,最后收集试管中的洗液,用分光光度计测定洗液吸光度(波长=540 nm)。每组样品每个观测点设置3个平行样。
1.2.8 生长因子释放测定将含有PRP的4组敷料(1 cm×1 cm,厚约5 mm)浸泡在无水乙醇中30 min,用PBS溶液(pH 7.4)冲洗3次后将敷料孵育在1 mL PBS溶液(pH 7.4,含有0.1%叠氮化钠)中,孵育过程保持37 ℃恒温,在1 h、3 h、5 h、7 h、24 h、72 h、168 h时间点取出PBS溶液,并在?20 ℃中冻存,等孵育结束后用ELISA试剂盒检测PDGF-BB与VEGF的含量。
1.2.9 大鼠体内止血测定取15只SD大鼠,随机分成5组,每组3只,大鼠体重控制在220–250 g。将大鼠仰卧固定于手术台后,腹腔注入2%戊巴比妥钠(50 mg/kg)。待大鼠麻醉后,于腹部中部处做一个3 cm横向切口,暴露胸腹壁浅静脉并剪断,自由流血3 s后将已称重的敷料(重量记作m1)覆盖于伤口处并轻轻按压,同时开始计时,前30 s每10 s观察1次创面出血情况,后30 s后每5 s观察1次创面出现情况,并记录止血时间,伤口停止出血后精确称量各组敷料重量(重量记作m2),并计算出血量,出血量=m1–m2。
1.2.10 统计学分析实验数据用

2 结果与分析2.1 敷料的孔隙分析敷料表面的微结构(如孔隙率、孔隙分布等)会影响材料吸收伤口血量[13]以及PRP中生长因子的释放速度[14]。从表 1中可以看出CS组的孔隙率最低,在CS敷料中引入PRP后对敷料的孔隙率无明显提高。加入丝素蛋白后,敷料的孔隙率有显著增加,PRP/CS-SK-1:1组敷料的孔隙率最高,约为86%。从SEM图(图 1)中也可看出,未加入丝蛋白的两组,CS组与PRP/CS-SK-1:0组(图 1A与图 1E)的孔隙表现虽有序均匀,但孔径分布不均匀。在敷料中加入丝素蛋白后,当壳聚糖与丝素蛋白的体积配比为1:3时(图 1D),敷料的孔隙表现不连贯,孔结构塌陷,这种孔隙会导致敷料蓬松易碎,但调节两者的体积配比为1:1后(图 1C),孔隙分布有序,结构紧密,具有此类孔结构的敷料的韧性会更高,同时有利于物理堵塞创伤口,促进止血,这可能是因为在支架中丝素蛋白的聚集态结构以无定型结构为主,在冷冻过程中,丝素蛋白溶液中丝素分子会自组装成片层,会在一定程度上影响孔隙结构,与壳聚糖复合后,壳聚糖与丝素蛋白发生了分子间的相互作用,促进丝素蛋白结构由无定型结构向β-折叠结构转变,使复合材料的孔结构更稳定[15]。
表 1 不同敷料的孔隙率测定结果Table 1 The porosity results of different wound dressings
| Group | CS | PRP/CS-SK-1:0 | PRP/CS-SK-1:3 | PRP/CS-SK-3:1 | PRP/CS-SK-1:1 |
| Porosity (%) | 71.70±4.56 | 72.04±5.03 | 78.67±3.21* | 74.72±5.28* | 86.83±3.84* |
| ????* P < 0.05. | |||||
表选项
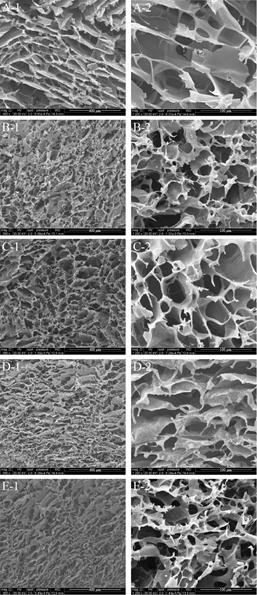 |
| 图 1 敷料电镜图(A: PRP/CS-SK-1:0敷料;B: PRP/CS-SK-3:1敷料;C: PRP/CS-SK-1:1敷料;D: PRP/CS-SK-1:3敷料;E: CS敷料) Fig. 1 The SEM images of dressings. (A) PRP/CS-SK-1:0 dressings. (B) PRP/CS-SK-3:1 dressings. (C) PRP/CS-SK- 1:1 dressings. (D) PRP/CS-SK-1:3 dressings. (E) CS dressings. |
| 图选项 |
2.2 敷料吸水性能分析敷料的吸水性能与支架的亲水性紧密相关,属于止血材料的物理特性之一。当材料按压在伤口上时,吸水性强的材料会吸收血液中的水分,导致血液黏度增加从而促进血小板聚集,实现血液凝固。表 2结果说明不同配比制备的敷料在吸水率上表现出较为明显的不同。CS组敷料与PRP/CS-SK-1:0组敷料相比,吸水率无明显变化,说明只引入PRP对敷料的吸水性无明显影响。在敷料中添加丝素蛋白后,敷料的吸水率提高,其中丝素蛋白溶液体积比越高,敷料吸水率越高,这可能是丝素蛋白中含有赖氨酸、组氨酸和精氨酸等含有亲水性基团的侧链氨基酸残基[16],因此加入丝素蛋白会提高敷料的吸水性能。其次根据孔隙分布结果知道,丝素蛋白的加入会提高敷料的孔隙率,使材料有更多的孔去吸收储存水分,从而提高材料的吸水能力。
表 2 壳聚糖与丝素蛋白不同比例的敷料吸水率测定结果Table 2 The water absorption results of different wound dressings
| Group | CS | PRP/CS-SK-1:0 | PRP/CS-SK-1:3 | PRP/CS-SK-3:1 | PRP/CS-SK-1:1 |
| Water absorbtion (%) | 1 015±27 | 1 037±30 | 1 563±136* | 1 317±62* | 1 474±114* |
| ????* P < 0.05. | |||||
表选项
2.3 敷料体外全血凝固分析图 2结果中纵坐标为血红蛋白的紫外吸光度值,吸光度越高,说明去离子水洗出来未凝固的红细胞数越多,相应的材料的凝血效果越差。在止血初期(前2 min),PRP/CS-SK-1:0与CS组的吸光度值差异不明显,说明两种材料的快速止血效果表现相近,但材料处理5 min后只引入了PRP的壳聚糖敷料的吸光度值明显低于CS组,说明引入了PRP的敷料开始表现出更好的凝固性,这可能是因为在止血初始阶段,两组敷料对血液中的水分吸收速度表现相似,从而导致红细胞发生凝块速度相似,使两组敷料在止血初期表现出相似的凝固效果,但在后期PRP中高浓度的凝血因子促进了敷料的全血凝固能力[17]。在敷料中添加丝素蛋白后,敷料的吸光度值明显低于未加入丝素蛋白的两组,说明加入丝素蛋白后会进一步提高敷料的凝血性,并且由图中结果发现,当壳聚糖与丝素蛋白配比为1:1时,敷料在各个时间点的吸光度值均为最低,表明敷料的凝血性最好,并且在15 min内血液几乎全部凝固,这是因为丝素蛋白的引入会提高敷料吸水性,敷料吸收血液中的水分后使血液变得黏稠,红细胞发生凝块,从而实现凝血效果。
 |
| 图 2 不同敷料的体外全血凝固结果 Fig. 2 In vitro whole blood coagulation results of different dressings. |
| 图选项 |
2.4 体内止血效果本试验采用大鼠胸腹壁浅静脉模型观察敷料体内止血情况。5组敷料的出血组织黏附性均表现好,敷料遇血液后,迅速吸血并变柔软。由表 3结果得知加入PRP的敷料组的止血时间与止血量均小于CS组,说明加入PRP会提高止血效果,尽管加入PRP不会对敷料的结构产生显著影响,但由于PRP是全血经离心后得到的血小板浓缩物,与普通血小板相比,其凝血因子的浓度增加,使凝血酶原时间和凝血活酶时间缩短,减少失血量。加入丝素蛋白后,敷料的止血时间进一步缩短,失血量进一步减少且与CS组相比均具有统计学差异,这与体外全血凝固时间试验结果基本一致,其中PRP/CS-SK-1:1组止血用时最短,仅需48 s,失血量最少。
表 3 不同敷料的止血时间与失血量测定结果Table 3 The hemostatic time and blood loss results of different dressings
| Group | CS | PRP/CS-SK-1:0 | PRP/CS-SK-1:3 | PRP/CS-SK-3:1 | PRP/CS-SK-1:1 |
| Hemostasis time (s) | 132±17 | 104±14 | 98±7* | 81±56* | 48±7* |
| Blood loss (g) | 0.257 3±0.03 | 0.188 3±0.02* | 0.174 9±0.07* | 0.168 5±0.20* | 0.151 1±0.10* |
| ????* P < 0.05. | |||||
表选项
2.5 敷料生长因子释放PRP是一种高成本的生物制品,因此需要基材促使PRP中的生长因子实现持续性释放,提高释放效率。图 3与图 4显示PDGF-BB以及VEGF从负载了PRP的4组敷料中的释放结果。对于PDGF-BB因子的释放控制,PRP/CS-SK-1:1组表现最佳,并在72 h实现持续性释放。其余3组对PDGF-BB因子的释放均显示出了较为明显的爆裂释放,PRP/CS-SK-1:0组、PRP/CS-SK-1:3与PRP/CS-SK-3:1这3组敷料在7 h的释放量就分别达到了528 pg/mL、554 pg/mL与601 pg/mL (3组释放量无显著统计学差异),而PRP/CS- SK-1:1组仅为426 pg/mL。对于VEGF因子的释放控制,在释放7 h时,PRP/CS-SK-1:0组的释放量已达到266 pg/mL,而PRP/CS-SK-1:1组最低,仅为210 pg/mL,但与其余3组无显著性差异。这可能是因为生长因子的释放情况与材料的结构、表面电性及生长因子与材料间的疏水作用等多个因素有关。PRP/CS-SK-1:1组敷料的爆裂释放情况的减弱可能是因为此体积配比的敷料孔隙紧密,更紧密的孔结构会减少孔径大小,造成更长的扩散通道,从而减少释放速度与爆裂现象[18]。此外,材料的表面电性会影响生长因子的释放速度,生长因子与材料之间的静电跨度越小,初始的爆裂释放情况越不显著[19]。本研究中丝素蛋白的引入可能会改变敷料表面电性,壳聚糖在pH 7.4的PBS中带正电,丝素蛋白在此条件下带负电[20],而VEGF与PDGF-BB两种生长因子在pH 7.4的环境下等电点(pI)分别为8.5与9.8,均为正电,由此推测丝素蛋白的引入可能会导致敷料正电荷的减少;此外两种生长因子的多肽结构有差别,与同一种敷料间的疏水作用也可能不同,从而导致不同敷料的生长因子的初始爆裂释放情况的不同以及两种生长因子在同一种敷料中出现了不一样的释放规律。本课题组会在后续的研究中进一步验证上述推测,并会从体外细胞培养和动物实验等多方面考察丝素蛋白的引入对负载PRP的壳聚糖敷料中生长因子释放的影响以及在促伤口愈合作用上的影响,从而筛选出能够同时实现快速止血与有效促伤口愈合的新型敷料。
 |
| 图 3 不同敷料的PDGF-BB的释放动力学结果 Fig. 3 The cumulative release kinetics of PDGF-BB of different dressings. |
| 图选项 |
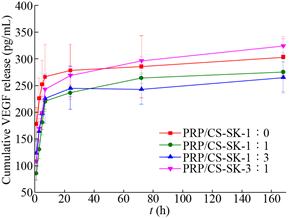 |
| 图 4 不同敷料的VEGF释放动力学结果 Fig. 4 The cumulative release kinetics of VEGF of different dressings. |
| 图选项 |
本研究制备的新型敷料主要包括壳聚糖、丝素蛋白与人源性富血小板血浆3种原料,通过传统且操作简单的冻干燥法制备得到。该敷料中的壳聚糖与丝素蛋白是目前生物敷料中最为常见的原料之一,易获取成本低,且国内外已有大量文献对如何制备这两种原料的溶液进行了描述。同时,文中的新型敷料是利用从血液中心获取的健康献血者的全血来制备得到的同种异体富血小板血浆,而非从患者自身提取的自体富血小板血浆。与自体PRP相比,利用从已检查合格的全血中提取的同种异体PRP进行治疗不会受患者自身情况的限制(例如,若患者为糖尿病创面患者是不适合作为供血者的),同时可降低治疗时间成本。但人源性的PRP仍然属于高成本的生物制品之一,这样的高成本不仅在于人全血的珍贵性也在于实现标准化制备异体PRP的困难性,目前已有团队开始探讨如何建立同种异体PRP制备的标准化流程[21]。因此本研究通过引入丝素蛋白来实现PRP中生长因子的可持续性释放,提高该敷料的治疗有效性,并且通过上述试验结果,发现体积比例为1:1的PRP-壳聚糖/丝素蛋白敷料能表现出较好的快速止血能力,有望应用于战场或灾难急救现场。
3 结论在纯壳聚糖敷料中加入PRP后虽不会明显改善敷料的孔隙结构与吸水性,但体外全血凝血实验与大鼠体内止血实验结果均显示会提高壳聚糖敷料的止血性能。在PRP壳聚糖敷料中继续引入丝素蛋白,并且在壳聚糖溶液与丝素蛋白溶液的体积配比为1:1时,敷料具有致密的孔隙结构与较高的吸水性,体外全血凝血实验与大鼠体内止血实验也证明此比例敷料与其余几组敷料相比,具有更好的止血性。同时,壳聚糖与丝素蛋白体积配比1:1的敷料中对PDGF-BB的调控作用较为明显,但对VEGF因子爆裂释放的减少虽是4组中最大的,但与其余3组差异性不明显。因此,本试验构建的PRP/CS-SK-1:1敷料无论在止血性能还是对生长因子释放控制方面均具有一定的潜力,有望在体表或体内慢性伤口敷料领域得到广泛应用。
参考文献
| [1] | Achneck HE, Sileshi B, Jamiolkowski RM, et al. A comprehensive review of topical hemostatic agents: efficacy and recommendations for use. Ann Surg, 2010, 251(2): 217-228. DOI:10.1097/SLA.0b013e3181c3bcca |
| [2] | Busilacchi A, Gigante A, Mattioli-Belmonte M, et al. Chitosan stabilizes platelet growth factors and modulates stem cell differentiation toward tissue regeneration. Carbohydr Polym, 2013, 98(1): 665-676. DOI:10.1016/j.carbpol.2013.06.044 |
| [3] | Kutlu B, Ti?l? Ayd?n RS, Akman AC, et al. Platelet-rich plasma-loaded chitosan scaffolds: preparation and growth factor release kinetics. J Biomed Mater Res Part B: Appl Biomater, 2013, 101(1): 28-35. |
| [4] | Kojima K, Okamoto Y, Kojima K, et al. Effects of chitin and chitosan on collagen synthesis in wound healing. J Vet Med Sci, 2004, 66(12): 1595-1598. DOI:10.1292/jvms.66.1595 |
| [5] | Shen EC, Chou TC, Gau CH, et al. Releasing growth factors from activated human platelets after chitosan stimulation: a possible bio-material for platelet-rich plasma preparation. Clin Oral Implants Res, 2006, 17(5): 572-578. DOI:10.1111/j.1600-0501.2004.01241.x |
| [6] | Zhu MF, Wang K, Mei JJ, et al. Fabrication of highly interconnected porous silk fibroin scaffolds for potential use as vascular grafts. Acta Biomater, 2014, 10(5): 2014-2023. DOI:10.1016/j.actbio.2014.01.022 |
| [7] | Zhang WJ, Zhu C, Ye DX, et al. Porous Silk Scaffolds for delivery of growth factors and stem cells to enhance bone regeneration. PLoS ONE, 2014, 9(7): e102371. DOI:10.1371/journal.pone.0102371 |
| [8] | Ma Y, Li Z, Ran RL, et al. Research on application of silk in biomaterial field. Mater Rev A: Rev, 2018, 32(1): 86-92, 101 (in Chinese). 马艳, 李智, 冉瑞龙, 等. 蚕丝在生物医用材料领域的应用研究. 材料导报A:综述篇, 2018, 32(1): 86-92, 101. |
| [9] | Shahverdi S, Hajimiri M, Esfandiari MA, et al. Fabrication and structure analysis of poly (lactide-co-glycolic acid)/silk fibroin hybrid scaffold for wound dressing applications. Int J Pharm, 2014, 473(1/2): 345-355. |
| [10] | Technical operation procedures for blood stations (2019 edition)[EB/OL]. Technical operation procedures for blood stations (2019 edition) [EB/OL].[2019-05-01]. http://dev. csbtweb.org.cn/uploads/soft/190528/3_0946011701.pdf (in Chinese). 血站技术操作规程(2019版)[EB/OL].[2019-05-01]. http://dev.csbtweb.org.cn/uploads/ soft/190528/3_0946011701.pdf. |
| [11] | Ministry of Health of the PRC. GB/T 18469-2012 Quality requirements for whole blood and blood components[S]. Beijing: China Standards Press, 2012 (in Chinese). 中华人民共和国卫生部. GB/T 18469-2012全血及成分血质量要求[S].北京: 中国标准出版社, 2012. |
| [12] | Yang YD, Zhang WY, Fang GJ. Three-dimensional degradable porous scaffolds made by silk fibroin-chitosan composite. J Clin Rehabil Tissue Eng Res, 2009, 13(51): 10074-10078 (in Chinese). 杨亚冬, 张文元, 房国坚. 丝素-壳聚糖复合制作的三维可降解多孔支架. 中国组织工程研究与临床康复, 2009, 13(51): 10074-10078. DOI:10.3969/j.issn.1673-8225.2009.51.014 |
| [13] | Kanokpanont S, Damrongsakkul S, Ratanavaraporn J, et al. An innovative bi-layered wound dressing made of silk and gelatin for accelerated wound healing. Int J Pharm, 2012, 436(1/2): 141-153. |
| [14] | Uttarwar M, Aswath P. Fabrication of porous, drug-releasing, biodegradable, polymer scaffolds for sustained drug release. J Biomed Mater Res Part B: Appl Biomater, 2008, 87(1): 121-131. |
| [15] | Zhang XZ, Situ FM, Peng P, et al. Chitosan improves the crystallization of silk fibroin: a three-dimensional scaffold material with better mechanical stability. Chin J Tissue Eng Res, 2015, 19(12): 1858-1863 (in Chinese). 张霞只, 司徒方民, 彭鹏, 等. 加入壳聚糖改善丝素蛋白结晶性:力学稳定强度更好的三维支架材料. 中国组织工程研究, 2015, 19(12): 1858-1863. |
| [16] | Rockwood DN, Preda RC, Yücel T, et al. Materials fabrication from Bombyx mori silk fibroin. Nat Protoc, 2011, 6(10): 1612-1631. DOI:10.1038/nprot.2011.379 |
| [17] | Lacci KM, Dardik A. Platelet-rich plasma: support for its use in wound healing. Yale J Biol Med, 2010, 83(1): 1-9. |
| [18] | Wang XQ, Wenk E, Matsumoto A, et al. Silk microspheres for encapsulation and controlled release. J Control Release, 2007, 117(3): 360-370. DOI:10.1016/j.jconrel.2006.11.021 |
| [19] | King WJ, Krebsbach PH. Growth factor delivery: how surface interactions modulate release in vitro and in vivo. Adv Drug Deliv Rev, 2012, 64(12): 1239-1256. DOI:10.1016/j.addr.2012.03.004 |
| [20] | Wenk E, Merkle HP, Meinel L. Silk fibroin as a vehicle for drug delivery applications. J Control Release, 2011, 150(2): 128-141. DOI:10.1016/j.jconrel.2010.11.007 |
| [21] | Lv M. The study of standardized preparation of the allogeneic platelet-rich plasma[D]. The Fourth Military Medical University, 2013 (in Chinese). 吕敏.同种异体富血小板血浆标准化制备的研究[D].第四军医大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-90032-1013033714.htm |
