
 , 陈磊1,2,3,4, 张卫文1,2,3,4,5
, 陈磊1,2,3,4, 张卫文1,2,3,4,5 1. 天津大学 化工学院 合成微生物学实验室,天津 300072;
2. 教育部系统生物工程重点实验室,天津 300072;
3. 教育部合成生物学前沿科学中心,天津 300072;
4. 天津化学化工协同创新中心,天津 300072;
5. 天津大学生物安全战略研究中心,天津 300072
收稿日期:2020-02-28;接收日期:2020-04-03
基金项目:国家自然科学基金(No. 31901017), 国家重点研发计划(Nos. 2019YFA09004600, 2018YFA0903600, 2018YFA0903000)资助
摘要:发展“液态阳光”被认为是解决化石燃料枯竭的关键技术之一。β-石竹烯是高性能的萜烯化合物,作为潜在的航空高密度燃料备受瞩目。新型光合蓝细菌底盘聚球藻UTEX 2973倍增时间短至1.5 h且耐受高温高光,利用光和CO2合成β-石竹烯具有很大的发展前景。为此,文中在聚球藻UTEX 2973中通过构建β-石竹烯合成途径、优化相关关键合酶、增强前体供应等一系列策略实现了在摇瓶中约121.22 μg/L β-石竹烯的合成(96 h)。在此基础上,通过培养条件的优化实现在光生物反应器中进行高密度培养,最终β-石竹烯产量达到约212.37 μg/L (96 h)。这是目前报道的蓝细菌底盘中β-石竹烯的最高产量,为未来利用光和CO2直接合成高密度燃料打下基础。
关键词:聚球藻UTEX 2973高密度燃料液态阳光β-石竹烯高密度培养
Light and carbon dioxide-driven synthesis of high-density fuel in Synechococcus elongates UTEX 2973
Shubin Li1,2,3,4, Tao Sun1,5

 , Lei Chen1,2,3,4, Weiwen Zhang1,2,3,4,5
, Lei Chen1,2,3,4, Weiwen Zhang1,2,3,4,5 1. Laboratory of Synthetic Microbiology, School of Chemical Engineering & Technology, Tianjin University, Tianjin 300072, China;
2. Key Laboratory of Systems Bioengineering, Ministry of Education of China, Tianjin 300072, China;
3. Frontier Science Center for Synthetic Biology, Ministry of Education of China, Tianjin 300072, China;
4. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin 300072, China;
5. Center for Biosafety Research and Strategy, Tianjin University, Tianjin 300072, China
Received: February 28, 2020; Accepted: April 3, 2020
Supported by: National Natural Science Foundation of China (No. 31901017), National Key Research and Development Program of China (Nos. 2019YFA09004600, 2018YFA0903600, 2018YFA0903000)
Corresponding author: Tao Sun. Tel/Fax: +86-22-27406394; E-mail: tsun@tju.edu.cn.
Abstract: Development of "liquid sunshine" could be a key technology to deal with the issue of fossil fuel depletion. β-caryophyllene is a terpene compound with high energy density and has attracted attention for its potential application as a jet fuel. The high temperature and high light-tolerant photosynthetic cyanobacterium Synechococcus elongatus UTEX 2973 (hereafter Synechococcus 2973), whose doubling time is as short as 1.5 h, has great potential for synthesizing β-caryophyllene using sunlight and CO2. In this study, a production of ~121.22 μg/L β-caryophyllene was achieved at 96 h via a combined strategy of pathway construction, key enzyme optimization and precursor supply enhancement. In addition, a final production of ~212.37 μg/L at 96 h was realized in a high-density cultivation. To our knowledge, this is the highest production reported for β-caryophyllene using cyanobacterial chassis and our study provide important basis for high-density fuel synthesis in cyanobacteria.
Keywords: Synechococcus elongates UTEX 2973high-density fuelliquid sunshineβ-caryophyllenehigh-density cultivation
过去的两个世纪,化石燃料为人类的经济带来了指数型增长,而如今我们正面临着这一增长带来的后果——气候变化、环境恶化、能源危机以及在未来大约100年的时间内因化石燃料的枯竭所带来的一系列问题。中国科学院院长、中科院院士白春礼研究员等在Joule杂志提出:在化石燃料枯竭的未来,“液态阳光”可能是解决问题的关键[1]。“液态阳光”源于丰富的阳光、CO2和水,属于可再生绿色液态燃料。一方面,利用太阳能可以减少我们对化石燃料的依赖,它是最丰富的能源资源,可以满足人类未来的能源需求;另一方面,2017年全球燃烧化石燃料产生的CO2排放量达到33亿t且这一数据在2018年又增长了2%,是CO2被自然吸收回陆地和海洋速率的两倍[1]。因此,应用合成生物学开展CO2的高效资源化利用,可同时缓解迫切的环境和能源压力,对我国经济、社会的可持续发展具有重大意义。
蓝细菌(Cyanobacteria),也称蓝藻,是唯一可进行放氧光合作用的原核生物,在地球化学元素循环以及生态环境中具有重要作用[2]。经由光合作用,每年大约有2 580亿t CO2被固定为有机物,而仅海洋中的两类蓝细菌——聚球藻和原绿球藻就可占到全球固碳的20%以上[3]。由于光合蓝细菌具有高效捕捉太阳能并固定CO2的特性,应用合成生物学技术开发其作为“光驱动的自养型细胞工厂”生产生物燃料和化学品的研究近年来也引起广泛的关注;迄今为止,已有几十种燃料和化学品包括乙醇、正丁醇、异丁醛、异戊二烯及3-羟基丁酸等的生物合成途径得以在多种模式蓝细菌中构建表达,实现了从CO2到这些产品的直接生物合成,同时达到了CO2的利用及大宗化学品的绿色制造的目的,为社会的可持续发展提供了新思路,也为发展“液态阳光”技术起到重要的推动作用[4-8]。
β-石竹烯(β-caryophyllene,简称为石竹烯)是一种双环倍半萜类化合物,分子式为C15H24,由于其有较高的能量密度和燃烧热,因此被列为下一代航空燃料[9-10]。随着“微生物细胞工厂”的兴起,以微生物作为宿主生产化合物受到了更多的关注,为石竹烯的合成提供了新的思路。早在2011年,有研究者在工程菌内实现了石竹烯的异源生物合成[11]。通过过表达黄花蒿Artemisia annua来源的石竹烯合酶(QHS1)在光合蓝细菌集胞藻PCC 6803中实现了(46.4±2.9) μg/L/week的石竹烯产量[12]。
近几年新分离的聚球藻Synechococcus elongates UTEX 2973,它能在41 ℃、1 500 μmol photons/(m2·s)以及3% CO2的情况下达到最快1.5 h的倍增时间,这一生长速度基本与酿酒酵母一致[13-14],远远超过目前几种模式蓝细菌。同时聚球藻UTEX 2973的基因组与被广泛研究的聚球藻Synechococcus elongates PCC 7942有99.8%的相似度,仅存在55个单碱基突变或插入缺失以及一个大的染色体翻转,这为聚球藻UTEX 2973中研究工作的开展奠定了很好的基础。同时,作为微生物细胞工厂,通过简单导入蔗糖转运蛋白即可得到与目前最好的蔗糖生产者相似的蔗糖生产速率;这体现了聚球藻UTEX 2973作为微生物细胞工厂的潜力。在本课题组先前的研究中,通过将编码Tfp菌毛组装蛋白的pilN导入聚球藻UTEX 2973,成功实现了聚球藻UTEX 2973的自然转化,为聚球藻UTEX 2973验证了包括超强启动子Pcpc560、PpsbA2、PpsbA3,诱导型启动子Plac、Ptrc等一系列启动子;验证基于核糖开关theoE*(riboswitch-E*)、theo/yitJ和xpt(C74U)/metE的诱导/抑制系统菌株;验证基于Hfq-MicC的sRNA工具,并在聚球藻UTEX 2973中对其进行了进一步优化,用于对内源基因的可诱导控制[15],使得在聚球藻UTEX 2973中进行复杂的代谢工程改造成为可能。
本研究中(图 1),为实现聚球藻UTEX 2973中石竹烯的高效合成,首先在聚球藻UTEX 2973中测试了一系列不同来源的石竹烯合酶,发现在仅过表达石竹烯合酶的情况下无法检测到石竹烯的存在,通过引入来自大肠杆菌Escherichia coli的IspA以及北美冷杉Abies grandis的GPPS2初步证实了在聚球藻UTEX 2973中合成石竹烯的可行性,并确定拟南芥Arabidopsis thaliana来源的TPS21在聚球藻UTEX 2973中效果最佳。随后通过进一步引入来自酿酒酵母Saccharomyces cerevisiae的异戊烯基二磷酸δ-异构酶(IDI1)大幅提高了石竹烯的产量。在此基础上进一步尝试分别过表达ispA、gpps以及大肠杆菌、酿酒酵母和聚球藻UTEX 2973内源的idi1。得出酿酒酵母来源的IDI1sc对于聚球藻UTEX 2973中石竹烯合成的关键作用,最后通过优化光生物反应器中的光照、pH实现了在光生物反应器中聚球藻UTEX 2973的高密度培养和石竹烯的高效合成。
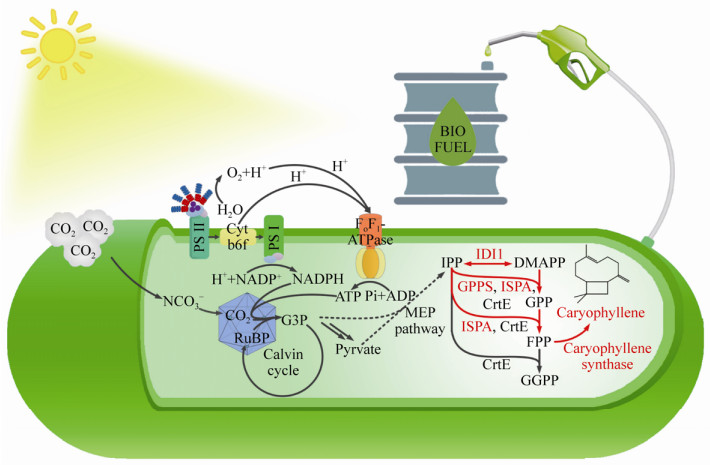 |
| 图 1 以聚球藻UTEX 2973为细胞工厂光合自养合成石竹烯的模型(其中红色标注的代谢途径为新引入或强化途径) Fig. 1 Schematic model of photosynthetic autotrophic synthesis of caryophyllene using S. elongates UTEX 2973, in which the metabolic pathways marked in red were introduced or enhanced. |
| 图选项 |
1 材料与方法1.1 实验材料1.1.1 菌株与质粒本实验用到的野生型聚球藻UTEX 2973及大肠杆菌Helper[16]由中国科学院青岛生物能源与过程研究所吕雪峰研究员惠赠[17]。大肠杆菌DH5α、大肠杆菌HB101以及聚球藻UTEX 2973由实验室保存。大肠杆菌DH5α用于质粒构建,大肠杆菌HB101用于作为接合转移质粒供体,大肠杆菌Helper用于接合转移辅助菌。pSIII-tps21、pSIII-tps23、pSIII-cscs和pSIII-qhs1为本实验构建,基于pBR322[18]的于聚球藻UTEX 2973中性位点NSIII处的整合型载体,用于筛选不同来源的石竹烯合酶,基因tps21 (NP_197784.2)[19]、tps23 (ABY79213)[20]、cscs (AAU05952.1)[21]、qhs1 (AAL79181)[22]经过对聚球藻UTEX 2973序列优化,由金维智公司(中国,苏州)合成。pSI-ispA、pSI-gpps-ispA、pSI-gpps-ispA-idi1sc为本实验构建,基于pBR322于NSI的整合型载体,以探究自萜烯前体DMAPP和IPP至FPP合成的途径对于石竹烯产量的影响,GPPS (AF513112.1)由金维智公司合成,IspA (NP_414955)扩增自大肠杆菌MG1655,IDI1sc (NP_015208)扩增自酿酒酵母BY4741。pSII-gpps、pSII-ispA、pSII-idi1sc、pSII-idi1se以及pSII-idi1ec为本实验构建,基于pBR322于NSII位点的整合型载体,用以探究GPPS、IspA、IDI1sc表达量及不同物种来源的IDI1对于石竹烯产量的影响,idi1ec扩增自大肠杆菌MG1655,idi1sc扩增自酿酒酵母BY4741,idi1se扩增自聚球藻UTEX 2973。
1.1.2 培养基大肠杆菌培养采用标准LB培养基[23],培养根据对应质粒的抗性标记添加卡那霉素50 μg/mL、氯霉素50 μg/mL、壮观霉素100 μg/mL以及氨苄青霉素200 μg/mL (抗生素浓度为终浓度)。聚球藻UTEX 2973培养采用标准BG11培养基[24],对于高密度培养用培养基额外添加1 g/L HEPES,用于调整并维持pH至8.5,固体培养基额外添加Na2S2O3 3 g/L以及1.5%琼脂粉,灭菌后添加单独灭菌的CaCl2·2H2O (36 g/L) 1 mL/L以及柠檬酸铁铵(6 g/L) 1 mL/L;蓝细菌突变株根据对应抗性标记添加卡那霉素25 μg/mL、氯霉素25 μg/mL、壮观霉素50 μg/mL。
1.1.3 试剂与仪器细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。质粒小提试剂盒、凝胶纯化回收试剂盒,PCR纯化试剂盒、2×Taq Master Mix (Dye Plus)、Phanta Max Super-Fidelity DNA Polymerase以及ClonExpress MultiS One Step Cloning Kit购自南京诺唯赞生物科技有限公司。限制性内切酶、DNA连接酶购自Thermo Fisher Scientific,引物合成与测序由金维智公司完成。
蓝细菌和大肠杆菌平板的培养在上海博讯SPX-250B-G光照培养箱中进行,液体菌株的培养在天津欧诺HNYC-202T叠加式光照摇床中进行。蓝细菌的高密度培养在配有可调光LED灯壳的Eppendorf BioFlo/CelliGen 310 7.5 L发酵罐中进行。
1.2 质粒与突变株构建1.2.1 菌株构建质粒提取、PCR纯化、胶回收等具体操作根据对应说明书进行。本实验中所用菌株见表 1,克隆所用引物见网络版中附件,菌株命名为StrainXYZ,其中X为NSI位点转入质粒的序号,Y为NSII位点转入质粒的序号,Z为NSIII位点转入质粒的序号,0代表该位点未转入质粒。
表 1 研究中用到的菌株Table 1 Strains used in this research
| Strains | Genotype |
| Strain002 | NSIII::Ppsba3-tps21-kanR in WT |
| Strain003 | NSIII::Ppsba3-tps23-kanR in WT |
| Strain004 | NSIII::Ppsba3-cscs-kanR in WT |
| Strain005 | NSIII::Ppsba3-qhs1-kanR in WT |
| Strain202 | NSI::Ppsba1-ispA-speR in Strain002 |
| Strain203 | NSI::Ppsba1-ispA-speR in Strain003 |
| Strain204 | NSI::Ppsba1-ispA-speR in Strain004 |
| Strain205 | NSI::Ppsba1-ispA-speR in Strain005 |
| Strain302 | NSI::Ppsba1-ispA-RBS-gpps-speR in Strain002 |
| Strain303 | NSI::Ppsba1-ispA-RBS-gpps-speR in Strain003 |
| Strain304 | NSI::Ppsba1-ispA-RBS-gpps-speR in Strain004 |
| Strain305 | NSI::Ppsba1-ispA-RBS-gpps-speR in Strain005 |
| Strain402 | NSI::Ppsba1-ispA-RBS-gpps-Ptrc-idi1sc-speR in Strain002 |
| Strain403 | NSI::Ppsba1-ispA-RBS-gpps-Ptrc-idi1sc-speR in Strain003 |
| Strain404 | NSI::Ppsba1-ispA-RBS-gpps-Ptrc-idi1sc-speR in Strain004 |
| Strain405 | NSI::Ppsba1-ispA-RBS-gpps-Ptrc-idi1sc-speR in Strain005 |
| Strain422 | NSII::Pcpc560-gpps-cmR in Strain402 |
| Strain432 | NSII::Pcpc560-ispA-cmR in Strain402 |
| Strain442 | NSII::Pcpc560-idi1sc-cmR in Strain402 |
| Strain352 | NSII::Pcpc560-idi1ec-cmR in Strain302 |
| Strain362 | NSII::Pcpc560-idi1se-cmR in Strain302 |
| Strain342 | NSII::Pcpc560-idi1sc-cmR in Strain302 |
表选项
1.2.2 聚球藻UTEX 2973的转化根据先前报道的研究[16],对聚球藻UTEX2973进行了优化。将带有pRL443和pRL623质粒的大肠杆菌HB101,即Helper,和带有目标质粒的大肠杆菌培养过夜,然后以1︰50 (V/V)的比例将其转移到含有合适抗生素的新鲜LB培养基中。当细胞生长到对数期(OD600约为0.5)时,将2 mL每种大肠杆菌菌株离心后收集菌体,并用1 mL新鲜(LB)培养基洗涤2次,以去除所有抗生素,然后重悬于0.1 mL LB培养基中,混合在一起,并孵育30 min。将1 mL处于对数生长期的聚球藻UTEX 2973 (OD750约为0.5)培养物离心并重悬于0.2 mL BG11培养基中(当转化的菌株培养基含有抗生素时,需要再洗涤2次)。然后将样品与上述大肠杆菌悬浮液混合并温育30 min。将混合物涂布在铺有无菌滤膜(孔径为0.45 μm)的含5% (V/V) LB的BG11琼脂平板上。在大约100 μmol photos/(m2·s)的光照强度下孵育24 h后,将滤膜转移到新的BG11琼脂平板上,根据需要添加抗生素(例如80 μg/mL氯霉素、50 μg/mL壮观霉素或50 μg/mL卡那霉素)。
1.3 聚球藻UTEX 2973细胞量及干重检测方法蓝细菌的细胞浓度通过BioTek ELx808酶标仪测量OD750得出。蓝细菌的干重通过将40 mL菌液冷冻干燥后称重得到。
1.4 蓝细菌中石竹烯检测方法将30 mL蓝细菌离心收集后在15 mL离心管中进行冷冻干燥,利用甲醇-氯仿-水萃取的方法[25]将菌体中的脂溶性物质提出,氯仿相通过GC-MS检测测定石竹烯的含量。GC-MS检测通过Agilent 7890进行,配有Agilent 5975质谱检测器以及HP-5MS (30 m × 0.25 mm × 0.25 μm film;Restek,Bellefonte,PA,USA)色谱柱。超高纯度氦气以1 mL/min的恒定流速用作载气,柱箱温度最初在60 ℃保持2 min,然后以3 ℃/min的速度升至150 ℃,再以30 ℃/min的速度升至280 ℃,最后在280 ℃保持5 min。质谱采用SIM模式,特定识别荷质比m/z为93、133、161、189、204的离子峰。
1.5 实时定量PCR (qRT-PCR)通过Direct-zol?RNA MiniPrep试剂盒(Zymo,CA,USA)提取总RNA。按照起始OD750为0.1将菌株接种于20 mL液体BG11培养基,光照培养48 h后,通过低温离心(7 000×g,5 min,4 ℃)收集培养物(体积×OD750=5),然后立即用液氮冷冻。根据制造商提供的方案进行RNA提取。按照制造商的规程(南京诺唯赞生物科技有限公司),使用HiScript Q RT SuperMix for qPCR (+gDNA wiper)合成cDNA。将每种稀释液1 μL (1%)用作qRT-PCR的模板。使用ChamQ SYBR qPCR Master Mix (High ROX Premixed) (南京诺唯赞生物科技有限公司)在10 μL反应体系中完成qPCR反应,其中包含5 μL混合物,2 μLddH2O,1 μL模板和1 μL每个引物。反应通过StepOnePlus?实时PCR系统(Applied Biosystems,CA,USA)进行。数据分析通过StepOnePlus分析软件(Applied Biosystems,CA,USA)和2–??Ct方法进行。编码RNase P亚基B的rnpB基因用作内参基因[15]。qRT-PCR所用引物见网络版中附件。
2 结果与分析2.1 石竹烯合酶在聚球藻UTEX 2973中的表达将4种不同来源的石竹烯合酶TPS21、TPS23、CSCS、QHS1与超强启动子Ppsba3[15]连接构建质粒pSIII-tps21、pSIII-tps23、pSIII-cscs以及pSIII-qhs1,分别转入蓝细菌UTEX 2973得到菌株Strain002、Strain003、Strain004和Strain005。分别培养96 h后(生长达到平台期)检测,发现均不能检出石竹烯含量。通过qRT-PCR检测4种石竹烯合酶均有较高的转录水平(图 2),推测几种石竹烯合酶均得到表达。
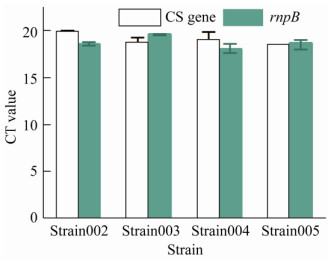 |
| 图 2 经qRT-PCR验证几种石竹烯合酶表达情况 Fig. 2 qRT-PCR validation of gene expression for several caryophyllene synthase. |
| 图选项 |
2.2 增强石竹烯合成前体FPP的积累通过分析蓝细菌聚球藻UTEX 2973内源的代谢途径,发现蓝细菌内源仅存在同时拥有3种催化活性酶酶牻牛儿基牻牛儿基焦磷酸合酶CrtE,能够催化DMAPP连续加成3个IPP依次合成牻牛儿基焦磷酸GPP、法尼基焦磷酸FPP以及牻牛儿基牻牛儿基焦磷酸GGPP[26],不能有效地萜烯合成途径的碳流截留在法尼基焦磷酸FPP以供给石竹烯的合成,因此尝试在聚球藻UTEX 2973中引入增强FPP合成的外源途径。
首先将pSI-ispA以及pSI-gpps-ispA分别转入菌株Strain002、Strain003、Strain004、Strain005中,获得菌株Strain202、Strain203、Strain204、Strain205以及Strain302、Strain303、Strain304、Strain305,以在聚球藻UTEX 2973中引入来自北美冷杉的GPP合酶GPPS或者同时引入大肠杆菌的双功能的FPP合酶IspA (能够将DMAPP与IPP反应生成GPP,并将GPP与IPP进一步反应生产FPP)。将这8个菌株培养96 h后检测产量发现在仅引入IspA的菌株中仅Strain202能够检测到很低的产量,为(6.141±0.483) μg/L。在引入GPPS和IspA的菌株中除Strain304外均能检测到产量,分别为(14.316±1.221) μg/L、(2.707±1.023) μg/L以及(5.218±0.759) μg/L,产量依然很低(图 3)。
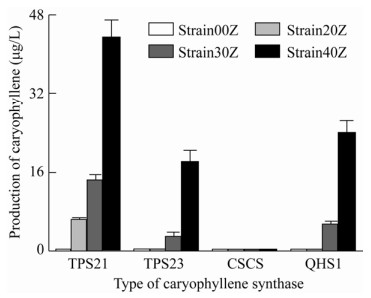 |
| 图 3 引入不同来源石竹烯合酶及不同前体合成途径的石竹烯产量(横坐标代表 4种合酶,菌株中“Z”代表引入不同的石竹烯合酶 Fig. 3 Production of caryophyllene after introducing caryophyllene synthase from different sources and different precursor synthesis pathways (x-axis represented the four kinds of synthase while "Z" in the strain represented the introduction of different synthase). |
| 图选项 |
在先前的研究中,经由MEP途径合成的DMAPP︰IPP的比例大概维持在1︰6左右[27],这对于萜烯合成来说可能是不利的,可以通过过表达idi1来改变这一比例[28],因此将pSI-gpps-ispA- idi1sc分别转入菌株Strain002、Strain003、Strain004和Strain005中分别得到菌株Strain402、Strain403、Strain404和Strain405,经过96 h的培养之后,仅有Strain404检测不到产量,其余菌株均检测到较高的产量,其中Strain402产量最高,达到了(43.373±3.496) μg/L。其他两个菌株的产量分别为(18.139±2.236) μg/L以及(23.726±2.683) μg/L (图 3)。结果表明:1)在蓝细菌中拟南芥来源的TPS21对于石竹烯的合成有较好的表现,此外黄瓜Cucumis sativus来源的石竹烯合酶没有表现出其活性;2)引入外源的FPP前体合成途径和平衡IPP和DMAPP对于石竹烯的合成有很大的促进。
2.3 探究前体合成途径限速酶,并进一步提高石竹烯前体FPP合成为了探究自DMAPP和IPP到FPP合成途径中的关键途径以及关键酶,在Strain402中通过分别引入pSII-gpps、pSII-ispA和pSII-idi1sc得到菌株Strain422、Strain432和Strain442。分别培养96 h后检测石竹烯产量(图 4),发现过表达该三步酶均对蓝细菌中石竹烯的产量有促进作用,其中过表达idi1sc对石竹烯产量帮助最大,使得石竹烯的产量达到了(121.233±9.732) μg/L,而过表达gpps或ispA仅可以使产量提高到(66.971±4.269) μg/L以及(63.221±7.623) μg/L,可以认为idi1是石竹烯合成中这几步反应中的关键限速酶。
 |
| 图 4 菌株Strain402中进一步过表达法尼基焦磷酸FPP合成途径中可能的限速酶ISPA、GPPS、IDI1后石竹烯产量 Fig. 4 The production of caryophyllene after further overexpression of possible rate-limiting enzymes IPA, GPPS, IDI1 in the synthesis pathway of farnesyl pyrophosphate FPP in strain Strain402. |
| 图选项 |
此外不同来源的IDI1可能有不同的催化速率并将DMAPP与IPP的比例控制在不同的程度[29],对于萜烯的合成可能会有不同的影响。因此分别尝试了来自大肠杆菌、酿酒酵母以及蓝细菌内源的IDI1,因此在菌株Strain302中分别转入pSII-idi1ec、pSII-idi1se和pSII-idi1sc,得到菌株Strain352、Strain362和Strain342,培养96 h检测石竹烯产量(图 5),发现来自酿酒酵母的IDI1sc效果最好,石竹烯产量达到(103.583±12.348)μg/L。
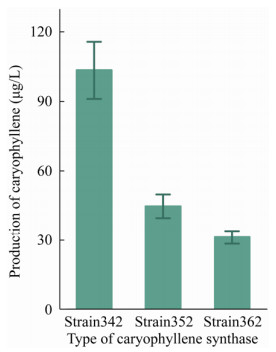 |
| 图 5 菌株Strain302中过表达不同来源idi1后石竹烯的产量 Fig. 5 The production of caryophyllene after overexpression of idi1 from different sources in strain Strain302. |
| 图选项 |
2.4 聚球藻UTEX 2973培养条件优化聚球藻UTEX 2973是一种最新发现的蓝细菌,能够在高温(41 ℃)高光(500 μmol photons/(m2·s))的情况下快速生长[30],但是其生长最适的温度、光照和pH等条件尚未见报道,因此为了优化聚球藻UTEX 2973的生长,获得更大的细胞密度和石竹烯产量,测试了其在不同温度、不同pH以及不同光照下的生长,确定最优的培养条件,为后续高密度培养生产石竹烯提供参考。
2.4.1 培养过程温度对于聚球藻UTEX 2973生长的影响聚球藻UTEX 2973是一种能够耐受相对高温的蓝细菌,适当提高温度应当有助于它的生长,因此测试了其在30 ℃、38 ℃、41 ℃、45 ℃的生长,发现在38 ℃和41 ℃生长速度较快(图 6),因此确定此为其培养温度。
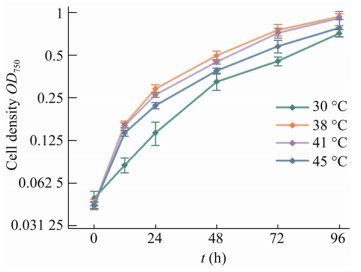 |
| 图 6 不同温度下聚球藻UTEX 2973的生长曲线 Fig. 6 Growth curves of S. elongates UTEX 2973 at different temperatures. |
| 图选项 |
2.4.2 pH对聚球藻UTEX 2973生长的影响培养基中的碳酸氢根离子是蓝细菌转运进入体内的CO2的主要形式[31],而培养基环境中的pH值会影响CO2在水中的溶解及解离[32],从而影响蓝细菌的固碳,因此不同pH可能对蓝细菌的生长产生不同的影响,测试了其在不同pH下的生长曲线,发现在pH为8.5时其生长速度最快(图 7),因此确定为其培养pH。
 |
| 图 7 不同pH下聚球藻UTEX 2973的生长曲线 Fig. 7 Growth curves of S. elongates UTEX 2973 at different pH. |
| 图选项 |
2.4.3 培养过程光照对于聚球藻UTEX 2973生长的影响光照是蓝细菌能量的来源,聚球藻UTEX 2973能够在相对高的光照(500 μmol photons/(m2·s))的情况下快速生长,最高甚至可耐受至2 400 μmol photons/(m2·s)[14],而光生物反应器中由于光程等因素与摇瓶实验不同,因此在光生物反应器测试了不同光照下蓝细菌的生长速度,在固定搅拌桨转速为600 r/min、通入空气速度为1 vvm的情况下,发现在能达到的最大光照1 000 μmol photons/(m2·s)蓝细菌的生长速度最快(图 8)。
 |
| 图 8 不同光照下聚球藻UTEX 2973在光生物反应器中的生长曲线 Fig. 8 Growth curves of S. elongates UTEX 2973 under different light densities in photobioreactor. |
| 图选项 |
2.5 光生物反应器中高密度培养生产石竹烯在上述确定的培养条件下,将Strain442在光生物反应器中培养,控制温度为38 ℃、pH为8.5、光照为1 000 μmol photons/(m2·s)、搅拌桨转速为600 r/min、通入空气速度为1 vvm的情况下,连续培养144 h,从48 h开始,每间隔24 h取样测定石竹烯产量,发现石竹烯产量在96 h时达到最大(212.37 μg/L)并在120 h后开始衰减(图 9)。
 |
| 图 9 聚球藻UTEX 2973突变株Strain442在光生物反应器中的生长和生产曲线 Fig. 9 Growth and production curves of S. elongates UTEX 2973 mutant Strain442 in photobioreactor. |
| 图选项 |
3 讨论在本研究中,我们成功在蓝细菌聚球藻UTEX 2973中构建了石竹烯的合成途径,并通过一系列途径和培养条件的优化使得石竹烯产量达到了212.37 μg/L。
萜烯化合物是一类重要的天然化合物,其代谢通路长且复杂,合成酶特异性差、选择性低、效率低,为萜烯在异源细胞工厂中合成造成了困难[33-34]。蓝细菌由于其与植物叶绿体的亲缘性近,为异源合成植物叶绿体内萜烯提供了基础,同时由于其能高效合成类胡萝卜素类四萜化合物,表明其MEP途径有相对高的效率[35],为萜烯等的合成提供了底物基础。
在合成生物学推动下,目前已在蓝细菌中实现了多种萜烯代谢物的生物合成,除石竹烯外,还有异戊二烯[36-37]、柠檬烯[38-39]、水芹烯[40]、鲨烯[41]、青蒿素前体紫穗槐二烯[42]及虾青素[43]等多种萜类化合物的研究。蓝细菌同其他多数原核生物相似,其体内缺乏MVA途径,为实现萜烯的高效合成,现有研究主要分为内源MEP途径的加强、外源MVA途径的引入、萜烯合酶筛选及培养条件优化等。首先,对于MEP途径而言,其入口端的1-脱氧-D-木酮糖5-磷酸合酶DXS与出口端的异戊烯基二磷酸δ-异构酶IDI被认为是限速步骤[36-44],加强内源DXS的表达量提高了萜烯前体供给,成功将异戊二烯的产量提高了20%[36],相比DXS,IDI1能够增加DMAPP/IPP的比例,从而更有利于萜烯的合成,过表达IDI能够使异戊二烯的产量获得两倍的提升[36]。其次,近期研究表明MEP途径中的4-羟基-3-甲基丁-2-烯-1-基二磷酸合酶IspG和2-C-甲基-D-赤藓糖醇-4-磷酸-胞嘧啶转移酶IspD同样可能是MEP途径的限速酶[36-45],其中对IspG的进一步强化使得异戊二烯产量提升了60%[36]。此外,也有研究者在蓝细菌体内引入了完整的MVA途径,以增加萜烯前体的供应[46]。但是,MVA途径相对较长,完整的导入对于蓝细菌来说相对困难;并且对于大部分萜烯合成途径来说,萜烯合酶选择性差、效率低,因此萜烯合酶的筛选和高表达对于萜烯合成也极为重要。在蓝细菌通过测试不同来源的萜烯合酶,并通过超强启动子Ppsba或者与高表达蛋白CpcB进行原位融合的方法以提高萜烯合酶的表达量,取得了不错的成果,其中利用超强启动子Ppsba已实现了柠檬烯产量30倍的提升[47],而利用CpcB与萜烯合酶融合提高萜烯合酶的表达量使得水芹烯产量提高了100倍[48]。另外由于蓝细菌生长和生产的唯一碳源是来自空气中的CO2溶解于培养基后解离的碳酸氢根,因此多数工作尝试了利用提高CO2浓度或者补加碳酸氢根的方式提高碳源的供给,从而提高产品的产量。例如在利用蓝细菌生产乙醇的研究中,通过将通入的空气换为5%的CO2使得摇瓶中乙醇的产量提高了4倍,达到了0.4 g/L[49]。
在本研究中,我们参考了很多早期研究的成果,例如选取了在聚球藻UTEX 2973中的强启动子Ppsba3控制各种石竹烯合酶的表达,并以此筛选了石竹烯合酶,发现不同种源的石竹烯合酶在蓝细菌中活性和功能差距较大,也显示了在萜烯类物质的合成中合成酶筛选的重要性。随后我们成功通过引入外源的FPP合成途径以及过表达酵母来源的IDI1sc在聚球藻UTEX 2973进一步提高了石竹烯的产量,其中引入FPP合成所需的GPPS和ISPA使得石竹烯产量提高到了可检测水平,证明了聚球藻UTEX 2973这一快速生长的蓝细菌作为“光合微生物细胞工厂”的可行性,进一步对于GPP合酶GPPS以及FPP合酶ISPA的过表达仅对产量有两倍左右的提升,而过表达酿酒酵母来源的异戊烯基二磷酸δ-异构酶IDI1sc能够使产量有6倍的提升,这与先前的研究结果相一致[36],同时我们也发现IDI1的来源同样对于萜烯的产量至关重要。最后我们通过在光生物反应器中进一步提高培养过程的光照和通气,严格控制生长过程的pH、温度等参数,使得聚球藻UTEX 2973的生物量有接近一倍的提升,同时石竹烯产量也得到了相应的提升,说明了培养条件尤其是光照强度和CO2的供给对于蓝细菌生物燃料产量的重要性,与先前的研究结果相一致[49],进一步证明了先前研究的结果[15-17]。
但是本研究中仅仅优化了从DMAPP和IPP到石竹烯的部分途径,并未引入/增强MVA/MEP途径的提高萜烯前体的供应或进行其他竞争途径的敲除,因此本研究中所得的石竹烯产量还有较大的提升空间。在接下来的工作中,可以通过加强内源MEP途径的限速酶,或引入外源的MVA途径,进一步提高前体供给,或者通过基因敲除、基因表达调控[50-52]等方式弱化FPP向GGPP以及鲨烯合成的碳流,以进一步提高FPP的供给。此外聚球藻UTEX 2973中有限的筛选标记数量限制了其连续多步改造的可能性,因此利用CRISPR等方式[53-54]进行连续多步无痕操作是在其体内进行复杂代谢工程的基础。
本研究中,通过光生物反应器实现了对于聚球藻UTEX 2973的高密度培养,但是其细胞干重依然只达到了(2.3±0.2) g/L,相比大肠杆菌[55]和酿酒酵母[56]等细胞工厂有较大的差距,这严重了限制了其作为“光合微生物细胞工厂”的应用,需要在未来的研究中得到进一步的提高。
利用光合微生物细胞工厂实现生物燃料及大宗化学品的生物合成,相比传统化学合成立体选择性好,反应过程温和,环境污染少;相比传统基于酿酒酵母等的微生物细胞工厂,不需要大量的糖和有机碳源作为底物,避免了传统微生物细胞工厂成本高、“与人争粮”的弊端。此外光合微生物细胞工厂仅利用太阳能作为能量来源,CO2作为底物即可合成生物燃料及大宗化学品,在化石燃料枯竭的未来,取之不尽的太阳能是最好的能量来源,而CO2是化石燃料燃烧和生物呼吸的必然产物,也是温室效应的主要原因。利用CO2作为碳源,既可以实现资源循环利用,又可以减缓温室效应。因此进一步优化以蓝细菌为底盘的微生物细胞工厂,选育更好的蓝细菌底盘细胞,以这种基于光合生物的“液态阳光”作为能源的主要发展方向之一,对于未来缓解能源紧缺实现可持续发展有着重要作用。
附表 研究中所用引物SupplementalTable Primers used in this research
| Primers | Sequence (5′–3′) |
| SPE-NSIUS-R | GGTGGGCCTTTCTGCGTTTATACTCGAGTCCCTGCTCGTCACG |
| SPE-F | GTATAAACGCAGAAAGGCCCACC |
| CPC-SPE-R | GGGACTCTTCTCTACAGGTGGATCCCGCACACCGTGGAAACGGAT |
| CPC-F | GGATCCACCTGTAGAGAAGAGTCCC |
| RBCL-NSIDS-F | TGATGTTCAACTTCGACAGCAGGCTTCTGGAGCAGGAAGATGTCG |
| RBCL-R | GCTGTCGAAGTTGAACATCA |
| AMP-NSIDS-R | AAACAAATAGGGGTTCCGCGCGCCGGGGCTGGCAGCTTAG |
| AMP-F | CGCGGAACCCCTATTTGTTT |
| PBR-NSIUS-F | TTCCATTCAGGTCGAGGTGGATCCGGCAGCCGGCGGAGCG |
| PBR-F | CCACCTCGACCTGAATGGAA |
| KAN-NSIIUDS-R | TCGATGAGTTTTTCTAACTCGAGGACCGATCAACCAGTCCCTC |
| KAN-F | CTCGAGTTAGAAAAACTCATCGA |
| CPC-KAN-R | AATCGAACTTTTGCTGAGTTGAAGGATCAGACCTGTAGAGAAGAGTCC |
| KAN-R | GCGGCCGCCTGATCCTTCAACTCA |
| RBCL-NSIIIDS-F | TCAACTTCGACAGCACTAGTGTCCCGTCGCCAGACGCGGG |
| AMP-NSIIIDS-R | AAACAAATAGGGGTTCCGCGATCACAGTCGGCGTCACGGC |
| PBR-NSIIIUS-F | TTCCATTCAGGTCGAGGTGGTCGAAACCCAAGCCACCCTC |
| CM-NSIIUS-R | CTTTCTGCGTTTATACTCGAGCCAGCGCGGTTGCTACCAAG |
| CM-F | CTCGAGTATAAACGCAGAAAGGCCC |
| CPC-CM-R | GGGACTCTTCTCTACAGGTGCGGCCGCATCGGATCCTACCTGTGACG |
| RBCL-NSIIDS-F | TGATGTTCAACTTCGACAGCACTAGTGGTTACCCGTGACGGGCTAC |
| AMP-NSIIDS-R | AAACAAATAGGGGTTCCGCGAGCTTGTCATCTGCCGGATG |
| PBR-NSIIUS-F | TTCCATTCAGGTCGAGGTGGGGATCCACGCATTTTAATTCTGGATG |
| SPE-R | CGCACACCGTGGAAACGGATG |
| SPE-NOT-PSBA1-F | ATCCGTTTCCACGGTGTGCGGCGGCCGCCTGGATTTAGCGTCTTCTAATCCAG |
| 2973PSBA1-R | ATCGATCTTGAGGTTGTAAAGGG |
| PSBA1-ISPA-F | TTTACAACCTCAAGATCGATATGGACTTTCCGCAGCAACTC |
| RBCL-ISPA-R | CTCCGACAATCCAAACACCGGTTTATTTATTACGCTGGATGATGTAG |
| RBS-ISPA-R | CATTTTTAACCTCCTTTAAATTATTTATTACGCTGGATGATGTAGTCCGC |
| RBS-GPPS-F | TTTAAAGGAGGTTAAAAATGGCCTATTCCGCCATGGCCACCATGGGCTACAAC |
| RBCL-GPPS-R | CCGACAATCCAAACACCGGTTTAATTCTGCCGGAAGGCCACATAATC |
| TRC-GPPS-R | ATTAATTGTCAACAGCTCATTTAATTCTGCCGGAAGGCCACATAATC |
| RBCL-IDI1SC-R | CCGACAATCCAAACACCGGTTTATAGCATTCTATGAATTTGCCTGTCATT |
| TRC-IDI1SC-F | ATGAGCTGTTGACAATTAATCATCCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAATGACTGCCGACAACAATAG |
| CPC-R | TGAATTAATCTCCTACTTGACTTTATGAGTTG |
| CPC-GPPS-F | TCAAGTAGGAGATTAATTCAATGGCCTATTCCGCCATGGCCACCATGGGCTACAAC |
| RBCL-F | ACCGGTGTTTGGATTGTCGG |
| CPC-IDI1SC-F | TCAAGTAGGAGATTAATTCAATGACTGCCGACAACAATAG |
| CPC-ISPA-F | TCAAGTAGGAGATTAATTCAATGGACTTTCCGCAGCAACTC |
| CPC-IDISE-F | TCAAGTAGGAGATTAATTCAATGAACTTCCCGATCGCAGC |
| RBCL-IDISE-R | CCGACAATCCAAACACCGGTTCAGCAGGGTCGCAAGACCC |
| CPC-IDIEC-F | TCAAGTAGGAGATTAATTCAATGCAAACGGAACACGTCAT |
| RBCL-IDI1EC-R | CCGACAATCCAAACACCGGTTTATTTAAGCTGGGTAAATGCAGAT |
| PSBA3-KAN-R | ATAACAAAACTTTGCGAATTCTGATCCTTCAACTCAGCAAAAGTTCGATT |
| 2973PSBA3-F | AATTCGCAAAGTTTTGTTATTATTAGC |
| 2973PSBA3-R | GATGTTTTGAGTCCAGTGAATT |
| PSBA3-TPS21-F | TTCACTGGACTCAAAACATCATGGGCTCGGAAGTCAACCG |
| RBCL-TPS21-R | CCGACAATCCAAACACCGGTCTAAATGGGGATGGTTTCGATC |
| PSBA3-TPS23-F | TTCACTGGACTCAAAACATCATGGCCGCCGATGAAGCGCG |
| RBCL-TPS23-R | CCGACAATCCAAACACCGGTCTAATCAATTAAATGGACGTATAAAG |
| PSBA3-QHS1-F | TTCACTGGACTCAAAACATCATGTCCGTGAAAGAAGAGAAAGTG |
| RBCL-QHS1-R | CCGACAATCCAAACACCGGTTTAAATGGGAATGGGATGCACCAATAAGG |
| PSBA3-CSCS-F | TTCACTGGACTCAAAACATCATGAGCAGCCACTTTCCGGC |
| RBCL-CSCS-R | CCGACAATCCAAACACCGGTCTAGAGATGTAAAGGATCAATCAGTAAAG |
| tps21-qRT-F | CGTGAGCGATGCTTGGAAAG |
| tps21-qRT-R | CTTGGGGTTGGTGTAGGCAT |
| tps23-qRT-F | CATGTCGTACAAGCGCGAAG |
| tps23-qRT-R | TGGGTGATGTCCATCCAAGC |
| cscs-qRT-F | AAACGGCAAGCTGAGTCGTA |
| cscs-qRT-R | AGAATCTGCGGGCAGTCAAA |
| qhs1-qRT-F | TGCGCCAGCAAGGTTTTTAC |
| qhs1-qRT-R | GGCCTCGTACAACTCCAACA |
表选项
参考文献
| [1] | Shih CF, Zhang T, Li JH, et al. Powering the future with liquid sunshine. Joule, 2018, 2(10): 1925-1949. DOI:10.1016/j.joule.2018.08.016 |
| [2] | Atia A, Saad A. Review on freshwater blue-green algae (Cyanobacteria): occurrence, classification and toxicology. Biosci Biotechnol Res Asia, 2014, 11(3): 1319-1325. DOI:10.13005/bbra/1522 |
| [3] | Li WKW. Primary production of prochlorophytes, cyanobacteria, and eucaryotic ultraphytoplankton: measurements from flow cytometric sorting. Limnol Oceanogr, 1994, 39(1): 169-175. DOI:10.4319/lo.1994.39.1.0169 |
| [4] | Gao XY, Sun T, Pei GS, et al. Cyanobacterial chassis engineering for enhancing production of biofuels and chemicals. Appl Microbiol Biotechnol, 2016, 100(8): 3401-3413. DOI:10.1007/s00253-016-7374-2 |
| [5] | Kanno M, Carroll AL, Atsumi S. Global metabolic rewiring for improved CO2 fixation and chemical production in cyanobacteria. Nat Commun, 2017, 8: 14724. |
| [6] | Anfelt J, Kaczmarzyk D, Shabestary K, et al. Genetic and nutrient modulation of acetyl-CoA levels in Synechocystis for n-butanol production. Microb Cell Fact, 2015, 14: 167. |
| [7] | Ku JT, Lan EI. A balanced ATP driving force module for enhancing photosynthetic biosynthesis of 3-hydroxybutyrate from CO2. Metab Eng, 2018, 46: 35-42. DOI:10.1016/j.ymben.2018.02.004 |
| [8] | Wang YP, Sun T, Gao XY, et al. Biosynthesis of platform chemical 3-hydroxypropionic acid (3-HP) directly from CO2 in cyanobacterium Synechocystis sp. PCC 6803. Metab Eng, 2016, 34: 60-70. DOI:10.1016/j.ymben.2015.10.008 |
| [9] | Meylemans HA, Quintana RL, Harvey BG. Efficient conversion of pure and mixed terpene feedstocks to high density fuels. Fuel, 2012, 97: 560-568. DOI:10.1016/j.fuel.2012.01.062 |
| [10] | Harvey BG, Meylemans HA, Gough RV, et al. High-density biosynthetic fuels: the intersection of heterogeneous catalysis and metabolic engineering. Phys Chem Chem Phys, 2014, 16(20): 9448-9457. DOI:10.1039/C3CP55349C |
| [11] | Reinsvold RE, Jinkerson RE, Radakovits R, et al. The production of the sesquiterpene β-caryophyllene in a transgenic strain of the cyanobacterium Synechocystis. J Plant Physiol, 2011, 168(8): 848-852. DOI:10.1016/j.jplph.2010.11.006 |
| [12] | Yang JM, Nie QJ. Engineering Escherichia coli to convert acetic acid to β-caryophyllene. Microb Cell Fact, 2016, 15: 74. DOI:10.1186/s12934-016-0475-x |
| [13] | Salari R, Salari R. Investigation of the best saccharomyces cerevisiae growth condition. Electron Phys, 2017, 9(1): 3592-3597. DOI:10.19082/3592 |
| [14] | Ungerer J, Lin PC, Chen HY, et al. Adjustments to photosystem stoichiometry and electron transfer proteins are key to the remarkably fast growth of the cyanobacterium Synechococcus elongatus UTEX 2973. MBio, 2018, 9(1): e02327-17. DOI:10.1128/mBio.02327-17 |
| [15] | Li SB, Sun T, Xu CX, et al. Development and optimization of genetic toolboxes for a fast-growing cyanobacterium Synechococcus elongatus UTEX 2973. Metab Eng, 2018, 48: 163-174. DOI:10.1016/j.ymben.2018.06.002 |
| [16] | Elhai J, Wolk CP. Conjugal transfer of DNA to cyanobacteria. Methods Enzymol, 1988, 167: 747-754. DOI:10.1016/0076-6879(88)67086-8 |
| [17] | Song K, Tan XM, Liang YJ, et al. The potential of Synechococcus elongatus UTEX 2973 for sugar feedstock production. Appl Microbiol Biotechnol, 2016, 100(18): 7865-7875. DOI:10.1007/s00253-016-7510-z |
| [18] | Bolivar F, Rodriguez RL, Greene PJ, et al. Construction and characterization of new cloning vehicle. Ⅱ.A multipurpose cloning system. Gene, 1977, 2(2): 95-113. |
| [19] | Chen F, Tholl D, D'Auria JC, et al. Biosynthesis and emission of terpenoid volatiles from Arabidopsis flowers. Plant Cell, 2003, 15(2): 481-494. DOI:10.1105/tpc.007989 |
| [20] | K?llner TG, Held M, Lenk C, et al. A maize (E)-β-caryophyllene synthase implicated in indirect defense responses against herbivores is not expressed in most American maize varieties. Plant Cell, 2008, 20(2): 482-494. DOI:10.1105/tpc.107.051672 |
| [21] | Mercke P, Kappers IF, Verstappen FW, et al. Combined transcript and metabolite analysis reveals genes involved in spider mite induced volatile formation in cucumber plants. Plant Physiol, 2004, 135(4): 2012-2024. DOI:10.1104/pp.104.048116 |
| [22] | Cai Y, Jia JW, Crock J, et al. A cDNA clone for β-caryophyllene synthase from Artemisia annua. Phytochemistry, 2002, 61(5): 523-529. DOI:10.1016/S0031-9422(02)00265-0 |
| [23] | Bertani G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J Bacteriol, 1951, 62(3): 293-300. |
| [24] | Stanier RY, Kunisawa R, Mandel M, et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriol Rev, 1971, 35(2): 171-205. DOI:10.1128/MMBR.35.2.171-205.1971 |
| [25] | Yang S, Lu SH, Yuan YJ. Cerium elicitor-induced phosphatidic acid triggers apoptotic signaling development in Taxus cuspidata cell suspension cultures. Chem Phys Lipids, 2009, 159(1): 13-20. |
| [26] | Pattanaik B, Lindberg P. Terpenoids and their biosynthesis in cyanobacteria. Life (Basel), 2015, 5(1): 269-293. |
| [27] | Eisenreich W, Bacher A, Arigoni D, et al. Biosynthesis of isoprenoids via the non-mevalonate pathway. Cell Mol Life Sci, 2004, 61(12): 1401-1426. |
| [28] | Phillips MA, D'Auria JC, Gershenzon J, et al. The Arabidopsis thaliana type I isopentenyl diphosphate isomerases are targeted to multiple subcellular compartments and have overlapping functions in isoprenoid biosynthesis. Plant Cell, 2008, 20(3): 677-696. |
| [29] | Adam P, Hecht S, Eisenreich W, et al. Biosynthesis of terpenes: studies on 1-hydroxy-2-methyl-2-(E)- butenyl 4-diphosphate reductase. Proc Natl Acad Sci USA, 2002, 99(19): 12108-12113. DOI:10.1073/pnas.182412599 |
| [30] | Yu JJ, Liberton M, Cliften PF, et al. Synechococcus elongatus UTEX 2973, a fast growing cyanobacterial chassis for biosynthesis using light and CO2. Sci Rep, 2015, 5: 8132. |
| [31] | Burnap RL, Hagemann M, Kaplan A. Regulation of CO2 concentrating mechanism in cyanobacteria. Life (Basel), 2015, 5(1): 348-371. |
| [32] | Ji X, Verspagen JMH, Stomp M, et al. Competition between cyanobacteria and green algae at low versus elevated CO2: who will win, and why?. J Exp Bot, 2017, 68(14): 3815-3828. DOI:10.1093/jxb/erx027 |
| [33] | Li MJ, Hou FF, Wu T, et al. Recent advances of metabolic engineering strategies in natural isoprenoid production using cell factories. Nat Prod Rep, 2020, 37(1): 80-99. |
| [34] | Pribat A, Boureau L, Mortain-Bertrand A, et al. Metabolic engineering of isoprenoid biosynthesis// Ramawat K, Mérillon JM. Natural Products. Springer Berlin Heidelberg: Springer, 2013: 2813-2851. |
| [35] | Vavitsas K, Fabris M, Vickers CE. Terpenoid metabolic engineering in photosynthetic microorganisms. Genes, 2018, 9(11): 520. |
| [36] | Gao X, Gao F, Liu D, et al. Engineering the methylerythritol phosphate pathway in cyanobacteria for photosynthetic isoprene production from CO2. Energy Environ Sci, 2016, 9(4): 1400-1411. DOI:10.1039/C5EE03102H |
| [37] | Chaves JE, Rueda-Romero P, Kirst H, et al. Engineering isoprene synthase expression and activity in cyanobacteria. ACS Synth Biol, 2017, 6(12): 2281-2292. DOI:10.1021/acssynbio.7b00214 |
| [38] | Lin PC, Saha R, Zhang FZ, et al. Metabolic engineering of the pentose phosphate pathway for enhanced limonene production in the cyanobacterium Synechocystis sp. PCC 6803. Sci Rep, 2017, 7: 17503. DOI:10.1038/s41598-017-17831-y |
| [39] | Davies FK, Work VH, Beliaev AS, et al. Engineering limonene and bisabolene production in wild type and a glycogen-deficient mutant of Synechococcus sp. PCC 7002. Front Bioeng Biotechnol, 2014, 2(21). |
| [40] | Formighieri C, Melis A. Regulation of β-phellandrene synthase gene expression, recombinant protein accumulation, and monoterpene hydrocarbons production in Synechocystis transformants. Planta, 2014, 240(2): 309-324. DOI:10.1007/s00425-014-2080-8 |
| [41] | Pattanaik B, Englund E, Nolte N, et al. Introduction of a green algal squalene synthase enhances squalene accumulation in a strain of Synechocystis sp. PCC 6803. Metab Eng Commun, 2020, 10: e00125. DOI:10.1016/j.mec.2020.e00125 |
| [42] | Choi SY, Lee HJ, Choi J, et al. Photosynthetic conversion of CO2 to farnesyl diphosphate-derived phytochemicals (amorpha-4, 11-diene and squalene) by engineered cyanobacteria. Biotechnol Biofuels, 2016, 9: 202. DOI:10.1186/s13068-016-0617-8 |
| [43] | Hasunuma T, Takaki A, Matsuda M, et al. Single-stage astaxanthin production enhances the nonmevalonate pathway and photosynthetic central metabolism in Synechococcus sp. PCC 7002. ACS Synth Biol, 2019, 8(12): 2701-2709. DOI:10.1021/acssynbio.9b00280 |
| [44] | Halfmann C, Gu LP, Zhou RB. Engineering cyanobacteria for the production of a cyclic hydrocarbon fuel from CO2 and H2O. Green Chem, 2014, 16(6): 3175-3185. |
| [45] | Englund E, Shabestary K, Hudson EP, et al. Systematic overexpression study to find target enzymes enhancing production of terpenes in Synechocystis PCC 6803, using isoprene as a model compound. Metabol Eng, 2018, 49: 164-177. DOI:10.1016/j.ymben.2018.07.004 |
| [46] | Formighieri C, Melis A. Sustainable heterologous production of terpene hydrocarbons in cyanobacteria. Photosynth Res, 2016, 130(1): 123-135. |
| [47] | Wang X, Liu W, Xin CP, et al. Enhanced limonene production in cyanobacteria reveals photosynthesis limitations. Proc Natl Acad Sci USA, 2016, 113(50): 14225-14230. DOI:10.1073/pnas.1613340113 |
| [48] | Formighieri C, Melis A. A phycocyanin·phellandrene synthase fusion enhances recombinant protein expression and β-phellandrene (monoterpene) hydrocarbons production in Synechocystis (cyanobacteria). Metabol Eng, 2015, 32: 116-124. DOI:10.1016/j.ymben.2015.09.010 |
| [49] | Gao ZX, Zhao H, Li ZM, et al. Photosynthetic production of ethanol from carbon dioxide in genetically engineered cyanobacteria. Energy Environ Sci, 2012, 5(12): 9857-9865. DOI:10.1039/C2EE22675H |
| [50] | Sun T, Li SB, Song XY, et al. Re-direction of carbon flux to key precursor malonyl-CoA via artificial small RNAs in photosynthetic Synechocystis sp.PCC 6803. Biotechnol Biofuels, 2018, 11: 26. DOI:10.1186/s13068-018-1032-0 |
| [51] | Knoot CJ, Biswas S, Pakrasi HB. Tunable repression of key photosynthetic processes using Cas12a CRISPR interference in the fast-growing cyanobacterium Synechococcus sp.UTEX 2973. ACS Synth Biol, 2019, 9(1): 132-143. |
| [52] | Huang CH, Shen CR, Li H, et al. CRISPR interference (CRISPRi) for gene regulation and succinate production in cyanobacterium S. elongatus PCC 7942. Microb Cell Fact, 2016, 15: 196. DOI:10.1186/s12934-016-0595-3 |
| [53] | Wendt KE, Ungerer J, Cobb RE, et al. CRISPR/Cas9 mediated targeted mutagenesis of the fast growing cyanobacterium Synechococcus elongatus UTEX 2973. Microb Cell Fact, 2016, 15: 115. |
| [54] | Ungerer J, Pakrasi HB. Cpf1 is a versatile tool for CRISPR genome editing across diverse species of cyanobacteria. Sci Rep, 2016, 6: 39681. DOI:10.1038/srep39681 |
| [55] | Knorre WA, Deckwer WD, Korz D, et al. High cell density fermentation of recombinant Escherichia coli with computer-controlled optimal growth rate. Ann New York Acad Sci, 1991, 646(1): 300-306. |
| [56] | Raj AE, Kumar HSS, Kumar SU, et al. High-cell-density fermentation of recombinant Saccharomyces cerevisiae using glycerol. Biotechnol Prog, 2002, 18(5): 1130-1132. DOI:10.1021/bp0201105 |
