
 , 靳婉君1,4, 马慧萍1,4, 景临林1, 贾正平1,3
, 靳婉君1,4, 马慧萍1,4, 景临林1, 贾正平1,3 1. 中国人民解放军联勤保障部队第九四〇医院 全军高原环境损伤防治重点实验室,甘肃 兰州 730050;
2. 北京生命组学研究所 国家蛋白质科学中心(北京) 北京蛋白质组学研究中心 蛋白质组学国家重点实验室,北京 102206;
3. 兰州大学 药学院,甘肃 兰州 730000;
4. 甘肃省中医药大学 药学院,甘肃 兰州 730000
收稿日期:2019-04-06;接收日期:2019-06-17
基金项目:国家自然科学基金(Nos. 81402848, 81571847),中国博士后科学基金(Nos. 2016T91005, 2015M582804),甘肃省自然科学****基金项目(No. 145RJDA331)资助
摘要:脑脊液(CSF)围绕并支持中枢神经系统(CNS),包括脑室和蛛网膜下腔,由于脑脊液与中枢神经系统直接接触,所以其是寻找中枢神经系统疾病生物标记物的重要来源。国内外****开展了大量CSF蛋白质组学的研究工作,并取得了较大进展。文中综述了近年来CSF蛋白质组学技术及临床应用研究进展。
关键词:脑脊液蛋白质组学临床应用质谱诊断标志物
Progress in cerebrospinal fluid proteome technology and its clinical application
Linpeng Yang1,3, Pengcheng Fan2

 , Wanjun Jin1,4, Huiping Ma1,4, Linlin Jing1, Zhengping Jia1,3
, Wanjun Jin1,4, Huiping Ma1,4, Linlin Jing1, Zhengping Jia1,3 1. Key Laboratory of Prevention and Cure for the Plateau Environmental Damage of PLA, The 940th Hospital of PLA Joint Logistics Support Force, Lanzhou 730050, Gansu, China;
2. State Key Laboratory of Proteomics, Beijing Proteome Research Center, National Center for Protein Sciences (Beijing), Beijing Institute of Lifeomics, Beijing 102206, China;
3. School of Pharmacy, Lanzhou University, Lanzhou 730000, Gansu, China;
4. College of Pharmacy, Gansu University of Traditional Chinese Medicine, Lanzhou 730000, Gansu, China
Received: April 6, 2019; Accepted: June 17, 2019
Supported by: National Natural Science Foundation of China (Nos. 81402848, 81571847), China Postdoctoral Science Foundation (Nos. 2016T91005, 2015M582804), Natural Science Funds for Distinguished Young Scholar in Gansu Province (No. 145RJDA331)
Corresponding author: Pengcheng Fan. Tel/Fax: +86-931-8994671; E-mail: fpch2001@yeah.net.
Abstract: Cerebrospinal fluid surrounds and supports the central nervous system, including the ventricles and subarachnoid spaces. Cerebrospinal fluid should be an important source of biomarkers for central nervous system diseases because it is in direct contact with the central nervous system. Many studies are reported on cerebrospinal fluid proteomics, highlighting many recent progresses. Here, we review recent advances in proteomics technology and clinical application of cerebrospinal fluid.
Keywords: cerebrospinal fluidproteomicsclinical applicationmass spectrometrydiagnostic markers
蛋白质组学是从整体水平上研究细胞、组织、器官或生物体的蛋白质组成及其变化的学科[1]。蛋白质组学经历了概念提出、技术发展到成为生命组学、精准医学研究中重要组成部分的过程[2]。其在重大疾病发生发展的分子机制研究、生物标志物发现及药物开发等多个领域都起着重要作用。脑脊液(Cerebrospinal fluid,CSF)围绕并支持中枢神经系统(Central nervous system,CNS),包括脑室和蛛网膜下腔[3]。CSF中约80%的蛋白来源于透过侧脑室脉络丛血脑屏障(Blood brain barrier,BBB)的血浆超滤液,其余来自CNS间质液的引流[4-5]。由于CSF与CNS直接接触,因此CSF是检测CNS系统疾病特征蛋白的理想生物样本,是寻找CNS疾病潜在生物标记物的重要来源[6-8]。
1 CSF蛋白质组分析技术人类CSF中的蛋白质浓度相对较低(0.2- 0.8 mg/mL)、成分复杂,存在高丰度蛋白对应肽段信号较强、干扰低丰度蛋白肽段信号检测的现象。通过蛋白质组学鉴定到的各蛋白浓度范围差异较大,故CSF蛋白质组分析对蛋白质组学技术提出了挑战。CSF蛋白分析常用策略(图 1)有:去除高丰度蛋白;对CSF蛋白/肽段进行预分离;对CSF中某些组分的蛋白质进行富集;对CSF中特定组分的分析,如外泌体等。也可以通过结合使用上述策略,来进一步提高分析能力。此外还有针对CSF中自身抗体的检测方法,如免疫蛋白质组分析和蛋白质芯片。
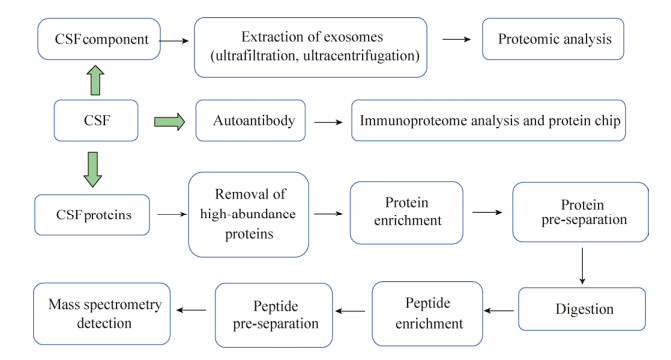 |
| 图 1 脑脊液蛋白质组分析常用技术流程 Fig. 1 Common technical procedures for proteome analysis of cerebrospinal fluid. |
| 图选项 |
1.1 去除高丰度蛋白将CSF中的高丰度蛋白去除,可以相对富集中低丰度蛋白质。主要是基于免疫亲和的原理,通过抗体去除白蛋白、免疫球蛋白及其他高丰度蛋白质,目前市场上有很多商品化的高丰度蛋白去除柱,可以单独使用,也可以与其他色谱柱串联使用。如Agilent公司的MARS-Hu14和GenWay公司的Seppro MIXED12免疫亲和色谱柱,MARS-Hu14能够有效地去除14种高丰度蛋白(白蛋白、IgG、抗胰蛋白酶、IgA、转铁蛋白、触珠蛋白、纤维蛋白原、α2-巨球蛋白、α1-酸性糖蛋白、IgM、载脂蛋白AI、载脂蛋白AII、补体C3和转甲状腺素蛋白),大大提高了对低丰度蛋白的检测[9-10]。Seppro MIXED12可以一次性去除12种高丰度蛋白,去除效率可以达到95%- 99.5%[11-12]。尽管去除高丰度蛋白之后,可以提高质谱检测的深度,但去除高丰度蛋白的同时,会一并带走那些与高丰度蛋白相互结合或者作用的蛋白,无法反映全部的蛋白质表达分布,同时增加的步骤也会引入人为操作差异[13]。
1.2 预分离与富集CSF样本可通过聚丙烯酰胺凝胶电泳或离子交换等多种色谱进行蛋白质水平的预分离,或者酶切为肽段后通过色谱分离。Schutzer等通过去除高丰度蛋白,然后进行强阳离子交换分级,在正常脑脊液中检测到共2 630种蛋白质[14]。Begcevic等首先对样品进行强阳离子交换色谱分级,然后进行LC-MS/MS分析,共在CSF中鉴定出2 615种蛋白质[15]。为了鉴定到更多的低丰度蛋白质,可对一些特定的CSF蛋白进行富集,如使用酰肼法富集N-连接糖蛋白。Wang等通过凝集素亲和层析富集糖蛋白,共鉴定了CSF中的795种蛋白[16]。Guldbrandse等使用3种富集策略结合Orbitrap LC-MS/MS绘制人CSF蛋白质组。SDS-PAGE和混合模式反相-阴离子交换,用于绘制CSF总蛋白质组和基于酰肼的糖肽捕获用于绘制糖肽蛋白质组,该研究鉴定了3 081种蛋白质组和28 811个肽序列,其中520个被鉴定为来自糖肽富集策略的糖蛋白,包括1 121个糖肽及其糖基化位点[17]。多种分离方式结合使用,可大大提高CSF蛋白的鉴定数目。但是随着分离组分的增多,质谱检测总时间也会增加,质谱机时的延长可能会影响大量样本的鉴定分析。
1.3 特定肽段靶向检测技术通过高通量蛋白质组技术发现的具有潜在临床价值的CSF差异蛋白,需要进一步验证。传统验证方法是基于ELISA和Western blotting的验证方法,但该方法需要特定的抗体,实验成本高并且周期长。选择反应监测(Selected reaction monitoring,SRM),是一种基于质谱的定量技术,可以用于验证发现的差异蛋白。SRM可特异地检测定量目标蛋白特有肽段,具有特异性好、通量高、不依赖抗体的优点。Jia等报道了一个高特异性和灵敏度的SRM测定方法,其多重SRM分析同时检测CSF中的26种蛋白质[18]。通过SRM方法来开发和验证CSF中的生物标记物,可监测与神经退行性疾病相关的目标蛋白。此外,平行反应监测(Parallel reaction monitoring, PRM)和多重反应检测(Multiple reaction monitoring, MRM)也常用于靶向验证发现的CSF差异蛋白[19-20]。
1.4 基于自身抗体的分析许多自身免疫病患者CSF中还会存在自身抗体,由于抗原-抗体免疫反应的检测灵敏度可达到1 ng/L以下,检测自身抗体也是发现疾病标志物的重要手段之一。为了提高分析的通量,蛋白芯片是检测自身抗体水平的常用方式,具有简单方便、检测速度快和需要样本量小的优点。马占云等探讨了结核分枝杆菌蛋白芯片检测CSF中结核抗体诊断结核性脑膜炎的应用价值,应用结核蛋白芯片检测30例临床诊断结核性脑膜炎患者CSF样本及血清样本,30例非结核性脑膜炎患者CSF样本,实验结果证明应用结核蛋白芯片检测CSF中特异性结核抗体可能成为诊断结核性脑膜炎的重要辅助检查方法[21]。吕萍等利用蛋白芯片技术检测25例神经梅毒患者和21例未累及神经系统的梅毒患者CSF中的差异蛋白,ELISA验证差异蛋白的表达,蛋白芯片分析发现相较于未累及神经系统的梅毒组,神经梅毒组脑脊液有41种蛋白显著升高,CSF中尿激酶型纤溶酶原激活物(uPA)可能可作为神经梅毒新的诊断指标[22]。
1.5 基于CSF组分的分析多种细胞类型可释放外泌体,其内容物含有蛋白质和RNA,CSF外泌体可作为CNS疾病生物标志物的重要来源[23]。通过超滤或超速离心的方式可提取CSF中外泌体,利用纳米颗粒跟踪分析、电子显微镜和免疫印迹等相关技术手段进行表征[24]。Street等在人体CSF中鉴定了外泌体蛋白质组,提示CSF外泌体蛋白质组可作为阿尔茨海默病(Alzheimer disease, AD)等CNS疾病生物标志物的潜在新储库[25]。
2 CSF蛋白质组学在疾病研究中的应用蛋白质组学在疾病的早期诊断、进程监测、分子分型、疗效监测、预后判断和分子机制中具有重要意义。精确诊断依赖于能够对疾病病理过程具有较高灵敏度及特异性的生物标志物[26-27]。疾病相关的生物标志物可以提供关于疾病的原因、致病因素的可能效果和对患者治疗的提示。风险指标和诊断生物标志物将为在疾病感染情况及其治疗所需药物的剂量之间取得药效和最小副作用的平衡提供依据。预测性生物标志物将提供对特定治疗类型最佳疗效的评估依据。预后标志物可以在接受或未接受治疗的情况下预测疾病的进展。治疗性生物标志物可以将患者同药物疗效相关联[28]。
2.1 CSF用于疾病诊断标志物的发现Pei等筛选了格林-巴利综合征(Guillain- Barré syndrome,GBS)患者CSF样本中差异表达的蛋白质,招募了50名GBS患者(实验组)和50名脑膜炎患者(对照组)来比较CSF中的蛋白质表达。最终通过ELISA验证表达水平,并通过接受者操作特征曲线分析其在GBS诊断中的准确性、灵敏度和特异性,鉴定了3种差异表达的蛋白质,包括上调的Haptoglobin (HP)和热休克蛋70 (Heat shock protein 70,Hsp70),以及下调的半胱氨酸蛋白酶抑制剂C (Cystatin C),为早期GBS诊断提供了重要的生物标志物[29]。Zou等研究了CSF中继发性癫痫的生物标志物。通过LiCl-毛果芸香碱建立慢性癫痫大鼠模型,非标记蛋白质组学技术分析大鼠CSF样本,ELISA和Western blotting确认蛋白质的差异表达。使用ELISA测定在脑膜炎急性期后的患者CSF相应蛋白的水平,并在对脑炎后症状性癫痫患者进行2年随访比较。结果表明CSF中的KNG蛋白可作为预测脑炎患者癫痫发生的潜在生物标志物[30]。
2.2 CSF用于疾病进程与严重程度标志物的发现Sathe等通过对患者CSF样本结合高分辨率质谱和串联质量标签(Tandem mass tags, TMT)技术进行分析,鉴定AD的潜在生物标志物。并使用PRM技术在各个CSF样品上分别验证这些标志物。在CSF中鉴定出共2 327种蛋白质,其中139种在AD患者的CSF中被观察到显著改变,AD中改变的蛋白质包括许多已知的AD标记,例如MAPT、NPTX2、VGF、GFAP和NCAM1,以及新的生物标记,例如PKM和YWHAG。发现在AD患者的CSF中发生改变的蛋白质具有监测疾病进展和治疗反应的潜在价值,有待在后续研究中得到验证,以期用于AD的进程监测[19]。
2.3 CSF用于疾病分子分型标志物的发现刘丹等将GBS分为经典急性炎性脱髓鞘性多神经根性神经病型(Acute inflammatory demyelinative polyradiculoneuropathy,AIDP)与急性轴索性运动神经病型(Aacute motor axonal neuropathy,AMAN),并寻找GBS不同亚型患者潜在的差异蛋白。实验分为3组:AIDP组、AMAN组和对照组。应用差异凝胶双向电泳结合质谱技术,通过蛋白质组学研究方法对GBS患者不同亚型的CSF进行整体蛋白质水平分析。最终发现AIDP型GBS患者CSF中存在4种表达差异蛋白质,上调蛋白为APOD,下调蛋白为APOE、Cathepsin和PEDF。AMAN型GBS患者CSF中存在8种表达差异蛋白质,上调蛋白为HP、APP和APOD,下调蛋白为FAD、APO E、TGAB、Cathepsin和PEDF。该研究发现APP在AMAN组CSF中上调,表明APP可能与AMAN型GBS的发生有关[31]。
目前CSF蛋白质组分析已经不再以提高蛋白鉴定数量为主要研究目的,而更多以研究疾病的分型和病理生理机制为目标。本课题组收集了兰州军区兰州总医院神经内科部分需要进行腰椎穿刺CSF临床检查的100余例患者经常规临床检查后的剩余CSF样品(研究方案经兰州军区兰州总医院伦理委员会审查批准),通过非标记定量蛋白质组学技术,结合LC-MS/MS检测,无需除高丰度蛋白操作,最终能鉴定到400余个CSF蛋白。该工作流程可在一天内快速完成,鉴定并定量了载脂蛋白家族、炎性标志物如C反应蛋白和一些FDA批准的生物标志物。
2.4 CSF用于疾病疗效监测标志物的发现Gong等利用非标记方法对淋巴结外鼻型自然杀伤-T细胞淋巴瘤(Extranodal natural killer cell/T-cell lymphoma of nasal-type,NKTCL)伴筛窦转移患者CSF样本进行蛋白质组学比较分析。在阿糖胞苷化疗后的NKTCL伴筛窦转移患者CSF中观察到IGFBP2、SERP1NC1、AMBP和GPX3显著降低,以及CPE水平显著增加。IGFBP2、SERP1NC1、AMBP、GPX3和CPE一起或单独有可能成为NKTCL伴筛窦转移患者对化疗药物疗效的预测指标[32]。
2.5 CSF用于疾病临床预后标志物的发现Bereman等研究了肌萎缩侧索硬化(Amyotrophic lateral sclerosis,ALS)患者的诊断和预后价值的生物标志物,利用纳流液相色谱串联高分辨率质谱进行分析。在ALS (n=33)和健康对照(n=30)的个体之间找到118个差异蛋白。参与补体激活、急性期反应和类视黄醇信号传导途径的蛋白在ALS患者的CSF中显著富集。几丁质酶-3、α-1-抗胰凝乳蛋白酶和补体因子Ⅰ三种蛋白质组的预后模型可以解释ALS功能评分量表评分中49%的差异[33]。
2.6 CSF用于疾病分子机制研究Avsar等研究了多发性硬化症(Multiple sclerosis,MS)不同亚型潜在的分子机制。选择临床孤立综合征、复发缓解型MS和进展型MS患者的CSF样本(n=179),通过蛋白质组学和生物信息学方法研究不同MS临床亚型中的发病相关分子通路。与对照组比较,疾病组中151种蛋白在各MS亚型中差异表达。结果表明尽管所有MS都有共同的生物学途径,但也有不同的临床亚型特异性和病理生理学途径[34]。Mu等研究了结核性脑膜炎(Tuberculous meningitis,TBM)的发病机制,通过定量蛋白质组学鉴定TBM患者(n=12)和健康对照(n=12) CSF样本中的差异蛋白质,发现了4种同脂质代谢相关的差异蛋白,ELISA验证结果显示TBM患者CSF中APOB水平显著增加,表明CSF脂质代谢失调,为深入了解TBM的发病机制提供实验证据[35]。
3 展望由于CSF是CNS疾病诊断检验中常用到的临床样本,对于CSF的高通量分析是未来精准医学重要的检测项目之一[36]。CSF蛋白质组分析更多的是以发现疾病标志物为目的,包括发现可用于疾病早期诊断、进程监测、分子分型、疗效监测、预后判断和分子机制等精准医学范畴的检测指标。但目前被批准用于临床的CSF生物标志物较少。当前CSF蛋白质组分析所面临的困难主要是:1)高质量的CSF临床样本较少,缺乏标准化的CSF收集程序,样品处理不当,而高质量的临床样本是通过蛋白质组学技术寻找生物标志物的关键。2)后期验证需要大量时间,大规模蛋白质组学分析往往可以找到多个差异蛋白质,但是在大量临床样本中进行后期验证需要大量的时间与成本[37-38]。3)去除高丰度蛋白对特定研究是否有帮助需要进行实验确定[39]。随着蛋白质组学分析技术的快速发展,质谱检测的灵敏度和分析通量大幅提高,使得在大样本量人群中分析中低丰度蛋白质的动态变化趋势成为可能,这些新方法还将加速生物标志物的发现,并为神经退行性疾病和其他与脑相关的疾病提供新的治疗方法[40]。CSF蛋白质组学分析为人们的健康状态提供了丰富的信息,其在临床诊断中的大规模使用可以为临床医生对不同患者制定具有针对性的治疗方案提供更多实验依据,同时患者的CSF蛋白质特征谱可以显示当前的疾病风险以及生活方式变化或药物干预的效果。人群大数据的积累和生物信息学整合分析,使得CSF蛋白质组分析为实现精准医疗和个体化诊疗提供了有力的工具。开发新的CSF蛋白质预处理技术及后期验证策略,选择对外泌体等CSF组分进行分析,发展高通量的特定肽段靶向检测或抗体芯片技术,把CSF蛋白质组学作为在神经生物学疾病精确疗法中的一部分,建立反映患者健康状态的CSF蛋白质组学大数据资源数据库,将成为CSF的部分研究方向。
参考文献
| [1] | Khalilpour A, Kilic T, Khalilpour S, et al. Proteomic-based biomarker discovery for development of next generation diagnostics. Appl Microbiol Biot, 2017, 101(2): 475-491. DOI:10.1007/s00253-016-8029-z |
| [2] | Wang K, Huang CH, Nice EC. Recent advances in proteomics: towards the human proteome. Biomed Chromatog, 2014, 28(6): 848-857. DOI:10.1002/bmc.3157 |
| [3] | Filis AK, Aghayev K, Vrionis FD. Cerebrospinal fluid and hydrocephalus: physiology, diagnosis, and treatment. Cancer Control, 2017, 24(1): 6-8. DOI:10.1177/107327481702400102 |
| [4] | Tumani H, Huss A, Bachhuber F. The cerebrospinal fluid and barriers-anatomic and physiologic considerations. Handb Clin Neurol, 2017, 146: 21-32. |
| [5] | Ueno M, Chiba Y, Murakami R, et al. Blood-brain barrier and blood-cerebrospinal fluid barrier in normal and pathological conditions. Brain Tumor Pathol, 2016, 33(2): 89-96. DOI:10.1007/s10014-016-0255-7 |
| [6] | Lista S, Zetterberg H, Dubois B, et al. Cerebrospinal fluid analysis in Alzheimer's disease: technical issues and future developments. J Neurol, 2014, 261(6): 1234-1243. DOI:10.1007/s00415-014-7366-z |
| [7] | Teunissen CE, Verheul C, Willemse EAJ. The use of cerebrospinal fluid in biomarker studies. Handb Clin Neurol, 2018, 146: 3-20. DOI:10.1016/B978-0-12-804279-3.00001-0 |
| [8] | Shen F, Zhang Y, Yao Y, et al. Proteomic analysis of cerebrospinal fluid: toward the identification of biomarkers for gliomas. Neurosurg Rev, 2014, 37(3): 367-380. DOI:10.1007/s10143-014-0539-5 |
| [9] | Maccarrone G, Milfay D, Birg I, et al. Mining the human cerebrospinal fluid proteome by immunodepletion and shotgun mass spectrometry. Electrophoresis, 2010, 25(14): 2402-2412. |
| [10] | Holewinski RJ, Jin ZC, Powell MJ, et al. A fast and reproducible method for albumin isolation and depletion from serum and cerebrospinal fluid. Proteomics, 2013, 13(5): 743-750. DOI:10.1002/pmic.201200192 |
| [11] | Comunale MA, Wang MJ, Hafner J, et al. Identification and development of fucosylated glycoproteins as biomarkers of primary hepatocellular carcinoma. J Proteome Res, 2009, 8(2): 595-602. DOI:10.1021/pr800752c |
| [12] | Sundberg M, Bergquist J, Ramstr?m M. High-abundant protein depletion strategies applied on dog cerebrospinal fluid and evaluated by high-resolution mass spectrometry. Biochem Biophys Rep, 2015, 3: 68-75. |
| [13] | Geyer PE, Holdt LM, Teupser D, et al. Revisiting biomarker discovery by plasma proteomics. Mol Syst Biol, 2017, 13(9): 942. DOI:10.15252/msb.20156297 |
| [14] | Schutzer SE, Liu T, Natelson BH, et al. Establishing the proteome of normal human cerebrospinal fluid. PLoS ONE, 2010, 5(6): e10980. DOI:10.1371/journal.pone.0010980 |
| [15] | Begcevic I, Brinc D, Drabovich AP, et al. Identification of brain-enriched proteins in the cerebrospinal fluid proteome by LC-MS/MS profiling and mining of the Human Protein Atlas. Clin Proteom, 2016, 13: 11. DOI:10.1186/s12014-016-9111-3 |
| [16] | Wang J, Cunningham R, Zetterberg H, et al. Label-free quantitative comparison of cerebrospinal fluid glycoproteins and endogenous peptides in subjects with Alzheimer's disease, mild cognitive impairment, and healthy individuals. Proteom Clin Appl, 2016, 10(12): 1225-1241. DOI:10.1002/prca.201600009 |
| [17] | Guldbrandsen A, Vethe H, Farag Y, et al. In-depth characterization of the cerebrospinal fluid (CSF) proteome displayed through the CSF proteome resource (CSF-PR). Mol Cell Proteomics, 2014, 13(11): 3152-3163. DOI:10.1074/mcp.M114.038554 |
| [18] | Jia Y, Wu TX, Jelinek CA, et al. Development of protein biomarkers in cerebrospinal fluid for secondary progressive multiple sclerosis using selected reaction monitoring mass spectrometry (SRM-MS). Clin Proteomics, 2012, 9: 9. DOI:10.1186/1559-0275-9-9 |
| [19] | Sathe G, Na CH, Renuse S, et al. Quantitative proteomic profiling of cerebrospinal fluid to identify candidate biomarkers for alzheimer's disease. Proteomics Clin Appl, 2018, e1800105. |
| [20] | Heywood WE, Galimberti D, Bliss E, et al. Identification of novel CSF biomarkers for neurodegeneration and their validation by a high-throughput multiplexed targeted proteomic assay. Mol Neurodegener, 2015, 10: 64. DOI:10.1186/s13024-015-0059-y |
| [21] | Ma ZY, Chen P, Yan Y, et al. The value of detecting antibodies of the cerebrospinal fluid by tuberculosis protein chip for the diagnosis of tuberculous meningitis. J Apoplexy Nerv Dis, 2014, 31(5): 429-432 (in Chinese). 马占云, 陈鹏, 晏阳, 等. 结核蛋白芯片检测脑脊液中抗体对结核性脑膜炎诊断价值. 中风与神经疾病杂志, 2014, 31(5): 429-432. |
| [22] | Lv P, Fang C, Huang JM, et al. Protein microarry in cerebrospinal fluid of neurosyphilis patients. J Diagn Ther Derma-Venereol, 2017, 24(1): 3-7 (in Chinese). 吕萍, 方昶, 黄进梅, 等. 神经梅毒患者脑脊液蛋白芯片分析. 皮肤性病诊疗学杂志, 2017, 24(1): 3-7. DOI:10.3969/j.issn.1674-8468.2017.01.002 |
| [23] | Yagi Y, Ohkubo T, Kawaji H, et al. Next-generation sequencing-based small RNA profiling of cerebrospinal fluid exosomes. Neurosci Lett, 2017, 636: 48-57. DOI:10.1016/j.neulet.2016.10.042 |
| [24] | Thompson AG, Gray E, Mager I, et al. UFLC-derived CSF extracellular vesicle origin and proteome. Proteomics, 2018, 18(24): 1800257. |
| [25] | Street JM, Barran PE, Mackay CL, et al. Identification and proteomic profiling of exosomes in human cerebrospinal fluid. J Transl Med, 2012, 10: 5. DOI:10.1186/1479-5876-10-5 |
| [26] | Li ML, Zhao MD, Gao YH. Changes of proteins induced by anticoagulants can be more sensitively detected in urine than in plasma. Sci China Life Sci, 2014, 57(7): 649-656. DOI:10.1007/s11427-014-4661-y |
| [27] | Gao YH. Urine—an untapped goldmine for biomarker discovery?. Sci China Life Sci, 2013, 56(12): 1145-1146. DOI:10.1007/s11427-013-4574-1 |
| [28] | Lycke J, Zetterberg H. The role of blood and CSF biomarkers in the evaluation of new treatments against multiple sclerosis. Expert Rev Clin Immu, 2017, 13(12): 1143-1153. DOI:10.1080/1744666X.2017.1400380 |
| [29] | Li P, Wang SJ, Zhang RL, et al. Identification of CSF biomarkers by proteomics in Guillain?Barré syndrome. Exp Ther Med, 2018, 15(6): 5177-5182. |
| [30] | Zou J, Wang XX, Huang LG, et al. Kininogen level in the cerebrospinal fluid may be a potential biomarker for predicting epileptogenesis. Front Neurol, 2019, 10. DOI:10.3389/fneur.2019.00037 |
| [31] | Liu D. Cerebrospinal fluid proteomics study in GBS patients with different subtypes[D]. Changchun: Ji Lin Univ, 2012 (in Chinese). 刘丹.不同亚型吉兰—巴雷综合征患者脑脊液蛋白质组学研究[D].长春: 吉林大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10183-1012366999.htm |
| [32] | Gong YQ, Pu WC, Jin HY, et al. Quantitative proteomics of CSF reveals potential predicted biomarkers for extranodal NK-/T-cell lymphoma of nasal-type with ethmoidal sinus metastasis. Life Sci, 2018, 198: 94-98. DOI:10.1016/j.lfs.2018.02.035 |
| [33] | Bereman MS, Beri J, Enders JR, et al. Machine learning reveals protein signatures in csf and plasma fluids of clinical value for ALS. Sci Rep, 2018, 8(1): 16334. DOI:10.1038/s41598-018-34642-x |
| [34] | Avsar T, Duras? IM, Uyguno?lu U, et al. CSF proteomics identifies specific and shared pathways for multiple sclerosis clinical subtypes. PLoS ONE, 2015, 10(5): e0122045. DOI:10.1371/journal.pone.0122045 |
| [35] | Mu J, Yang YT, Chen J, et al. Elevated host lipid metabolism revealed by iTRAQ-based quantitative proteomic analysis of cerebrospinal fluid of tuberculous meningitis patients. Biochem Bioph Res Commun, 2015, 466(4): 689-695. DOI:10.1016/j.bbrc.2015.08.036 |
| [36] | Martínez-Girón R, Pantanowitz L. Cerebrospinal fluid cytology in nonmalignant aseptic meningeal disorders. Diagn Cytopathol, 2017, 45(11): 1020-1029. DOI:10.1002/dc.23797 |
| [37] | Yu XB, Petritis BO, Labaer J. Advancing translational research with next-generation protein microarrays. Proteomics, 2016, 16(8): 1238-1250. DOI:10.1002/pmic.201500374 |
| [38] | Wilhelm M, Schlegl J, Hahne H, et al. Mass-spectrometry-based draft of the human proteome. Nature, 2014, 509(7502): 582-587. DOI:10.1038/nature13319 |
| [39] | Geyer PE, Kulak NA, Pichler G, et al. Plasma proteome profiling to assess human health and disease. Cell Syst, 2016, 2(3): 185-195. |
| [40] | Hosp F, Mann M. A primer on concepts and applications of proteomics in neuroscience. Neuron, 2017, 96(3): 558-571. DOI:10.1016/j.neuron.2017.09.025 |
