
 , 赵铁军
, 赵铁军

浙江师范大学 化学与生命科学学院,浙江 金华 321004
收稿日期:2017-11-30;接收日期:2018-04-23; 网络出版时间:2018-06-21 基金项目:国家自然科学基金(No. 31470262),浙江省公益性技术应用研究计划项目(No. 2015C33149),2017年度浙江省教育厅项目(No.Y201738673),浙江省“重中之重”学科“生物学”2014年度开放基金(No. KFJJ2014003)资助
摘要:本研究旨在分析雷公藤红素对成人T细胞白血病细胞增殖、凋亡的影响,并探讨其分子机制。使用不同浓度的雷公藤红素溶液处理多种成人T细胞白血病细胞株,通过四唑盐比色法(MTT)、克隆形成实验检测细胞的增殖情况;Annexin V/PI双染检测细胞凋亡情况;最后通过Western blotting及双荧光素酶报告基因技术探究雷公藤红素抑制成人T细胞白血病细胞生长的调控机制。结果表明雷公藤红素能显著抑制成人T细胞白血病细胞增殖并诱导其凋亡,随着雷公藤红素浓度的增加Bax/Bcl-2蛋白比率明显升高,凋亡途径中Caspase-3/7蛋白也随之被切割活化,同时病毒编码的癌蛋白Tax的表达也明显受到抑制。以上结果表明,雷公藤红素通过调控Bcl-2家族蛋白,激活了Caspase途径诱导细胞凋亡,并通过抑制病毒关键蛋白Tax的表达,从而有效抑制了成人T细胞白血病细胞的增殖。该研究为临床应用雷公藤红素治疗成人T细胞白血病提供了实验依据。
关键词:雷公藤红素 成人T细胞白血病 增殖 凋亡 Tax蛋白
Inhibition of proliferation of adult T-cell leukemia cells by celastrol
Jinyong Fang, Kaining Yi, Zaowen Song, Mengyun Chen, Lingling Xu

 , Tiejun Zhao
, Tiejun Zhao

College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, Zhejiang, China
Received: November 30, 2017; Accepted: April 23, 2018; Published: June 21, 2018
Supported by: National Natural Science Foundation of China (No. 31470262), Public Welfare Technology Application Research Project of Zhejiang (No. 2015C33149), Foundation of Zhejiang Educational Committee in 2017 (No. Y201738673), the 2014 Annual Open Fund of "Biology" in the "Top Key" Discipline of Zhejiang Province (No. KFJJ2014003)
Corresponding author:Lingling Xu. E-mail: xll0518@zjnu.cn
Tiejun Zhao. E-mail: tjzhao@zjnu.cn
Abstract: We studied the effect of celastrol on the proliferation and apoptosis of adult T-cell leukemia (ATL) cells. After treating adult T-cell leukemia cell lines with different concentrations of celastrol, we analyzed the cell proliferation by MTT and colony formation assays. Flow cytometry was conducted to detect cell apoptosis by Annexin V-FITC/PI staining. Western blotting and dual-luciferase reporter assay were done to study the mechanism how celastrol suppressed the growth of adult T-cell leukemia cells. Celastrol could significantly inhibit the proliferation of adult T-cell leukemia cells, and induce apoptosis of ATL cells. With the increase of the concentration of celastrol, the ratio of Bax/Bcl-2 protein was up-regulated. The Caspase-3/7 protein was cleaved and activated after treatment with celastrol. Moreover, the expression of HTLV-1-encoded viral protein Tax was significantly inhibited in the celastrol treated cells. Taken together, these results indicated that celastrol effectively inhibited the proliferation of adult T-cell leukemia cells by regulating the expression of Bcl-2 family protein, and induced cell apoptosis by activating Caspase dependent pathway. In addition, celastrol could inhibit the expression of viral protein Tax. This study will provide an experimental basis for the clinical application of celastrol in the treatment of adult T-cell leukemia.
Keywords: celastrol adult T-cell leukemia proliferation apoptosis Tax protein
成人T细胞白血病(AdultT-cell leukemia, ATL)是一种由人类T细胞白血病病毒1型(Human T cell leukemia virus type-1, HTLV-1)引起的恶性淋巴系增殖性肿瘤疾病[1-3]。在HTLV-1编码的一系列病毒调控蛋白中,Tax蛋白在ATL的发病机制中起着重要作用[2, 4]。由于ATL的潜伏期长,存在化疗耐药以及严重的免疫抑制,预后极差[5-8],使得治愈成人T细胞白血病的情况不容乐观。目前白血病治疗方法主要是联合化学疗法、干细胞移植等[9],但由于其疗效的不确定,存在毒副作用和费用昂贵等不足严重限制了其应用,故寻找一种更为廉价、高效的治疗手段迫在眉睫。
目前将植物来源的天然产物作为抗肿瘤药物是当今肿瘤治疗的一大研究热点。大量的研究表明这些天然产物在肿瘤治疗中有着重要作用。雷公藤红素(Celastrol)是从雷公藤属(Tripterygium wilfordii Hook. f.)植物的根皮中提取的一种五环三萜类化合物,其分子式为C29H38O4 (图 1),它具有较强的抗炎、抗氧化和抗肿瘤等药理活性[10]。同时研究表明雷公藤红素是一种天然的蛋白酶体抑制剂,能有效地抑制蛋白酶体活性进而诱发癌细胞凋亡[11]。近年来,大量研究表明雷公藤红素能显著抑制多种肿瘤细胞的恶性增殖,如乳腺癌[12]、非小细胞细胞肺癌[13]、胰腺癌[14]、神经胶质瘤[15]、白血病[16]和前列腺癌[17]。然而,其对成人T细胞白血病细胞增殖的抑制作用及分子机制研究未见报道。文中以成人T细胞白血病细胞为研究对象,采用MTT法、克隆形成和流式细胞术,检测了雷公藤红素对成人T细胞白血病细胞的增殖和凋亡的影响,并通过Western blotting和报告基因技术深入探究了雷公藤红素抗肿瘤作用的分子机制。该研究成果为今后临床应用雷公藤红素治疗成人T细胞白血病提供了实验依据。
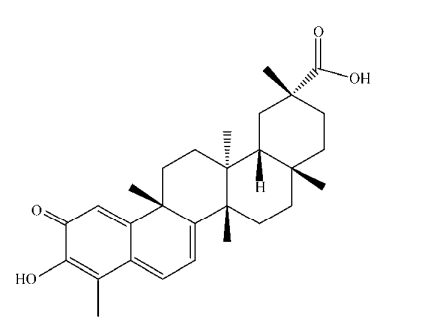 |
| 图 1 雷公藤红素化学结构式 Figure 1 Chemical structure of celastrol. |
| 图选项 |
1 材料与方法1.1 细胞株成人T细胞白血病细胞株:ATL-T、ATL-2、MT-4、TL-Om1均由日本京都大学松冈雅雄教授惠赠。
1.2 药品与试剂雷公藤红素:CAS号为34157-83-0,购自MCE公司,产品货号为HY-13067,HPLC纯度为99.90%。细胞培养基RPMI-1640、胰蛋白酶购自Gibco公司;胎牛血清(FBS)购自法国Biowest公司;兔抗人Caspase3、Caspase7、Bax、Bcl-2多克隆抗体,鼠抗人Tax、GAPDH单克隆抗体,以及山羊抗兔Biotin (IgG H & L)、Streptavidin-HRP和山羊抗鼠IgG HRP多克隆抗体均购自Cell Signaling Technology(CST)公司;AnnexinV/PI凋亡试剂盒购自北京联科生物公司;Trizol Reagent试剂购自Invitrogen公司;逆转录试剂盒、双荧光素酶报告基因试剂盒购自Promega公司。
1.3 细胞培养白血病细胞株培养于含10%胎牛血清和双抗(青、链霉素,100 IU/mL)的RPMI-1640完全培养基中,于37 ℃、5% CO2培养箱中培养及传代,使用对数期细胞进行实验。
1.4 MTT法检测细胞存活率先将5×103个/孔白血病细胞接种于96孔板,随后加入不同浓度的雷公藤红素溶液,同时以DMSO作为阴性对照(DMSO的量与配置最高浓度雷公藤红素溶液所需母液的量相等,下同)。药物处理0、24、48、72 h后,每孔加入10 μL的MTT溶液(5 mg/mL),4 h后裂解细胞后,采用酶标仪(美国Bio-Rad公司)测定595 nm波长处各孔的吸光值(OD值),计算细胞增殖率(%)=实验组OD值/对照组OD值×100。
1.5 克隆形成检测细胞增殖能力先将400个/孔ATL-T细胞接种于6孔板。待细胞贴壁后,换成含有不同浓度的雷公藤红素溶液培养基。2–3周后,用甲醇固定,再用0.1%结晶紫染色,最后在显微镜下记录含有50个以上细胞的克隆数,重复计数3次,计算出其平均克隆数。
1.6 流式细胞仪检测细胞凋亡分别用DMSO (阴性对照)和不同浓度的雷公藤红素溶液培养白血病细胞,24 h后收集细胞,先用PBS清洗,再用Annexin-FITC及PI染色,最后运用流式细胞仪(德国Partec公司)检测细胞凋亡情况。
1.7 Western blotting定量分析凋亡相关蛋白表达水平分别用DMSO和不同浓度的雷公藤红素溶液培养ATL-T和TL-Oml细胞,48 h后用RIPA细胞裂解液提取总蛋白。变性后的总蛋白样进行垂直凝胶电泳及蛋白印迹转膜(美国Bio-Rad公司),奶粉封闭,抗体孵育,最后加入ECL (电化学发光试剂)进行发光反应,使用蛋白曝光仪(上海天能)拍照。
1.8 双荧光素酶报告基因检测相关基因的启动子活性将1×105个/孔白血病细胞接种于12孔板,12 h后转染所需质粒,再过12 h加入雷公藤红素溶液,继续培养24 h后,收集细胞,使用Promega公司双荧光素酶报告基因试剂盒检测荧光素酶活性。
1.9 实时荧光定量PCR检测基因转录水平使用Trizol法提取总RNA,利用Promega公司的逆转录试剂盒进行逆转录,以SYBR Green为探针,使用实时荧光定量PCR仪(德国耶拿公司)检测基因表达,反应结束后,采用2–??CT法分析实验数据。
1.10 统计方法采用Excel、SPSS19.0统计软件进行显著性检验,*P < 0.05,表示统计学上有显著性差异;**P < 0.01表示统计学上有极显著性差异;OriginProPorable8.5软件作图。
2 结果与分析2.1 雷公藤红素显著抑制多种成人T细胞白血病细胞的恶性增殖本实验采用4种成人T细胞白血病细胞株(ATL-T,ATL-2,MT-4和TL-Om1)研究雷公藤红素对成人T细胞白血病细胞增殖的影响。用0、1.25、2.5、5、10、20 μmol/L雷公藤红素溶液分别处理各细胞株,在0、24、48、72 h后通过MTT检测各细胞株的增殖情况。结果表明(图 2),雷公藤红素对多种成人T细胞白血病株的增殖都存在显著的抑制,且该抑制作用呈一定的剂量和时间依赖性。
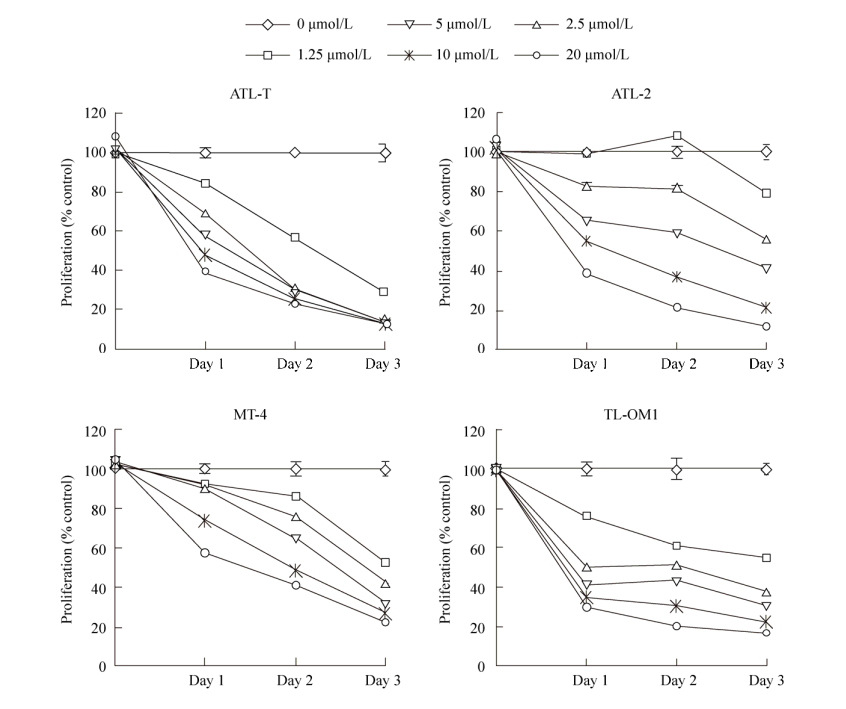 |
| 图 2 MTT检测雷公藤红素对四种成人T细胞白血病细胞生长的影响 Figure 2 Effects of celastrol on the growth of adult T-cell leukemia cells. The proliferation rate of leukemic cells was inhibited with the increase of celastrol concentration. Representative data from three independent experiments were shown. |
| 图选项 |
为了再次确认雷公藤红素对ATL细胞生长的抑制作用,我们采用了克隆形成实验。结果显示(图 3),与DMSO处理的对照组相比,雷公藤红素处理的ATL-T细胞形成克隆的个数随着浓度的增加而减少,并且该抑制作用呈现出一定浓度依赖性。
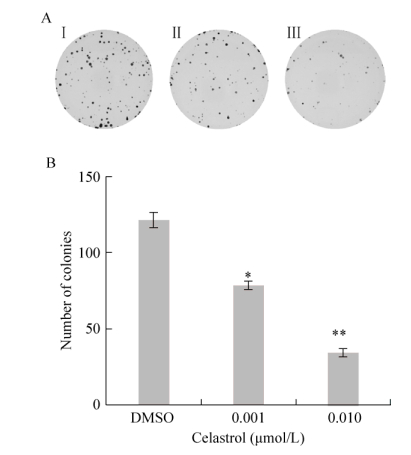 |
| 图 3 克隆形成检测雷公藤红素对ATL-T生长的影响 Figure 3 Effects of celastrol on the growth of ATL-T cells. (A) Influence of celastrol on colony forming efficiency of ATL-T cells.Ⅰ: control group; Ⅱ: 0.001 μmol/L celastrol group; Ⅲ: 0.01 μmol/L celastrol group. (B) Quantitative representation of colonies of ATL-T cells. Asterisks denote significance compared with control (DMSO). *P < 0.05; **P < 0.01. |
| 图选项 |
2.2 雷公藤红素可诱导白血病细胞凋亡根据上述结果,我们发现雷公藤红素对ATL-T、TL-Om1细胞增殖的抑制效果最明显,因此选择将ATL-T、TL-Om1作为主要的研究对象,进一步探索雷公藤红素抑制成人T细胞白血病细胞增殖的分子机制。为了研究雷公藤红素是否能促进成人T细胞白血病细胞的凋亡,选用0、0.5、2.5 μmol/L的雷公藤红素溶液处理ATL-T、TL-Om1细胞,24 h后收集细胞,运用流式细胞术检测细胞的凋亡情况。结果表明(图 4),DMSO处理组细胞的凋亡率分别为1.2%、1.9%,随着雷公藤红素浓度增加细胞的凋亡率也明显增加,在雷公藤红素浓度为0.5 μmol/L时,ATL-T、TL-Om1细胞凋亡率分别为6.7%和12.1%,而在2.5 μmol/L时ATL-T、TL-Om1细胞凋亡率分别达到了23.3%和68.7%。结果表明雷公藤红素能显著诱导成人T细胞白血病细胞凋亡,且该作用呈现出一定药物浓度依赖性。
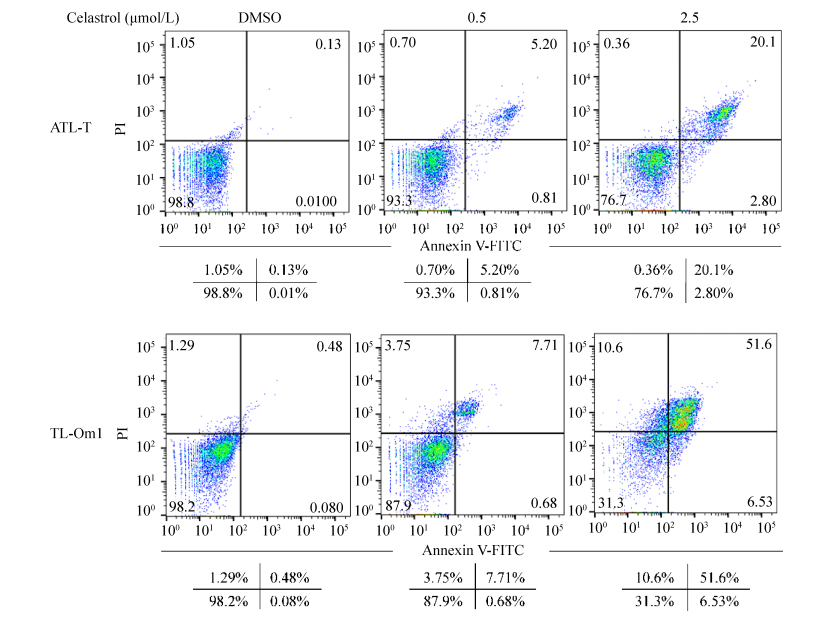 |
| 图 4 流式细胞检测雷公藤红素对ATL-T、TL-Om1凋亡的影响 Figure 4 Flow cytometry shows effect of celastrol on the apoptosis of ATL-T and TL-Om1 cells. The percentages of each fraction were shown. Three major populations of cells can be observed in the cytotoxicity assay: Annexin V-/PI-cells are defined as live cells, Annexin V+/PI-cells as apoptotic cells and PI+ as dead cells (late apoptotic or necrotic). |
| 图选项 |
2.3 雷公藤红素通过caspase途径诱导成人T细胞白血病细胞凋亡为了进一步揭示雷公藤红素促进成人T细胞白血病细胞凋亡的分子机制,我们随后检测了经典caspase凋亡途径中的执行者Caspase3/7蛋白的表达,并选取甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参蛋白。选择5、10 μmol/L的雷公藤红素溶液处理ATL-T细胞,由于TL-Om1对雷公藤红素更为敏感,故在处理TL-Om1细胞时选择雷公藤红素浓度为2、4 μmol/L。Western blotting检测结果显示(图 5),与对照组相比,雷公藤红素处理两种ATL细胞株后,Caspase3/7蛋白均出现了剪切条带。该结果表明雷公藤红素能激活caspase途径,从而诱导成人T细胞白血病细胞凋亡。
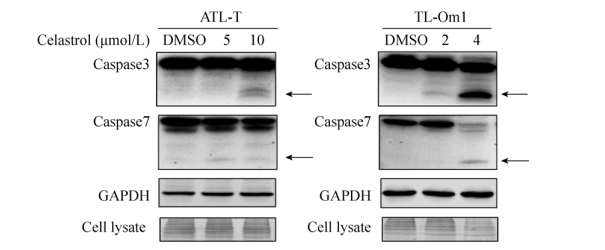 |
| 图 5 雷公藤红素对ATL-T、TL-Om1细胞Caspase家族蛋白表达的影响 Figure 5 Effect of celastrol on Caspase family proteins expression in ATL-T and TL-Om1 cells. Protein extracts were immunoblotted with antibodies against Caspase3, Caspase7 and GAPDH (loading control). The arrow indicates the cleaved form of caspase protein. |
| 图选项 |
2.4 雷公藤红素参与调控Bax、Bcl-2蛋白表达Bcl-2家族蛋白在细胞凋亡起着“主开关”作用,我们运用Western blotting技术检测了Bcl-2家族蛋白中的关键蛋白Bax、Bcl-2以及内参蛋白GAPDH的表达。结果如图 6A所示,随着雷公藤红素浓度的增加,在ATL-T和TL-Om1细胞中的促凋亡蛋白Bax表达显著上调,而抗凋亡蛋白Bcl-2的表达则明显降低。为了进一步分析雷公藤红素调控Bcl-2家族蛋白表达的分子机制,构建了含有Bax启动子区域的报告基因质粒Bax-Luc,并运用双荧光素酶报告基因实验分析了雷公藤红素对Bax启动子的影响。结果如图 6B所示,随着雷公藤红素浓度的增加,Bax-Luc的荧光强度也随之增加,表明雷公藤红素能增强Bax基因启动子的活性。因此,我们推测雷公藤红素通过增强Bax启动子的活性从而促进了Bax蛋白的表达,最终诱导成人T细胞白血病细胞的凋亡。
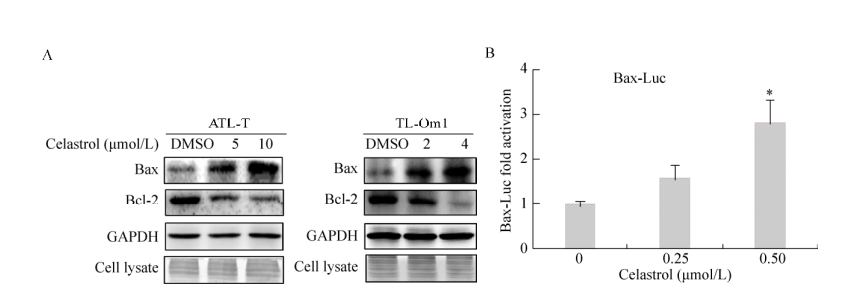 |
| 图 6 雷公藤红素对ATL-T、TL-Om1细胞Bcl-2家族蛋白表达及对Bax启动子活力的影响 Figure 6 Effect of celastrol on Bcl-2 family proteins expression and Bax promoter activity. (A) Protein extracts were immunoblotted with antibodies against Bax, Bcl-2 and GAPDH (loading control). (B) Celastrol enhanced Bax promoter activity in Jurkat cells. Cells were transfected with the Bax reporter plasmid with the different celastrol concentrations. Luciferase activity was measured. Asterisks denote significance compared with control (DMSO). *P < 0.05; **P < 0.01. |
| 图选项 |
2.5 雷公藤红素能抑制病毒蛋白Tax的表达研究表明雷公藤红素不仅能抑制肿瘤细胞的生长,同时它还有一定的抗病毒活性[18]。ATL是由HTLV-1病毒感染所引起,尤其是病毒编码的Tax蛋白在ATL发生过程中发挥着关键的作用。因此,我们探究了雷公藤红素是否通过调控病毒关键蛋白Tax的表达,从而抑制了细胞的增殖。结果显示(图 7),雷公藤红素处理ATL-T细胞48 h后,通过实时定量PCR和Western blotting检测发现不同浓度的雷公藤红素均能显著降低病毒核心蛋白Tax的表达量。该结果表明雷公藤红素能通过降低Tax蛋白的表达,从而抑制ATL的恶性增殖。
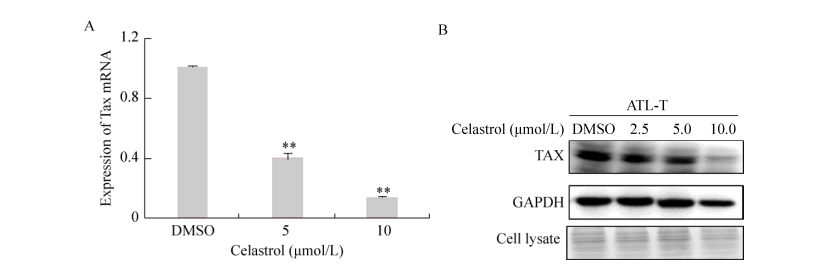 |
| 图 7 雷公藤红素对病毒蛋白Tax表达的影响 Figure 7 Effect of celastrol on viral protein Tax protein expression. (A) Expression of Tax transcripts was detected by RT-PCR in ATL-T cells after treating with celastrol. (B) ATL-T cells were treated with celastrol for 48 h. The expression of Tax and GAPDH were analyzed by Western blotting. Asterisks denote significance compared with control (DMSO). *P < 0.05; **P < 0.01. |
| 图选项 |
3 讨论近年来,有大量研究表明雷公藤红素作为一种天然的蛋白酶体抑制剂能显著抑制多种肿瘤细胞的恶性增殖[12-17]。本研究表明较低浓度的雷公藤红素能显著抑制成人T细胞白血病(ATL)细胞的增殖,且这种抑制呈现出时间及药物浓度依赖。通过流式细胞术发现雷公藤红素能诱导ATL细胞发生凋亡,从而抑制了细胞的增殖。
半胱氨酸天冬氨酸特异性蛋白酶(Caspase)家族在细胞凋亡中起着关键的作用,Lakhani等[19]认为Caspase-3/7是细胞发生凋亡的执行者,一旦被剪切激活就会引起级联介导的凋亡途径,从而引起细胞凋亡。而Bcl-2家族蛋白在细胞凋亡起着“主开关”作用,能调控线粒体膜的膜电位和通透性,促使线粒体释放促凋亡因子,从而激活了Caspase介导的凋亡途径[20-21]。有文献证实在非小细胞细胞肺癌A549[13]、乳腺癌[12]等细胞中雷公藤红素能显著促进细胞色素c、凋亡诱导因子释放,上调Bax蛋白表达,下调Bcl-2蛋白表达,从而促进肿瘤凋亡。本研究使用不同浓度的雷公藤红素处理ATL细胞,发现高浓度药物下Caspase3/7出现了明显的剪切带,并且显著降低了Bcl-2蛋白,上调了Bax蛋白,表明雷公藤红素很可能通过调控凋亡蛋白的表达,促进线粒体释放凋亡因子,从而调控细胞的凋亡。Del Poeta等[22]检测了急性髓型白血病患者Bcl-2、Bax的表达水平,发现Bax/Bcl-2的比值与患者的完全缓解率呈现正相关关系,表明Bax和Bcl-2可作为白血病的重要治疗靶标。本研究结果表明雷公藤红素能明显提高成人T细胞白血病细胞中Bax/Bcl-2的比值,这将为今后药物治疗成人T细胞白血病提供依据。
成人T细胞白血病ATL是一种由人类T细胞白血病病毒1型(HTLV-1)引起的侵袭性肿瘤。HTLV-1能编码一系列调节基因Tax、Rex、p12、p21和HBZ等[23]。有研究表明Tax蛋白参与调控细胞内多条肿瘤相关信号通路,促进白血病细胞恶性增殖,从而诱导白血病的发生[2, 4]。故我们推测雷公藤红素可能影响病毒蛋白Tax的表达,从而抑制细胞生长。本研究结果发现雷公藤红素能降低Tax蛋白水平,且在转录水平也存在明显的抑制。而Narayan等[18]发现雷公藤红素能显著抑制艾滋病病毒(HIV)前病毒基因Tat蛋白的活性,其机制是雷公藤红素通过共价修饰改变Tat蛋白的二级结构,抑制其转录激活功能,从而抑制HIV前病毒基因组的转录延伸。HTLV-1中的Tax功能与HIV中Tat的结构和功能较为相似,Tax也能促进HTLV-1病毒的5′LTR的活性,从而促进病毒蛋白的转录,故推测雷公藤红素可能通过抑制Tax的活性,抑制了HTLV-1病毒的5′LTR的活性,从而抑制了Tax自身的转录。后续研究将进一步探究其具体的分子作用机制,为今后运用雷公藤红素实现抗病毒治疗提供线索。
综上所述,雷公藤红素能显著抑制成人T细胞白血病细胞的增殖,并促进其凋亡,其机制可能是雷公藤红素通过调控Bcl-2家族蛋白,改变了粒体膜的膜电位和通透性,促使线粒体释放促凋亡因子,激活了Caspase介导的凋亡途径,从而促进细胞凋亡。本研究还发现雷公藤红素能抑制HTLV-1病毒蛋白Tax的表达,推测雷公藤红素可能是通过下调Tax的表达,抑制Tax对细胞内各信号通路的调控作用,从而抑制ATL的恶性增殖。本研究将为今后进一步开展动物实验,以及最终应用于临床提供了实验依据。
参考文献
| [1] | Bazarbachi A, Ghez D, Lepelletier Y, et al. New therapeutic approaches for adult T-cell leukaemia.Lancet Oncol, 2004, 5(11): 664–672.DOI: 10.1016/S1470-2045(04)01608-0 |
| [2] | Matsuoka M, Jeang KT. Human T-cell leukaemia virus type 1 (HTLV-1) infectivity and cellular transformation.Nat Rev Cancer, 2007, 7(4): 270–280.DOI: 10.1038/nrc2111 |
| [3] | Gallo RC. Research and discovery of the first human cancer virus, HTLV-1.Best Pract Res Clin Haematol, 2011, 24(4): 559–565.DOI: 10.1016/j.beha.2011.09.012 |
| [4] | Kfoury Y, Nasr R, Hermine O, et al. Proapoptotic regimes for HTLV-I-transformed cells: targeting Tax and the NF-κB pathway.Cell Death Differ, 2005, 12(Suppl 1): 871–877. |
| [5] | Bazarbachi A, Suarez F, Fields P, et al. How I treat adult T-cell leukemia/lymphoma.Blood, 2011, 118(7): 1736–1745.DOI: 10.1182/blood-2011-03-345702 |
| [6] | Hermine O, Wattel E, Gessain A, et al. Adult T cell leukaemia.BioDrugs, 1998, 10(6): 447–462.DOI: 10.2165/00063030-199810060-00003 |
| [7] | Mahieux R, Watanabe T. Forefront studies on HTLV-1 oncogenesis.Front Microbiol, 2013, 4: 156. |
| [8] | Tsukasaki K, Hermine O, Bazarbachi A, et al. Definition, prognostic factors, treatment, and response criteria of adult T-cell leukemia-lymphoma: a proposal from an international consensus meeting.J Clin Oncol, 2009, 27(3): 453–459.DOI: 10.1200/JCO.2008.18.2428 |
| [9] | Matsuoka M, Jeang KT. Human T-cell leukemia virus type 1 (HTLV-1) and leukemic transformation: viral infectivity, Tax, HBZ and therapy.Oncogene, 2011, 30(12): 1379–1389.DOI: 10.1038/onc.2010.537 |
| [10] | Peng A, Gu Y, Lin SY. Herbal treatment for renal diseases.Ann Acad Med Singapore, 2005, 34(1): 44–51. |
| [11] | Kim Y, Kang H, Jang SW, et al. Celastrol inhibits breast cancer cell invasion via suppression of NF-κB-mediated matrix metalloproteinase-9 expression.Cell Physiol Biochem, 2011, 28(2): 175–184.DOI: 10.1159/000331729 |
| [12] | Yang HS, Kim JY, Lee JH, et al. Celastrol isolated from Tripterygium regelii induces apoptosis through both caspase-dependent and-independent pathways in human breast cancer cells.Food Chem Toxicol, 2011, 49(2): 527–532.DOI: 10.1016/j.fct.2010.11.044 |
| [13] | Mou HB, Zheng Y, Zhao P, et al. Celastrol induces apoptosis in non-small-cell lung cancer A549 cells through activation of mitochondria- and Fas/FasL-mediated pathways.Toxicol in Vitro, 2011, 25(5): 1027–1032.DOI: 10.1016/j.tiv.2011.03.023 |
| [14] | Zhang T, Hamza A, Cao XH, et al. A novel Hsp90 inhibitor to disrupt Hsp90/Cdc37 complex against pancreatic cancer cells.Mol Cancer Ther, 2008, 7(1): 162–170.DOI: 10.1158/1535-7163.MCT-07-0484 |
| [15] | Huang YL, Zhou YX, Fan YS, et al. Celastrol inhibits the growth of human glioma xenografts in nude mice through suppressing VEGFR expression.Cancer Lett, 2008, 264(1): 101–106.DOI: 10.1016/j.canlet.2008.01.043 |
| [16] | Ma YL, Yi H, Yang FL, et al. Celastrol down-regulates expression of P-Akt and cyclin D1 in HL-60 cells and induces apoptosis.J Exp Hematol, 2010, 18(4): 898–902.(in Chinese). 马永岚, 易虹, 杨飞兰, 等. 雷公藤红素下调HL-60细胞P-Akt与Cyclin D1蛋白表达及其诱导细胞凋亡的效应.中国实验血液学杂志, 2010, 18(4): 898-902. |
| [17] | Yang HJ, Chen D, Cui QC, et al. Celastrol, a triterpene extracted from the Chinese "Thunder of God Vine", is a potent proteasome inhibitor and suppresses human prostate cancer growth in nude mice.Cancer Res, 2006, 66(9): 4758–4765.DOI: 10.1158/0008-5472.CAN-05-4529 |
| [18] | Narayan V, Ravindra KC, Chiaro C, et al. Celastrol inhibits Tat-mediated human immunodeficiency virus (HIV) transcription and replication.J Mol Biol, 2011, 410(5): 972–983.DOI: 10.1016/j.jmb.2011.04.013 |
| [19] | Lakhani SA, Masud A, Kuida K, et al. Caspases 3 and 7: key mediators of mitochondrial events of apoptosis.Science, 2006, 311(5762): 847–851.DOI: 10.1126/science.1115035 |
| [20] | Du YL, Yin F, Liu CJ, et al. Depression of MAD2 inhibits apoptosis of gastric cancer cells by upregulating Bcl-2 and interfering mitochondrion pathway.Biochem Biophys Res Commun, 2006, 345(3): 1092–1098.DOI: 10.1016/j.bbrc.2006.04.172 |
| [21] | Katoh I, Sato S, Fukunishi N, et al. Apaf-1-deficient fog mouse cell apoptosis involves hypo-polarization of the mitochondrial inner membrane, ATP depletion and citrate accumulation.Cell Res, 2008, 18(12): 1210–1219.DOI: 10.1038/cr.2008.87 |
| [22] | Del Poeta G, Venditti A, Del Principe MI, et al. Amount of spontaneous apoptosis detected by Bax/Bcl-2 ratio predicts outcome in acute myeloid leukemia (AML).Blood, 2003, 101(6): 2125–2131.DOI: 10.1182/blood-2002-06-1714 |
| [23] | Gaudray G, Gachon F, Basbous J, et al. The complementary strand of the human T-cell leukemia virus type 1 RNA genome encodes a bZIP transcription factor that down-regulates viral transcription.J Virol, 2002, 76(24): 12813–12822.DOI: 10.1128/JVI.76.24.12813-12822.2002 |
