
 , 王人杰1,3,4, 崔飞云1,3,4, 刘海涛1,2,3,5, 陈李1,2,3,5
, 王人杰1,3,4, 崔飞云1,3,4, 刘海涛1,2,3,5, 陈李1,2,3,51 重庆大学 化学化工学院,重庆 400030;
2 重庆大学 新型微纳器件与系统技术重点学科实验室,重庆 400030;
3 重庆大学 光电技术与系统教育部重点实验室,重庆 400044;
4 重庆大学 微纳系统与新材料国际联合研发中心,重庆 400030;
5 重庆大学 光电工程学院,重庆 400044
收稿日期:2017-07-03;接收日期:2017-08-25 基金项目:国家自然科学基金(No. 21375156),国家高技术研究发展计划(863计划) (No. 2015AA021104),重庆市前沿研究重点项目(No. cstc2015jcyjBX0010),重庆市科学技术委员会社会民生科技创新项目(No. cstc2015shmszx00014)资助
摘要:生物被膜是细菌及其自身分泌的胞外聚合物组成的微生物群落,其形成是受多种机制共同调控的多阶段动态过程,具有较强的耐药性且难以清除,给医疗、食品等行业带来了巨大的威胁。近年来,生物被膜的相关研究领域备受关注,尤其是针对生物被膜的有效检测技术。本文在简要介绍生物被膜的特点、形成过程及群感效应对生物被膜的调控作用基础之上,总结了生物被膜常用的检测方法,重点针对电化学阻抗技术在生物被膜检测中的应用进行调研和讨论,并对基于微流控芯片的生物被膜电化学阻抗原位检测进行了综述和展望。
关键词:细菌 生物被膜 群感效应 电化学阻抗 微流控芯片
Detection of biofilms formation by electrochemical impedance spectroscopy
Lulu Liu1,3,4, Yi Xu1,2,3,4

 , Renjie Wang1,3,4, Feiyun Cui1,3,4, Haitao Liu1,2,3,5, Li Chen1,2,3,5
, Renjie Wang1,3,4, Feiyun Cui1,3,4, Haitao Liu1,2,3,5, Li Chen1,2,3,5 1 School of Chemistry and Chemical Engineering, Chongqing University, Chongqing 400030, China;
2 Key Disciplines Laboratory of Novel Micro-Nano Devices and System Technology, Chongqing University, Chongqing 400030, China;
3 Key Laboratory for Optoelectronic Technology & System of Ministry of Education, Chongqing University, Chongqing 400044, China;
4 International R & D Center of Micro-Nano Systems and New Materials Technology, Chongqing University, Chongqing 400030, China;
5 School of Optoelectronics Engineering, Chongqing University, Chongqing 400044, China
Received: July 3, 2017; Accepted: August 25, 2017
Supported by: National Natural Science Foundation of China (No. 21375156), National High Technology Research and Development Program of China (863 Program) (No. 2015AA021104), Frontier Research Key Projects of Chongqing Science and Technology Committee (No. cstc2015jcyjBX0010), Scientific and Technical Innovation Projects for People?s Livelihood of Chongqing Science and Technology Committee (No. cstc2015shmszx00014)
Corresponding author:Yi Xu. Tel: +86-23-65111022; E-mail: xuyibbd@sina.com
Abstract: Biofilms are microbial communities composed of bacteria cells and self-produced extracellular polymeric substances and lead to antibiotic resistance, forming a great threat in the fields of medicine, food industries and so on. The formation of biofilms is a multi-stage dynamic process regulated by multiple mechanisms. Recently, researchers paid much more attention to the related research areas of biofilms, especially the detection methods of biofilms. This paper introduced the characteristics and formation process of biofilms as well as the effects of quorum sensing on biofilms development. Meanwhile, we discussed the detection methods of biofilms, especially electrochemical impedance spectroscopy (EIS) in detection of biofilms in detail. Furthermore, we reviewed and predicted that microfluidic chips based EIS served as an in-situ and online monitoring method for biofilms growth.
Key words: bacteria biofilm quorum sensing electrochemical impedance spectroscopy microfluidic chip
生物被膜是为适应环境而在有生命或无生命的物体表面形成的有组织的微生物群落[1]。生物被膜可谓是细菌的天然保护屏障,为细菌提供了相对稳定的生存环境[2]。生物被膜在自然界中广泛存在[3],对人类生产生活的各个方面都有重要影响。据统计,65%的医源性感染与生物被膜相关[4],生物被膜内细菌的耐药性是医疗行业所面临的重大难题之一。此外,生物被膜会引发水污染影响饮用水质[5],导致食品污染[6]。
生物被膜的形成不是一蹴而就的,是一个细菌粘附到基质表面,并不断增殖分裂形成微菌落直至生物被膜发展成熟,最后生物被膜破裂细菌重新定植的多阶段动态过程[7]。生物被膜的形成既受外界环境的影响,又受细菌内部基因的调控,群感效应作为细菌进行信息传递的重要机制,它在生物被膜的形成中起到了重要的调节作用[8]。
生物被膜是当前的研究热点,而生物被膜的检测技术对于增进人类对生物被膜的认识及解决生物被膜带来的难题是必不可少的。本文首先从生物被膜的特点、形成过程及群感效应对生物被膜的调控作用等背景出发,在介绍目前常用的几种生物被膜检测方法基础之上,重点综述了电化学阻抗技术以及基于微流控芯片的电化学阻抗技术在生物被膜检测及研究中的应用和进展。
1 生物被膜的结构特点及形成过程1.1 生物被膜的结构特点过去人们常认为细菌倾向以游离的状态存在,是以单细胞的方式生存,直到17世纪,Van Leeuwenhoek发现固着在牙齿上的细菌是以细菌群落的形式存在的,生物被膜的理论才逐渐被人们所认可[9]。生物被膜研究之父Costerton将生物被膜定义为由粘附在有生命或无生命表面上并包裹在自分泌的胞外聚合物的细菌组成的微生物群落[4]。生物被膜广泛存在于自然界中,其更倾向于形成在潮湿的物体表面,如食品加工设备、医疗器械等[10]。生物被膜可有效地保护其中的细菌,使得膜内细菌具有更强地抵御过酸过碱、高温、高渗透压等不利生存环境的能力和更强的耐药性,有利于细菌更好地适应周围环境[11-12]。
生物被膜由粘附在物体表面的细菌及胞外基质组成。胞外基质主要指的是胞外聚合物(EPS),它是生物被膜的主要化学成分,胞外基质也包含蛋白质、DNA等物质[13]。例如,铜绿假单胞菌生物被膜胞外多糖主要是Pel、Psl和海藻酸盐,eDNA也是铜绿假单胞菌生物被膜的重要组成成分,其作用是维持生物被膜的稳定性[14]。生物被膜不是细菌及胞外聚合物(EPS)的简单聚合,而具有复杂的架构。例如,铜绿假单胞菌及枯草芽孢杆菌生物被膜中点缀有开放的水通道,这些水通道有利于生物被膜中营养物质及代谢废物的交换[15]。
1.2 生物被膜的形成过程生物被膜的形成是个动态而复杂的过程。这一过程可划分为几个主要的阶段:可逆粘附期、不可逆粘附期、微菌落的形成、生物被膜成熟期以及散播期[16-17](图 1)。在可逆粘附期,细菌通过鞭毛或菌毛可逆地粘附到物体表面,在这一时期细菌可以脱离表面重新回到浮游状态;之后细菌表面蛋白和胞外聚合物(EPS)协助细菌粘附到固体表面,可逆粘附转变为不可逆粘附[18],粘附期是生物被膜形成的关键时期,它是细菌由浮游状态到生物被膜形成的转折点;随后粘附的细菌不断增殖分裂,胞外聚合物(EPS)逐渐增多,形成微菌落直到形成成熟的生物被膜,在成熟的生物被膜中胞外聚合物(EPS)占生物被膜干重的90%,胞外聚合物(EPS)把生物被膜中的细菌粘附在一起,维持着生物被膜的三维结构,使得膜内细菌具有更强的耐药性,以及抵御不良环境的能力,如增强生物被膜内细菌对环境中有害金属离子的抗干扰能力[19-20],同时胞外聚合物(EPS)可积累群感效应信号分子、胞外酶、细菌次级代谢产物,为细菌提供了信息交流的场所[21];最后,生物被膜内细菌从成熟的膜中逃离,成为浮游菌,重新定植到新的表面,到达散播期,散播期不仅是上一个生物被膜形成周期的结束,而且是下一个生物被膜周期的开始[22]。有趣的是,研究发现生物被膜的结构随外界环境的改变而改变,如铜绿假单胞菌在氧气充足的条件下形成的生物被膜呈“蘑菇状”,而在无氧条件下可形成三维“网状”结构的生物被膜[23]。
 |
| 图 1 生物被膜形成过程示意图[7] Figure 1 Stages of biofilms development[7]. |
| 图选项 |
2 细菌群感效应与生物被膜1979年,Nealson等[24]在研究费氏弧菌生物发光现象时,首次提出了群感效应。群感效应又称细菌密度依赖型基因表达调控,它是细菌进行信号转导的重要机制。群感效应信号分子又称自诱导物,是细菌群感效应调节的关键因子,细菌具有产生、分泌、感知信号分子的能力,随着细菌数量的不断增加,信号分子的浓度逐渐增大,一旦外界环境中信号分子的浓度达到一定阈值时,细菌便启动其群感效应系统从而调控下游相关基因的表达[25-26]。不同种类的细菌具有不同类型的群感效应系统及信号分子。根据信号分子的结构差异,主要将其分为三大类,即革兰氏阴性菌产生的高丝氨酸内酯类信号分子(AHLs)、革兰氏阳性菌产生的多肽类信号分子(AIP)、部分革兰氏阴性菌和革兰氏阳性菌均会产生的呋喃酮二酯类信号分子(AI-2)。其中高丝氨酸内酯类信号分子(AHLs)用于革兰氏阴性菌之间的信息传递,多肽类信号分子(AIP)用于革兰氏阳性菌之间的信息传递,而呋喃酮二酯类信号分子(AI-2)是一种可用于革兰氏阴性菌及革兰氏阳性菌种间信息交流的群感效应信号分子[27-28]。近年来,随着人类对细菌群感效应现象的不断探索与深入研究,发现细菌的多种生物学过程都受到群感效应系统的调节,如细菌的生物发光、细菌次级代谢物的合成、病原菌毒力因子的分泌、孢子的形成、细菌群游现象、免疫逃逸、细菌抗药性的产生以及生物被膜的形成等[29-30]。
细菌生存的外部环境因素,以及包含群感效应系统、环二鸟苷酸(c-di-GMP)等在内的细菌内部调控系统共同调节着生物被膜的形成。细菌会随氧气的浓度、温度、培养基的营养状况、细菌代谢物以及细菌粘附的界面性质等外部环境因素的改变而调节其形成的生物被膜结构,从而更好地适应周围环境[7]。环二鸟苷酸(c-di-GMP)参与调控生物被膜形成的可逆粘附期、成熟期、散播期,决定着细菌是否会以生物被膜的方式生存[8]。细菌群感效应也与生物被膜的形成密切相关[31],在生物被膜形成过程中,可逆粘附期由于细菌在培养基中自由游动,不适于群感效应信号分子的累积,当附着的细菌分裂形成微菌落时,细菌密度增加,群感效应信号分子可逐渐达到足够的水平,从而开始调节生物被膜的成熟和分解,因此,群感效应主要在生物被膜的成熟期和散播期发挥调节作用[32]。不同的细菌调节生物被膜形成的机制有差异,根据细菌各自产生群感效应信号分子的类别主要可将其分为3类:以铜绿假单胞菌为代表的革兰氏阴性菌,此类细菌产生的群感效应信号分子为高丝氨酸内酯类信号分子(AHLs),铜绿假单胞菌通过群感效应信号分子调控鼠李糖脂的合成以及eDNA的分泌,鼠李糖脂在铜绿假单胞菌生物被膜形成后期发挥重要的作用,维持“蘑菇云”形状生物被膜内水通道的稳定性[33],eDNA可使铜绿假单胞菌生物被膜自我分解[34];以金黄色葡萄球菌为代表的革兰氏阳性菌,这类细菌产生的群感效应信号分子为多肽(AIP),金黄色葡萄球菌的群感效应系统可促进其蛋白酶和多肽酶的表达,加快生物被膜的分解[35];沙门氏菌、大肠杆菌等细菌利用呋喃酮二酯类信号分子(AI-2)去参与调控生物被膜的形成,该类信号分子对细菌共生生物被膜的形成至关重要[36],有文献报道野生型的链霉菌与放线菌可以形成致密的生物被膜,LuxS突变链霉菌与放线菌不能形成致密的生物被膜,当加入外源呋喃酮二酯类信号分子(AI-2)后恢复了链霉菌形成共生生物被膜的能力[37]。
近年来,抗生素的滥用使得细菌耐药性问题日益严重,目前急需寻找抵制细菌感染的新型药物[38]。研究表明,细菌耐药性的产生与生物被膜的形成密切相关[39],阐明群感效应与细菌生物被膜形成之间的内在联系,对开发以抑制群感效应为靶点的新型生物被膜抑制剂具有重要意义。而寻找抑制生物被膜的有效方法离不开生物被膜的分析检测技术,它使观测生物被膜的内部结构及分析生物被膜内细菌的生理状态成为可能,而实现生物被膜动态结构持续监测及对生物被膜生理状态进行实时分析,则对细菌检测方法和技术提出了新的需求和更高的要求。
3 生物被膜常见检测方法显微成像技术、生物化学及分子生物学领域相关技术的发展加深了人类对生物被膜的认识。目前,生物被膜检测方法大致可分为化学法、显微观察法、生物法[40]。表 1对生物被膜常用检测方法的特点进行了总结。
表 1 生物被膜检测方法及其特色和用途Table 1 Methods of biofilms detection and its characteristics and application
| Methods | Advantage | Disadvantage | Application | |
| Chemical methods | Crystal violet staining | Versatility, high-throughput | Lack of reproducibility, lack of sensitivity | Measurement of biofilm biomass |
| Reassuring staining | Non-toxic, less time-consuming | High lower limit, not suitable for poly-microbial consortia | Measurement of biofilm metabolic activity | |
| Microscopy methods | Confocal laser scanning microscopy | Resolution compatible with single cell visualization | Interference properties of biofilms with the fluorescence probes | Biofilm visualization |
| Scanning electron microscopy | Resolution higher than other imaging techniques | Tedious, time-consuming of sample preparation | Study of biofilm spatial structure | |
| Atomic force microscopy | Nondestructive technique | Inability to obtain a large area survey scan | In situ imaging of biofilm | |
| Microbiological and molecular methods | Colony formation units | Easy to perform | Time-consuming | Detection of bacterial concentration |
| Quantitative polymerase chain reaction (q-PCR) | Time-saving | Expensive, overestimates the number of cells due to the presence of eDNA | Detection of bacterial concentration |
表选项
化学法主要是利用能与生物被膜结合的化学试剂进行测定,可实现对生物被膜组分如胞外聚合物(EPS)的间接检测。例如,微孔板结晶紫染色法可实现对生物被膜的定量检测,不论是死菌、活菌、还是生物被膜基质都会被结晶紫染色,是评估生物被膜总生物量的有效方法[41]。此方法的主要优点是适用范围广,同一微孔板上可同时测定多组样本,但操作步骤繁琐、染色剂浓度、染色时间等因素都会对测试结果造成一定程度的影响,导致该方法重现性较差[42-43]。另外结晶紫是通用染色剂,不具有特异性,无法对细菌种类进行区分[44]。微孔板结晶紫染色法还可用于初步评价抗菌剂对生物被膜的清除效果[45]。刃天青是一种稳定的氧化还原指示剂,活细胞中的线粒体酶可将蓝色的刃天青还原为红色的异酚恶唑酮[46],同时其荧光性质也会发生变化,但死细胞却不能还原刃天青,因此刃天青染色法可用于评估生物被膜内细菌的活性[47]。刃天青水溶性好,对细菌细胞无毒,不影响细菌的正常代谢和基因表达,但此法检测限较高,且不同的细菌还原刃天青的速率不同,该方法不适用于检测混菌样本[48]。
显微观察法是利用激光共聚焦显微镜(CLSM)、电子显微镜(EM)、原子力学显微镜(AFM)等先进的仪器设备对生物被膜组成和内部结构进行可视化的观测方法。激光共聚焦显微镜(CLSM)可消除远离焦点的荧光信号,在焦平面上可达到单细胞水平的分辨率,通过专用的图像分析软件将从样本不同深度焦平面上获得的荧光信号进行整合分析,从而获得样本信息的三维结构[49],其可用于研究生物被膜的空间结构,提取生物被膜的厚度、粗糙程度、生物量等结构参数[50]。激光共聚焦显微镜(CLSM)对生物被膜可视化观测需结合各种荧光探针,如SYTO9和PI两种荧光探针联用可用于评价生物被膜内细菌的死活情况[51],其中SYTO9能够穿透所有细菌的细胞膜使细菌细胞染为绿色,而PI只能穿透受损细菌细胞的细胞膜使细菌细胞染为红色,因此,可利用激光共聚焦显微镜(CLSM)观察染色后生物被膜内细菌的颜色差异区别出死菌和活菌[52-53]。而ConA-FITC及PI两种荧光试剂联用可用于分析生物被膜内胞外聚合物(EPS)及细菌细胞的分布情况,其中ConA-FITC可标记生物被膜内的胞外聚合物(EPS),PI可标记生物被膜内的细菌细胞[54-55]。除了激光共聚焦显微镜(CLSM)外,扫描电子显微镜(SEM)也可用于生物被膜的可视化观测。扫描电子显微镜(SEM)可探测生物被膜的空间结构及胞外聚合物(EPS)的存在,广泛应用于生物被膜研究中[56],还可评估抗菌剂对生物被膜形成的抑制效果[57]。SEM具有分辨率高、放大范围宽等优点,但是进行SEM观测之前需要对生物被膜样品进行处理,包括固定、脱水、干燥以及喷金,制备过程可能破坏生物被膜的结构[58]。原子力学显微镜(ATM)是在纳米及微米尺度对生物样品进行无损可视化观测的新兴技术,可对生物被膜进行可视化观测及获得生物被膜内部结构信息[59-60]。
平板计数法及聚合酶链式反应(PCR)是生物被膜检测主要采用的生物法。平板计数法可计算生物被膜样本中细菌浓度,该方法简单易行,但耗时长[61]。聚合酶链式反应(PCR)是广泛应用的基因学方法,可用于检测生物被膜内细菌的基因序列及用于生物被膜内细菌的定量检测[62]。
上文述及的生物被膜检测方法各有优缺点。但是,这些检测方法存在一些共同的缺点,即只能对某个时刻形成的生物被膜进行检测及表征,未能对生物被膜形成过程进行连续检测。另一方面,化学法及显微观察法在对生物被膜样本检测之前需要对其进行预处理,如标记各种荧光试剂、利用染色剂对生物被膜进行染色等。预处理过程在一定程度上会破坏生物被膜本身结构,可能会导致检测结果与生物被膜的真实状态有一定差距。从生物被膜显微图像上分析生物被膜结构信息的观察法需要借助经验,具有一定的主观性,很难客观地对生物被膜进行量化分析。因此,目前急需发展研究生物被膜形成过程的持续、无损、免标记检测方法,这将有助于加深人类对生物被膜形成的认识,从而为寻找清除生物被膜的有效策略奠定基础。
4 生物被膜的电化学阻抗检测4.1 生物被膜电化学阻抗检测现状电化学阻抗是以小振幅的正弦波电势或电流为扰动信号,使电极系统产生近似线性的关系响应,测量电极系统在很宽频率范围内的阻抗谱,从而研究电极过程动力学信息和电极界面结构信息的方法,在材料、金属腐蚀、电池性能研究等诸多领域有着广泛的应用。电化学阻抗法所施加扰动信号很小,避免对体系产生较大影响,可实现无损检测。此外,电化学阻抗法无需样品标记,还可进行原位实时分析[63]。生物被膜的形成不是一蹴而就的,而是个多阶段的动态过程,处于不同生长时期的生物被膜,不仅在结构上存在差异,而且膜内细菌的代谢状况也会有所差别。与生物被膜常规检测方法相较,电化学阻抗无疑是检测生物被膜动态形成过程的选择之一。同时,电化学阻抗在很宽的频率范围研究待测体系的信号响应,可获得更多电极表面粘附的生物被膜生长发展过程的相关信息[64-65]。
等效电路模型的构建是采用电化学阻抗法检测生物被膜的关键,等效电路模型中生物被膜相关电阻及电容元件参数值的变化情况与生物被膜生长状态密切相关。生物被膜主要由细菌菌体及包裹在细菌外的胞外聚合物(EPS)组成,理想条件下可将生物被膜中的细菌看作是电容元件,而生物被膜中的胞外聚合物(EPS)看作是电阻元件,一旦细菌成功地粘附到电极表面并逐渐形成生物被膜后,会引起电极-溶液界面信息的改变,从而通过等效电路模型对电极表面粘附的生物被膜进行分析[66-67]。在生物被膜电化学阻抗检测中,电极表面粘附的生物被膜和细菌细胞的生长变化是影响待测电极体系双层电容及电阻改变的主要原因。此外,粘附在电极表面的蛋白质等大分子物质也会在一定程度上改变待测电极体系的双层电容。细菌可能产生的具有电活性的次级代谢物、培养液中游离细菌的浓度变化、培养液中营养物质的消耗等则是影响待测电极体系溶液电阻改变的重要因素(图 2)。
 |
| 图 2 生物被膜引起阻抗改变的因素 Figure 2 Scheme of the impedance response factors caused by microorganisms. |
| 图选项 |
在采用电化学阻抗法检测生物被膜形成过程中,电极表面粗糙程度、材质等因素会影响细菌在电极表面处的粘附及生物被膜的形成[68]。近年来,人们利用电化学阻抗研究了各种电极表面处形成的生物被膜。例如,Kim等[69]将金电极插入含有铜绿假单胞菌PA14培养液的电解池中进行孵育,使该细菌粘附到金电极表面进而形成生物被膜,为了消除细菌本身代谢物对阻抗信号的影响,又将粘附有生物被膜的金电极插入到新鲜配制的培养液中,进行电化学阻抗测试,并采用等效电路模型对不同孵育时间获得的阻抗值进行拟合,发现金电极表面生物被膜的粘附会导致双层电容值减少。Ward等[70]使用低成本的丝网印刷碳电极,利用电化学阻抗法分别对铜绿假单胞菌、金黄色葡萄球菌以及这两种细菌形成的生物被膜进行了长达3 d的持续检测,发现在生物被膜生长过程的不同时刻得到的阻抗信号存在差异,还发现铜绿假单胞菌产生的绿脓菌素是造成阻抗信号差异的可能原因之一。
相比金电极、丝网印刷碳电极等传统电极,叉指微电极具有阻抗降低、可快速建立稳态信号、信噪比高、灵敏度高等优点,并可在有限的空间里提供相对较大的电极检测面积[71-72]。因此,将叉指微电极应用于生物被膜的阻抗检测中,检测灵敏度可得到一定程度的提高。如Kim等[73]利用叉指微电极对铜绿假单胞菌PAO1生物被膜形成过程的早期粘附期进行了阻抗测试,发现早期细菌的粘附会导致双层电容减少,通过等效电路模型计算得出细菌粘附1 h后,双层电容值下降近15%,证实了双层电容可作为检测早期生物被膜粘附的关键参数。
综上,电化学阻抗法检测生物被膜无需标记,且较小的扰动电压在检测过程中不会影响生物被膜内细菌的代谢和生长,可实现生物被膜的原位在线无损检测。在生物被膜原位连续阻抗监测中,为了保证生物被膜生长过程中所需的营养物质,电解液通常都是未添加氧化还原探针的培养基,电极界面处生物被膜的发展变化主要引起的是体系双层电容等参数的改变。
4.2 微流控芯片应用于电化学阻抗生物被膜检测新进展微流控芯片可集成不同的生化功能单元及实现高灵敏度、高通量检测[74],具有样品需求量小、操作简便的优势,提供比常规体系更加稳定的微环境[75-76],其用于生物被膜的检测具有很大优势。将细菌引入到微流控芯片的微通道中,在微流控芯片电极检测区形成生物被膜,可对其进行原位阻抗检测。此外,微流控芯片允许在人为可控的条件下研究生物被膜的生长情况,为生物被膜研究及在线监测提供了良好的平台。在此,我们详细介绍了近几年来文献报道的利用电化学阻抗检测生物被膜的微流控芯片。
Ben-Yoav等[77]设计了由2个上下平行放置的氧化铟锡涂层电极(ITO)组装而成的微流控芯片装置,利用多聚物加工出椭圆形电解槽,在电解槽的底部和顶部分别留有矩形凹槽便于放置氧化铟锡涂层电极,分别在电解槽两侧打孔,便于向电解槽注入细菌培养液以及排除废液。将大肠杆菌菌液通入到该芯片中,完成细菌在氧化铟锡涂层电极上的粘附和形成生物被膜,再插入Ag/AgCl电极作为参比电极,与上下2个平行放置的氧化铟锡涂层电极构成三电极体系进行阻抗测试,利用等效电路模型分析了由大肠杆菌粘附及其生物被膜生长引起的电容和电阻的变化情况,发现培养0–23 h电容值升高而电阻值下降,之后电容值下降而电阻值升高,电容及电阻值的变化情况与大肠杆菌生物被膜的生长发展过程密切相关(图 3C)。
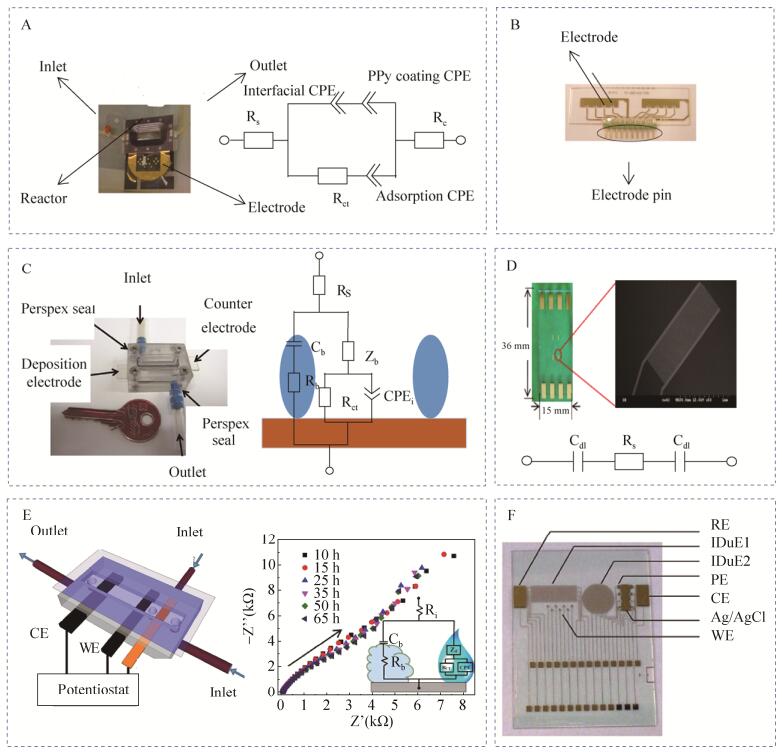 |
| 图 3 微流控芯片电化学阻抗检测生物被膜实例 Figure 3 Examples of the microfluidic chips applied for biofilms detection based on electrochemical impedance spectroscopy. (A) Microfluidic impedance chip for Pseudomonas aeruginosa biofilms detection based on gold electrodes deposited polypyrrole and a modified Randles circuit with an additional adsorption CPE and coating CPE to analysis impedance spectroscopy of Pseudomonas aeruginosa biofilms. (B) Photograph of a cyclic olefin copolymer substrate with gold electrodes and contact pins for impedance detection of Pseudomonas aeruginosa biofilms. (C) Microfluidic impedance chip for E. coli biofilms detection based on indium-tin-oxide-coated electrodes and equivalent electrical circuit which described the electrochemical interactions between the biomaterial and the conducting surface. (D) Microfluidic impedance chip containing four interdigital microelectrodes for E. coli detection in urine samples and equivalent electrical circuit for impedance analysis. (E) Schematic layout of the microfluidic impedance chip for Pseudomonas fluorescens biofilms detection based on graphite electrodes and time series Nyquist curves of Pseudomonas fluorescens biofilms growth. (F) Microfluidic impedance chip containing reference electrode(RE), interdigital microelectrode(IDuE), punctual electrode(PE), counter electrode(CE), Ag/AgCl electrode, and working electrode(WE) for Staphylococcus aureus biofilms detection. |
| 图选项 |
Zheng等[78]采用光刻技术在聚乙烯对苯二酸酯(PET)基质上先后蒸发溅射一层铬层和金层,制作出3个不同尺寸的金参比电极和5个不同尺寸的金工作电极,可通过改变工作电极和参比电极的尺寸大小和两者之间的距离,对电化学阻抗测试操作条件进行优化;之后将生物相容性良好、稳定性良好的聚吡咯(ppy)修饰到金电极表面,增强金电极对生物被膜粘附能力。将聚碳酸酯电化学流动池和包含电极的基质材料进行组装,实现外部培养基及菌液的注入,对铜绿假单胞菌的生物被膜进行了长达232 h的原位阻抗信号监测,用等效电路模型进行拟合计算,发现修饰聚吡咯的金电极与未修饰的金电极相比,对等效电路中的电荷转移阻抗Rct具有更高的灵敏度(图 3A)。
Pires等[79]设计了基于金电极阵列的多通道微流控芯片,该芯片由1条上游参比通道和1条下游测量通道构成,测量通道中4个相同的金工作电极可同时监测铜绿假单胞菌生物被膜的发展变化引起的阻抗信号,这既可减少因局部环境不同造成的实验误差,又可实现多通道的并行检测。他们利用此芯片对铜绿假单胞菌生物被膜进行了原位实时阻抗监测,并通过测试通道内电流随着培养时间的变化情况评估生物被膜内细菌的生活状态。此外,还评价了杀菌剂叠氮化钠的杀菌效果及对生物被膜的清除效果,由阻抗测试和电流测试结果,得出叠氮化钠有一定的杀菌效果,但不能完全瓦解已形成的生物被膜(图 3B)。
近年来,在微流控芯片微通道里利用叉指微电极开展了基于电化学阻抗检测生物被膜的生长情况。Settu等[80]采用微机电加工技术将4个相同的叉指微电极集成到玻璃基片上,再使用硅橡胶粘合剂将聚苯乙烯腔体整合到基片上部,实现外部培养液及菌液的引入,对含大肠杆菌尿液样本进行了12 h的监测,利用等效电路模型分析了随细菌培养时间延长所导致的阻抗信号的变化情况,发现Cdl随着培养时间延长显示出减少趋势,大肠杆菌的粘附及其生物被膜的形成是造成其变化的主要原因(图 3D)。Estrada-Leypon等[81]设计了用于金黄色葡萄球菌生物被膜原位实时检测的微流控电化学阻抗芯片,该芯片基片包含两种叉指微电极、参比电极、对电极以及测试K+、Na+的PE电极,芯片盖片由聚二甲基硅氧烷(PDMS)材料制作,其中两种叉指微电极用于金黄色葡萄球菌生物被膜的阻抗测试。他们利用有限元法对矩形叉指电极的几何尺寸进行了优化,并将优化后的矩形叉指微电极与圆形叉指微电极获得的生物被膜阻抗信号进行比较,发现矩形叉指微电极的检测灵敏度得到了提高,并将显微观测技术与阻抗技术相结合,同时观测和检测金黄色葡萄球菌生物被膜的生长情况(图 3F)。
生物被膜的形成会受到周围环境因素的影响,如培养基、温度等,满足生物被膜生长所需培养基的流动状态也会影响生物被膜的结构[82-83],在流动状态下形成的生物被膜与生物被膜造成感染的环境更加接近。利用微流控技术在流动状态下研究生物被膜的形成更有价值。Zarabadi等[84]将石墨工作电极及石墨参比电极剪切成长条状,再通过电沉积法制作金工作电极,将3个电极用双面胶粘合于硅基片上,将聚二甲基硅氧烷(PDMS)浇筑到模具上制作出微通道再与含3个电极的硅基片贴合,成功构建实验所需微流控芯片装置(图 3E)。利用此微流控芯片装置分别对流动状态下微通道拐角及中心处铜绿假单胞菌形成的生物被膜进行了长达65 h的在线监测,并采用等效电路模型对微通道拐角及中心处获得的生物被膜阻抗信号进行拟合分析,发现随培养时间的延长,微通道拐角及中心处拟合得到的生物被膜电容Cb均先增加后减少,生物被膜电阻Rb均呈现降低趋势,但相比微通道中心,微通道拐角处拟合得到的生物被膜电阻Rb较大,可能是由于两处形成的生物被膜结构存在差异。
综上所述,不同的细菌种类成膜能力及其形成时间会存在差异,电化学阻抗是通过获取生物被膜响应的阻抗信号进行检测,阻抗信号本身不具有特异性。但是,不同的细菌生物被膜响应的阻抗信号有所不同,我们可通过控制及优化阻抗检测的相关参数,由阻抗相关参数对不同种细菌形成的生物被膜进行区分。电极的材料构型及等效电路分析模型是应用电化学阻抗检测生物被膜的关键。相同细菌在不同的电极表面处生物被膜的形成情况也可能存在差异,对生物被膜检测具有高灵敏度且易于粘附细菌的电极材料及电极结构设计有待进一步研究。针对不同的生物被膜阻抗检测体系,会有不同的等效电路分析模型,且模型选择不同,拟合得到的生物被膜相关电容及电阻结果也存在差异。细菌生物被膜的形成过程分为可逆粘附期、不可逆粘附期、成熟期及散播期,处于不同时期的生物被膜具有不同的结构,因此不同时刻获得的生物被膜阻抗谱图呈现出规律性的变化趋势,等效电路拟合得到的生物被膜相关电容及电阻也会呈现出一定的变化规律,但目前的研究还未能清晰地由阻抗分析结果严格区分生物被膜所处的生长周期。所以今后,深入解析生物被膜特征阻抗信号并建立生物被膜与阻抗分析结果的关联模型是完善电化学阻抗检测生物被膜研究的一个重点。微流控芯片具有便携、易于功能化及集成化的特点,如何充分发挥微流控芯片本身的优势,并将其与电化学阻抗技术有机结合起来应用到生物被膜的检测及生物被膜形成机制的研究中,是今后具有特色的研究方向之一。
5 总结及展望自人类认识到细菌不单是以个体的形式存在,还会以群体的方式即生物被膜的形式存在以来,生物被膜的研究就一直备受关注。生物被膜的形成既受到周围环境因素的影响,又受到细菌内基因的调控。细菌群感效应是一种调节生物被膜形成的重要机制。当前,生物被膜的检测方法显得尤为重要,它是解决由生物被膜引发院内感染及食品污染等问题的基础。结晶紫染色、激光共聚焦(CLSM)显微观测等方法虽可对生物被膜的结构进行表征,但不能满足对生物被膜动态形成过程的持续在线检测。此时,电化学阻抗以其无标、无损、原位持续在线检测的优势,应用到生物被膜动态形成过程的检测中恰到好处。在生物被膜阻抗检测中,电极的选择是决定检测灵敏度的关键,一方面,可对普通电极表面进行化学修饰以提高生物被膜阻抗信号响应灵敏度;另一方面,设计制作超灵敏微电极,并将微电极集成到微流控芯片中,合理布局微流控芯片功能区,即可提高生物被膜电化学阻抗检测灵敏度,又可发挥出微流控芯片本身的优势,以实现生物被膜形成过程的高通量检测。除此之外,微流控芯片微通道微环境中受外界干扰小,可对流体流速等条件进行人为操纵,具有模拟人体内环境的潜能, 微流控芯片为电化学阻抗研究体内生物被膜在肺部、肠道等部位的感染及生物被膜形成情况提供了良好的操作平台。总之,将微流控芯片与电化学阻抗结合在生物被膜检测方面较常规体系具有很大优势。今后,用于生物被膜阻抗检测的高灵敏电极结构设计及电极修饰、满足生物被膜在不同环境下检测的微流控芯片设计是极具前景和重大意义的研究方向。
参考文献
| [1] | O'Toole G, Kaplan HB, Kolter R. Biofilm formation as microbial development.Annu Rev Microbiol, 2000, 54: 49–79.DOI: 10.1146/annurev.micro.54.1.49 |
| [2] | Srivastava S, Bhargava A. Biofilms and human health.Biotechnol Lett, 2016, 38(1): 1–22.DOI: 10.1007/s10529-015-1960-8 |
| [3] | Stoodley P, Sauer K, Davies DG, et al. Biofilms as complex differentiated communities.Annu Rev Microbiol, 2002, 56: 187–209.DOI: 10.1146/annurev.micro.56.012302.160705 |
| [4] | Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections.Science, 1999, 284(5418): 1318–1322.DOI: 10.1126/science.284.5418.1318 |
| [5] | Wingender J, Flemming HC. Biofilms in drinking water and their role as reservoir for pathogens.Int J Hyg Environ Health, 2011, 214(6): 417–423.DOI: 10.1016/j.ijheh.2011.05.009 |
| [6] | Jahid IK, Ha SD. A review of microbial biofilms of produce: future challenge to food safety.Food Sci Biotechnol, 2012, 21(2): 299–316.DOI: 10.1007/s10068-012-0041-1 |
| [7] | Toyofuku M, Inaba T, Kiyokawa T, et al. Environmental factors that shape biofilm formation.Biosci Biotechnol Biochem, 2016, 80(1): 7–12. |
| [8] | Wolska KI, Grudniak AM, Rudnicka Z, et al. Genetic control of bacterial biofilms.J Appl Genet, 2016, 57(2): 225–238.DOI: 10.1007/s13353-015-0309-2 |
| [9] | Costerton JW, Geesey GG, Cheng KJ. How bacteria stick.Sci Am, 1978, 238(1): 86–95.DOI: 10.1038/scientificamerican0178-86 |
| [10] | Coughlan LM, Cotter PD, Hill C, et al. New weapons to fight old enemies: novel strategies for the (Bio)control of bacterial biofilms in the food industry.Front Microbiol, 2016, 7: 1641. |
| [11] | Pikuta EV, Hoover RB, Tang J. Microbial extremophiles at the limits of life.Crit Rev Microbiol, 2007, 33(3): 183–209.DOI: 10.1080/10408410701451948 |
| [12] | Smadhi M, de Bentzmann S, Imberty A, et al. Expeditive synthesis of trithiotriazine-cored glycoclusters and inhibition of Pseudomonas aeruginosa biofilm formation.Beilstein J Org Chem, 2014, 10: 1981–1990.DOI: 10.3762/bjoc.10.206 |
| [13] | Dickschat JS. Quorum sensing and bacterial biofilms.Nat Prod Rep, 2010, 27(3): 343–369.DOI: 10.1039/b804469b |
| [14] | Rybtke M, Hultqvist LD, Givskov M, et al. Pseudomonas aeruginosa biofilm infections: community structure, antimicrobial tolerance and immune response.J Mol Biol, 2015, 427(23): 3628–3645.DOI: 10.1016/j.jmb.2015.08.016 |
| [15] | Wilking JN, Zaburdaev V, de Volder M, et al. Liquid transport facilitated by channels in Bacillus subtilis biofilms.Proc Natl Acad Sci USA, 2013, 110(3): 848–852.DOI: 10.1073/pnas.1216376110 |
| [16] | Satpathy S, Sen SK, Pattanaik S, et al. Review on bacterial biofilm: an universal cause of contamination.Biocatal Agric Biotechnol, 2016, 7: 56–66. |
| [17] | Sauer K. The genomics and proteomics of biofilm formation.Genome Biol, 2003, 4(6): 219.DOI: 10.1186/gb-2003-4-6-219 |
| [18] | Petrova OE, Sauer K. Sticky situations: key components that control bacterial surface attachment.J Bacteriol, 2012, 194(10): 2413–2425.DOI: 10.1128/JB.00003-12 |
| [19] | Verstraeten N, Braeken K, Debkumari B, et al. Living on a surface: swarming and biofilm formation.Trends Microbiol, 2008, 16(10): 496–506.DOI: 10.1016/j.tim.2008.07.004 |
| [20] | Flemming HC, Neu TR, Wozniak DJ. The EPS matrix: the "house of biofilm cells".J Bacteriol, 2007, 189(22): 7945–7947.DOI: 10.1128/JB.00858-07 |
| [21] | Drescher K, Nadell CD, Stone HA, et al. Solutions to the public goods dilemma in bacterial biofilms.Curr Biol, 2014, 24(1): 50–55.DOI: 10.1016/j.cub.2013.10.030 |
| [22] | McDougald D, Rice SA, Barraud N, et al. Should we stay or should we go: mechanisms and ecological consequences for biofilm dispersal.Nat Rev Microbiol, 2012, 10(1): 39–50.DOI: 10.1038/nrmicro2695 |
| [23] | Hamada M, Toyofuku M, Miyano T, et al. cbb3-type cytochrome c oxidases, aerobic respiratory enzymes, impact the anaerobic life of Pseudomonas aeruginosa PAO1.J Bacteriol, 2014, 196(22): 3881–3889.DOI: 10.1128/JB.01978-14 |
| [24] | Nealson KH, Hastings JW. Bacterial bioluminescence: its control and ecological significance.Microbiol Rev, 1979, 43(4): 496–518. |
| [25] | Reading NC, Sperandio V. Quorum sensing: the many languages of bacteria.FEMS Microbiol Lett, 2006, 254(1): 1–11.DOI: 10.1111/fml.2006.254.issue-1 |
| [26] | Obst U. Quorum sensing: bacterial chatting.Anal Bioanal Chem, 2007, 387(2): 369–370.DOI: 10.1007/s00216-006-0965-5 |
| [27] | Tarighi S, Taheri P. Different aspects of bacterial communication signals.World J Microbiol Biotechnol, 2011, 27(6): 1267–1280.DOI: 10.1007/s11274-010-0575-4 |
| [28] | Hooshangi S, Bentley WE. From unicellular properties to multicellular behavior: bacteria quorum sensing circuitry and applications.Curr Opin Biotechnol, 2008, 19(6): 550–555.DOI: 10.1016/j.copbio.2008.10.007 |
| [29] | Yong YC, Zhong JJ. Impacts of quorum sensing on microbial metabolism and human health//Zhong JJ, Ed. Future Trends in Biotechnology. Berlin Heidelberg: Springer, 2013: 25-61. |
| [30] | Bassler BL, Losick R. Bacterially speaking.Cell, 2006, 125(2): 237–246.DOI: 10.1016/j.cell.2006.04.001 |
| [31] | Fazli M, Almblad H, Rybtke ML, et al. Regulation of biofilm formation in Pseudomonas and Burkholderia species.Environ Microbiol, 2014, 16(7): 1961–1981.DOI: 10.1111/emi.2014.16.issue-7 |
| [32] | Davies DG, Parsek MR, Pearson JP, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm.Science, 1998, 280(5361): 295–298.DOI: 10.1126/science.280.5361.295 |
| [33] | Davey ME, O'Toole GA. Microbial biofilms: from ecology to molecular genetics.Microbiol Mol Biol Rev, 2000, 64(4): 847–867.DOI: 10.1128/MMBR.64.4.847-867.2000 |
| [34] | Allesen-Holm M, Barken KB, Yang L, et al. A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms.Mol Microbiol, 2006, 59(4): 1114–1128.DOI: 10.1111/mmi.2006.59.issue-4 |
| [35] | Boles BR, Horswill AR. agr-mediated dispersal of Staphylococcus aureus biofilms.PLoS Path, 2008, 4(4): e1000052.DOI: 10.1371/journal.ppat.1000052 |
| [36] | Choudhary S, Schmidt-Dannert C. Applications of quorum sensing in biotechnology.Appl Microbiol Biotechnol, 2010, 86(5): 1267–1279.DOI: 10.1007/s00253-010-2521-7 |
| [37] | Rickard AH, Palmer RJ Jr, Blehert DS, et al. Autoinducer 2: a concentration-dependent signal for mutualistic bacterial biofilm growth.Mol Microbiol, 2006, 60(6): 1446–1456.DOI: 10.1111/mmi.2006.60.issue-6 |
| [38] | Rasamiravaka T, Vandeputte OM, Pottier L, et al. Pseudomonas aeruginosa biofilm formation and persistence, along with the production of quorum sensing-dependent virulence factors, are disrupted by a triterpenoid coumarate ester isolated from Dalbergia trichocarpa, a tropical legume.PLoS ONE, 2015, 10(7): e0132791.DOI: 10.1371/journal.pone.0132791 |
| [39] | Stepanovi? S, Vukovi? D, Daki? I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation.J Microbiol Methods, 2000, 40(2): 175–179.DOI: 10.1016/S0167-7012(00)00122-6 |
| [40] | Azeredo J, Azevedo NF, Briandet R, et al. Critical review on biofilm methods.Crit Rev Microbiol, 2017, 43(3): 313–351.DOI: 10.1080/1040841X.2016.1208146 |
| [41] | Pitts B, Hamilton MA, Zelver N, et al. A microtiter-plate screening method for biofilm disinfection and removal.J Microbiol Methods, 2003, 54(2): 269–276.DOI: 10.1016/S0167-7012(03)00034-4 |
| [42] | Aquino SF, Stuckey DC. Integrated model of the production of soluble microbial products (SMP) and extracellular polymeric substances (EPS) in anaerobic chemostats during transient conditions.Biochem Eng J, 2008, 38(2): 138–146.DOI: 10.1016/j.bej.2007.06.010 |
| [43] | Peeters E, Nelis HJ, Coenye T. Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates.J Microbiol Methods, 2008, 72(2): 157–165.DOI: 10.1016/j.mimet.2007.11.010 |
| [44] | Stepanovi? S, Vukovi? D, Hola V, et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci.APMIS, 2007, 115(8): 891–899.DOI: 10.1111/apm.2007.115.issue-8 |
| [45] | Wajima T, Anzai Y, Yamada T, et al. Oldenlandia diffusa extract inhibits biofilm formation by Haemophilus influenzae clinical isolates.PLoS ONE, 2016, 11(11): e0167335.DOI: 10.1371/journal.pone.0167335 |
| [46] | Pettit RK, Weber CA, Kean MJ, et al. Microplate Alamar blue assay for Staphylococcus epidermidis biofilm susceptibility testing.Antimicrob Agents Chemother, 2005, 49(7): 2612–2617.DOI: 10.1128/AAC.49.7.2612-2617.2005 |
| [47] | van den Driessche F, Rigole P, Brackman G, et al. Optimization of resazurin-based viability staining for quantification of microbial biofilms.J Microbiol Methods, 2014, 98: 31–34.DOI: 10.1016/j.mimet.2013.12.011 |
| [48] | Sandberg ME, Schellmann D, Brunhofer G, et al. Pros and cons of using resazurin staining for quantification of viable Staphylococcus aureus biofilms in a screening assay.J Microbiol Methods, 2009, 78(1): 104–106.DOI: 10.1016/j.mimet.2009.04.014 |
| [49] | Oubekka SD, Briandet R, Fontaine-Aupart MP, et al. Correlative time-resolved fluorescence microscopy to assess antibiotic diffusion-reaction in biofilms.Antimicrob Agents Chemother, 2012, 56(6): 3349–3358.DOI: 10.1128/AAC.00216-12 |
| [50] | Benoit MR, Conant CG, Ionescu-Zanetti C, et al. New device for high-throughput viability screening of flow biofilms.Appl Environ Microbiol, 2010, 76(13): 4136–4142.DOI: 10.1128/AEM.03065-09 |
| [51] | Boulos L, Prévost M, Barbeau B, et al. LIVE/DEAD? BacLightTM: application of a new rapid staining method for direct enumeration of viable and total bacteria in drinking water.J Microbiol Methods, 1999, 37(1): 77–86.DOI: 10.1016/S0167-7012(99)00048-2 |
| [52] | Garcez AS, Nú?ez SC, Azambuja N Jr, et al. Effects of photodynamic therapy on Gram-positive and Gram-negative bacterial biofilms by bioluminescence imaging and scanning electron microscopic analysis.Photomed Laser Surg, 2013, 31(11): 519–525.DOI: 10.1089/pho.2012.3341 |
| [53] | Guilbaud M, Piveteau P, Desvaux M, et al. Exploring the diversity of Listeria monocytogenes biofilm architecture by high-throughput confocal laser scanning microscopy and the predominance of the honeycomb-like morphotype.Appl Environ Microbiol, 2015, 81(5): 1813–1819.DOI: 10.1128/AEM.03173-14 |
| [54] | Daniels KJ, Park YN, Srikantha T, et al. Impact of environmental conditions on the form and function of Candida albicans Biofilms.Eukaryotic Cell, 2013, 12(10): 1389–1402.DOI: 10.1128/EC.00127-13 |
| [55] | Ansari MA, Khan HM, Khan AA, et al. Anti-biofilm efficacy of silver nanoparticles against MRSA and MRSE isolated from wounds in a tertiary care hospital.Indian J Med Microbiol, 2015, 33(1): 101–109.DOI: 10.4103/0255-0857.148402 |
| [56] | Hung C, Zhou YZ, Pinkner JS, et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure.mBio, 2013, 4(5): e00645–13. |
| [57] | Li YF, Sun HW, Gao R, et al. Inhibited biofilm formation and improved antibacterial activity of a novel nanoemulsion against cariogenic Streptococcus mutans in vitro and in vivo.Int J Nanomedicine, 2015, 10: 447–462.DOI: 10.2217/nnm.14.179 |
| [58] | Hannig C, Follo M, Hellwig E, et al. Visualization of adherent micro-organisms using different techniques.J Med Microbiol, 2010, 59(1): 1–7.DOI: 10.1099/jmm.0.015420-0 |
| [59] | Cabral V, Znaidi S, Walker LA, et al. Targeted changes of the cell wall proteome influence Candida albicans ability to form single-and multi-strain biofilms.PLoS Path, 2014, 10(12): e1004542.DOI: 10.1371/journal.ppat.1004542 |
| [60] | Chatterjee S, Biswas N, Datta A, et al. Atomic force microscopy in biofilm study.Microscopy, 2014, 63(4): 269–278.DOI: 10.1093/jmicro/dfu013 |
| [61] | Allen MJ, Edberg SC, Reasoner DJ. Heterotrophic plate count bacteria-what is their significance in drinking water?.Int J Food Microbiol, 2004, 92(3): 265–274.DOI: 10.1016/j.ijfoodmicro.2003.08.017 |
| [62] | Klein MI, Scott-Anne KM, Gregoire S, et al. Molecular approaches for viable bacterial population and transcriptional analyses in a rodent model of dental caries.Mol Oral Microbiol, 2012, 27(5): 350–361.DOI: 10.1111/omi.2012.27.issue-5 |
| [63] | Chang BY, Park SM. Electrochemical impedance spectroscopy.Annu Rev Anal Chem, 2010, 3(1): 207–229.DOI: 10.1146/annurev.anchem.012809.102211 |
| [64] | Daniels JS, Pourmand N. Label-free impedance biosensors: opportunities and challenges.Electroanalysis, 2007, 19(12): 1239–1257.DOI: 10.1002/(ISSN)1521-4109 |
| [65] | Franklin MJ, Nivens DE, Guckert JB, et al. Technical note: effect of electrochemical impedance spectroscopy on microbial biofilm cell numbers, viability, and activity.Corrosion, 1991, 47(7): 519–522.DOI: 10.5006/1.3585287 |
| [66] | Yang LJ, Li YB. Detection of viable Salmonella using microelectrode-based capacitance measurement coupled with immunomagnetic separation.J Microbiol Methods, 2006, 64(1): 9–16.DOI: 10.1016/j.mimet.2005.04.022 |
| [67] | Varshney M, Li YB. Interdigitated array microelectrode based impedance biosensor coupled with magnetic nanoparticle-antibody conjugates for detection of Escherichia coli O157:H7 in food samples.Biosens Bioelectron, 2007, 22(11): 2408–2414.DOI: 10.1016/j.bios.2006.08.030 |
| [68] | Bohinc K, Dra?i? G, Fink R, et al. Available surface dictates microbial adhesion capacity.Int J Adh Adhes, 2014, 50: 265–272.DOI: 10.1016/j.ijadhadh.2014.01.027 |
| [69] | Kim T, Kang J, Lee JH, et al. Influence of attached bacteria and biofilm on double-layer capacitance during biofilm monitoring by electrochemical impedance spectroscopy.Water Res, 2011, 45(15): 4615–4622.DOI: 10.1016/j.watres.2011.06.010 |
| [70] | Ward AC, Connolly P, Tucker NP. Pseudomonas aeruginosa can be detected in a polymicrobial competition model using impedance spectroscopy with a novel biosensor.PLoS ONE, 2014, 9(3): e91732.DOI: 10.1371/journal.pone.0091732 |
| [71] | Maruyama K, Ohkawa H, Ogawa S, et al. Fabrication and characterization of a nanometer-sized optical fiber electrode based on selective chemical etching for scanning electrochemical/optical microscopy.Anal Chem, 2006, 78(6): 1904–1912.DOI: 10.1021/ac0502549 |
| [72] | Ciszkowska M, Stojek Z. Vosltammetry in solutions of low ionic Strength. Electrochemical and analytical aspects.J Electroan Chem, 1999, 466(2): 129–143.DOI: 10.1016/S0022-0728(99)00141-2 |
| [73] | Kim S, Yu G, Kim T, et al. Rapid bacterial detection with an interdigitated array electrode by electrochemical impedance spectroscopy.Electrochim Acta, 2012, 82: 126–131.DOI: 10.1016/j.electacta.2012.05.131 |
| [74] | Wang R, Xu Y, Wang RJ, et al. A microfluidic chip based on an ITO support modified with Ag-Au nanocomposites for SERS based determination of melamine.Microchim Acta, 2017, 184(1): 279–287.DOI: 10.1007/s00604-016-1990-5 |
| [75] | Wang RJ, Ni YN, Xu Y, et al. Immuno-capture and in situ detection of Salmonella typhimurium on a novel microfluidic chip.Anal Chim Acta, 2015, 853: 710–717.DOI: 10.1016/j.aca.2014.10.042 |
| [76] | Wang RJ, Xu Y, Liu HT, et al. An integrated microsystem with dielectrophoresis enrichment and impedance detection for detection of Escherichia coli.Biomed Microdevices, 2017, 19(2): 34.DOI: 10.1007/s10544-017-0167-2 |
| [77] | Ben-Yoav H, Freeman A, Sternheim M, et al. An electrochemical impedance model for integrated bacterial biofilms.Electrochim Acta, 2011, 56(23): 7780–7786.DOI: 10.1016/j.electacta.2010.12.025 |
| [78] | Zheng LY, Congdon RB, Sadik OA, et al. Electrochemical measurements of biofilm development using polypyrrole enhanced flexible sensors.Sens Actuators B Chem, 2013, 182: 725–732.DOI: 10.1016/j.snb.2013.03.097 |
| [79] | Pires L, Sachsenheimer K, Kleintschek T, et al. Online monitoring of biofilm growth and activity using a combined multi-channel impedimetric and amperometric sensor.Biosens Bioelectron, 2013, 47: 157–163.DOI: 10.1016/j.bios.2013.03.015 |
| [80] | Settu K, Chen CJ, Liu JT, et al. Impedimetric method for measuring ultra-low E. coli concentrations in human urine.Biosens Bioelectron, 2015, 66: 244–250.DOI: 10.1016/j.bios.2014.11.027 |
| [81] | Estrada-Leypon O, Moya A, Guimera A, et al. Simultaneous monitoring of Staphylococcus aureus growth in a multi-parametric microfluidic platform using microscopy and impedance spectroscopy.Bioelectrochemistry, 2015, 105: 56–64.DOI: 10.1016/j.bioelechem.2015.05.006 |
| [82] | Stoodley P, Lewandowski Z, Boyle JD, et al. Oscillation characteristics of biofilm streamers in turbulent flowing water as related to drag and pressure drop.Biotechnol Bioeng, 1998, 57(5): 536–544.DOI: 10.1002/(ISSN)1097-0290 |
| [83] | Lee JH, Kaplan JB, Lee WY. Microfluidic devices for studying growth and detachment of Staphylococcus epidermidis biofilms.Biomed Microdevices, 2008, 10(4): 489–498.DOI: 10.1007/s10544-007-9157-0 |
| [84] | Zarabadi MP, Paquet-Mercier F, Charette SJ, et al. Hydrodynamic effects on biofilms at the biointerface using a microfluidic electrochemical cell: case study of Pseudomonas sp..Langmuir, 2017, 33(8): 2041–2049.DOI: 10.1021/acs.langmuir.6b03889 |
