

华中农业大学 生命科学技术学院 农业微生物学国家重点实验室,湖北 武汉 430070
收稿日期:2017-03-04;接收日期:2017-05-03 基金项目:国家自然科学基金(No. 31270105),中央高校基本科研专项资金(No. 2662015PY175) 资助
作者简介:何进??博士,华中农业大学生命科学技术学院教授,博导,生物工程系主任,生物工程专业负责人,农业微生物学国家重点实验室固定研究人员。1994年6月留校任教至今。其中2007?2008年在伊利诺伊大学微生物学系从事博士后研究。主要研究方向为微生物的代谢调控、细菌核苷类第二信使分子及非编码RNA的功能等。以责任作者身份发表SCI论文36篇。获武汉市科技进步二等奖1项。任Current Bioinformatics、《微生物学杂志》及《生物资源》等期刊的编委
摘要:环二鸟苷单磷酸(c-di-GMP)是细菌中广泛存在的一类核苷类第二信使分子,能够调控细菌的生物被膜形成、运动性、黏附、毒力以及胞外多糖的产生等众多生理活动。核糖开关是mRNA 5′-非翻译区(5′-Untranslational region, 5′-UTR)的一段RNA序列,包含可以识别并结合配体的保守序列——适配体区(Aptamer domain, AD),以及结构多变、可以调控下游编码基因的表达平台区(Expression platform, EP)。当代谢物分子浓度比较高时,其与适配体区结合,引起下游的表达平台区发生构象变化,进而实现对下游基因的调节。目前已发现c-di-GMP-Ⅰ和c-di-GMP-Ⅱ两类c-di-GMP的核糖开关。它们通过特异性地结合c-di-GMP,调控种类繁多的下游基因的表达。c-di-GMP-I核糖开关分布广泛,尤其在厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的细菌中最为丰富。c-di-GMP-Ⅱ核糖开关具备变构核酶的功能,结合c-di-GMP后在其非典型剪切位点处发生结构变化,调节下游基因表达。文中围绕c-di-GMP核糖开关的发现、功能、分类以及下游调控基因的功能进行综述与分析。
关键词:核苷类第二信使分子 环二鸟苷单磷酸 核糖开关 基因调控
Structure and function of c-di-GMP riboswitches
Li Xinfeng, Chen Fang, Xiao Jinfeng, He Jin


State Key Laboratory of Agricultural Microbiology, College of Life Science and Technology, Huazhong Agricultural University, Wuhan 430070, Hubei, China
Received: March 4, 2017; Accepted: May 3, 2017
Supported by: National Natural Science Foundation of China (No. 31270105), the Fundamental Research Funds for the Central Universities (No. 2662015PY175)
Corresponding author:Jin He. Tel/Fax: +86-27-87280670; E-mail: hejin@mail.hzau.edu.cn
Abstract: Cyclic diguanosine monophosphate (c-di-GMP) is a ubiquitous nucleotide second messenger present in a wide variety of bacteria. It regulates many important bacterial physiological functions such as biofilm formation, motility, adhesion, virulence and extracellular polysaccharide synthesis. It binds with many different proteins or RNA receptors, one of which is called riboswitch that is usually located at the 5′-untranslational region (5′-UTR) in some mRNA. Riboswitch usually comprises a specific ligand-binding (sensor) domain (named aptamer domain, AD), as well as a variable domain, termed expression platform (EP), to regulate expression of downstream coding sequences. When a specific metabolite concentration exceeds its threshold level, it will bind to its cognate riboswitch receptor to induce a conformational change of 5′-UTR, leading to modulation of downstream gene expression. Two classes of c-di-GMP-binding riboswitches (c-di-GMP-Ⅰ and c-di-GMP-Ⅱ) have been discovered that bind with this second messenger with high affinity to regulate diverse downstream genes, underscoring the importance of this unique RNA receptor in this pathway. Class Ⅰ c-di-GMP riboswitches are present in a wide variety of bacteria, and are most common in the phyla Firmicutes and Proteobacteria, while class Ⅱ c-di-GMP riboswitches typically function as allosteric ribozymes, binding to c-di-GMP to induce folding changes at atypical splicing site junctions to modulate downstream gene expression. This review introduces the discovery, classification, function, and also the affected downstream genes of c-di-GMP riboswitches.
Key words: nucleotide second messenger c-di-GMP riboswitch gene regulation
环二鸟苷单磷酸(Cyclic diguanosine monophosphate,c-di-GMP)是细菌体内普遍存在的一类核苷类第二信使,在细菌的代谢调控中处于中心调节的地位,广泛参与调控细菌的生长和分化、群体感应、生物被膜的形成和分泌、运动性、毒力等生理功能[1]。最近在产酶溶杆菌Lysobacter enzymogenes中发现c-di-GMP可以同时调节Ⅳ型菌毛以及抗真菌抗生素的生物合成[2]。c-di-GMP最早发现于1987年,是Benziman及其同事分析木驹形杆菌Komagataeibacter xylinus (当时称木醋酸杆菌Acetobacter xylinus)纤维素的产生机制时意外发现的[1, 3],c-di-GMP作为一种变构激活剂能显著提高纤维素合成酶的活性,自此开拓了c-di-GMP生理功能研究的新领域。目前对c-di-GMP的代谢和功能都有了较清楚的认识,它由含有GGDEF结构域的二鸟苷酸环化酶(Diguanylate cyclases, DGC)合成[4];通过含有EAL[5]或HD-GYP[6]结构域的磷酸二酯酶(Phosphodiesterase, PDE)降解。c-di-GMP可以与下游受体或靶标结合进而行使其生物学功能,其下游受体/靶标多种多样,包括:含有PilZ结构域的蛋白[7-8]、含有退化的GGDEF或EAL结构域的蛋白[9]、转录因子[10-11]、含有MshEN结构域的蛋白[12]、核糖开关[13-14]以及一些其他蛋白(如PNPase、YajQ、LCN2)[15-17]。其中,核糖开关是一种特殊的RNA类受体。
核糖开关一般位于mRNA的5′-非翻译区(5′-Untranslational region, 5′-UTR),由适配体区(Aptamer domain)和表达平台区(Expression platform)两部分组成。适配体区较为保守,可以特异性地结合某种小分子代谢物,感知并响应其浓度变化;表达平台区位于适配体区的下游,通常与适配体区有一定程度的重叠,序列多变。当适配体区结合代谢物后使下游的表达平台区发生构象变化,“开启”或“关闭”下游基因的表达,从而实现对下游基因的调节。核糖开关对下游基因的表达调控可以在转录水平通过形成终止子(Terminator)或抗终止子(Anti-terminator)实现;也可以在翻译水平通过掩盖SD序列形成隔离子(Sequestor)或通过释放SD序列形成抗隔离子(Anti-sequestor)实现。目前,已经发现20多种核糖开关,它们响应的代谢物即配体分子种类繁多,包括核苷酸代谢物、氨基酸、单糖衍生物、金属离子等,其中核苷类代谢物最为丰富,它们包括辅酶、维生素、第二信使分子等[18-19]。第二信使分子c-di-GMP核糖开关最初由耶鲁大学Breaker团队于2008年发现[13],2010年Breaker团队又发现一种不同类别的c-di-GMP核糖开关[14],根据二级结构和作用方式的不同分别将其命名为Ⅰ类(ClassⅠ) c-di-GMP核糖开关(c-di-GMP-Ⅰ)和Ⅱ类(Class Ⅱ) c-di-GMP核糖开关(c-di-GMP-Ⅱ)。c-di-GMP核糖开关的发现不仅拓宽了核糖开关感知的范围,也丰富了c-di-GMP的信号调控网络。本文围绕c-di-GMP核糖开关的发现、结构以及下游调控基因的功能进行综述与分析。
1 c-di-GMP核糖开关的发现c-di-GMP核糖开关最早发现于2008年,早在2006年时,Jenal和Malon就推测可能存在RNA分子识别并结合c-di-GMP[20]。2007年,Breaker团队通过比较基因组学的方法发现了一类保守的RNA序列,这类序列通常存在于环境、膜组装和细菌运动相关基因的5′-UTR中,并将其命名为GEMM (Genes for the environment, membranes and motility),并将其视为一种潜在的核糖开关[21]。GEMM广泛分布于细菌中,尤其是在变形菌门和厚壁菌门中。2008年,Breaker团队在体外证明了来自霍乱弧菌Vibrio cholerae的GEMM RNA序列能够与c-di-GMP特异性结合,解离常数KD≈1 nmol/L[13]。至此,他们正式提出这类GEMM RNA序列是一类能够特异性结合c-di-GMP的核糖开关。GEMM在结构上一般由3个发夹结构(P1、P2和P3) 组成(图 1A),P1序列比较保守,起到稳定构象的作用;P2的序列也比较保守,其末端通常是由GNRA组成的四元环(Tetraloop);P3发夹结构则根据其是否含有四元环的受体分成两种类型。Ⅰ型(TypeⅠ) GEMM P2上的四元环通常为GRRA,第二位碱基为R (嘌呤),P3上含有相应的四元环受体。Ⅱ型(TypeⅡ) GEMM P2上的四元环通常为GYRA,第二位碱基为Y (嘧啶),P3上没有对应的四元环受体[21]。
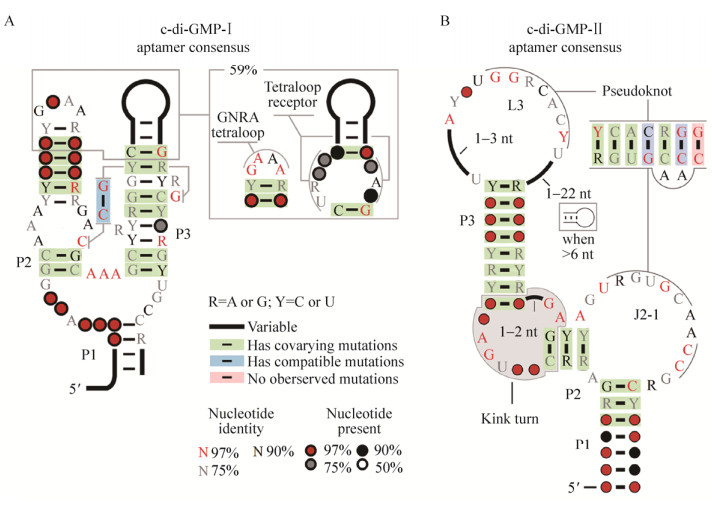 |
| 图 1 Ⅰ类与Ⅱ类c-di-GMP核糖开关适配体区的保守序列[14] Figure 1 The aptamer domain consensus of classⅠ and class Ⅱ c-di-GMP riboswitches[14] |
| 图选项 |
此后,人们又通过比较基因组学的方法预测出大量的保守RNA元件,其中有一类RNA元件的下游基因广泛参与c-di-GMP的代谢及信号通路,但这类RNA元件与之前报道的c-di-GMP核糖开关大不相同(图 1A)[4, 22]。2010年,Breaker团队证明了此类RNA元件能够与c-di-GMP特异结合,艰难梭菌Clostridium difficile中的该类RNA元件84 Cd与c-di-GMP解离常数KD ≈ 200 pmol/L[14]。进一步实验表明84 Cd的表达平台区是1种Ⅰ型核酶,两者组成1个变构核酶,c-di-GMP与变构核酶非典型剪切位点处结合,通过调节其自剪切能力来实现对下游基因的调控。为了区别之前发现的c-di-GMP-Ⅰ核糖开关,将该类变构核酶命名为c-di-GMP-Ⅱ核糖开关。至此,两类调节机制完全不同的c-di-GMP核糖开关被发现,其保守序列如图 1所示。c-di-GMP核糖开关的发现使人们认识到c-di-GMP不仅作用于蛋白类受体,还可以通过RNA类受体调节细菌的生理功能,不仅丰富了c-di-GMP受体的种类,也为揭示c-di-GMP的调控网络提供了新的线索。
2 c-di-GMP核糖开关的结构和功能2.1 c-di-GMP-Ⅰ核糖开关的结构与功能c-di-GMP-Ⅰ核糖开关自2008年发现以来一直受到广泛关注,2009年Smith等对来自霍乱弧菌的核糖开关Vc2进行了晶体结构解析,获得了2.7 ?分辨率的晶体结构(图 2)[23]。晶体结构清晰地展示了核糖开关Vc2的两个发夹结构P2和P3之间的相互联系以及c-di-GMP与Vc2之间的相互作用。P2和P3分别形成螺旋结构,其中,P2颈上第44位的C与P3颈上第83位的G形成碱基互补配对,四聚环与其受体通过氢键相互连接使两个螺旋结构紧密靠近,起到稳定结构的作用。虽然c-di-GMP分子结构自身对称,但它以非对称的方式结合于Vc2的三螺旋交界处。c-di-GMP中的一个G (Gα)通过Hoogsteen配对方式与Vc2上第20位的G相互作用,除此之外Gα与第46位的C以及48位的A也存在相互作用;而另一个G (Gβ)与Vc2上92位的C形成典型的Watson-Crick碱基互补配对,同时Gβ的7位N与Vc2第47位A的2′-OH也会通过氢键相互作用。
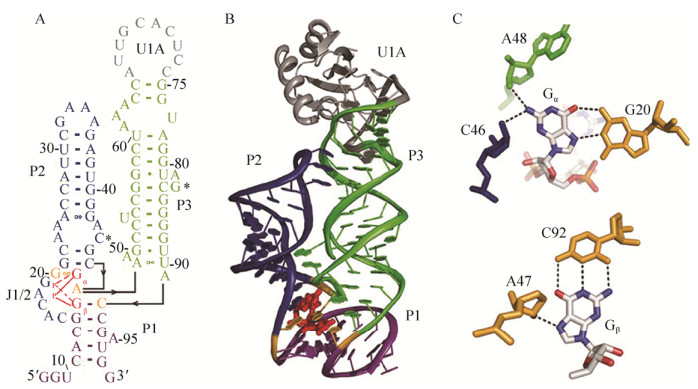 |
| 图 2 c-di-GMP-Ⅰ核糖开关Vc2适配体区结构[23] Figure 2 Structure of the c-di-GMP-Ⅰ riboswitch Vc2 aptamer domain[23]. |
| 图选项 |
近年来除了结构外,对c-di-GMP-Ⅰ核糖开关功能的研究也有报道。研究结果表明c-di-GMP结合核糖开关后对下游基因的调节既有“开启”作用也有“关闭”作用,这种调控主要发生在转录水平,通过形成终止子/抗终止子来实现。2008年Breaker团队报道,霍乱弧菌N16961中的Vc2以及蜡样芽胞杆菌Bacillus cereus ATCC 10987中的Bc1核糖开关在高浓度c-di-GMP时呈现“开启”状态,促进下游基因表达;蜡样芽胞杆菌ATCC 14579中的Bc2以及艰难梭菌ATCC 9689中的Cd1核糖开关在高浓度c-di-GMP时呈现“关闭”状态,抑制下游基因表达[13]。在此之后更多的c-di-GMP-Ⅰ核糖开关调控机制被报道,艰难梭菌630中的Cdi1_1[24]、霍乱弧菌C6706中的Vc1[25]以及苏云金芽胞杆菌Bacillus thuringiensis CT-43中3个串联排布的c-di-GMP-Ⅰ核糖开关Bc3、Bc4、Bc5[26]在高浓度c-di-GMP时呈现“开启”状态,在转录水平促进下游基因表达;艰难梭菌630中的Cdi1_2、Cdi1_3、Cdi1_4、Cdi1_5、Cdi1_6、Cdi1_7、Cdi1_8、Cdi1_9、Cdi1_10、Cdi1_11、Cdi1_12呈现“关闭”状态,在转录水平抑制下游基因表达[24]。
2.2 c-di-GMP-Ⅱ核糖开关的结构与功能c-di-GMP-Ⅱ核糖开关是一种变构核酶,自2010年发现以来对其结构和功能的研究也比较清楚。2011年,Smith等对来自丙酮丁醇梭菌Clostridium acetobutylicum的c-di-GMP-Ⅱ核糖开关进行了晶体结构解析,获得了2.5 ?分辨率的晶体结构(图 3)[27]。晶体结构结果显示c-di-GMP-Ⅱ核糖开关存在4个发卡结构P1、P2、P3和P4,它们以螺旋的形式存在。其中,第34位的碱基A与45位的U非典型配对(A34/U45),第31位的U与46位的G配对(U31/G46),A34/U45与U31/G46碱基四聚化有利于P3和P4交界处“急转弯”结构的形成。c-di-GMP结合c-di-GMP-Ⅱ核糖开关也是非对称的,与识别c-di-GMP-Ⅰ核糖开关不同的是这里没有典型的碱基互补配对,主要通过碱基堆积作用力以及非典型配对方式结合于P1、P2和P4的交界处。第70位的A夹在c-di-GMP的2个鸟嘌呤(Gα和Gβ)中间,除此之外,Gα还与61位的A和69位的A相互作用,Gβ与13位的A和73位的G相互作用。c-di-GMP-Ⅱ核糖开关的调控过程比较复杂,整个过程除了c-di-GMP外还需要GTP的参与,GTP负责攻击Ⅰ型核酶,实现剪接。与c-di-GMP-Ⅰ核糖开关不同,c-di-GMP-Ⅱ核糖开关不是通过形成终止子/抗终止在转录水平调控下游基因表达量,而是通过改变Ⅰ型核酶的剪接位点,进而通过形成或者删除RBS在翻译水平对其进行调控[28]。艰难梭菌中的84 Cd是非常典型的c-di-GMP-Ⅱ核糖开关,当GTP和c-di-GMP充足时,c-di-GMP结合到84 Cd,改变下游核酶的剪接位点,最终形成的剪接体含有完整RBS (AGGAGG),促进下游基因翻译;当缺乏c-di-GMP时,GTP攻击位点在起始密码子上游4个核苷酸处,最终无法形成完整RBS,抑制下游基因翻译。艰难梭菌630中存在4个c-di-GMP-Ⅱ核糖开关Cdi2_1、Cdi2_2、Cdi2_3以及Cdi2_4,当c-di-GMP充足时它们均呈现“开启”状态,促进下游基因表达,但这种促进体现在转录水平(qRT-PCR结果)[24],这可能是由于结合c-di-GMP后改变了它们的构象,最终影响了转录本的稳定性。
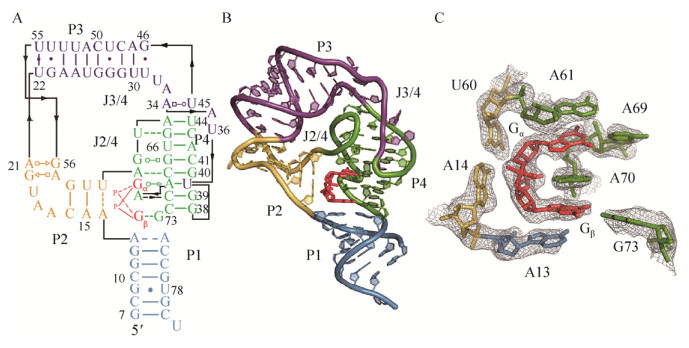 |
| 图 3 c-di-GMP-Ⅱ核糖开关适配体区结构[27] Figure 3 Structure of the c-di-GMP-Ⅱ riboswitch aptamer domain[27]. |
| 图选项 |
3 c-di-GMP核糖开关下游调控基因的功能分析c-di-GMP具有广泛的调控作用,参与调节细菌生长和分化、群体感应、生物被膜的形成、运动性以及毒力等重要生理生化功能,这些功能的行使需要借助其下游受体,通过核糖开关调控下游基因是最直接的受体介导的调控方式。c-di-GMP核糖开关下游调控基因种类繁多,在艰难梭菌中c-di-GMP-Ⅰ核糖开关Cd1位于flgB操纵子(编码早期鞭毛蛋白)上游,2012年Purcell等研究表明,提高胞内c-di-GMP浓度下调flgB操纵子的转录,最终导致细菌运动能力降低[29]。有趣的是sigD基因位于flgB操纵子中,即c-di-GMP可以调控sigD的表达,进一步研究表明sigD调控103个基因的表达,包括鞭毛相关基因、趋化蛋白、胶原黏附蛋白以及一些转运蛋白,这意味着c-di-GMP可以间接调控这些基因及相关过程[30-31]。c-di-GMP-Ⅱ核糖开关Cdi2_4位于Ⅳ型菌毛编码相关基因的上游,Ⅳ型菌毛参与调节细菌的运动性、黏附、生物被膜的形成以及菌体的聚集、沉降等行为。Bordeleau等研究表明c-di-GMP上调Ⅳ型菌毛编码基因的转录[32],这为c-di-GMP参与调控相关表型提供了可能。在苏云金芽胞杆菌中,Bc2位于胶原黏附蛋白(Collagen adhesion protein)编码基因cap的上游,2016年Tang等研究表明:当c-di-GMP浓度较高时,Bc2处于“开启”状态,激活下游cap基因的表达,最终影响细菌的运动性、聚集、胞外多糖分泌、生物被膜形成以及毒力等多种重要表型[33]。噬菌蛭弧菌Bdellovibrio bacteriovorus中存在1个表达量特别高的c-di-GMP-Ⅰ核糖开关merRNA,由于c-di-GMP核糖开关与c-di-GMP有非常高的特异性及结合能力,作者认为merRNA可能通过海绵效应吸附游离的c-di-GMP,进而调控噬菌蛭弧菌在自由生长状态和在宿主细菌中寄生状态的转换[34]。除此之外,其他的一些研究表明c-di-GMP核糖开关还参与调控细菌信号转导、分泌、膜蛋白以及肽的合成等过程[21, 24]。
我们对3 079株已完成全基因组测序的细菌进行分析,发现存在989个c-di-GMP-Ⅰ核糖开关和167个c-di-GMP-Ⅱ核糖开关。通过生物信息学分析得到核糖开关下游相关基因序列,并对这些序列进行COG (Cluster of orthologous groups of proteins, 蛋白质直系同源簇)注释,如图 4所示,信号转导机制[T]以及细胞运动[N]两条通路被明显富集。富集结果中信号转导机制主要包括二鸟苷酸环化酶、磷酸二酯酶以及细菌趋化性等相关系统;细胞运动主要包括细菌趋化性以及鞭毛合成、组装等相关系统。这说明c-di-GMP直接通过核糖开关调控细菌间的信息交流、运动以及趋化等相关过程,并且近些年研究表明运动性和趋化性等相关过程会影响细菌的胞外基质、生物被膜、致病性以及毒力等。除此之外,转录[K]、细胞壁细胞膜生物发生[M]以及糖转运与代谢[G]通路相关基因也被明显富集,进一步丰富了c-di-GMP调控的信号网络。
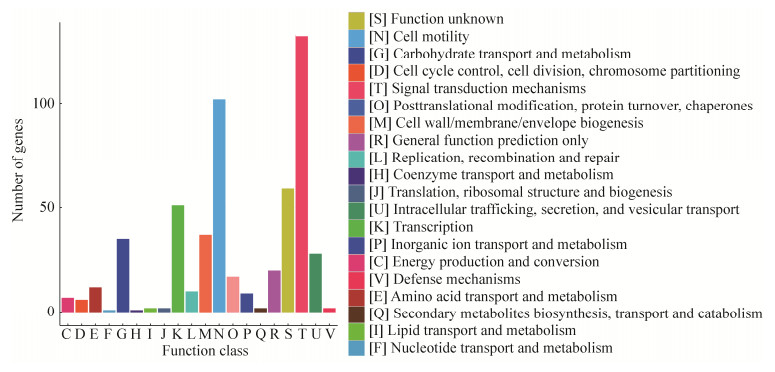 |
| 图 4 c-di-GMP核糖开关下游调控基因COG注释 Figure 4 COG annotation of c-di-GMP riboswitches downstream genes. |
| 图选项 |
4 c-di-GMP通过RNA类和蛋白类受体调控的基因功能比较与调控其RNA类受体——核糖开关相比,c-di-GMP通过其蛋白类受体介导的调控方式更为复杂:如通过结合后改变其蛋白类受体的构象,直接调节其酶活力[35];与蛋白类受体结合后再与其他蛋白相互作用影响细菌的生理功能[36];影响转录因子类受体对目的基因启动子的结合来实现其调节功能[10-11]。
c-di-GMP通过RNA类与蛋白类受体调控下游基因的生理功能有许多相似之处,涉及细菌的运动性、胞外多糖、生物被膜、毒性等生理表型。c-di-GMP通过核糖开关调控下游基因引起的相关表型在上文已有详细介绍(图 4),我们在此重点讨论其蛋白受体介导的相关表型。目前,已经报道了多种由c-di-GMP蛋白类受体介导的细菌鞭毛运动调控方式。PilZ结构域是最早发现可以与c-di-GMP结合的蛋白结构域,伯氏疏螺旋体Borrelia burgdorferi中的PlzA蛋白是1个含有PilZ结构域的c-di-GMP受体蛋白,通过其PilZ结构域与c-di-GMP相互作用,PlzA/c-di-GMP复合物能够结合CheY的磷酸化酶CheX,激活CheX,从而降低CheY的磷酸化水平,促进细菌的运动[36]。在大肠杆菌Escherichia coli和沙门氏菌Salmonella中,受体蛋白YcgR结合c-di-GMP后与FliG-FliM-FliN复合物紧密结合,调节鞭毛旋转的方向[37]。新月柄杆菌Caulobacter crescentus中,结合c-di-GMP后促进受体蛋白DgrA与FliL的结合,抑制鞭毛运动[38]。此外,巴西固氮螺菌Azospirillum brasilense的甲基趋化蛋白Tlp1[39]、地毯草黄单胞菌Xanthomonas axonopodis转录调控因子Clp[40]、霍乱弧菌转录调控因子VspT[41]等蛋白类受体结合c-di-GMP后通过不同的方式调节细菌的运动。除了影响运动性外,c-di-GMP蛋白类受体介导的胞外多糖、生物被膜、毒性等生理表型的调控也有很多报道。铜绿假单胞菌Pseudomonas aeruginosa FleQ蛋白是第一个被鉴定的可以作为信号受体的转录调控因子,在结合c-di-GMP后,FleQ无法结合胞外多糖合成相关基因pel的启动子,解除对相关基因的抑制,促进胞外多糖和生物被膜的形成[10]。野油菜黄单胞菌Xanthomonas campestris中,YajQ受体蛋白突变后降低菌体生物被膜的形成以及对植物的侵染能力。并且YajQ在铜绿假单胞菌和嗜麦芽寡养单胞菌Stenotrophomonas maltophilia中的同源蛋白也调节细菌的毒性[16]。水稻黄单胞菌Xanthomonas oryzae敲除c-di-GMP合成酶后影响其生物被膜、运动性、胞外多糖以及毒性[42],其转录调控因子Clpxoo蛋白与cAMP受体蛋白CRP同源,参与调控类似生理功能[43-44]。MshEN结构域蛋白是最近报道的一类c-di-GMP受体蛋白,与c-di-GMP有极强的结合能力,广泛分布于细菌中[12, 45]。铜绿假单胞菌中MshE蛋白的c-di-GMP关键结合位点突变影响菌体的运动性、表面附着能力以及生物被膜的形成,同时还影响细菌Ⅱ型和Ⅳ型分泌系统[45]。此外,新月柄杆菌GGDEF结构域蛋白PopA[46]、霍乱弧菌GGDEF结构域蛋白CdgG[47]都可通过其Ⅰ位点与c-di-GMP结合,参与调控细菌细胞周期进程、菌体褶皱状态以及生物被膜的形成。以上研究都表明了c-di-GMP的蛋白类受体和核糖开关受体下游调控基因在生理表型上的共性。此外,两者也都可以通过各自的方式调控其他方面的功能,如c-di-GMP胞内浓度/代谢以及相关基因的转录。图 4的分类结果显示,c-di-GMP核糖开关下游调控基因中,信号转导机制[T]被显著富集,其中包含很多DGC和PDE,表明c-di-GMP通过核糖开关来控制自身合成酶和降解酶的表达,进而调控其代谢方式及细胞内浓度;而其蛋白类受体则主要通过结合c-di-GMP改变自身构象,调节其酶活力。例如,很多c-di-GMP合成酶都含有1个由RXXD模体组成的反馈抑制位点(Ⅰ位点),c-di-GMP与Ⅰ位点结合能够抑制DGC的活性,从而调节细胞内c-di-GMP的浓度[48-49]。关于转录,c-di-GMP核糖开关调控的下游基因中转录[K]被显著富集,其中很多基因属于σ因子,所以核糖开关通过调控σ因子来实现转录调控;而蛋白类受体则主要通过影响CRP以及其他一些转录因子的活性来实现转录调控[10-11, 50]。
综上,c-di-GMP的RNA类受体和蛋白类受体调控下游基因的功能总体上比较相似,但是它们调控的方式有所不同,这可能与细菌所处的环境以及长期的进化有关。此外,目前对其蛋白类受体的研究还不够充分,很多受体还没有被发现,更多c-di-GMP介导的调控方式有待于进一步揭示。
5 小结与展望c-di-GMP是细菌体内一种重要的第二信使分子,在调控细菌的运动性、生物被膜的形成、胞外多糖的合成、胞外酶分泌、致病性以及毒性等方面发挥重要的作用。近年来,对c-di-GMP的代谢、调控及功能的研究取得了很大的进展。c-di-GMP核糖开关作为c-di-GMP的RNA受体,直接或间接介导c-di-GMP调控多种生理生化过程,具有重要作用。越来越多的研究表明c-di-GMP在细菌的致病性方面具有重要作用,c-di-GMP核糖开关调控的基因通常是编码细菌生存或致病必需的基因,而在动物和植物中至今还没有发现c-di-GMP核糖开关,这为我们提供了1个新的药物靶点,为药物研发提供了可能。此外,c-di-GMP核糖开关还可以应用到c-di-GMP合成酶DGC和降解酶PDE的鉴定、c-di-GMP浓度的检测以及合成生物学领域。相信在科学家们的共同努力下c-di-GMP核糖开关会有更加广阔的应用前景。
参考文献
| [1] | Jenal V, Reinders A, Lori C. Cyclic di-GMP: Second messenger entraordinaire.Nat Rev Microbiol, 2017, 15(5): 271–284.DOI: 10.1038/nrmicro.2016.190 |
| [2] | Chen Y, Xia J, Su ZH, et al. The regulator of type Ⅳ pili synthesis, PilR, from Lysobacter controls antifungal antibiotic production via a c-di-GMP pathway.Appl Environ Microbiol, 2017, 83(7): e03397–16. |
| [3] | Ross P, Weinhouse H, Aloni Y, et al. Regulation of cellulose synthesis in Acetobacter xylinum by cyclic diguanylic acid.Nature, 1987, 325(6101): 279–281.DOI: 10.1038/325279a0 |
| [4] | Hengge R. Principles of c-di-GMP signalling in bacteria.Nat Rev Microbiol, 2009, 7(4): 263–273.DOI: 10.1038/nrmicro2109 |
| [5] | Schmidt AJ, Ryjenkov DA, Gomelsky M. The ubiquitous protein domain EAL is a cyclic diguanylate-specific phosphodiesterase: enzymatically active and inactive EAL domains.J Bacteriol, 2005, 187(14): 4774–4781.DOI: 10.1128/JB.187.14.4774-4781.2005 |
| [6] | Dow JM, Fouhy Y, Lucey JF, et al. The HD-GYP domain, cyclic di-GMP signaling, and bacterial virulence to plants.Mol Plant Microbe Interact, 2006, 19(12): 1378–1384.DOI: 10.1094/MPMI-19-1378 |
| [7] | Amikam D, Galperin MY. PilZ domain is part of the bacterial c-di-GMP binding protein.Bioinformatics, 2006, 22(1): 3–6.DOI: 10.1093/bioinformatics/bti739 |
| [8] | Ryjenkov DA, Simm R, R?mling U, et al. The PilZ domain is a receptor for the second messenger c-di-GMP: the PilZ domain protein YcgR controls motility in enterobacteria.J Biol Chem, 2006, 281(41): 30310–30314.DOI: 10.1074/jbc.C600179200 |
| [9] | Newell PD, Monds RD, O'Toole GA. LapD is a bis-(3′, 5′)-cyclic dimeric GMP-binding protein that regulates surface attachment by Pseudomonas fluorescens Pf0-1.Proc Natl Acad Sci USA, 2009, 106(9): 3461–3466.DOI: 10.1073/pnas.0808933106 |
| [10] | Hickman JW, Harwood CS. Identification of FleQ from Pseudomonas aeruginosa as a c-di-GMP-responsive transcription factor.Mol Microbiol, 2008, 69(2): 376–389.DOI: 10.1111/mmi.2008.69.issue-2 |
| [11] | Wilksch JJ, Yang J, Clements A, et al. MrkH, a novel c-di-GMP-dependent transcriptional activator, controls Klebsiella pneumoniae biofilm formation by regulating type 3 fimbriae expression.PLoS Pathog, 2011, 7(8): e1002204.DOI: 10.1371/journal.ppat.1002204 |
| [12] | Wang YC, Ko-Hsin C, Tu ZL, et al. Nucleotide binding by the widespread high-affinity cyclic di-GMP receptor MshEN domain.Nat Commun, 2016, 7: 12481.DOI: 10.1038/ncomms12481 |
| [13] | Sudarsan N, Lee ER, Weinberg Z, et al. Riboswitches in eubacteria sense the second messenger cyclic di-GMP.Science, 2008, 321(5887): 411–413.DOI: 10.1126/science.1159519 |
| [14] | Lee ER, Baker JL, Weinberg Z, et al. An allosteric self-splicing ribozyme triggered by a bacterial second messenger.Science, 2010, 329(5993): 845–848.DOI: 10.1126/science.1190713 |
| [15] | Tuckerman JR, Gonzalez G, Gilles-Gonzalez MA. Cyclic di-GMP activation of polynucleotide phosphorylase signal-dependent RNA processing.J Mol Biol, 2011, 407(5): 633–639.DOI: 10.1016/j.jmb.2011.02.019 |
| [16] | An SQ, Caly DL, McCarthy Y, et al. Novel cyclic di-GMP effectors of the YajQ protein family control bacterial virulence.PLoS Pathog, 2014, 10(10): e1004429.DOI: 10.1371/journal.ppat.1004429 |
| [17] | Li WH, Cui T, Hu LH, et al. Cyclic diguanylate monophosphate directly binds to human siderocalin and inhibits its antibacterial activity.Nat Commun, 2015, 6: 8330.DOI: 10.1038/ncomms9330 |
| [18] | Serganov A, Nudler E. A decade of riboswitches.Cell, 2013, 152(1/2): 17–24. |
| [19] | Mellin JR, Cossart P. Unexpected versatility in bacterial riboswitches.Trends Genet, 2015, 31(3): 150–156.DOI: 10.1016/j.tig.2015.01.005 |
| [20] | Jenal U, Malone J. Mechanisms of cyclic-di-GMP signaling in bacteria.Ann Rev Genet, 2006, 40(1): 385–407.DOI: 10.1146/annurev.genet.40.110405.090423 |
| [21] | Weinberg Z, Barrick JE, Yao ZZ, et al. Identification of 22 candidate structured RNAs in bacteria using the CMfinder comparative genomics pipeline.Nucleic Acids Res, 2007, 35(14): 4809–4819.DOI: 10.1093/nar/gkm487 |
| [22] | Weinberg Z, Wang JX, Bogue J, et al. Comparative genomics reveals 104 candidate structured RNAs from bacteria, archaea, and their metagenomes.Genome Biol, 2010, 11(3): R31.DOI: 10.1186/gb-2010-11-3-r31 |
| [23] | Smith KD, Lipchock SV, Ames TD, et al. Structural basis of ligand binding by a c-di-GMP riboswitch.Nat Struct Mol Biol, 2009, 16(12): 1218–1223.DOI: 10.1038/nsmb.1702 |
| [24] | Soutourina OA, Monot M, Boudry P, et al. Genome-wide identification of regulatory RNAs in the human pathogen Clostridium difficile.PLoS Genet, 2013, 9(5): e1003493.DOI: 10.1371/journal.pgen.1003493 |
| [25] | Kariisa AT, Weeks K, Tamayo R. The RNA domain Vc1 regulates downstream gene expression in response to cyclic diguanylate in Vibrio cholerae.PLoS ONE, 2016, 11(2): e0148478.DOI: 10.1371/journal.pone.0148478 |
| [26] | Zhou H, Zheng C, Su JM, et al. Characterization of a natural triple-tandem c-di-GMP riboswitch and application of the riboswitch-based dual-fluorescence reporter.Sci Rep, 2016, 6: 20871.DOI: 10.1038/srep20871 |
| [27] | Smith KD, Shanahan CA, Moore EL, et al. Structural basis of differential ligand recognition by two classes of bis-(3′, 5′)-cyclic dimeric guanosine monophosphate-binding riboswitches.Proc Natl Acad Sci USA, 2011, 108(19): 7757–7762.DOI: 10.1073/pnas.1018857108 |
| [28] | Chen AGY, Sudarsan N, Breaker RR. Mechanism for gene control by a natural allosteric group Ⅰ ribozyme.RNA, 2011, 17(11): 1967–1972.DOI: 10.1261/rna.2757311 |
| [29] | Purcell EB, McKee RW, McBride SM, et al. Cyclic diguanylate inversely regulates motility and aggregation in Clostridium difficile.J Bacteriol, 2012, 194(13): 3307–3316.DOI: 10.1128/JB.00100-12 |
| [30] | El Meouche I, Peltier J, Monot M, et al. Characterization of the SigD regulon of C. difficile and its positive control of toxin production through the regulation of tcdR.PLoS ONE, 2013, 8(12): e83748.DOI: 10.1371/journal.pone.0083748 |
| [31] | Tulli L, Marchi S, Petracca R, et al. CbpA: a novel surface exposed adhesin of Clostridium difficile targeting human collagen.Cell Microbiol, 2013, 15(10): 1674–1687. |
| [32] | Bordeleau E, Purcell EB, Lafontaine DA, et al. Cyclic di-GMP riboswitch-regulated type Ⅳ pili contribute to aggregation of Clostridium difficile.J Bacteriol, 2015, 197(5): 819–832.DOI: 10.1128/JB.02340-14 |
| [33] | Tang Q, Yin K, Qian HL, et al. Cyclic di-GMP contributes to adaption and virulence of Bacillus thuringiensis through a riboswitch-regulated collagen adhesion protein.Sci Rep, 2016, 6: 28807.DOI: 10.1038/srep28807 |
| [34] | Karunker I, Rotem O, Dori-Bachash M, et al. A global transcriptional switch between the attack and growth forms of Bdellovibrio bacteriovorus.PLoS ONE, 2013, 8(4): e61850.DOI: 10.1371/journal.pone.0061850 |
| [35] | Whitney JC, Colvin KM, Marmont LS, et al. Structure of the cytoplasmic region of PelD, a degenerate diguanylate cyclase receptor that regulates exopolysaccharide production in Pseudomonas aeruginosa.J Biol Chem, 2012, 287(28): 23582–23593.DOI: 10.1074/jbc.M112.375378 |
| [36] | Sultan SZ, Pitzer JE, Boquoi T, et al. Analysis of the HD-GYP domain cyclic dimeric GMP phosphodiesterase reveals a role in motility and the enzootic life cycle of Borrelia burgdorferi.Infect Immun, 2011, 79(8): 3273–3283.DOI: 10.1128/IAI.05153-11 |
| [37] | Fang X, Gomelsky M. A post-translational, c-di-GMP-dependent mechanism regulating flagellar motility.Mol Microbiol, 2010, 76(5): 1295–1305.DOI: 10.1111/mmi.2010.76.issue-5 |
| [38] | Christen M, Christen B, Allan MG, et al. DgrA is a member of a new family of cyclic diguanosine monophosphate receptors and controls flagellar motor function in Caulobacter crescentus.Proc Natl Acad Sci USA, 2007, 104(10): 4112–4117.DOI: 10.1073/pnas.0607738104 |
| [39] | Russell MH, Bible AN, Fang X, et al. Integration of the second messenger c-di-GMP into the chemotactic signaling pathway.mBio, 2013, 4(2): e00001–13. |
| [40] | Leduc JL, Roberts GP. Cyclic di-GMP allosterically inhibits the CRP-like protein (Clp) of Xanthomonas axonopodis pv. citri.J Bacteriol, 2009, 191(22): 7121–7122.DOI: 10.1128/JB.00845-09 |
| [41] | Krasteva PV, Fong JCN, Shikuma NJ, et al. Vibrio cholerae VpsT regulates matrix production and motility by directly sensing cyclic di-GMP.Science, 2010, 327(5967): 866–868.DOI: 10.1126/science.1181185 |
| [42] | Su JM, Zou X, Huang LB, et al. DgcA, a diguanylate cyclase from Xanthomonas oryzae pv. oryzae regulates bacterial pathogenicity on rice.Sci Rep, 2016, 6: 25978.DOI: 10.1038/srep25978 |
| [43] | Guan WJ, Wu MS, He CY. Molecular identification and functional analysis of Clpxoo, a homologue to the nucleotide receptor protein in Xanthomonas oryzae pv. oryzae.Acta Microbiol Sin, 2009, 49(1): 32–37.(in Chinese). 管文静, 吴茂森, 何晨阳. 水稻白叶枯病菌核苷酸信号受体蛋白Clpxoo的分子鉴定及其功能.微生物学报, 2009, 49(1): 32-37. |
| [44] | Li B, Tian F, Chen HM, et al. Binding of transcription regulator Clpxoo to promoter of endoglucanase gene engAxoo was inhibited by c-di-GMP in Xanthomonas oryzae pv. oryzae.Acta Microbiol Sin, 2013, 53(11): 1166–1171.(in Chinese). 李波, 田芳, 陈华民, 等. c-di-GMP抑制转录调控因子Clpxoo与葡聚糖酶基因启动子的结合.微生物学报, 2013, 53(11): 1166-1171. |
| [45] | Roelofs KG, Jones CJ, Helman SR, et al. Systematic Identification of cyclic-di-GMP binding proteins in Vibrio cholerae reveals a novel class of cyclic-di-GMP-binding ATPases associated with type Ⅱ secretion systems.PLoS Pathog, 2015, 11(10): e1005232.DOI: 10.1371/journal.ppat.1005232 |
| [46] | Ozaki S, Schalch-Moser A, Zumthor L, et al. Activation and polar sequestration of PopA, a c-di-GMP effector protein involved in Caulobacter crescentus cell cycle control.Mol Microbiol, 2014, 94(3): 580–594.DOI: 10.1111/mmi.2014.94.issue-3 |
| [47] | Beyhan S, Odell LS, Yildiz FH. Identification and characterization of cyclic diguanylate signaling systems controlling rugosity in Vibrio cholerae.J Bacteriol, 2008, 190(2): 7392–7405. |
| [48] | Chan C, Paul R, Samoray D, et al. Structural basis of activity and allosteric control of diguanylate cyclase.Proc Natl Acad Sci USA, 2004, 101(49): 17084–17089.DOI: 10.1073/pnas.0406134101 |
| [49] | Christen B, Christen M, Paul R, et al. Allosteric control of cyclic di-GMP signaling.J Biol Chem, 2006, 281(42): 32015–32024.DOI: 10.1074/jbc.M603589200 |
| [50] | Gomelsky M. Cyclic-di-GMP-binding CRP-like protein: a spectacular new role for a veteran signal transduction actor.J Bacteriol, 2009, 191(22): 6785–6787.DOI: 10.1128/JB.01173-09 |
