
 , 张炼辉1,2,3
, 张炼辉1,2,31 亚热带农业生物资源保护与利用国家重点实验室, 广东 广州 510642;
2 广东省微生物信号与作物病害防控重点实验室, 广东 广州 510642;
3 华南农业大学农学院 群体微生物研究中心, 广东 广州 510642
收稿日期:2017-03-21;接收日期:2017-06-05 基金项目:国家自然科学基金(No.31570122),国家重点基础研究发展计划(973计划)(No.2015CB150600),广州市珠江科技新星专项(No.201506010029)资助
作者简介:崔紫宁??教授,2010年毕业于中国农业大学获得理学博士。日本JSPS外籍特别研究员(2010?2012年),入选2015年珠江科技新星。主要从事活性小分子的设计合成、农药学以及化学生物学相关的科研与教学工作。主持国家自然科学基金面上及青年项目各1项,973计划子课题1项,省部级项目3项。至今发表SCI研究论文40余篇,申请中国发明专利12项,获得授权5项;
张炼辉??教授,国际群体感应研究权威专家,国家“****”特聘专家、长江讲座****、“973”首席科学家(微生物群体感应通讯系统及病害防控应用基础)、国务院学位委员会第七届学科评议组成员、广东省领军人才、新加坡2005年度“国家科学奖”得主,2017年当选为美国微生物科学院(American Academy of Microbiology, AAM)院士(Fellow),被认为是群体感应领域的奠基者之一,群体淬灭防治植物病害新理论的建立者。2013年协调华南农业大学校内多个单位组建“广东省微生物信号与作物病害防控重点实验室”;同年协助引进广东省“群体微生物基础理论与前沿技术创新团队”;2016年组建了首个华南农业大学校级研究中心——“群体微生物研究中心”
摘要:细菌的生物被膜是其在自然界中一种常见的生存状态。生物被膜的形成是细菌耐药性产生的主要机制之一,也是许多感染性疾病难以控制的重要原因。由于生物被膜在传染性疾病中的突出地位和细菌多重耐药性的蔓延,目前急需研制开发出能够调节生物被膜形成的新型抗菌药物。文中对调节生物被膜形成和发育的小分子抑制剂进行了详细的综述。
关键词:生物被膜 信号分子 抑制 分散 天然产物 构效关系分析
Chemical agents modulating bacterial biofilm formation and development
Liu Xingyu1,2,3, Xiang Xuwen1,2,3, Tao Hui1,2,3, Cui Zining1,2,3

 , Zhang Lianhui1,2,3
, Zhang Lianhui1,2,3 1 State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Guangzhou 510642, Guangdong, China;
2 Guangdong Province Key Laboratory of Microbial Signals and Disease Control, Guangzhou 510642, Guangdong, China;
3 Integrative Microbiology Research Centre, College of Agriculture, South China Agricultural University, Guangzhou 510642, Guangdong, China
Received: March 21, 2017; Accepted: June 5, 2017
Supported by: National Natural Science Foundation of China (No. 31570122), National Basic Research Program of China (973 Program) (No. 2015CB150600), Pearl River S&T Nova Program of Guangzhou (No. 201506010029)
Corresponding author:Zining Cui. Tel: +86-20-85288229; E-mail: ziningcui@scau.edu.cn
Abstract: Biofilm is a bacterial lifestyle ubiquitously in natural environments. Bacterial biofilm leads to drug resistance, a main reason why many infectious diseases are difficult to control. Due to the prominent points of biofilms implicated in infectious disease and the spread of multi-drug resistance, it is urgent to discover new antibacterial agents that can regulate biofilm formation and development. This review introduces chemical agents that could modulate bacterial biofilm formation and development.
Key words: biofilm signaling molecules inhibit dispersal natural products structure-activity relationship analysis
生物被膜是一种由胞外基质包裹的高度组织化表面吸附类细菌群体,目前已渐渐发展成为严重威胁人类健康和安全的社会性问题[1-4]。在全球范围内,农业、工程、医疗等相关行业每年花费数十亿美元用于解决生物被膜产生的相关问题[5]。据估计,世界上80%的微生物以生物被膜的形式存在,美国国立卫生院也估计人体65%-80%的微生物感染都与生物被膜息息相关[5]。2000年,美国疾病预防中心将生物被膜和生物被膜相关感染列入21世纪医疗行业面临的7个主要障碍之一[6]。生物被膜能够造成包括烧伤感染、耳部感染、尿液管感染、霍乱、细菌性心内膜炎、龋齿和肺囊性纤维化(Cystic fibrosis,CF)患者肺部感染等一系列疾病(表 1)[5, 7]。同时,由于特效药的缺乏,现有的药物又不能完全根除生物被膜,也给植入式医疗器械(Indwelling medical devices, IMDs)的安全使用带来了严重威胁[3, 8-9]。细菌处于生物被膜这张“盾牌”保护下时,对传统抗生素的抗性上升了10-1 000倍[10],而用药后杀死的往往都是浮游态细菌。但大多数致病性细菌却都是以生物被膜形式存在。为了达到疗效,医生们不得不增加抗生素的用量和使用频率,这种做法也促进了细菌抗性的不断出现和发展以及多重耐药性(Multi-drug resistant,MDR)在全球医疗界的蔓延加重[11-12]。
表 1 医疗相关形成生物被膜的细菌和所造成疾病Table 1 Medically relevant biofilm forming bacteria and the diseases they cause
| Bacteria | Classification | Biofilm related disease |
| Burkholderia cenocepacia | Gram (–) β-proteobacterium | Cystic fibrosis lung infection[29] |
| Klebsiella pneumoniae | Gram (–) γ-proteobacterium | Catheter, lung infection[131] |
| Acinetobacter baumannii | Gram (–) γ-proteobacterium | Burn wound, trauma infection[123] |
| Pseudomonas aeruginosa | Gram (–) γ-proteobacterium | Cystic Fibrosis lung infection[20] |
| Escherichia coli | Gram (–) γ-proteobacterium | Urinary and gastrointestinal infection[41] |
| Vibrio cholerae | Gram (+) | Cholera[131] |
| Staphylococcus epidermidis | Gram (+) | Nosocomial sepsis, catheter infection[51] |
| Staphylococcus aureus | Gram (+) | Burn wound, catheter, lung infection[39] |
| Streptococcus mutans | Gram (+) | Dental caries[59] |
表选项
关于不同细菌不同基因型的生物被膜形成过程已有详尽的研究[13-14]。虽然每种细菌形成生物被膜时所需的环境和条件不尽相同,但它们的形成过程也有相似之处。普遍认为生物被膜的形成经历5个阶段,每个阶段都有各自的表型和特点[14]。第一阶段,浮游细菌可逆性地吸附在一个适合其生长发育的表面,这也是使用杀菌剂和抗生素的最好时机——在细菌形成生物被膜前杀死它。据推测这也是许多抗生物被膜调节剂发挥药效的时候——阻止细菌的吸附,让它维持在浮游态。第二阶段,细菌对表面的吸附变为了一个不可逆的过程,并开始分泌多种表面聚合物。这些表面聚合物是一种高极性物质,由多糖、肽类和DNA混合组成,形状类似海绵。这些表面聚合物也是判断生物被膜是否拥有活性的关键,Sauer等[15]认为这些表面聚合物也是一种毒力因子,赋予了细菌高抗药性并保护细菌抵御宿主的免疫反应。第三阶段,在细菌完成不可逆地吸附后,这时可以观察到生物被膜的早期成熟,同时细菌仍在继续分泌表面聚合物。第四阶段,生物被膜完全成熟并展现出三维结构——通常呈一种独特的圆柱形结构,其中包含有视觉可见的空腔。这些空腔用作水和浮游细菌的运输通道,也是生物被膜吸收养分和排泄废物的最佳场所。第五阶段是生物被膜的分散,此时细菌的表型与浮游态相似[4]。更重要的是,这时细菌丧失了生物被膜态下所拥有的抗性,对杀菌剂和抗生素复敏[16]。最后这个阶段观察到有2个特定的分离模式:侵蚀——即单一菌株或小部分的生物被膜持续不断脱离;坍塌——生物被膜生物量快速流逝[17]。
本文详细介绍了目前已知的能够调节生物被膜形成及发育的小分子抑制剂,包括:1) 细菌群体感应信号分子的衍生物;2) 基于化合物库筛选的化合物;3) 天然产物及其衍生物;4) 其他类分子。
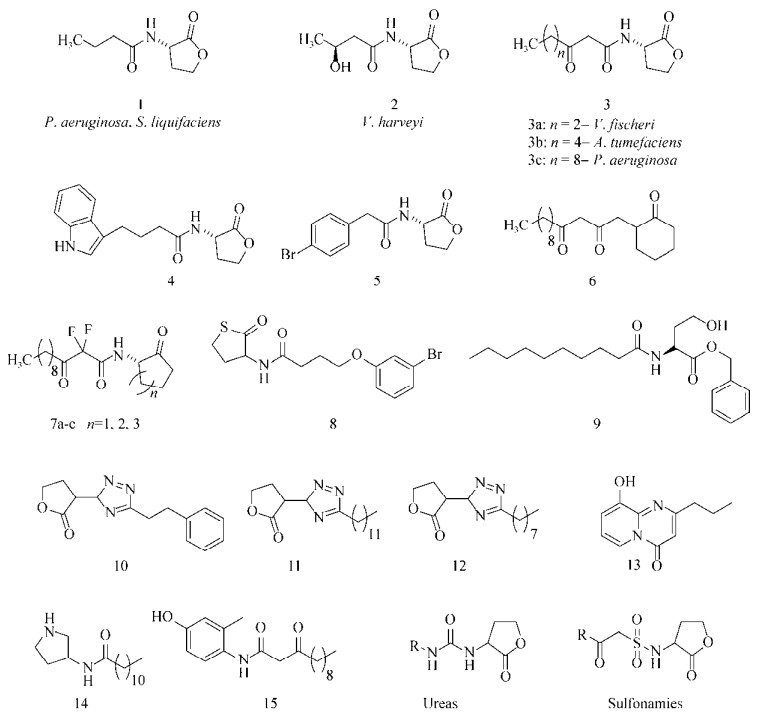
1 抗生物被膜化合物的研究进展1.1 群体感应信号分子衍生物1.1.1 高丝氨酸内酯类(AHLs)群体感应(Quorum sensing,QS)能够影响和调控生物被膜的形成[18]。自从发现酰基高丝氨酸内酯类化合物(Acyl homoserine lactones,AHLs,图 1:1–3) 在革兰氏阴性菌QS系统所扮演的关键角色后,AHLs类化合物就成为潜在生物被膜调节剂而被不断地开发和研究[19]。华盛顿大学的Greenberg课题组[20]发现AHL信号分子对绿脓杆菌Pseudomonas aeruginosa生物被膜的分化和发育起重要作用。他们发现一种对野生型菌株没有作用的表面活性剂十二烷基硫酸钠却能够使P. aeruginosa的LasI突变菌株从黏附表面脱离和分散,而在加入了合成的3c (图 1)后,再加入0.2%十二烷基硫酸钠培养24 h后却并未造成生物被膜的分离分散。
 |
| 图 1 N-AHLs衍生物 Figure 1 N-acyl homoserine lactone (N-AHLs) analogs. |
| 图选项 |
威斯康辛大学麦迪逊分校的Blackwell课题组[21]合成表征了一系列AHLs衍生物后,发现这类化合物能够调节P. aeruginosa和根癌农杆菌Agrobacterium tumefaciens的QS系统,其中活性最好的化合物(图 1:4–5) 延缓了P. aeruginosaPAO1生物被膜的形成。随后他们还合成了一些QS拮抗剂/激动剂,构建出了几个不同的AHLs化合物库,针对P. aeruginosa、A. tumefaciens和费氏弧菌Vibrio fischeri进行活性筛选[22],遗憾的是这类化合物并没有表现出抗生物被膜活性。纽约州立大学的Suga课题组[23-24]利用各种功能性基团(例如噻唑烷酮、环己烷酮等)对高丝氨酸内酯基团进行替换,发现AHLs衍生物6虽然不能影响P. aeruginosa POA1生物被膜的生长,但却使其形态发生了明显的变化。
剑桥大学的Spring课题组[25]将AHLs中的内酯环变为环烷基酮的同时,在酮酰胺β位引入了氟原子(图 1:7a–c),改善了AHLs类衍生物易水解的缺点,并保持了该类化合物的优良活性。普林斯顿大学的Bassler课题组[26]利用生物电子等排体的思路,以硫代内酯环替换AHLs中的内酯环,进一步改善了内酯环易水解的缺点,其中化合物8 (图 1)能有效地抑制P. aeruginosa生物被膜的形成。最近Weng等[27]发现化合物8在浓度为200 μmol/L时,能够降低生物被膜对托普霉素的抗性。Yang等[28]合成了一类没有内酯结构的酯类化合物,发现其中N-癸酰基-L-高丝氨酸苯甲基酯(N-decanoyl-L-homoserine benzylester,图 1,9)能够抑制P. aeruginosa浮游细菌的聚集和毒力因子的产生,且对细菌正常生长无影响。进一步研究发现,该化合物是通过抑制群体感应中Las和Rhl系统从而调控细菌毒力的表达。
Brackman等[29]以1,3,4-三氮唑替换AHLs中酰胺键及其所连接的碳链,合成了一系列AHLs衍生物triazolyldihydrofuranones (图 1:10–12)。在测定该类化合物对洋葱伯克霍尔德菌Burkholderia cenocepacia和P. aeruginosa QS系统和生物被膜的影响时,发现化合物10和11能够抑制P. aeruginosa PAO1生物被膜的形成,化合物11和12对B. cenocepacia LMG16656生物被膜形成有抑制效果。
牙龈卟啉单胞菌Porphyromonas gingivalis是牙周病的主要致病菌,目前尚不清楚这类细菌QS系统的具体调控机制,不过有研究表明:AHLs类信号分子(图 1:13–15) 能够降低P. gingivalis生物被膜的厚度[30],将这类衍生物与一些抗生素连用(如头孢呋辛、米诺环素和氧氟沙星等)能够增强抗生素对P. gingivalis生物被膜的药效[31]。
还有一些脲类(Ureas,图 1)[32]和磺酰胺类(Sulfonamies,图 1)[33]化合物也能通过调控细菌QS系统,达到影响生物被膜的效果。这些QS信号分子的衍生物活性优良且均没有杀菌活性,不过这类骨架结构存在生理pH下容易水解的缺点[34],还需要进一步的研究来推动其作为潜在新型抗菌药物的应用前景。
1.1.2 肽类(Peptides)革兰氏阳性菌QS系统中有一种独特的信号分子——肽类。目前肽类拮抗剂研究中最重要的一类是RNA-Ⅲ抑制肽(RNA-Ⅲ inhibiting peptide, RIP),RIP能够显著减弱葡萄球菌Staphylococci生物被膜的形成[35]。RIP竞争性抑制了RNA-Ⅲ激动蛋白,阻止了该类蛋白的磷酸化和细菌毒力因子产生,使细菌黏附效果严重下降并导致生物被膜形成失败。在动物模型上的体内活性测试也发现RIP可以预防多种类型的细菌性感染,包括具有耐药性的菌株[36],而且没有观察到药物对细菌的毒性反应,目前也尚无抗RIP的菌株报道[37]。Chan等[38]发现化合物16 (图 2)对AgrC-I QS系统具有拮抗效果。不过也有报道发现,1种基于这些抑制剂结构的类似物17 (图 2),能够促进金黄色葡萄球菌Staphylococcus aureus生物被膜的形成[39]。这些潜在的生物被膜激动剂能够使人们进一步了解细菌的信号通路,也有利于潜在拮抗剂的开发。
 |
| 图 2 肽类衍生物 Figure 2 Peptide analogs. |
| 图选项 |
不列颠哥伦比亚大学的Hancock课题组[40]发现1种多肽1018 (VRLIVAVRIWRR-NH2)拥有广谱的抗生物被膜活性,能够阻止包括P. aeruginosa、大肠杆菌Escherichia coli、鲍氏不动杆菌Acinetobacter baumannii、肺炎克雷伯菌Klebsiella pneumoniae、methicillin resistant Staphylococcus aureus (MRSA,耐甲氧西林金黄色葡萄球菌)、鼠伤寒沙门氏菌Salmonella typhimurium和B. cenocepacia在内的生物被膜的形成。进一步研究后发现了其中的机理——这种多肽通过抑制酶RelA和SpoT合成(p)ppGpp (生物被膜发育中的重要信号分子),导致生物被膜发育受阻,且此多肽在低浓度时对细菌正常生长也无影响。
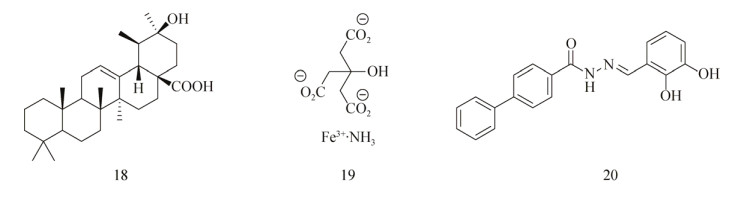
1.2 化合物库筛选高通量筛选(High throughput screening, HTS)也是开发新型抗生物被膜剂的方法之一,Ren等[41]对13 000个化合物进行筛选,发现熊果酸(Ursolic acid,图 3:18) 在22 μmol/L浓度下,对E. coli生物被膜的形成具有抑制作用,且该化合物对细菌正常的生长无影响。此外,对熊果酸处理后的E. coli进行基因组学分析后发现其展现出了趋化性,其中运动性和热休克相关的基因明显上调,而上述的基因都与生物被膜的形成密切相关,说明其作用机制可能是通过抑制生物被膜的成熟从而阻碍生物被膜的生长。
 |
| 图 3 利用化合物库筛选到的活性分子 Figure 3 Molecules possessed anti-biofilm properties identified by chemical library screening. |
| 图选项 |
Musk等[42]进行高通量筛选时发现,铁盐可以作为非杀菌性的P. aeruginosa生物被膜抑制剂,初筛时发现有6个化合物在浓度为50 μmol/L时能够至少抑制30% P. aeruginosa生物被膜的形成,其中柠檬酸铁铵(Ferric ammonium citrate,FAC,图 3:19) 的IC50值大约在60 μmol/L,且在500 μmol/L时对细菌的正常生长无影响。进一步实验发现单独添加铵或者柠檬酸铁盐均无效果。对其他一些铁盐(氯化铁、硫酸铁、硫酸亚铁)检测分析后也得到了与FAC相似的活性,还发现将P. aeruginosa转移到富含铁的培养基中时,已建立的生物被膜在随后的流动性实验中会受到破坏和清除。此外,他们对来自芝加哥CF患者中的一些不同致病型菌株进行测试后,发现每一个基因型不同的菌株随着铁元素水平的升高都表现出了不同程度的抗生素易感性。众所周知铁元素在细菌QS系统和毒力因子的表达上都扮演着重要角色,Yang等[43]发现外源添加了高浓度铁后,将会抑制细菌体内过量铁清除酶编码基因的表达,对P. aeruginosa生物被膜的成长和维持造成不利影响,Musk等[44]之后还报道了一些不同的铁螯合剂也能抑制P. aeruginosa生物被膜的形成。
Junker等[45]对66 095个化合物(包括已上市的药物和天然产物)进行高通量筛选后,得到了61个能够明显抑制P. aeruginosa POA1生物被膜形成的化合物,包括Schiff碱类衍生物和含氮、含硫杂环化合物。进一步活性测试发现其中30个化合物的IC50值都小于20 μmol/L,其中活性最好的化合物20 (图 3,IC50=530 nmol/L)还能够分散已形成的生物被膜(EC50=230 μmol/L)。
1.3 天然产物和天然产物类似物1.3.1 植物提取物许多传统药物都来自于天然植物中[46],例如Slusarenko等[47]报道从大蒜中分离得到了具有杀菌活性的大蒜素21 (Allicin,图 4)。Bjarnsholt等[48]发现大蒜提取物能够清除大鼠模型中由P. aeruginosa引起的肺部感染,还发现使用大蒜素处理过后的P. aeruginosa生物被膜对抗生素妥布霉素变得更加敏感。Shuford等[49]发现大蒜提取物能够抑制白色念珠菌Candida albicans生物被膜的形成,进一步对提取物分离分析发现其中2个二噻烷类化合物(Dithianes,图 4:22–23) 能够调节QS中的LuxR系统,且无杀菌活性[50]。
 |
| 图 4 植物中分离得到的生物被膜抑制剂 Figure 4 Plant-derived biofilm inhibitors. |
| 图选项 |
水杨酸(图 4:24) 是一类常见的植物激素,最初发现这种非甾类抗炎药(Nonsteroidal anti-inflammatory drug,NSAID)能够抑制表皮葡萄球菌Staphylococcus epidermidis生物被膜的形成,但后来确定其作用机制是杀死细菌从而抑制生物被膜的形成[51]。Rosenberg等[52]发现一种酸酐聚合物(图 4:25),经生物降解后转化为水杨酸和脂肪酸,在体外亚致死浓度下能够预防P. aeruginosa和肠炎沙门氏菌Salmonella enterica生物被膜的形成。
天然植物提取物肉桂醛(Cinnamaldehyde图 4:26) 常作为多种食品和饮料的无毒香料添加剂。与水杨酸类似,Niu等[53]发现肉桂醛能够有效抑制E. coli生物被膜的形成,但随后发现其活性也是通过杀死细菌而产生的。不过Brackman等[54]对肉桂醛的苯环进行修饰,发现在邻对位引入取代基的一些衍生物(图 4:27–29,100 μmol/L)能够高效地抑制多种Vibrio菌株生物被膜的形成,而且这些衍生物无杀菌效果。进一步的作用机制研究表明,这些衍生物通过降低DNA与LuxR蛋白的结合能力,干扰了Vibrio中基于AI-2的QS系统。
有报道发现从食物中(如蔓越莓和可可粉)分离到的一些多酚类化合物对多种口腔疾病有预防作用[55-58]。Bodet等[59]也发现蔓越莓(含多种高分子量多酚类物质,以30为代表)能够阻止多种口腔细菌(如变形链球菌Streptococcus mutans)生物被膜形成,他们认为可能是多酚干扰了细菌对牙齿表面进行最初黏附时的两个酶的功效(葡萄糖和果糖转移酶,分别催化葡聚糖、果聚糖的形成,在生物被膜形成的起始阶段起关键作用),从而阻止细菌在牙齿上的定植和吸附。
Murata等[60]从Rheedia brasiliensis中分离纯化得到了1种天然产物7-epiclusianone (图 4),该化合物在浓度为250 μg/mL时能够抑制Streptococcus mutans生物被膜的形成,从而减少口腔内龋齿的产生。
Emodin (图 4)是1种天然的蒽醌类物质,在许多植物的树皮和根、霉菌、地衣中都能够分离得到。Ding等[61]发现emodin能够显著地抑制P. aeruginosa和嗜麦芽窄食单胞菌Stenotrophomonas maltophilia生物被膜的形成。而且使用emodin处理后能造成细菌从黏附的表面分离和分散,他们认为其中的机制可能是emodin渗透进入了P. aeruginosa生物被膜中,影响了细菌的QS系统。
Lee等[62]从苹果中分离得到1种黄酮类化合物phloretin (图 4),能够抑制E. coli O157:H7生物被膜的形成,进一步研究发现是由于phloretin抑制了生物被膜形成时所需菌毛的产生所致。Phloretin在浓度为50 μg/mL时减少了高达98% E. coli O157:H7生物被膜的形成,几乎完全抑制,但对浮游态细菌的生长无影响。而且,phloretin并没有抑制人体共生菌E. coli K-12生物被膜的形成[62],表明该类化合物在抑制致病型菌株和人体共生菌的生物被膜上具有良好的选择性,这一发现对提高和改善抗生物被膜药剂的选择性非常关键和重要[63-64]。
Vikram等[65]发现1种柑桔类植物的三萜类次生代谢产物isolimonic acid (图 4)能够干扰哈维氏弧菌Vibrio harveyi中的QS系统,并展现出了剂量依赖型的生物被膜抑制活性(IC50= 94.18 μmol/L)。随后他们还发现isolimonic acid能够抑制E. coli O157:H7生物被膜的形成(IC50=19.7 μmol/L),并能够通过抑制E. coli O157:H7中的Ⅲ型分泌系统(Type Ⅲ secretion system)影响其致病性[66]。
贯叶金丝桃(Hypericum perforatum,又被称为圣约翰草,St. John’s Wort)的提取物早已展现出了一系列的临床活性,其中贯叶金丝桃素是贯叶金丝桃中的主要成分,但是由于其不稳定,大多数人认为贯叶金丝桃素不是贯叶金丝桃临床活性的来源。不过Schiavone等[67]发现了贯叶金丝桃素1种稳定存在的形式——氢化贯叶金丝桃素(Hyperforin and its hydrogenated analog,图 5),这种氢化物能够抑制S. aureus ATCC 29213、MRSA、粪肠球菌Enterococcus faecalis ATCC 29212和S. aureus Ig5生物被膜的形成和生长。对S. aureus ATCC 29213和S. aureus Ig5的IC50值分别为150和37.5 μg/mL,在浓度为37.5 μg/mL时也分别使S. aureus ATCC 43300和E. faecalis ATCC 29212生物被膜的形成减少了47%和45%。Sarkisian等[68]则从另一个方向出发,对金丝桃属植物的次生代谢产物进行研究,发现其中5个化合物(31a–b和32a–c,图 5)能够抑制S. epidermidis和S. aureus生物被膜的形成,这些化合物的最小抑菌浓度均低于8 μg/mL。
 |
| 图 5 植物中分离得到的生物被膜抑制剂 Figure 5 Plant-derived biofilm inhibitor. |
| 图选项 |
Artini等[69]从植物Chelidonium majus中分离得到化合物chelerythrine (图 5),chelerythrine能够抑制S. aureus ATCC 6538P (IC50=15.2 μmol/L)和S. epidermidis ATCC 35984 (IC50=8.6 μmol/L)生物被膜的形成,均具有剂量依赖的特点。他们还发现另一种来源于药用植物Krameria lappacea的化合物proanthocyanidin A2 (图 5)能够抑制两种Staphylococcus菌株生物被膜的形成(EC50= 6.9 μmol/L和7.6 μmol/L)。这两种分子在最小抑制浓度时对实验用的两种Staphylococcus菌株细胞生长都没有影响,不过这两种化合物都没有展现出分散生物被膜的活性。
Lee等[70]发现银杏酸(Ginkgolic acid C15:1,图 5)与其他几个植物源化合物在浓度为5 μg/mL时能够抑制E. coli O157:7生物被膜的形成,且对细菌正常生长无影响。随后研究发现这是由于银杏酸C15:1抑制了编码菌毛(curli)的基因表达,导致了菌毛的产生受到影响。值得一提的是,当用银杏酸C15:1处理人体的共生菌E. coli K-12时,发现该菌生物被膜的形成并没有受到影响,反而促进了其生长。当浓度为5 μg/mL时,银杏酸C15:1也能够抑制MRSA和S. aureus生物被膜的形成,对细胞生长也没有影响。
最初有报道[71]发现银杏酸中的1种主要成分——白果新酸(Ginkgoneolic acid,C13:0,图 5)具有抗菌活性。后来He等[72]也发现2 μg/mL的白果新酸能够抑制S. mutans对羟基磷灰石(S-HA)的黏附。在32 μg/mL时能够抑制超过50% S. mutans生物被膜的形成,同时还引起了生物被膜形态的变化。Nostro等[73]发现牛至油气体中的香芹酚和百里酚(Carvacrol and thymol,图 5)能够高效地抑制并分散S. aureus和S. epidermidis的生物被膜。Soni等[74]也发现百里香油、牛至油中百里酚的含量仅在0.012%时就能S. typhimurium生物被膜的发育。还有发现香芹酚能够抑制紫色色杆菌Chromobacterium violaceum (0.1–0.3 mmol/L)、S. typhimurium (0.75–1.25 mmol/L)和S. aureus (0.5–1 mmol/L)生物被膜的形成[75],且在这些浓度下,对细菌生长均无影响。进一步实验发现香芹酚能够影响C. violaceum中QS系统从而抑制AHLs、几丁质酶和紫色杆菌素的产生。
最近Majik等[76]报道了1种N-去甲基化吡咯环天然生物碱(Norbgugaine)对P. aeruginosa QS系统和生物被膜的影响,发现P. aeruginosa生物被膜的密度随(R)-norbgugaine (0–4 mmol/L,图 5)浓度上升而降低,当(R)-norbgugaine上升至1.8 mmol/L时抑制效果达83%,且不影响细菌的生长。除抑制生物被膜外,(R)-norbgugaine还能够降低细菌活力、绿脓菌素、LasA蛋白酶和鼠李糖脂的产生。
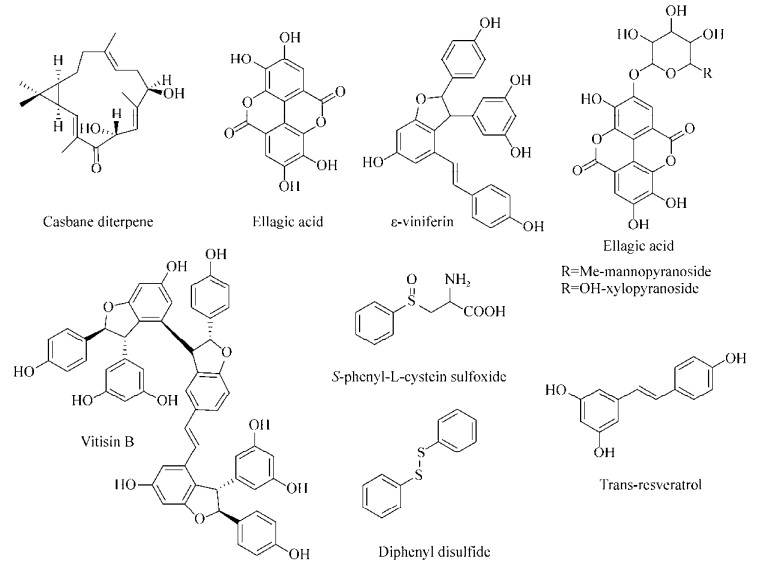
Carneiro等[77]发现1种Croton nepetaefolius植物的提取物casbane diterpene (图 6)能够抑制革兰氏阴性菌和阳性菌生物被膜的形成。在浓度为125和250 μg/mL时,显著抑制了S. aureus和S. epidermidis CECT 4183生物被膜的形成,在浓度为15.6和250 μg/mL时抑制K. pneumoniae ATCC 11296 (45%)和P. aeruginosa ATCC 10145 (80%)生物被膜的形成。在高浓度时,对P. aeruginosa CGCT 111、E. coli K12和荧光假单胞菌Pseudomonas fluorescens的生物被膜形成也都有抑制效果。
 |
| 图 6 植物中得到的生物被膜抑制剂 Figure 6 Plant-derived biofilm inhibitors. |
| 图选项 |
Morelli课题组[78-79]用Rubus ulmifolius Schott (Rosaceae-Elmleaf blackberry,地中海地区广泛存在的1种灌木丛)的根部提取物处理多种不同S. aureus菌株的生物被膜后,发现生物被膜都分散成了细胞团。之后Quave等[80]证实R. ulmifolius提取物用量在50-200 μmol/L时能够抑制S. aureus生物被膜的形成,但这些提取物对成熟的生物被膜没有效果,不过能够增强一些特定的抗生素对生物被膜的药效。用LC-UV/MS/MS分析后发现这些提取物的活性主要来源于ellagicacid及其衍生物(Ellagic acid mannopyranoside和ellagic acid xylopyranoside,图 6)。
Lee等[81]对近500种植物提取物进行活性筛选,发现Carex dimorpholepsis提取物的主要成分反式白藜芦醇(Trans-resveratrol,图 6)能够抑制E. coli O157:H7生物被膜的形成,且对人体共生型的E. coli菌株无影响。也有报道发现在葡萄藤和苔属植物中分离得到具有抗氧化活性的ε-白藜芦醇二聚体[82]。Cho等[83]发现反式白藜芦醇和ε-白藜芦醇二聚体(ε-Viniferin,图 6)对P. aeruginosa PAO1、PA14的生物被膜具有抑制作用,在浓度为50 μg/mL时反式白藜芦醇对PAO1生物被膜形成的抑制效果为92%,ε-白藜芦醇二聚体对PA14的抑制效果为82%,生物活性均表现出剂量依赖的特点。还发现ε-白藜芦醇二聚体(10 μg/mL)对E. coli O157:H7生物被膜形成的抑制效果高达98%,且不影响浮游态细菌的生长。Lee等[84]对白藜芦醇的三聚体和四聚体也进行了活性测定,发现vitisin B (图 6)对E. coli O157:H7和P. aeruginosa PA14生物被膜的形成有抑制效果。在浓度为5 μg/mL时,对E. coli O157:H7抑制效果超过90%,且在浓度低于50 μg/mL时无杀菌活性,其机理也涉及到抑制菌毛的产生。
Cady等[85]从亚马逊的药用植物Petiveria alliacea L. (Phytolaccaceae)提取物中分离得到一些含硫衍生物如S-phenyl-L-cystein sulfoxide和diphenyl disulfide (图 6),他们发现这些含硫衍生物在1 mmol/L时能够降低P. aeruginosa生物被膜态下细胞的活性(41%和45%),而对浮游态细菌生长无影响。
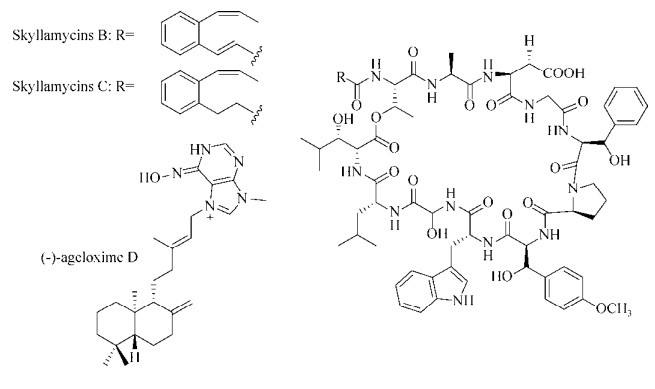
1.3.2 海洋源化合物Navarro等[86]利用Streptomyces sp.筛选P. aeruginosa生物被膜抑制剂时得到了1类结构独特的环肽分子——skyllamycins。其中skyllamycins B和C (图 7)能够抑制P. aeruginosa生物被膜的形成(EC50值分别为30 μmol/L和60 μmol/L),skyllamycinsB还能够清除P. aeruginosa PAO1 ΔwspF (c-di-GMP过表达,能够形成更强的生物被膜)已经成熟的生物被膜,且对细菌正常生长无影响。Hertiani等[87]从印尼海绵Agelas nakamurai中分离得到了1种二萜类生物碱(-)-ageloxime D (图 7),他们发现(-)-ageloxime D能够抑制S. epidermidis生物被膜的形成,且对细菌生长无影响。
 |
| 图 7 海洋源生物被膜抑制剂 Figure 7 Marine-derived biofilm inhibitors. |
| 图选项 |
Tello等[88-89]对从哥伦比亚加勒比海八叉珊瑚Pseudoplexaura flagellosa和Euniceaknighti中分离得到的西松烷衍生物(图 8)的抗生物被膜活性进行了测试,发现西松烷C8位的差向异构体能够抑制P. aeruginosa、V. harveyi和S. aureus生物被膜的形成及生长[88]。在浓度为10 μg/mL时,化合物33和35对V. harveyi生物被膜的成熟抑制效果达75%,而化合物34–36对S. aureus生物被膜的形成抑制效果为70%;在浓度为100 μg/mL时,化合物37和38对V. harveyi生物被膜的成熟抑制效果分别为40%和95%,且这些西松烷在100 μg/mL时对细菌生长均无影响。他们还发现化合物39–45能够抑制P. aeruginosa生物被膜的形成[89],IC50值都在50 μmol/L以下。化合物40和41能够抑制S. aureus生物被膜的形成,IC50值达到了nmol/L级,分别为160 nmol/L和80 nmol/L。而化合物43–45对V. harveyi的IC50值分别为5.20 μmol/L、30.80 μmol/L和9.91 μmol/L,且这些化合物都没有影响细菌的正常生长。
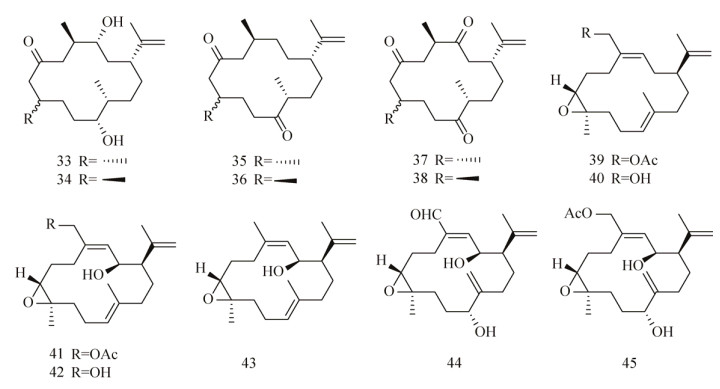 |
| 图 8 西松烷化合物库 Figure 8 Cembranoids library. |
| 图选项 |
1.3.3 卤代呋喃酮类关于卤代呋喃酮类化合物(Halogenated furanones,HFs)对细菌QS系统的作用已有详尽的报道[90-93]。这类小分子(图 9:46–49) 来源于海洋红藻Delisea pulchra,作为海藻体内的1种化学防御剂[94]。Kjellebergl等[95]认为这些化合物是植物与细菌经过多年的相互作用而最终代谢产生的,当海藻受到细菌攻击时,体内迅速合成一些能够调控细菌QS系统的群体感应信号分子及其类似物,这些化合物可以扰乱细菌对寄主的侵染及攻击。研究也证明了海藻中提取的天然HFs确实能够阻止E. coli和枯草芽孢杆菌Bacillus subtilis细菌的聚集和生物被膜的形成[92-93]。
 |
| 图 9 呋喃酮类抗生物被膜剂 Figure 9 Halogenated furanones that possess anti-biofilm activity. |
| 图选项 |
HFs和AHLs在结构上十分相似,都是由一个非极性的脂肪碳链作为“尾部”与极性的“头部”相连,有无溴原子取代是这两类化合物结构上最大的差异。许多报道也都证明了HFs可以模拟AHLs对细菌的QS系统进行干扰[96-97],包括抑制V. fischeri的发光,影响液化沙雷氏菌Serratia liquefaciens的群集运动,并且通过DNA微阵列分析实验发现HFs影响了P. aeruginosa中93个基因的表达等,其中许多基因都与细菌毒力因子的产生和生物被膜的形成密切相关。Giskov课题组[98-99]发现一些HFs分子能够与LuxR蛋白结合(AHLs的受体蛋白),对蛋白水解切割造成蛋白的降解,影响AHLs依赖型蛋白的活性。Konaklieva等[100]认为HFs的生物活性来源于其与LuxR蛋白非常强的结合能力,即来自受体结合口袋中的亲核性氨基酸残基对亲电性的HFs烯酮基团进行亲电进攻,导致蛋白质的构象发生变化,形成一种更容易被降解的复合物。
Hentzer等[90]发现人工合成的HFs能够穿透P. aeruginosa生物被膜基质并干扰细菌的QS系统,且对细菌生长没有影响。之后的研究发现用化合物50 (图 9)处理的P. aeruginosa生物被膜结构发生显著变化[96],这种变化与缺失LasI基因的P. aeruginosa突变型十分相似。该化合物对细菌最初的黏附阶段没有任何影响,但处理后的生物被膜相比空白对照,在分离阶段变得更迅速,也就导致了更多细菌生物量的损失。处理和未处理的生物被膜在形态上无显著差异,不过处理后的生物被膜对抗生素妥布霉素变得十分敏感。Wu等[101]合成了一批HFs衍生物,发现化合物50和51能够干扰已侵染了大鼠的P. aeruginosa中的QS系统,并加快免疫系统对P. aeruginosa肺部感染的清除速度。
L?nn-Stensrud等[102]发现呋喃酮类化合物50对一些革兰氏阳性菌如口腔细菌链球菌Streptococci的生物被膜也有效果,还发现先用60 μmol/L预处理聚苯乙烯平板后,S. mutans和S. intermedius生物被膜在平板上的生长量分别减少了63%和76%。
Han等[103]对HFs进行构效关系分析,发现呋喃酮环上溴原子取代的位置和取代度对其调节E. coli生物被膜的活性十分重要,他们先合成了10个目标产物并评估了其各个浓度下的毒性后,测试了这些化合物对E. coli生物被膜的作用。其中衍生物52–54能够抑制生物被膜的形成,在浓度分别为224 μmol/L (52和53) 和141 μmol/L (54) 时抑制效果分别达80%、63%和75%。对这些化合物进行构效关系分析发现,它们在结构上有1个共同的特点,即呋喃酮环5-位的取代基都是溴乙烯基。Kim等[104]合成了一些呋喃酮环上完全没有溴代且5-位是酯取代的衍生物(55–59),他们在流式细胞仪和共聚焦显微镜下发现这些化合物对P. aeruginosa生物被膜形成也有明显抑制效果。之后他们还利用分子对接的方法比较了人工合成的呋喃酮衍生物和已知P. aeruginosa QS系统中信号分子3-oxo-C12-HSL (3c)与LasR受体蛋白的结合模式。对接结果表明,在受体的活性腔内,呋喃酮与AHL中高丝氨酸内酯基团在结合口袋中重叠,与受体具有相似的作用方式,对接的打分结果也相似,这就合理验证和解释了所观察到的实验结果。
生物被膜对植入式医疗器械(IMDs)持续性的致病性也是亟待解决的问题之一,Baveja等[105]发现在医用材料中添加呋喃酮类衍生物(无论通过共价键或非共价键方式),都能够降低细菌侵染后带来的毒性。他们先将卤化呋喃酮60 (图 9)通过非共价键连接到医疗设备常用的聚合材料上,测试了其对S. epidermidis黏附和生物被膜形成的影响。他们发现与未处理的对照相比,所有添加了呋喃酮涂层的生物材料在24 h后都显著抑制了细菌的黏附和生物被膜的发育。在之后的研究中[106],他们又将相同的呋喃酮与苯乙烯通过共价键形成聚苯乙烯共聚物,或通过等离子体EDC反应,在尿液管上形成呋喃酮涂层。之后的体外测试发现生成的共聚物对S. epidermidis生物被膜发育的抑制率为89%,对还有呋喃酮涂层的尿液管上生物被膜形成的抑制率为78%。虽然前者活性更好,但后者的抑制活性有效期能够持续2年。而在动物模型实验中,与没有得到治疗的羊相比,在感染了S. epidermidis的羊体内植入有呋喃酮涂层的尿液管后,可以阻止致命性的感染长达65 d之久。
虽然上述这些HFs都拥有优越的抗生物被膜活性,但是HFs距真正应用还有一些问题需要解决,如药物的毒性、致癌性和易水解等缺陷[107]。未来的研究应该着重关注并解决这些缺陷,让这类小分子尽早成为新型抗生物被膜药物,帮助人类抵御细菌侵染与危害。
1.3.4 咪唑衍生物天然产物中有一类独特的小分子生物碱——2-氨基咪唑,其结构中含密集排布的氮原子[108]。这些小分子大多来源于热带水域的群海绵科(Agelasidae)[109],在海绵体内作为1种抵御其捕食者的化学防御机制[110-111]。广谱的生物活性也让这些小分子成为了目标导向合成的热点化合物[112-114]。Yamada[115]等在1997年首次发现了orodin和bromoageliferin (图 10)能够抑制革兰氏阴性菌Rhodospirillum salexigen生物被膜的形成和其导致的生物污损。生物污损由微生物污着引起,是细菌在水相与气相交界处,依靠表面张力形成生物被膜后所造成的结果。他们用一块预先浸泡过海绵提取物的玻璃接种R. salexigen,之后转移到培养基培养,测定吸光度以确定细菌生长值。得到bromoageliferin的IC50值为2.43 μmol/L,oroidin为169 μmol/L。Kelly等[116]先用液体培养基培养创伤弧菌Vibrio vulnificus,然后转入含有oroidin的琼脂平板上,观察到V. vulnificus未能产生菌落。基于上述现象,他们认为oroidin对V. vulnificus具有抗黏附的活性。
 |
| 图 10 Orodin和bromoageliferin Figure 10 Orodin and bromoageliferin. |
| 图选项 |
北卡罗来纳州立大学的Melander课题组[117]设计合成了2个简单的bromoageliferin类似物,TAGE 61 (Trans-bromoageliferin)和CAGE 62 (Cis-bromoageliferin) (图 11),然后评估了它们对P. aeruginosa PAO1和PA14生物被膜的抑制和分散活性。结果显示2个化合物的活性相当,其中TAGE (IC50=100 μmol/L vs. PAO1,IC50= 190 μmol/L vs. PA14),CAGE (IC50=100 μmol/L vs. PAO1,IC50=180 μmol/L vs. PA14),而且活性效果也都为剂量依赖型。其中TAGE还对P. aeruginosa PAO1和PA14展现出了良好的剂量依赖型分散活性(EC50=82 μmol/L vs. PAO1,EC50=114 μmol/L vs. PA14)。生长曲线和菌落统计结果均表明TAGE和CAGE都没有杀菌活性。为了确定观察到的结果是否由生物被膜结构的变化或选择性杀菌效果所致,他们进一步实验发现,在100 μmol/L TAGE存在时,48 h后用共聚焦微镜观察到P. aeruginosa的生物被膜生物量显著下降,而活细胞/死细胞的比例与未处理的对照接近,也就证实TAGE并没有杀死细菌[118]。
 |
| 图 11 TAGE、CAGE和TAGE的衍生物 Figure 11 TAGE, CAGE and TAGE's derivatives. |
| 图选项 |
Bromoageliferin结构上1个重要的特征就是环己烷环上的氨基连有溴化2-酰基吡咯基团。在对TAGE进行了活性评估后,下一步的设计应该是连接溴吡咯环然后评价其对活性的影响,同时他们还研究了TAGE骨架溴化模式(溴化的位置和程度)对活性的影响。结果发现合成的二溴化物、单溴化物和去溴化物(图 11:63–65) 都拥有非常好的抗生物被膜活性[118]。构效上一个明显的趋势是随着吡咯环上溴化程度的上升,活性也随之上升,但是这些类似物的生物被膜分散活性均低于TAGE。之后Melander课题组设计合成了一系列能够抑制和分散生物被膜的新骨架小分子[119-122],进一步证明了2-aminoimidazole骨架与生物活性间的重要联系。
Reyes等[123]合成了一系列2-aminoimidazol-etriazoles (2-AITs)化合物,并针对A. baumannii ATCC 19606和MRSA进行活性筛选。在初筛中(100 μmol/L)发现化合物66 (a–e) (图 12)对生物被膜的形成抑制效果高达94%,但是随后发现化合物66 (b–d)的杀菌效果也十分明显。化合物66 (a–d)在浓度为100 μmol/L时具有非常好的生物被膜分散活性,其中活性最好的化合物66c对A. baumannii的EC50值为44.70 μmol/L。化合物66a、66c、66d还能够抑制MRSA ATCC BAA-44的生物被膜的形成(IC50=9.86,8.55,4.50 μmol/L),且都没有杀菌活性。
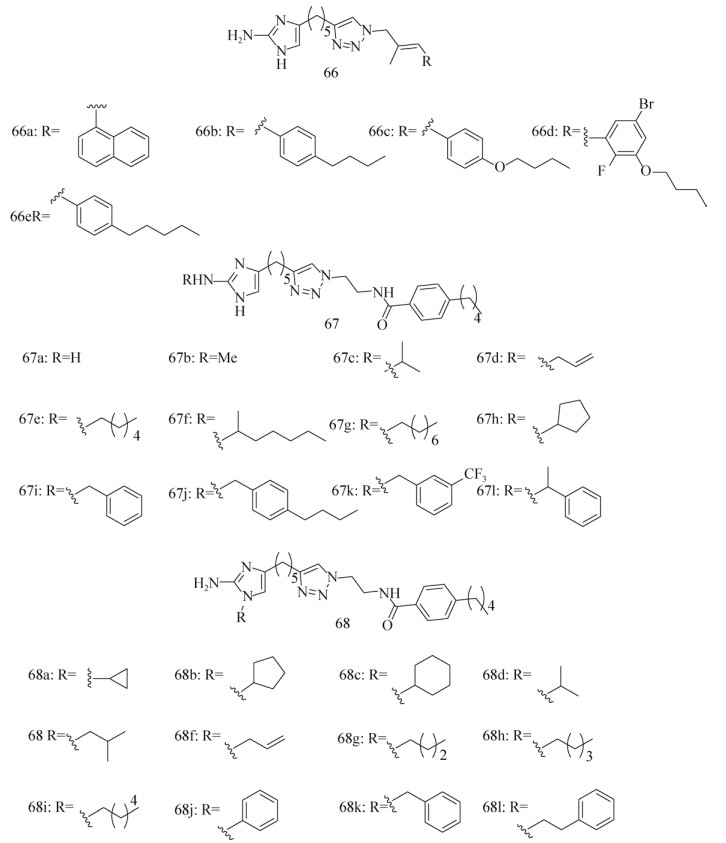 |
| 图 12 2-氨基咪唑类生物被膜抑制剂 Figure 12 2-aminoimidazolebased biofilm inhibitors. |
| 图选项 |
随后Su等[124]合成了一系列化合物67a (抗生物被膜活性优良)及其衍生物(图 12),然后又测定其200 μmol/L用量时对3种MRSA菌株BAA-1770、BAA-1685和43 300的抑制效果[125]。发现取代的烷基链碳原子数小于4 (67b–d)的衍生物与母体化合物67a的抑制活性接近,当碳原子数超过4或者变为苄基取代时,其抑制效果超过了母体化合物67a (特别是衍生物67j, IC50=5.9±0.66, 5.5±0.77, 4.4±0.76 μmol/L),同时还发现短脂肪烃的取代基(67c,67d)能够增加苯唑西林对MRSA的治疗效果。
最近,Melander课题组[126]又新开发了另一个系列的化合物——1, 4位二取代的2-氨基咪唑(1, 4-Disubstituted-2-aminoimidazoles,图 12:68a-l),检测了其对MRSA生物被膜的抑制效果。发现这些化合物的抑制活性非常好,其中活性最高的化合物68 h的IC50值为(4.14±2.03) μmol/L。
Rogers等[127]还发现了一类基于薄荷基氨基甲酸酯骨架的小分子,对多种不同的Staphylococcal菌株生物被膜都有极强的抑制效果,且均无杀菌活性。之后他们又合成了一系列由2-aminoimidazole (2-AI)基团作为“头”部与氨基甲酸酯基团连接的化合物(图 13:69–73),生物活性测试发现,这些化合物对MRSA、S. aureus ATCC#29213、P. aeruginosa PA14的生物被膜都具有抑制和分散效果[128]。其中化合物69–72对P. aeruginosa PA14生物被膜的抑制活性IC50值分别为18、18、58.7和40.3 μmol/L,化合物73对A. baumannii生物被膜的抑制活性IC50值为16.7 μmol/L。
 |
| 图 13 2-氨基咪唑连薄荷基氨基甲酸酯类生物被膜抑制剂 Figure 13 2-aminoimidazole and menthyl carbamate biofilm inhibitors. |
| 图选项 |
Bromoageliferin、3-indolylacetonitrile和resveratrol (图 14)都能够有效地抑制P. aeruginosa生物被膜的形成,那么一种包含上述3种骨架的分子是否也具有抗生物被膜活性呢?Blackwell课题组[129]设计合成了一组包含2-AI或吲哚基团的分子,发现化合物74、75 (100 μmol/L)对P. aeruginosa生物被膜的抑制效果分别为56%和48%。为了进一步分析构效关系,确定这些化合物中究竟是哪一部分使其拥有抗生物被膜的活性,他们将这些化合物拆解,分别合成了拆解后的部分,发现小分子76 (图 14)的活性优于拆解前活性最好的化合物74,在24 h时几乎完全抑制了生物被膜的形成(抑制率为94%,IC50=47 μmol/L)。随后他们分别测试了环上不同取代基对活性的影响,发现2-ABI环上拥有卤素或甲基取代时表现出更好的活性,其中化合物77的IC50值达到了4.0 μmol/L。进一步研究其作用机制发现,2-氨基苯并咪唑类化合物是通过抑制QS中的Las和Rhl系统,达到抑制生物被膜的效果。
 |
| 图 14 苯并咪唑类衍生物和吲哚类衍生物 Figure 14 Benzimidazoles and indole analogs. |
| 图选项 |
Melander课题组[130]在2-ABIs咪唑环的氮上引入取代基后,发现这类化合物对S. aureus生物被膜的抑制效果是通过锌离子辅助产生的,并且对二价锌离子的浓度具有正向依赖。其中吲哚类衍生物(78) 是这类化合物中活性最强的,对S. aureus 43300和BAA-44的IC50值分别为3.7和4.4 μmol/L,但这些化合物都没有表现出分散生物被膜的活性。
Sambanthamoorthy等[131]发现2个结构相近的苯并咪唑类化合物(79和80,图 14)在10 μmol/L时都能抑制霍乱弧菌Vibrio cholerae生物被膜的形成,还测定了化合物79对其他6种人体致病菌(P. aeruginosa CF-145、K. pneumoniae、解淀粉欧文氏菌Erwinia amylovora、鲍氏志贺菌Shigella boydii、MRSA USA300和S. aureus Newman)的活性。发现在浓度为100 μmol/L时,79能够在流动条件下抑制P. aeruginosa在医疗硅胶导尿管上形成生物被膜,但对其他菌均无效。
1.3.5 吲哚衍生物色氨酸酶降解色氨酸生成的吲哚[132]能够作为一种细胞间的信号分子,影响多种不同种类的细菌[133]。在吲哚浓度为500 μmol/L时,E. coli O157:H7生物被膜的形成和细菌活力均被抑制[134-135]。对吲哚处理后的生物被膜进行基因表达研究,发现吲哚能够使冷休克调节基因(cspGH)表达量下调2.5倍,磷酸盐相关基因的表达也受到了影响。细菌中存在着许多加氧酶,Rui等[136]发现吲哚很容易被这些加氧酶转化成羟基吲哚,如5-羟基吲哚和7-羟基吲哚。
Lee等[137]发现,与空白对照相比吲哚能使E. coli O157:H7生物被膜的形成减少7倍,而7-羟基吲哚能使生物被膜的形成减少10倍。5-羟基吲哚和7-羟基吲哚也都能够减少E. coli O157:H7和E. coli K12在聚苯乙烯平板上生物被膜的形成量[131]。当浓度达到1 000 μmol/L时,5-羟基吲哚和7-羟基吲哚分别使E. coli O157:H7的生物被膜的形成减少11倍和27倍;使E. coli K12的生物被膜的形成减少6倍和8倍。Lee等[138]发现1种植物病原菌Rhodococcus sp. BFI332能够产生大量的3-吲哚乙醛和3-吲哚乙酸,随后发现3-吲哚乙醛对E.coli O157:H7生物被膜的抑制效果比吲哚更强,在浓度均为100 μmol/L时,3-吲哚乙醛使E. coli O157:H7生物被膜的形成量减少了10倍,而吲哚仅能减少4倍。
Lee等[139]还发现一些吲哚类植物次生代谢产物3-indolylacetonitrile (IAN,图 14)和indole-3-carboxyaldehyde (I3CA)也能够抑制E. coli O157:H7生物被膜的形成,并展现出了比吲哚更好的抑制活性。在浓度均为100 μmol/L时,吲哚仅使E. coli O157:H7生物被膜的形成量减少3倍,而INA和I3CA能使生物被膜的形成量减少24倍和11倍。此外,在此浓度下INA (2.3倍)和I3CA (1.9倍)也能抑制P. aeruginosa生物被膜的形成,而吲哚和7-羟基吲哚反而促进了P. aeruginosa生物被膜的形成。
Melander课题组[140]也设计合成了一些吲哚-三氮唑-酰胺类衍生物(图 14),发现化合物81 (a–c)能够抑制S. aureus生物被膜的形成(IC50值分别为44.4、173.6和174.8 μmol/L);化合物82在浓度为150 μmol/L时,对E. coli生物被膜的形成率为12%,对A. baumannii和MRSA的IC50值分别为325.5和151.4 μmol/L。此外,这些衍生物都没有表现出杀菌活性,对浮游细菌的生长无影响。
1.4 其他化合物1.4.1 氨基衍生物哈佛大学的Losick课题组[141-142]发现B. subtilis生物被膜上的细胞是通过胞外多糖和淀粉样纤维聚集在一起的,他们发现一些D型氨基酸(D-amino acids,包括D-Tyr、D-Leu、D-trp和D-Met,也是肽聚糖的组成单元之一)可以触发TasA纤维的释放。D-tyr和D-Met还可以抑制B. subtilis、P. aeruginosa和S. aureus生物被膜的形成[141],这些D型氨基酸的抑制效果都能够被其同源的L型氨基酸逆转。
之后他们还报道发现B. subtilis生物被膜的稳定依赖于亚精胺(Spermidine,图 15)[143],在生长成熟的B. subtilis培养基中得到了一种亚精胺类似物——降亚精胺(Norspermidine,比亚精胺少1个碳原子,图 15),并发现降亚精胺能够直接与胞外多糖相互作用,充当B. subtilis中一种生物被膜的分散因子。他们先在接种前的培养基中加入了25 μmol/L外源降亚精胺,结果发现生物被膜的形成被充分抑制,且降亚精胺对浮游态细菌生长无影响。同时还发现降亚精胺也能抑制S. aureus和E. coli生物被膜的形成。但是Hobley等却发表文章[144]驳斥了这一说法,他们发现外源添加降亚精胺的确能够抑制B. subtilis生物被膜的形成,但抑制浓度却是Losick课题组报道的10倍,且降亚精胺抑制了浮游细菌的生长。更重要的是他们还发现降亚精胺也不是B. subtilis的自体诱导分散因子,事实上B. subtilis根本不能合成降亚精胺,在B. subtilis任何阶段中都没有发现天然的降亚精胺产生。他们还发现B. subtilis生物被膜形成过程中所需的亚精胺也可以被降亚精胺更有效地代替。
 |
| 图 15 脂肪酸和多胺 Figure 15 Fatty acids and polyamine. |
| 图选项 |
1.4.2 脂肪酸脂肪酸能够借助酶从脂质中逃离,转变成游离脂肪酸(Free fatty acids,FFAs)[145],FFAs对革兰氏阴性菌沙眼衣原体Chlamydia trachomatis[146]、淋病奈瑟球菌Neisseria gonorrhoeae[147]和革兰氏阳性菌幼虫芽孢杆菌Bacillus larvae[148-149]都有抗菌活性。FFAs也存在于人体的皮肤中[150]并能够抵御细菌,控制其造成的感染[151]。还有发现FFAs能够抑制细菌生物被膜的形成[152-153]。Stenz等[152]发现在动植物体内广泛存在的油酸(Oleic acid,图 15)能够阻断细菌的黏附,抑制S. aureus生物被膜的形成,8种S. aureus菌株在添加了油酸后初始黏附时期的生物被膜形成量都显著降低。另1种由P. aeruginosa产生的顺式-2-癸烯酸
(cis-2-decenoic acid,图 15)能够诱使P. aeruginosa、E. coli、K. pneumoniae、奇异变形杆菌Proteus mirabilis、化脓性链球菌Streptococcus pyogenes、B. subtilis、S. aureus和白假丝酵母菌C. albicans生物被膜的分散[153]。Cis-2-decenoic acid在浓度大于或等于125 μg/mL时,能够抑制微孔板上细菌生物被膜的形成,但在浓度上升至500 μg/mL时对细菌生长也有抑制作用。Jennings等[154]发现cis-2-decenoic acid与一些抗生素联合使用后能够抑制S. aureus生物被膜的形成,特别是与利奈唑胺(Linezolid)联合使用时,利奈唑胺的用量只需减少至1/2–1/16就能达到同样的抑制效果。目前只知道FFAs能够影响细菌细胞膜上的一些基本过程,尤其是能量产生的过程[145],但是具体的抗生物被膜机制尚不清楚。
1.4.3 NO在实际应用上往往更需要一些能够诱导生物被膜分散的药物,因为在多数情况下,药物介入和使用的对象是成熟的生物被膜。有报道[155-156]发现人体内重要的生物信使NO能够诱使细菌的生物被膜分散,包括使细菌从生物被膜模式向自由游动的浮游态转变。生物被膜对外源NO的吸收是通过NO供体的呈递实现的(图 16),Barraud等[155]发现当NO供体处于低浓度时,P. aeruginosa生物被膜的生物量降低而浮游态细菌生物量上升,NO供体还能加强抗生素(如托普霉素)对P. aeruginosa生物被膜的分散效果。
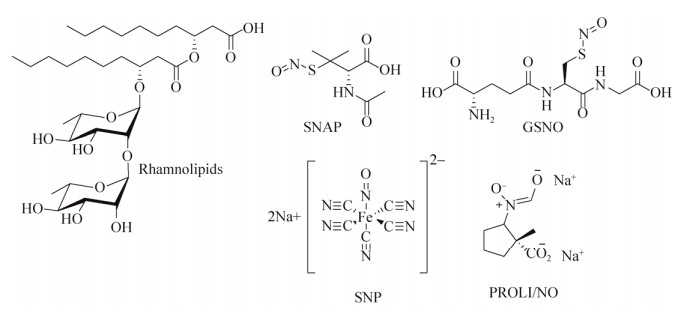 |
| 图 16 NO供体和鼠李糖脂 Figure 16 NO donors and rhamnolipids. |
| 图选项 |
血红素一氧化氮/氧合(Heme-nitric oxide/ oxygen binding,H-NOX)蛋白域能够帮助细菌(如伍迪希瓦氏菌Shewanella woodyi、奥奈达希瓦氏菌Shewanella oneidensis)识别NO和调节胞内c-di-GMP水平[157]。Plate等[158]发现H-NOX蛋白能与DGC/PDE (二鸟苷酸环化酶/磷酸二酯酶)蛋白一同构成1个调节复合体。NO与H-NOX结合后能够抑制c-di-GMP的产生,有时也能增强PDE的活性,这统统都将导致c-di-GMP浓度的降低,最后引发生物被膜的分散。还有报道[159]发现NO能够诱使P. aeruginosa中的PDE活性上升,导致其生物被膜分散,这个结果也是在细胞内c-di-GMP浓度降低后进行的[155-156]。
为了确定P. aeruginosa中响应NO信号、调控c-di-GMP水平的蛋白,Li等[159]在P. aeruginosa基因库中寻找能够调节c-di-GMP水平的蛋白编码基因,特别是一些推测有识别气体功效的MHYT结构域的编码基因。他们发现P. aeruginosa基因组中有基因能够编码2种含MHYT结构域的蛋白,分别是膜锚定蛋白MucR (PA1727) 和NbdA (PA3311)。其中NbdA负责响应分散生物被膜的NO信号,有趣的是他们发现MucR在细菌浮游态时充当PDE,但在生物被膜状态时充当DGC。
NO不仅充当一些革兰氏阴性菌中的信号分子,Gusarov等[160]发现NO还能够保护一些革兰氏阳性菌(如B. subtilis)不受H2O2的氧化,他们推测其中的机制可能是NO激活过氧化氢酶,降解了过氧化氢;NO也能够抑制Fe2+与H2O2形成的OH·自由基对DNA的损害。Schreiber等[161]发现NO也能够影响B. subtilis生物被膜的分散。
1.4.4 多糖与糖脂类化合物Bendaoud等[162]发现K. kingae能够产生1种胞外半乳聚糖,这种聚糖能够抑制其自身和其他一些细菌包括伴放线放线杆菌Aggregatibacter actinomycetemcomitans、K. pneumoniae、S. aureus、S. epidermidis和C. albicans生物被膜的形成。半乳聚糖由呋喃半乳糖线性聚合而成,作者推测这种聚糖可能负责调控生物被膜的结构,或者介导分散阶段中浮游态细菌的释放,具体机制尚不清楚。半乳糖在许多生物体内都扮演着不可或缺的角色,其代谢过程直接影响着B. subtilis生物被膜的形成[163]。UDP-半乳糖(尿苷二磷酸半乳糖)对浮游态的细菌细胞有毒,却是B. subtilis生物被膜形成时胞外多糖合成通路中不可缺少的底物。在半乳糖转化至UDP-半乳糖的Leloir途经中,由GalK (半乳糖激酶),GalT (半乳糖转移酶)和GalE (半乳糖异构酶)分别负责[164]。不过这些酶对浮游态细菌的生长十分不利[163]。在第三步时,半乳糖转化成UDP-葡萄糖,该反应是可逆的。
Chai等[163]研究B. subtilis galE的缺失去突变体时发现,外源添加半乳糖引起的浮游态细菌裂解是由于UDP-半乳糖积累过量所致。而galE突变菌株能通过产生胞外多糖(Exopolysaccharide,EPS)的方式,抵抗外源添加过量半乳糖带来的压力。之后的分析也发现EPS中含有大量半乳糖,证明UDP-半乳糖确实进入了EPS合成途径中。
鼠李糖脂(Rhamnolipid,图 16)在P. aeruginosa生物被膜的形成和维持上扮演重要角色[165-166]。Bole等[167]发现含有1种或2种鼠李糖组成的糖脂展现出一些表面活性剂的性质,通过改变细胞—细胞和细胞—表面的相互作用来调节生物被膜结构,并作为营养物、废物和浮游态细菌出入的通道。而不能合成鼠李糖酯的P. aeruginosa突变菌株的生物被膜上则缺少这种打开的空腔,导致其不能最终成熟并形成厚度均匀的细胞层。另一方面,过表达鼠李糖酯合成基因的菌株或在生长过程中加入了外源鼠李糖酯的菌株则表现为与平板表面超分离的状态。Irie等[168]发现鼠李糖脂能够打散预先已形成好的支气管炎博德特菌Bordetella bronchiseptica生物被膜,而且观察到了细菌细胞成功从生物被膜上分离,表明了其机制是非杀菌性的。
Dusane等[169]利用酶法合成了月桂酰葡萄糖,并对一些细菌和真菌进行了生物活性筛选,发现在加入月桂酰葡萄糖48 h后,P. aeruginosa和Pseudomonas aureofaciens已经形成的生物被膜分别被破坏了51%和57%;在抗真菌实验中,也分别对C. albicans和解脂假丝酵母菌Candida lipolytica已形成的生物被膜造成了45%和65%的破坏。Dusane等[170]发现1种热带海洋细菌粘质沙雷菌Serratia marcescens能够产生1种表面活性剂,由棕榈酸和葡萄糖构成的糖酯随后经S. marcescens纯化后得到,展现出了抗菌、抗黏附和抗生物被膜的活性。50 μg/mL这种纯化了的糖酯,能够清除70.6% P. aeruginosa PAO1已形成的生物被膜,在浓度为100 μg/mL时清除效果达到90.5%。
1.4.5 抗生物被膜涂层Chung等[171]发现工程微型结构能够影响S. aureus生物被膜的形成。他们在2 μm宽、3 μm高的弹性聚二甲基硅氧烷(Poly dimethyl siloxaneelastomer,PDMSe)表面上进行了1种Sharklet AFTM工程微型结构的修饰。发现与未经修饰的光滑表面相比,S. aureus生物被膜的形成受到了严重抑制,只记录到7%的生长,而光滑PDMSe上生物被膜的形成量为54% (持续培育了21 d、足以使S. aureus侵染植入体内式的装置,证明这种表面修饰确实阻止了S. aureus的侵染过程,这些修饰过的表面所造成的抑制效果也没有涉及到任何杀菌机制)。
Treter等[172]利用一些含有聚环氧乙烷的表面活性剂作为聚苯乙烯的表面涂层,研究了其对S. epidermidis生物被膜形成的影响。发现Pluronic?F127能够使S. epidermidis生物被膜的形成减少90%,不过所有用于研究的涂层对P. aureginosa生物被膜都没有效果。
1.4.6 离子液体离子液体是一类全部由阳离子和阴离子构成的离散型液体盐,其阴、阳离子可以被分别修饰,广泛应用于化学和生物领域中,也被视作潜在的抗菌和抗生物被膜药物[173-174]。Busetti等[173]发现溴化1-烷基喹啉离子液体(图 17)拥有广谱的抗菌和抗生物被膜活性,严重抑制了用于测试的革兰氏阴性菌和阳性菌浮游态的生长和生物被膜的形成。之前也有研究发现氯化1-烷基-3-甲基咪唑离子液体(图 17)对一系列致病菌的生物被膜都具有抑制活性[174]。两项研究都发现随烷基链的增长,抑制效果也变强,一般在烷基链长为14时达到顶峰。
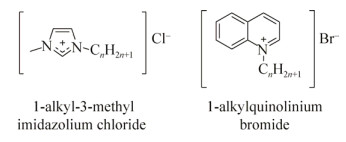 |
| 图 17 离子性液体 Figure 17 Ionic liquids. |
| 图选项 |
2 展望随着不断进行的研究和取得的突破,人们对化学分子与生物被膜之间的联系也愈发清楚,得到了一系列潜在的抗生物被膜形成或者分散生物被膜的药物。其中大部分都是一些信号分子类似物(如AHLs类似物),或来源于天然产物及其衍生物(如咪唑、吲哚类衍生物)。其活性也从数百微摩尔到数微摩尔,甚至纳摩尔级。不过目前尚未有注册使用的抗生物被膜或者分散生物被膜的临床药物,从实验室出发到真正上市应用间还有一些急需解决的问题,如药物毒性和稳定性等。值得一提的是,应该注意那些通过灭杀微生物来达到抑制/分散生物被膜的化合物。新型的抗生物被膜剂不仅应拥有高效低毒的特点,还应对微生物无灭杀活性,减少对微生物的选择压力,以此来减少微生物抗药性的产生,延长药剂的使用寿命。同时抑制/分散生物被膜的药剂与抗生素和杀菌剂联用,可以在减少抗生素和杀菌剂用量的同时增加其药效。因此该类药剂可以作为抗生素和杀菌剂的复配增效剂来使用。所以复配药剂、配方、剂型及联合用药的开发应用也是未来一个值得研究和发展的方向。对抗生物被膜的研究也不仅限于活性分子的设计开发,其他技术手段的开发应用也该同时进行,如对医用材料表面进行修饰,或添加抗生物被膜涂层等,均能有效防止生物被膜的形成。
参考文献
| [1] | Costerton JW, Lewandowski Z, Caldwell DE, et al. Microbial biofilms.Annu Rev Microbiol, 1995, 49(1): 711–745.DOI: 10.1146/annurev.mi.49.100195.003431 |
| [2] | Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections.Science, 1999, 284(5418): 1318–1322.DOI: 10.1126/science.284.5418.1318 |
| [3] | Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms.Clin Microbiol Rev, 2002, 15(2): 167–193.DOI: 10.1128/CMR.15.2.167-193.2002 |
| [4] | Musk DJ Jr, Hergenrother PJ. Chemical countermeasures for the control of bacterial biofilms: effective compounds and promising targets.Curr Med Chem, 2006, 13(18): 2163–2177.DOI: 10.2174/092986706777935212 |
| [5] | Davies D. Understanding biofilm resistance to antibacterial agents.Nat Rev Drug Discov, 2003, 2(2): 114–122.DOI: 10.1038/nrd1008 |
| [6] | Center for Disease Control and Prevention. Issues in healthcare settings: CDC's Seven healthcare safety challenges.Atlanta, GA: Center for Disease Control and Prevention, 2001. |
| [7] | Singh PK, Schaefer AL, Parsek MR, et al. Quorum-sensing signals indicate that cystic fibrosis lungs are infected with bacterial biofilms.Nature, 2000, 407(6805): 762–764.DOI: 10.1038/35037627 |
| [8] | Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms.Lancet, 2001, 358(9276): 135–138.DOI: 10.1016/S0140-6736(01)05321-1 |
| [9] | Weinstein RA, Darouiche RO. Device-associated infections: a macroproblem that starts with microadherence.Clin Infect Dis, 2001, 33(9): 1567–1572.DOI: 10.1086/cid.2001.33.issue-9 |
| [10] | Rasmussen TB, Givskov M. Quorum-sensing inhibitors as anti-pathogenic drugs.Int J Med Microbiol, 2006, 296(2/3): 149–161. |
| [11] | Neu HC. The crisis in antibiotic resistance.Science, 1992, 257(5073): 1064–1073.DOI: 10.1126/science.257.5073.1064 |
| [12] | Pinheiro LCS, Abreu PA, Afonso IF, et al. Identification of a potential lead structure for designing new antimicrobials to treat infections caused by Staphylococcus epidermidis-resistant strains.Curr Microbiol, 2008, 57(5): 463–468.DOI: 10.1007/s00284-008-9234-5 |
| [13] | Parsek MR, Singh PK. Bacterial biofilms: an emerging link to disease pathogenesis.Annu Rev Microbiol, 2003, 57(1): 677–701.DOI: 10.1146/annurev.micro.57.030502.090720 |
| [14] | Stoodley P, Sauer K, Davies DG, et al. Biofilms as complex differentiated communities.Annu Rev Microbiol, 2002, 56: 187–209.DOI: 10.1146/annurev.micro.56.012302.160705 |
| [15] | Sauer K, Camper AK, Ehrlich GD, et al. Pseudomonas aeruginosa displays multiple phenotypes during development as a biofilm.J Bacteriol, 2002, 184(4): 1140–1154.DOI: 10.1128/jb.184.4.1140-1154.2002 |
| [16] | Costerton JW, Cheng KJ, Geesey GG, et al. Bacterial biofilms in nature and disease.Annu Rev Microbiol, 1987, 41(1): 435–464.DOI: 10.1146/annurev.mi.41.100187.002251 |
| [17] | Purevdorj-Gage B, Costerton WJ, Stoodley P. Phenotypic differentiation and seeding dispersal in non-mucoid and mucoid Pseudomonas aeruginosa biofilms.Microbiology, 2005, 151(5): 1569–1576.DOI: 10.1099/mic.0.27536-0 |
| [18] | Camilli A, Bassler BL. Bacterial small-molecule signaling pathways.Science, 2006, 311(5764): 1113–1116.DOI: 10.1126/science.1121357 |
| [19] | Manefield M, Kjelleberg S, Givskov M. Controlling bacterial infection by inhibiting intercellular signalling.Curr Med Chem Anti Infect Agents, 2003, 2(3): 213–218.DOI: 10.2174/1568012033483033 |
| [20] | Davies DG, Parsek MR, Pearson JP, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm.Science, 1998, 280(5361): 295–298.DOI: 10.1126/science.280.5361.295 |
| [21] | Geske GD, Wezeman RJ, Siegel AP, et al. Small molecule inhibitors of bacterial quorum sensing and biofilm formation.J Am Chem Soc, 2005, 127(37): 12762–12763.DOI: 10.1021/ja0530321 |
| [22] | Geske GD, O'Neill JC, Miller DM, et al. Modulation of bacterial quorum sensing with synthetic ligands: systematic evaluation of N-acylated homoserine lactones in multiple species and new insights into their mechanisms of action.J Am Chem Soc, 2007, 129(44): 13613–13625.DOI: 10.1021/ja074135h |
| [23] | Smith KM, Bu YG, Suga H. Library screening for synthetic agonists and antagonists of a Pseudomonas aeruginosa autoinducer.Chem Biol, 2003, 10(6): 563–571.DOI: 10.1016/S1074-5521(03)00107-8 |
| [24] | Smith KM, Bu YG, Suga H. Induction and inhibition of Pseudomonas aeruginosa quorum sensing by synthetic autoinducer analogs.Chem Biol, 2003, 10(1): 81–89.DOI: 10.1016/S1074-5521(03)00002-4 |
| [25] | Glansdorp FG, Thomas GL, Lee JK, et al. Synthesis and stability of small molecule probes for Pseudomonas aeruginosa quorum sensing modulation.Org Biomol Chem, 2004, 2(22): 3329–3336.DOI: 10.1039/b412802h |
| [26] | O'Loughlin CT, Miller LC, Siryaporn A, et al. A quorum-sensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation.Proc Natl Acad Sci USA, 2013, 110(44): 17981–17986.DOI: 10.1073/pnas.1316981110 |
| [27] | Weng LX, Yang YX, Zhang YQ, et al. A new synthetic ligand that activates QscR and blocks antibiotic-tolerant biofilm formation in Pseudomonas aeruginosa.Appl Microbiol Biotechnol, 2014, 98(6): 2565–2572.DOI: 10.1007/s00253-013-5420-x |
| [28] | Yang YX, Xu ZH, Zhang YQ, et al. A new quorum-sensing inhibitor attenuates virulence and decreases antibiotic resistance in Pseudomonas aeruginosa.J Microbiol, 2012, 50(6): 987–993.DOI: 10.1007/s12275-012-2149-7 |
| [29] | Brackman G, Risseeuw M, Celen S, et al. Synthesis and evaluation of the quorum sensing inhibitory effect of substituted triazolyldihydrofuranones.Bioorg Med Chem, 2012, 20(15): 4737–4743.DOI: 10.1016/j.bmc.2012.06.009 |
| [30] | Asahi Y, Noiri Y, Igarashi J, et al. Effects of N-acyl homoserine lactone analogues on Porphyromonas gingivalis biofilm formation.J Periodontal Res, 2010, 45(2): 255–261.DOI: 10.1111/jre.2010.45.issue-2 |
| [31] | Asahi Y, Noiri Y, Igarashi J, et al. Synergistic effects of antibiotics and an N-acyl homoserine lactone analog on Porphyromonas gingivalis biofilms.J Appl Microbiol, 2012, 112(2): 404–411.DOI: 10.1111/j.1365-2672.2011.05194.x |
| [32] | Frezza M, Castang S, Estephane J, et al. Synthesis and biological evaluation of homoserine lactone derived ureas as antagonists of bacterial quorum sensing.Bioorg Med Chem, 2006, 14(14): 4781–4791.DOI: 10.1016/j.bmc.2006.03.017 |
| [33] | Castang S, Chantegrel B, Deshayes C, et al. N-sulfonyl homoserine lactones as antagonists of bacterial quorum sensing.Bioorg Med Chem Lett, 2004, 14(20): 5145–5149.DOI: 10.1016/j.bmcl.2004.07.088 |
| [34] | Yates EA, Philipp B, Buckley C, et al. N-acylhomoserine lactones undergo lactonolysis in a pH-, temperature-, and acyl chain length-dependent manner during growth of Yersinia pseudotuberculosis and Pseudomonas aeruginosa.Infect Immun, 2002, 70(10): 5635–5646.DOI: 10.1128/IAI.70.10.5635-5646.2002 |
| [35] | Abraham WR. Controlling biofilms of gram-positive pathogenic bacteria.Curr Med Chem, 2006, 13(13): 1509–1524.DOI: 10.2174/092986706777442039 |
| [36] | Cirioni O, Giacometti A, Ghiselli R, et al. RNAIII-inhibiting peptide significantly reduces bacterial load and enhances the effect of antibiotics in the treatment of central venous Catheter—associated Staphylococcus aureus infections.J Infect Dis, 2006, 193(2): 180–186.DOI: 10.1086/jid.2006.193.issue-2 |
| [37] | Balaban N, Cirioni O, Giacometti A, et al. Treatment of Staphylococcus aureus biofilm infection by the quorum-sensing inhibitor RIP.Antimicrob Agents Chemother, 2007, 51(6): 2226–2229.DOI: 10.1128/AAC.01097-06 |
| [38] | Chan WC, Coyle BJ, Williams P. Virulence regulation and quorum sensing in staphylococcal infections: competitive AgrC antagonists as quorum sensing inhibitors.J Med Chem, 2004, 47(19): 4633–4641.DOI: 10.1021/jm0400754 |
| [39] | Fowler SA, Stacy DM, Blackwell HE. Design and synthesis of macrocyclic peptomers as mimics of a quorum sensing signal from Staphylococcus aureus.Org Lett, 2008, 10(12): 2329–2332.DOI: 10.1021/ol800908h |
| [40] | de la Fuente-Nú?ez C, Reffuveille F, Haney EF, et al. Broad-spectrum anti-biofilm peptide that targets a cellular stress response.PLoS Pathogens, 2014, 10(5): e1004152.DOI: 10.1371/journal.ppat.1004152 |
| [41] | Ren DC, Zuo RJ, Barrios AFG, et al. Differential gene expression for investigation of Escherichia coli biofilm inhibition by plant extract ursolic acid.Appl Environ Microbiol, 2005, 71(7): 4022–4034.DOI: 10.1128/AEM.71.7.4022-4034.2005 |
| [42] | Musk DJ, Banko DA, Hergenrother PJ. Iron salts perturb biofilm formation and disrupt existing biofilms of Pseudomonas aeruginosa.Chem Biol, 2005, 12(7): 789–796.DOI: 10.1016/j.chembiol.2005.05.007 |
| [43] | Yang L, Barken KB, Skindersoe ME, et al. Effects of iron on DNA release and biofilm development by Pseudomonas aeruginosa.Microbiology, 2007, 153(5): 1318–1328.DOI: 10.1099/mic.0.2006/004911-0 |
| [44] | Musk DJ Jr, Hergenrother PJ. Chelated iron sources are inhibitors of Pseudomonas aeruginosa biofilms and distribute efficiently in an in vitro model of drug delivery to the human lung.J Appl Microbiol, 2008, 105(2): 380–388.DOI: 10.1111/jam.2008.105.issue-2 |
| [45] | Junker LM, Clardy J. High-throughput screens for small-molecule inhibitors of Pseudomonas aeruginosa biofilm development.Antimicrob Agents Chemother, 2007, 51(10): 3582–3590.DOI: 10.1128/AAC.00506-07 |
| [46] | Lai PK, Roy J. Antimicrobial and chemopreventive properties of herbs and spices.Curr Med Chem, 2004, 11(11): 1451–1460.DOI: 10.2174/0929867043365107 |
| [47] | Slusarenko AJ, Patel A, Portz D. Control of plant diseases by natural products: allicin from garlic as a case study.Eur J Plant Pathol, 2008, 121(3): 313–322.DOI: 10.1007/s10658-007-9232-7 |
| [48] | Bjarnsholt T, Jensen P?, Rasmussen TB, et al. Garlic blocks quorum sensing and promotes rapid clearing of pulmonary Pseudomonas aeruginosa infections.Microbiology, 2005, 151(12): 3873–3880.DOI: 10.1099/mic.0.27955-0 |
| [49] | Shuford JA, Steckelberg JM, Patel R. Effects of fresh garlic extract on Candida albicans biofilms.Antimicrob Agents Chemother, 2005, 49(1): 473.DOI: 10.1128/AAC.49.1.473.2005 |
| [50] | Persson T, Hansen TH, Rasmussen TB, et al. Rational design and synthesis of new quorum-sensing inhibitors derived from acylated homoserine lactones and natural products from garlic.Org Biomol Chem, 2005, 3(2): 253–262.DOI: 10.1039/B415761C |
| [51] | Muller E, Al-Attar J, Wolff AG, et al. Mechanism of salicylate-mediated inhibition of biofilm in Staphylococcus epidermidis.J Infect Dis, 1998, 177(2): 501–503.DOI: 10.1086/jid.1998.177.issue-2 |
| [52] | Rosenberg LE, Carbone AL, R?mling U, et al. Salicylic acid-based poly(anhydride esters) for control of biofilm formation in Salmonella enterica serovar Typhimurium.Lett Appl Microbiol, 2008, 46(5): 593–599.DOI: 10.1111/j.1472-765X.2008.02356.x |
| [53] | Niu C, Gilbert ES. Colorimetric method for identifying plant essential oil components that affect biofilm formation and structure.Appl Environ Microbiol, 2004, 70(12): 6951–6956.DOI: 10.1128/AEM.70.12.6951-6956.2004 |
| [54] | Brackman G, Defoirdt T, Miyamoto C, et al. Cinnamaldehyde and cinnamaldehyde derivatives reduce virulence in Vibrio spp. by decreasing the DNA-binding activity of the quorum sensing response regulator LuxR.BMC Microbiol, 2008, 8(1): 149.DOI: 10.1186/1471-2180-8-149 |
| [55] | Labrecque J, Bodet C, Chandad F, et al. Effects of a high-molecular-weight cranberry fraction on growth, biofilm formation and adherence of Porphyromonas gingivalis.J Antimicrob Chemother, 2006, 58(2): 439–443.DOI: 10.1093/jac/dkl220 |
| [56] | Yamanaka A, Kimizuka R, Kato T, et al. Inhibitory effects of cranberry juice on attachment of oral streptococci and biofilm formation.Oral Microbiol Immunol, 2004, 19(3): 150–154.DOI: 10.1111/omi.2004.19.issue-3 |
| [57] | Yamanaka A, Kouchi T, Kasai K, et al. Inhibitory effect of cranberry polyphenol on biofilm formation and cysteine proteases of Porphyromonas gingivalis.J Periodontal Res, 2007, 42(6): 589–592.DOI: 10.1111/jre.2007.42.issue-6 |
| [58] | Duarte S, Gregoire S, Singh AP, et al. Inhibitory effects of cranberry polyphenols on formation and acidogenicity of Streptococcus mutans biofilms.FEMS Microbiol Lett, 2006, 257(1): 50–56.DOI: 10.1111/fml.2006.257.issue-1 |
| [59] | Bodet C, Grenier D, Chandad F, et al. Potential oral health benefits of cranberry.Crit Rev Food Sci Nutr, 2008, 48(7): 672–680.DOI: 10.1080/10408390701636211 |
| [60] | Murata RM, Branco-de-Almeida LS, Franco EM, et al. Inhibition of Streptococcus mutans biofilm accumulation and development of dental caries in vivo by 7-epiclusianone and fluoride.Biofouling, 2010, 26(7): 865–872.DOI: 10.1080/08927014.2010.527435 |
| [61] | Ding X, Yin B, Qian L, et al. Screening for novel quorum-sensing inhibitors to interfere with the formation of Pseudomonas aeruginosa biofilm.J Med Microbiol, 2011, 60(12): 1827–1834.DOI: 10.1099/jmm.0.024166-0 |
| [62] | Lee JH, Regmi SC, Kim JA, et al. Apple flavonoid phloretin inhibits Escherichia coli O157:H7 biofilm formation and ameliorates colon inflammation in rats.Infect Immun, 2011, 79(12): 4819–4827.DOI: 10.1128/IAI.05580-11 |
| [63] | Kolter R, Greenberg EP. Microbial sciences: the superficial life of microbes.Nature, 2006, 441(7091): 300–302.DOI: 10.1038/441300a |
| [64] | Clatworthy AE, Pierson E, Hung DT. Targeting virulence: a new paradigm for antimicrobial therapy.Nat Chem Biol, 2007, 3(9): 541–548.DOI: 10.1038/nchembio.2007.24 |
| [65] | Vikram A, Jesudhasan PR, Jayaprakasha GK, et al. Citrus limonoids interfere with Vibrio harveyi cell-cell signalling and biofilm formation by modulating the response regulator LuxO.Microbiology, 2011, 157(1): 99–110.DOI: 10.1099/mic.0.041228-0 |
| [66] | Vikram A, Jesudhasan PR, Pillai SD, et al. Isolimonic acid interferes with Escherichia coli O157:H7 biofilm and TTSS in QseBC and QseA dependent fashion.BMC Microbiol, 2012, 12(1): 261.DOI: 10.1186/1471-2180-12-261 |
| [67] | Schiavone BIP, Rosato A, Marilena M, et al. Biological evaluation of hyperforin and its hydrogenated analogue on bacterial growth and biofilm production.J Nat Prod, 2013, 76(9): 1819–1823.DOI: 10.1021/np400394c |
| [68] | Sarkisian SA, Janssen MJ, Matta H, et al. Inhibition of bacterial growth and biofilm production by constituents from Hypericum spp.Phytother Res, 2012, 26(7): 1012–1016.DOI: 10.1002/ptr.v26.7 |
| [69] | Artini M, Papa R, Barbato G, et al. Bacterial biofilm formation inhibitory activity revealed for plant derived natural compounds.Bioorg Med Chem, 2012, 20(2): 920–926.DOI: 10.1016/j.bmc.2011.11.052 |
| [70] | Lee JH, Kim YG, Ryu SY, et al. Ginkgolic acids and Ginkgo biloba extract inhibit Escherichia coli O157:H7 and Staphylococcus aureus biofilm formation.Int J Food Microbiol, 2014, 174: 47–55.DOI: 10.1016/j.ijfoodmicro.2013.12.030 |
| [71] | Wu XY, Yang LQ, Chen J, et al. Preparation of ginkgolic acid monomers and their antifungal activity.Chem Ind For Prod, 2003, 23(4): 17–21. |
| [72] | He JZ, Wang SD, Wu TX, et al. Effects of ginkgoneolic acid on the growth, acidogenicity, adherence, and biofilm of Streptococcus mutans in vitro.Folia Microbiol, 2013, 58(2): 147–153.DOI: 10.1007/s12223-012-0191-9 |
| [73] | Nostro A, Roccaro AS, Bisignano G, et al. Effects of oregano, carvacrol and thymol on Staphylococcus aureus and Staphylococcus epidermidis biofilms.J Med Microbiol, 2007, 56(Pt 4): 519–523. |
| [74] | Soni KA, Oladunjoye A, Nannapaneni R, et al. Inhibition and inactivation of Salmonella typhimurium biofilms from polystyrene and stainless steel surfaces by essential oils and phenolic constituent carvacrol.J Food Prot, 2013, 76(2): 205–212.DOI: 10.4315/0362-028X.JFP-12-196 |
| [75] | Burt SA, Ojo-Fakunle VTA, Woertman J, et al. The natural antimicrobial carvacrol inhibits quorum sensing in Chromobacterium violaceum and reduces bacterial biofilm formation at sub-lethal concentrations.PLoS ONE, 2014, 9(4): e93414.DOI: 10.1371/journal.pone.0093414 |
| [76] | Majik MS, Naik D, Bhat C, et al. Synthesis of (R)-norbgugaine and its potential as quorum sensing inhibitor against Pseudomonas aeruginosa.Bioorg Med Chem Lett, 2013, 23(8): 2353–2356.DOI: 10.1016/j.bmcl.2013.02.051 |
| [77] | Carneiro VA, dos Santos HS, Arruda FVS, et al. Casbane diterpene as a promising natural antimicrobial agent against biofilm-associated infections.Molecules, 2011, 16(1): 190–201. |
| [78] | Flamini G, Catalano S, Caponi C, et al. Three anthrones from Rubus ulmifolius.Phytochemistry, 2002, 59(8): 873–876.DOI: 10.1016/S0031-9422(02)00012-2 |
| [79] | Panizzi L, Caponi C, Catalano S, et al. In vitro antimicrobial activity of extracts and isolated constituents of Rubus ulmifolius.J Ethnopharmacol, 2002, 79(2): 165–168.DOI: 10.1016/S0378-8741(01)00363-4 |
| [80] | Quave CL, Estévez-Carmona M, Compadre CM, et al. Ellagic acid derivatives from Rubus ulmifolius inhibit Staphylococcus aureus biofilm formation and improve response to antibiotics.PLoS ONE, 2012, 7(1): e28737.DOI: 10.1371/journal.pone.0028737 |
| [81] | Lee JH, Cho HS, Joo SW, et al. Diverse plant extracts and trans-resveratrol inhibit biofilm formation and swarming of Escherichia coli O157:H7.Biofouling, 2013, 29(10): 1189–1203.DOI: 10.1080/08927014.2013.832223 |
| [82] | Piver B, Berthou F, Dreano Y, et al. Differential inhibition of human cytochrome P450 enzymes by ε-viniferin, the dimer of resveratrol: comparison with resveratrol and polyphenols from alcoholized beverages.Life Sci, 2003, 73(9): 1199–1213.DOI: 10.1016/S0024-3205(03)00420-X |
| [83] | Cho HS, Lee JH, Ryu SY, et al. Inhibition of Pseudomonas aeruginosa and Escherichia coli O157:H7 biofilm formation by plant metabolite ε-viniferin.J Agric Food Chem, 2013, 61(29): 7120–7126.DOI: 10.1021/jf4009313 |
| [84] | Lee JH, Kim YG, Ryu SY, et al. Resveratrol oligomers inhibit biofilm formation of Escherichia coli O157:H7 and Pseudomonas aeruginosa.J Nat Prod, 2014, 77(1): 168–172.DOI: 10.1021/np400756g |
| [85] | Cady NC, McKean KA, Behnke J, et al. Inhibition of biofilm formation, quorum sensing and infection in Pseudomonas aeruginosa by natural products-inspired organosulfur compounds.PLoS ONE, 2012, 7(6): e38492.DOI: 10.1371/journal.pone.0038492 |
| [86] | Navarro G, Cheng AT, Peach KC, et al. Image-based 384-well high-throughput screening method for the discovery of skyllamycins a to c as biofilm inhibitors and inducers of biofilm detachment in Pseudomonas aeruginosa.Antimicrob Agents Chemother, 2014, 58(2): 1092–1099.DOI: 10.1128/AAC.01781-13 |
| [87] | Hertiani T, Edrada-Ebel R, Ortlepp S, et al. From anti-fouling to biofilm inhibition: new cytotoxic secondary metabolites from two Indonesian Agelas sponges.Bioorg Med Chem, 2010, 18(3): 1297–1311.DOI: 10.1016/j.bmc.2009.12.028 |
| [88] | Tello E, Castellanos L, Arevalo-Ferro C, et al. Absolute stereochemistry of antifouling cembranoid epimers at C-8 from the Caribbean octocoral Pseudoplexaura flagellosa. Revised structures of plexaurolones.Tetrahedron, 2011, 67(47): 9112–9121.DOI: 10.1016/j.tet.2011.09.094 |
| [89] | Tello E, Castellanos L, Arévalo-Ferro C, et al. Disruption in quorum-sensing systems and bacterial biofilm inhibition by cembranoid diterpenes isolated from the octocoral Eunicea knighti.J Nat Prod, 2012, 75(9): 1637–1642.DOI: 10.1021/np300313k |
| [90] | Hentzer M, Riedel K, Rasmussen TB, et al. Inhibition of quorum sensing in Pseudomonas aeruginosa biofilm bacteria by a halogenated furanone compound.Microbiology, 2002, 148(Pt 1): 87–102. |
| [91] | Manefield M, Welch M, Givskov M, et al. Halogenated furanones from the red alga, Delisea pulchra, inhibit carbapenem antibiotic synthesis and exoenzyme virulence factor production in the phytopathogen Erwinia carotovora.FEMS Microbiol Lett, 2001, 205(1): 131–138.DOI: 10.1111/fml.2001.205.issue-1 |
| [92] | Ren DC, Sims JJ, Wood TK. Inhibition of biofilm formation and swarming of Escherichia coli by (5Z)-4-bromo-5-(bromomethylene)-3-butyl-2(5H)-furanone.Environ Microbiol, 2001, 3(11): 731–736.DOI: 10.1046/j.1462-2920.2001.00249.x |
| [93] | Ren D, Sims JJ, Wood TK. Inhibition of biofilm formation and swarming of Bacillus subtilis by (5Z)-4-bromo-5-(bromomethylene)-3-butyl-2(5H)-furanone.Lett Appl Microbiol, 2002, 34(4): 293–299.DOI: 10.1046/j.1472-765x.2002.01087.x |
| [94] | De Nys R, Wright AD, K?nig GM, et al. New halogenated furanones from the marine alga Delisea pulchra (cf. fimbriata).Tetrahedron, 1993, 49(48): 11213–11220.DOI: 10.1016/S0040-4020(01)81808-1 |
| [95] | Kjelleberg S, Steinberg P, Givskov M, et al. Do marine natural products interfere with prokaryotic AHL regulatory systems?.Aquat Microb Ecol, 1997, 13(1): 85–93. |
| [96] | Hentzer M, Wu H, Andersen JB, et al. Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors.EMBO J, 2003, 22(15): 3803–3815.DOI: 10.1093/emboj/cdg366 |
| [97] | Rasmussen TB, Manefield M, Andersen JB, et al. How Delisea pulchra furanones affect quorum sensing and swarming motility in Serratia liquefaciens MG1.Microbiology, 2000, 146(12): 3237–3244.DOI: 10.1099/00221287-146-12-3237 |
| [98] | Manefield M, De Nys R, Naresh K, et al. Evidence that halogenated furanones from Delisea pulchra inhibit acylated homoserine lactone (AHL)-mediated gene expression by displacing the AHL signal from its receptor protein.Microbiology, 1999, 145(2): 283–291.DOI: 10.1099/13500872-145-2-283 |
| [99] | Manefield M, Rasmussen TB, Henzter M, et al. Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover.Microbiology, 2002, 148(4): 1119–1127.DOI: 10.1099/00221287-148-4-1119 |
| [100] | Konaklieva MI, Plotkin BJ. Chemical communication-do we have a quorum?.Mini Rev Med Chem, 2006, 6(7): 817–825.DOI: 10.2174/138955706777698589 |
| [101] | Wu H, Song Z, Hentzer M, et al. Synthetic furanones inhibit quorum-sensing and enhance bacterial clearance in Pseudomonas aeruginosa lung infection in mice.J Antimicrob Chemother, 2004, 53(6): 1054–1061.DOI: 10.1093/jac/dkh223 |
| [102] | L?nn-Stensrud J, Petersen FC, Benneche T, et al. Synthetic bromated furanone inhibits autoinducer-2-mediated communication and biofilm formation in oral streptococci.Oral Microbiol Immunol, 2007, 22(5): 340–346.DOI: 10.1111/omi.2007.22.issue-5 |
| [103] | Han YB, Hou SY, Simon KA, et al. Identifying the important structural elements of brominated furanones for inhibiting biofilm formation by Escherichia coli.Bioorg Med Chem Lett, 2008, 18(3): 1006–1010.DOI: 10.1016/j.bmcl.2007.12.032 |
| [104] | Kim C, Kim J, Park HY, et al. Furanone derivatives as quorum-sensing antagonists of Pseudomonas aeruginosa.Appl Microbiol Biotechnol, 2008, 80(1): 37–47.DOI: 10.1007/s00253-008-1474-6 |
| [105] | Baveja JK, Willcox MDP, Hume EBH, et al. Furanones as potential anti-bacterial coatings on biomaterials.Biomaterials, 2004, 25(20): 5003–5012.DOI: 10.1016/j.biomaterials.2004.02.051 |
| [106] | Hume EBH, Baveja J, Muir B, et al. The control of Staphylococcus epidermidis biofilm formation and in vivo infection rates by covalently bound furanones.Biomaterials, 2004, 25(20): 5023–5230.DOI: 10.1016/j.biomaterials.2004.01.048 |
| [107] | Hentzer M, Givskov M. Pharmacological inhibition of quorum sensing for the treatment of chronic bacterial infections.J Clin Investig, 2003, 112(9): 1300–1307.DOI: 10.1172/JCI20074 |
| [108] | Hoffmann H, Lindel T. Synthesis of the pyrrole-imidazole alkaloids.Synthesis, 2003, 2003(12): 1753–1783. |
| [109] | Braekman JC, Daloze D, Stoller C, et al. Chemotaxonomy of Agelas (Porifera, Demospongiae).Biochem Syst Ecol, 1992, 20(5): 417–431.DOI: 10.1016/0305-1978(92)90082-O |
| [110] | Chanas B, Pawlik JR, Lindel T, et al. Chemical defense of the Caribbean sponge Agelas clathrodes (Schmidt).J Exp Mar Biol Ecol, 1997, 208(1/2): 185–196. |
| [111] | Lindel T, Hoffmann H, Hochgürtel M, et al. Structure-activity relationship of inhibition of fish feeding by sponge-derived and synthetic pyrrole-imidazole alkaloids.J Chem Ecol, 2000, 26(6): 1477–1496.DOI: 10.1023/A:1005591826613 |
| [112] | Birman VB, Jiang XT. Synthesis of sceptrin alkaloids.Org Lett, 2004, 6(14): 2369–2371.DOI: 10.1021/ol049283g |
| [113] | O'Malley DP, Li K, Maue M, et al. Total synthesis of dimeric pyrrole-imidazole alkaloids: sceptrin, ageliferin, nagelamide E, oxysceptrin, nakamuric acid, and the axinellamine carbon skeleton.J Am Chem Soc, 2007, 129(15): 4762–4775.DOI: 10.1021/ja069035a |
| [114] | Wang SH, Romo D. Enantioselective synthesis of (+)-monobromophakellin and (+)-phakellin: a concise phakellin annulation strategy applicable to palau'amine.Angew Chem Int Ed, 2008, 47(7): 1284–1286.DOI: 10.1002/(ISSN)1521-3773 |
| [115] | Yamada A, Kitamura H, Yamaguchi K, et al. Development of chemical substances regulating biofilm formation.Bull Chem Soc Jpn, 1997, 70(12): 3061–3069.DOI: 10.1246/bcsj.70.3061 |
| [116] | Kelly SR, Jensen PR, Henkel TP, et al. Effects of Caribbean sponge extracts on bacterial attachment.Aquat Microb Ecol, 2003, 31(2): 175–182. |
| [117] | Huigens RW Ⅲ, Richards JJ, Parise G, et al. Inhibition of Pseudomonas aeruginosa biofilm formation with bromoageliferin analogues.J Am Chem Soc, 2007, 129(22): 6966–6967.DOI: 10.1021/ja069017t |
| [118] | Huigens RW Ⅲ, Ma LY, Gambino C, et al. Control of bacterial biofilms with marine alkaloid derivatives.Mol Biosyst, 2008, 4(6): 614–621.DOI: 10.1039/b719989a |
| [119] | Richards JJ, Ballard TE, Melander C. Inhibition and dispersion of Pseudomonas aeruginosa biofilms with reverse amide 2-aminoimidazole oroidin analogues.Org Biomol Chem, 2008, 6(8): 1356–1363.DOI: 10.1039/b719082d |
| [120] | Richards JJ, Ballard TE, Huigens RW Ⅲ, et al. Synthesis and screening of an oroidin library against Pseudomonas aeruginosa biofilms.ChemBioChem, 2008, 9(8): 1267–1279.DOI: 10.1002/cbic.v9:8 |
| [121] | Rogers SA, Melander C. Construction and screening of a 2-aminoimidazole library identifies a small molecule capable of inhibiting and dispersing bacterial biofilms across order, class, and phylum.Angew Chem Int Ed, 2008, 47(28): 5229–5231.DOI: 10.1002/anie.v47:28 |
| [122] | Ballard TE, Richards JJ, Aquino A, et al. Antibiofilm activity of a diverse oroidin library generated through reductive acylation.J Org Chem, 2009, 74(4): 1755–1758.DOI: 10.1021/jo802260t |
| [123] | Reyes S, Huigens RW Ⅲ, Su ZM, et al. Synthesis and biological activity of 2-aminoimidazole triazoles accessed by Suzuki-Miyaura cross-coupling.Org Biomol Chem, 2011, 9(8): 3041–3049.DOI: 10.1039/c0ob00925c |
| [124] | Su ZM, Peng LL, Worthington RJ, et al. Evaluation of 4, 5-disubstituted-2-aminoimidazole-triazole conjugates for antibiofilm/antibiotic resensitization activity against MRSA and Acinetobacter baumannii.ChemMedChem, 2011, 6(12): 2243–2251.DOI: 10.1002/cmdc.v6.12 |
| [125] | Yeagley AA, Su ZM, McCullough KD, et al. N-substituted 2-aminoimidazole inhibitors of MRSA biofilm formation accessed through direct 1, 3-bis(tert-butoxycarbonyl)guanidine cyclization.Org Biomol Chem, 2013, 11(1): 130–137.DOI: 10.1039/C2OB26469B |
| [126] | Furlani RE, Yeagley AA, Melander C. A flexible approach to 1, 4-di-substituted 2-aminoimidazoles that inhibit and disperse biofilms and potentiate the effects of β-lactams against multi-drug resistant bacteria.Eur J Med Chem, 2013, 62: 59–70.DOI: 10.1016/j.ejmech.2012.12.005 |
| [127] | Rogers SA, Whitehead DC, Mullikin T, et al. Synthesis and bacterial biofilm inhibition studies of ethyl N-(2-phenethyl) carbamate derivatives.Org Biomol Chem, 2010, 8(17): 3857–3859.DOI: 10.1039/c0ob00063a |
| [128] | Rogers SA, Lindsey EA, Whitehead DC, et al. Synthesis and biological evaluation of 2-aminoimidazole/carbamate hybrid anti-biofilm and anti-microbial agents.Bioorg Med Chem Lett, 2011, 21(4): 1257–1260.DOI: 10.1016/j.bmcl.2010.12.057 |
| [129] | Frei R, Breitbach AS, Blackwell HE. 2-aminobenzimidazole derivatives strongly inhibit and disperse Pseudomonas aeruginosa biofilms.Angew Chem Int Ed, 2012, 51(21): 5226–5229.DOI: 10.1002/anie.201109258 |
| [130] | Lindsey EA, Brackett CM, Mullikin T, et al. The discovery of N-1 substituted 2-aminobenzimidazoles as zinc-dependent S. aureus biofilm inhibitors.MedChemComm, 2012, 3(11): 1462–1465.DOI: 10.1039/c2md20244a |
| [131] | Sambanthamoorthy K, Gokhale AA, Lao WW, et al. Identification of a novel benzimidazole that inhibits bacterial biofilm formation in a broad-spectrum manner.Antimicrob Agents Chemother, 2011, 55(9): 4369–4378.DOI: 10.1128/AAC.00583-11 |
| [132] | Martino PD, Fursy R, Bret L, et al. Indole can act as an extracellular signal to regulate biofilm formation of Escherichia coli and other indole-producing bacteria.Can J Microbiol, 2003, 49(7): 443–449.DOI: 10.1139/w03-056 |
| [133] | Lee JH, Lee J. Indole as an intercellular signal in microbial communities.FEMS Microbiol Rev, 2010, 34(4): 426–444.DOI: 10.1111/j.1574-6976.2009.00204.x |
| [134] | Bansal T, Englert D, Lee J, et al. Differential effects of epinephrine, norepinephrine, and indole on Escherichia coli O157:H7 chemotaxis, colonization, and gene expression.Infect Immun, 2007, 75(9): 4597–4607.DOI: 10.1128/IAI.00630-07 |
| [135] | Domka J, Lee J, Wood TK. YliH (BssR) and YceP (BssS) regulate Escherichia coli K-12 biofilm formation by influencing cell signaling.Appl Environ Microbiol, 2006, 72(4): 2449–2459.DOI: 10.1128/AEM.72.4.2449-2459.2006 |
| [136] | Rui LY, Reardon KF, Wood TK. Protein engineering of toluene ortho-monooxygenase of Burkholderia cepacia G4 for regiospecific hydroxylation of indole to form various indigoid compounds.Appl Microbiol Biotechnol, 2005, 66(4): 422–429.DOI: 10.1007/s00253-004-1698-z |
| [137] | Lee J, Bansal T, Jayaraman A, et al. Enterohemorrhagic Escherichia coli biofilms are inhibited by 7-hydroxyindole and stimulated by isatin.Appl Environ Microbiol, 2007, 73(13): 4100–4109.DOI: 10.1128/AEM.00360-07 |
| [138] | Lee JH, Kim YG, Kim CJ, et al. Indole-3-acetaldehyde from Rhodococcussp. BFI 332 inhibits Escherichia coli O157:H7 biofilm formation.Appl Microbiol Biotechnol, 2012, 96(4): 1071–1078.DOI: 10.1007/s00253-012-3881-y |
| [139] | Lee JH, Cho MH, Lee J. 3-indolylacetonitrile decreases Escherichia coli O157:H7 biofilm formation and Pseudomonas aeruginosa virulence.Environ Microbiol, 2011, 13(1): 62–73.DOI: 10.1111/emi.2011.13.issue-1 |
| [140] | Minvielle MJ, Bunders CA, Melander C. Indole—triazole conjugates are selective inhibitors and inducers of bacterial biofilms.MedChemComm, 2013, 4(6): 916–919.DOI: 10.1039/c3md00064h |
| [141] | Kolodkin-Gal I, Romero D, Cao SG, et al. D-amino acids trigger biofilm disassembly.Science, 2010, 328(5978): 627–629.DOI: 10.1126/science.1188628 |
| [142] | Leiman SA, May JM, Lebar MD, et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis.J Bacteriol, 2013, 195(23): 5391–5395.DOI: 10.1128/JB.00975-13 |
| [143] | Kolodkin-Gal I, Cao SG, Chai L, et al. A self-produced trigger for biofilm disassembly that targets exopolysaccharide.Cell, 2012, 149(3): 684–692.DOI: 10.1016/j.cell.2012.02.055 |
| [144] | Hobley L, Kim SH, Maezato Y, et al. Norspermidine is not a self-produced trigger for biofilm disassembly.Cell, 2014, 156(4): 844–854.DOI: 10.1016/j.cell.2014.01.012 |
| [145] | Desbois AP, Smith VJ. Antibacterial free fatty acids: activities, mechanisms of action and biotechnological potential.Appl Microbiol Biotechnol, 2010, 85(6): 1629–1642.DOI: 10.1007/s00253-009-2355-3 |
| [146] | Bergsson G, Arnfinnsson J, Karlsson SM, et al. In vitro inactivation of Chlamydia trachomatis by fatty acids and monoglycerides.Antimicrob Agents Chemother, 1998, 42(9): 2290–2294. |
| [147] | Bergsson G, Steingrímsson ó, Thormar H. In vitro susceptibilities of Neisseria gonorrhoeae to fatty acids and monoglycerides.Antimicrob Agents Chemother, 1999, 43(11): 2790–2792. |
| [148] | Kabara JJ, Swieczkowski DM, Conley AJ, et al. Fatty acids and derivatives as antimicrobial agents.Antimicrob Agents Chemother, 1972, 2(1): 23–28.DOI: 10.1128/AAC.2.1.23 |
| [149] | Feldlaufer MF, Knox DA, Lusby WR, et al. Antimicrobial activity of fatty acids against Bacillus larvae, the causative agent of American foulbrood disease.Apidologie, 1993, 24(2): 95–99.DOI: 10.1051/apido:19930202 |
| [150] | Wille JJ, Kydonieus A. Palmitoleic acid isomer (C16:1Δ6) in human skin sebum is effective against Gram-positive bacteria.Skin Pharmacol Appl Skin Physiol, 2003, 16(3): 176–187.DOI: 10.1159/000069757 |
| [151] | Georgel P, Crozat K, Lauth X, et al. A toll-like receptor 2-responsive lipid effector pathway protects mammals against skin infections with Gram-positive bacteria.Infect Immun, 2005, 73(8): 4512–4521.DOI: 10.1128/IAI.73.8.4512-4521.2005 |
| [152] | Stenz L, Fran?ois P, Fischer A, et al. Impact of oleic acid (cis-9-octadecenoic acid) on bacterial viability and biofilm production in Staphylococcus aureus.FEMS Microbiol Lett, 2008, 287(2): 149–155.DOI: 10.1111/fml.2008.287.issue-2 |
| [153] | Davies DG, Marques CNH. A fatty acid messenger is responsible for inducing dispersion in microbial biofilms.J Bacteriol, 2009, 191(5): 1393–1403.DOI: 10.1128/JB.01214-08 |
| [154] | Jennings JA, Courtney HS, Haggard WO. Cis-2-decenoic acid inhibits S. aureus growth and biofilm in vitro: a pilot study.Clin Orthop Relat Res, 2012, 470(10): 2663–2670.DOI: 10.1007/s11999-012-2388-2 |
| [155] | Barraud N, Hassett DJ, Hwang SH, et al. Involvement of nitric oxide in biofilm dispersal of Pseudomonas aeruginosa.J Bacteriol, 2006, 188(21): 7344–7353.DOI: 10.1128/JB.00779-06 |
| [156] | Barraud N, Schleheck D, Klebensberger J, et al. Nitric oxide signaling in Pseudomonas aeruginosa biofilms mediates phosphodiesterase activity, decreased cyclic di-gmp levels, and enhanced dispersal.J Bacteriol, 2009, 191(23): 7333–7342.DOI: 10.1128/JB.00975-09 |
| [157] | Liu N, Xu YM, Hossain S, et al. Nitric oxide regulation of cyclic di-GMP synthesis and hydrolysis in Shewanella woodyi.Biochemistry, 2012, 51(10): 2087–2099.DOI: 10.1021/bi201753f |
| [158] | Plate L, Marletta MA. Nitric oxide-sensing H-NOX proteins govern bacterial communal behavior.TrendsBiochem Sci, 2013, 38(11): 566–575. |
| [159] | Li Y, Heine S, Entian M, et al. NO-induced biofilm dispersion in Pseudomonas aeruginosa is mediated by an MHYT domain-coupled phosphodiesterase.J Bacteriol, 2013, 195(16): 3531–3542.DOI: 10.1128/JB.01156-12 |
| [160] | Gusarov I, Nudler E. NO-mediated cytoprotection: instant adaptation to oxidative stress in bacteria.Proc Natl Acad Sci USA, 2005, 102(39): 13855–13860.DOI: 10.1073/pnas.0504307102 |
| [161] | Schreiber F, Beutler M, Enning D, et al. The role of nitric-oxide-synthase-derived nitric oxide in multicellular traits of Bacillus subtilis 3610: biofilm formation, swarming, and dispersal.BMC Microbiol, 2011, 11(1): 111.DOI: 10.1186/1471-2180-11-111 |
| [162] | Bendaoud M, Vinogradov E, Balashova NV, et al. Broad-spectrum biofilm inhibition by Kingella kingae exopolysaccharide.J Bacteriol, 2011, 193(15): 3879–3886.DOI: 10.1128/JB.00311-11 |
| [163] | Chai Y, Beauregard PB, Vlamakis H, et al. Galactose metabolism plays a crucial role in biofilm formation by Bacillus subtilis.MBio, 2012, 3(4): e00184–e00112. |
| [164] | Holden HM, Rayment I, Thoden JB. Structure and function of enzymes of the Leloir pathway for galactose metabolism.J Biol Chem, 2003, 278(45): 43885–43888.DOI: 10.1074/jbc.R300025200 |
| [165] | Davey ME, Caiazza NC, O'Toole GA. Rhamnolipid surfactant production affects biofilm architecture in Pseudomonas aeruginosa PAO1.J Bacteriol, 2003, 185(3): 1027–1036.DOI: 10.1128/JB.185.3.1027-1036.2003 |
| [166] | Espinosa-Urgel M. Resident parking only: rhamnolipids maintain fluid channels in biofilms.J Bacteriol, 2003, 185(3): 699–700.DOI: 10.1128/JB.185.3.699-700.2003 |
| [167] | Boles BR, Thoendel M, Singh PK. Rhamnolipids mediate detachment of Pseudomonas aeruginosa from biofilms.Mol Microbiol, 2005, 57(5): 1210–1223.DOI: 10.1111/j.1365-2958.2005.04743.x |
| [168] | Irie Y, O'Toole GA, Yuk MH. Pseudomonas aeruginosa rhamnolipids disperse Bordetella bronchiseptica biofilms.FEMS Microbiol Lett, 2005, 250(2): 237–243.DOI: 10.1016/j.femsle.2005.07.012 |
| [169] | Dusane DH, Rajput JK, Kumar AR, et al. Disruption of fungal and bacterial biofilms by lauroyl glucose.Lett Appl Microbiol, 2008, 47(5): 374–379.DOI: 10.1111/lam.2008.47.issue-5 |
| [170] | Dusane DH, Pawar VS, Nancharaiah YV, et al. Anti-biofilm potential of a glycolipid surfactant produced by a tropical marine strain of Serratia marcescens.Biofouling, 2011, 27(6): 645–654.DOI: 10.1080/08927014.2011.594883 |
| [171] | Chung KK, Schumacher JF, Sampson EM, et al. Impact of engineered surface microtopography on biofilm formation of Staphylococcus aureus.Biointerphases, 2007, 2(2): 89–94.DOI: 10.1116/1.2751405 |
| [172] | Treter J, Bonatto F, Krug C, et al. Washing-resistant surfactant coated surface is able to inhibit pathogenic bacteria adhesion.Appl Surf Sci, 2014, 303: 147–154.DOI: 10.1016/j.apsusc.2014.02.123 |
| [173] | Busetti A, Crawford DE, Earle MJ, et al. Antimicrobial and antibiofilm activities of 1-alkylquinolinium bromide ionic liquids.Green Chem, 2010, 12(3): 420–425.DOI: 10.1039/b919872e |
| [174] | Carson L, Chau PKW, Earle MJ, et al. Antibiofilm activities of 1-alkyl-3-methylimidazolium chloride ionic liquids.Green Chem, 2009, 11(4): 492–497.DOI: 10.1039/b821842k |
