
 , 张巍2
, 张巍2

1 中国科学院青岛生物能源与过程研究所 中国科学院生物基材料重点实验室,山东 青岛 266101
2 新加坡科技研究局生物处理科技研究院,新加坡 138668
网络出版时间:2016-05-06
基金项目:中科院青能所所长创新基金 (No. Y571061905),新加坡生物医药研究计划 (No. ETPL/12-R15GAP-0009) 资助。
摘要: 治疗性单克隆抗体药物已成为生物医药领域市场最主要的产品类别。蛋白A亲和层析作为第一步捕获抗体蛋白最为有效的手段仍然在现有单克隆抗体纯化平台中占据主导地位。在本研究中,首先开发了一种基于低pH处理抗体细胞回收液的新型细胞液回收技术,该技术能有效去除宿主相关污染物 (非组蛋白宿主杂质蛋白、组蛋白、DNA、蛋白聚合物等),同时保证较高的抗体回收率。通过该技术有效预处理后,蛋白A纯化效率可提高10倍左右,并且有效避免了抗体洗脱液中和后浊度的上升,大大减轻了后续蛋白纯化的压力。同时我们也对酸性处理中各种宿主杂质去除机制进行了研究。然后,预处理的洗脱液再经一步Capto adhere色谱纯化,非组蛋白宿主杂质蛋白降低至5 ppm、DNA小于1 ppb、组蛋白降低至检测限以下、蛋白聚合物小于0.01%。总过程抗体蛋白收率87%。该两步法抗体纯化技术可有效集成至当前主流抗体纯化平台,具有良好的大规模应用价值。
关键词: 蛋白A 单克隆抗体 纯化 细胞回收液 酸性沉淀 宿主杂质蛋白 组蛋白 DNA
Improved protein-A chromatography for monoclonal antibody purification
Chen Quan1, Toh Phyllicia2, Hoi Aina2, Xian Mo1, Peng Xinying1, Yang Yuansheng2, Zhang Haibo1, Nian Rui1

 , Zhang Wei2
, Zhang Wei2

1 Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, CAS Key Laboratory of Biobased Materials, Qingdao 266101, Shandong, China;
2 Bioprocessing Technology Institute, Agency for Science, Technology and Research (A*STAR), Singapore 138668, Singapore
Received: April 5, 2016; Accepted: April 25, 2016
Supported by:Qingdao Institute of Bioenergy and Bioprocess Technology, Start-up Fund (No. Y571061905), Singapore Biomedical Research Council (No. ETPL/12-R15GAP-0009).
Corresponding authors:Rui Nian. Tel: +86-532-80662681; Fax: +86-532-80662765; E-mail: nianrui@qibebt.ac.cn
Wei Zhang. Tel: +65-64070933; Fax: +65-64789561; E-mail: zhang_wei@bti.a-star.edu.sg
Abstract: Therapeutic monoclonal antibodies become the major product class within the biopharmaceutical market. Protein A as the first capture step is still dominant in current platforms for purification of monoclonal antibodies. In this study, we developed a new antibody harvest process that incorporates acidic treatment of cell harvest, demonstrating high process yield, improved clearance of host cell associated contaminants, like non-histone host cell protein, histone, DNA and heteroaggregates. Host protein contamination was reduced about 10-fold compared to protein A loaded with harvest clarified by centrifugation and microfiltration. Turbidity increase of eluted IgG upon pH neutralization was nearly eliminated. Residual levels of impurities in the protein A eluate were achieved that potentially meet requirements of drug substance and thus alleviate the burden for further impurities removal in subsequent chromatography steps. The mechanism of host cell associated contaminants removal during acidic treatment was also explored. After a polishing step by Capto adhere, host cell protein was reduced to less than 5 ppm, DNA less than 1 ppb, histone to undetectable level, heteroaggregates less than 0.01% with total IgG recovery around 87%. This efficient process can be easily integrated into current IgG purification platforms, and may overcome downstream processing challenges.
Key words: protein A monoclonal antibody purification cell culture supernatant acidic precipitation host cell protein histone DNA
1986年,世界首个单克隆抗体 (Monoclonal antibody,简称单抗) 获得美国食品与药品监督管理局的上市批准,拉开了单抗药物发展的序幕,成为生物医药领域中最耀眼的明珠。该类药物具有靶向性强、特异性高和毒副作用低等特点,代表了药品治疗领域最新发展方向[1-4]。目前全球医药产业正快速走向精准医疗时代,靶向药物单抗正是其中最为成熟的领域,仍将是继续引领生物制药发展最为重要的驱动力。
单抗药物通常是由中国仓鼠卵巢细胞 (Chinese hamster ovary cell,简称CHO细胞) 表达产生。由CHO细胞分泌的这些高价值蛋白分子,通过一系列纯化过程实现由细胞培养液中回收[5]。随着单抗生产上游基因改造、发酵条件的不断优化,其产量已达5?10 g/L;但这同时也大大增加了下游蛋白回收中去除各种宿主杂质的负担。此外,宿主杂质的组成随着培养条件的改变呈现出显著的变化。单抗药物杂质主要包括与产品相关的污染物和工艺相关的污染物。与产品相关污染物包括目标分子变异体、聚集体、以及由于不同翻译后修饰产生的产品变异体或降解产物。与工艺过程相关的污染物包括宿主细胞蛋白 (host cell protein,简称HCP)、宿主DNA、化学添加剂和残留培养基成分。在所有影响产品质量的污染物中,HCP和DNA占绝大多数。由于在理化性质上的差异 (分子量、等电点、疏水性以及表面电荷分布等) 使得HCP尤其难以有效完全去除,通常需要多个不同分离机制的单元处理进行分离去除,进而消除由任何微量存在的HCP所引起的严重的免疫反应[6-8]。
由于对于最终产品纯度、杂质量的严格要求 (HCP<100 ppm、DNA<10 ppb等),单抗目前广泛采用三步纯化策略:粗纯 (样品捕获)、中度纯化和精细纯化,该策略工艺复杂、对操作要求严格,导致纯化成本一般占总生产成本的50%?80%[5]。用蛋白A亲和层析凝胶捕获抗体是大规模单抗纯化的首先步骤,一步纯化可使蛋白纯度达95%以上。但蛋白A树脂价格昂贵 (超过2.2万美元/升,GE报价),在大规模生产中,蛋白A纯化步骤的成本占整个抗体纯化成本的35%以上[9-10]。因此,蛋白A纯化效率的提高是进一步提高产品质量、降低生产成本的关键[11-12]。
本研究通过分析pH、盐浓度对细胞回收液中各种宿主杂质的影响机制,确立低pH处理抗体细胞回收液的新型细胞液回收技术,提高了后续蛋白A纯化效率,减轻了纯化压力,与Capto adhere色谱纯化联用,真正实现两步法抗体纯化平台的建立。
1 材料与方法1.1 试剂和仪器实验常用试剂均购自于Sigma-Aldrich。蛋白A树脂MabSelectTM Sure,混合型疏水性阴离子交换树脂CaptoTM adhere购自于GE Healthcare。蛋白A树脂Eshmono? A购自于Merck Millipore,蛋白A树脂ToyopearlTM AF-rProtein A-650 F购自于日本Tosoh Bioscience。UNOsphereTM Q阴离子交换树脂购自于Bio-Rad。以上层析介质均填充于XK或TricornTM系列色谱柱。所有色谱实验均于?KTATM Explorer 100 或 Avant 25 室温进行。
1.2 方法1.2.1 细胞培养生物仿制单克隆抗体IgG1 (赫赛汀?或Herceptin?) 由CHO (DG44,Life Technologies) 表达产生,利用新加坡科技发展局生物处理科技研究院开发的三顺反子载体[13]。抗体由5 L BIOSTAT? B搅拌式玻璃生物反应器生产 (Sartorius Stedim Biotech),采用补料分批培养方式,利用1∶1的无蛋白培养基CD CHO (Life Technologies)和HyQ PF (GE Healthcare)。30%?50%细胞活力下收集细胞液。在室温、 4 000×g条件下离心20 min,之后经由0.22 μm滤膜 (Nalgene? Rapid-Flow Filters,Thermo Scientific) 过滤。澄清后细胞回收液贮存在2?8 ℃以供短期使用或-20 ℃长期保存。
1.2.2 细胞液预处理为研究细胞液在不同盐浓度下各种宿主杂质的响应机制,细胞回收液经Sartorius Vivaspin 15R 超滤离心管 (2 kDa截留分子量) 进行缓冲液置换至50 mmol/L MES,pH 6.0。通过添加NaCl以及1 mol/L醋酸,将细胞液NaCl浓度以及pH调整至指定值。测量浊度后经由0.22 μm滤膜滤除沉淀物,进行相关分析。
细胞液预处理通过向细胞回收液添加 1 mol/L醋酸调节pH至指定值。经由0.22 μm滤膜滤除沉淀物。滤过液pH由1 mol/L Tris缓冲液调至中性,进行相关分析或蛋白纯化研究。
1.2.3 蛋白纯化4 mL蛋白A树脂填充于Tricorn 5/10 色谱柱,线性流速300 cm/h (4 mL/min,1 min停留时间)。色谱柱经由5倍柱体积平衡液 (50 mmol/L HEPES,150 mmol/L NaCl,pH 7.0) 清洗后上样。3倍柱体积平衡液冲洗,之后由5倍柱体积的50 mmol/L HEPES,1 mol/L NaCl,pH 7.0缓冲液进一步冲洗,之后再经2倍柱体积平衡液冲洗去除高浓度NaCl。抗体蛋白最后由5倍柱体积蛋白洗脱液 (100 mmol/L醋酸,pH 3.5) 洗脱。在UV 280 nm达到50 mAU开始收集蛋白,当UV降至同一值结束收集。色谱柱由5倍柱体积0.1 mol/L NaOH清洗之后保存在20%乙醇中。收集的蛋白液pH调至8.0,添加NaCl至 1 mol/L。40 mg蛋白上样至4 mL Capto adhere色谱柱,线性流速300 cm/h。色谱柱经由5倍柱体积平衡液 (50 mmol/L Tris,1 mol/L NaCl,pH 8.0) 冲洗,之后由10倍柱体积洗脱液 (50 mmol/L MES,0.35 mol/L NaCl,pH 6.0) 洗脱。蛋白按上述收集方式收集。色谱柱经由1 M NaOH清洗后保存在20%乙醇中。
1.3 检测方法1.3.1 宿主残留杂蛋白检测非组蛋白宿主蛋白应用ELISA法测定[14],使用Generation III CHO HCP试剂盒 (Cygnus Technologies Inc.)。
组蛋白宿主杂质由Total H3 Histone 试剂盒 (Active Motif) 或PathScan? Total Histone H3 Sandwich ELISA试剂盒 (Cell Signaling Technology Inc.) 测定。组蛋白应用如下方法进行提取:待测样品在200 mmol/L HCl,1.5 mol/L NaCl,0.1% NonidetTM NP 40,0.2%依沙吖啶条件下作用1 h,之后经由0.22 μm滤膜过滤。滤液应用UNOsphere Q色谱柱,在50 mmol/L Tris,pH 8.0条件下基于空隙排阻色谱法进行纯 化[14-15]。纯化后组蛋白保存于-20 ℃直至检测。
1.3.2 宿主残留DNA检测宿主残留DNA由数字型PCR仪QX100TM Droplet DigitalTM PCR System (Bio-Rad) 测量。根据生产厂家推荐的DNA提取以及样品制备方法进行样品制备[14]。该数字型PCR仪可用于对起始样品DNA的绝对定量,理论检测限为1个拷贝数目标DNA。
1.3.3 蛋白聚合物、浓度测量通过尺寸排阻色谱 (Size exclusion chromatography) 进行蛋白聚合物的测量。应用G3000SWx色谱柱 (Tosoh Bioscience) 在Dionex UltiMateTM 3000 UPLC (Thermo Scientific) 系统,流速0.6 mL/min,缓冲液 50 mmol/L MES,20 mmol/L EDTA,200 mmol/L Arginine,pH 6.0。上样量为100 μL。非聚合物IgG浓度通过与已知浓度抗体蛋白标准曲线对比由SEC测量。该方法有效避免了应用亲和层析法对于吸附蛋白聚合物而造成的IgG浓度错误高估[14-16]。
1.3.4 SDS-PAGE蛋白检测蛋白经由还原性或非还原性SDS-PAGE分离,应用4%-15% CriterionTM TGX Stain-FreeTM Gel (Bio-Rad) 蛋白预制胶。蛋白分离胶由SilverQuestTM试剂盒 (Invitrogen) 银染。
1.3.5 浊度测量溶液浊度由Orion Q4500 (Thermo Scientific) 手持式浊度仪测量,单位为NTU。
2 结果与讨论2.1 细胞发酵液残留杂质分析单抗细胞发酵液经过离心过滤后通过高效液相尺寸排阻色谱分离,收集不同保留时间组分。然后通过还原型SDS-PAGE凝胶电泳分离各保留时间组分 (图 1),并利用相应手段分析其成分 (图 2):残留DNA通过数字型PCR测定,非组蛋白宿主杂质蛋白通过ELISA测定。需要注意的是,传统宿主杂质检测试剂盒不能有效识别组蛋白 (检测量低于万分之一),需通过组蛋白高效提取分离后通过组蛋白检测试剂盒测定。
 |
| 图1 离心过滤细胞上清液通过尺寸排阻色谱分离之后经过还原型SDS-PAGE凝胶电泳分离 Figure1 Reduced SDS-PAGE of fractions from SEC cell culture supernatant. Histone identities confirmed by mass spectrometry and western blotting (data not shown). Lane 10-18,fractions at 10-18th min from SEC. |
| 图选项 |
 |
| 图2 离心过滤细胞上清液通过尺寸排阻色谱分离,各种组分残留的分布 Figure2 SEC of cell culture supernatant showing native size distribution of DNA,histone and non-histone HCP. LC is the abbreviation of light chain. |
| 图选项 |
由图 1和2可以看出,蛋白聚集区域 10?12 min左右富集了大量的DNA、组蛋白以及非组蛋白宿主杂质,是细胞回收液中主要污染物的来源。另外,12?16 min主要成分为IgG,18 min左右为游离的轻链 (LC)。
正如前文所述,由于宿主杂质蛋白在理化性质如分子量、等电点、疏水性以及表面电荷分布等方面的巨大差异,导致其难以有效完全去除,通常需要多个不同分离机制的单元操作交叉进行、分离去除,进而消除由任何微量存在的宿主杂质蛋白所引起的严重的免疫反应[6-8]。因此,对于这些宿主杂质蛋白的分析鉴定、探索其对后续分离纯化的影响机制一直以来吸引了科学家们的巨大兴趣。近几年来,出现了大量应用蛋白质组学结合荧光差异双向电泳技术 (Two dimension difference gel electrophoresis,简称2D-DIGE)、二维液相色谱-串联质谱 (Two-dimensional liquid chromatography/tandem mass spectrometry,简称2D-LC-MS/MS) 等进行HCP分析鉴定的研究[17-22]。在这些杂质宿主蛋白中,约15%是高酸性蛋白 (等电点低于5),60%属于酸性偏中性蛋白,不到25%属于碱性蛋白 (等电点高于8.0)。表达条件、细胞液澄清决定HCP的组成,极大影响到下游蛋白纯化。对于这些种类繁杂、理化性质差别很大的杂质的有效前处理是实现下游高效、简便纯化、降低生产成本的重要保证。由于一直以来缺少具有强大吸附或沉淀能力的细胞液预处理技术,这一目标很难实现,而这一领域也成为单抗上、下游的研究热点[23-24]。
近期有国外****报道了通过对细胞液的酸性沉淀去除部分宿主杂质蛋白[25],本研究中将进一步对酸性沉淀中各种宿主杂质的表现方式进行详细分析,并研究其对后续色谱纯化的影响,进而建立起更加简便的抗体纯化平台技术。
2.2 缓冲液环境对各种宿主杂质的影响基于已报道实验发现,我们进一步研究了pH和盐浓度 (主要是NaCl) 对细胞回收液中各种杂质的影响 (图 3A-F)。明确了各种杂质 (包括组蛋白宿主杂质蛋白、非组蛋白宿主杂质蛋白、DNA、蛋白聚合物) 以及单体抗体蛋白IgG、溶液浊度对于不同pH、盐浓度的响应方式。从图 3中我们可以明显看到各种杂质均随着pH的降低而减少,其中DNA和组蛋白的减少最为明显。DNA和组蛋白在盐浓度为0、pH为 5.5-6.0左右时,浓度均降低到检测限附近。非组蛋白宿主杂质蛋白受pH的影响最小,在最低pH条件下浓度只降低到原来的40%左右。而随着盐浓度的提高,各种杂质受pH的影响逐渐减弱。IgG在pH 3.5-4.0损失严重,在pH 4.0以及盐浓度150 mmol/L (接近细胞回收液盐浓度) 以上均能保证90%以上回收率 (图 3E)。
 |
| 图3 缓冲液pH、盐浓度 (氯化钠) 对细胞回收液中各种杂质以及抗体蛋白、浊度的影响 Figure3 Solubility of each component in cell culture supernatant and its corresponding turbidity as a function of pH and salt concentration. (A) DNA. (B) Non-histone HCP. (C) Histone. (D) Heteroaggregates. (E) IgG recovery. (F) Turbidity. |
| 图选项 |
伴随着pH下降,各种杂质溶解度下降,造成溶液浊度逐渐上升 (图 3F),在盐浓度为0时尤为明显,随着盐浓度的上升,浊度上升逐渐趋缓。
通过以上实验,我们发现细胞液中杂质,尤其是DNA和组蛋白受环境pH影响很大,随着pH下降,溶解度迅速降低,造成浊度上升,然后通过过滤能够实现大量杂质的有效去除。
2.3 细胞回收液低pH预处理效果分析细胞回收液预处理通过1 mol/L醋酸调节pH至指定值,过滤去除沉淀物,之后调整pH至中性进行分析或用于后续蛋白A纯化实验。
为进一步研究沉淀组成,上述细胞液处理后沉淀部分通过离心分离回收,经由非还原性SDS-PAGE分离 (图 4),随着pH的降低,大量杂质蛋白沉淀。图 5尺寸排阻色谱显示,随着pH的降低,8-13 min蛋白聚合区明显降低。伴随着各种杂质如DNA、组蛋白、非组蛋白宿主杂质蛋白的大量去除 (表 1)。其中DNA降低为起始浓度的0.007%,组蛋白减低为起始浓度的2.2%,非组蛋白宿主蛋白降低为起始浓度的75%。蛋白聚合物由18.73%降低为3.42%。在pH 4.0处理后,IgG回收率为92.36%。
 |
| 图4 细胞上清液经不同pH沉淀的非还原型SDS-PAGE凝胶电泳图 Figure4 Non-Reduced SDS-PAGE,precipitates from cell culture supernatant treated to different pHs (3.5-9.0). |
| 图选项 |
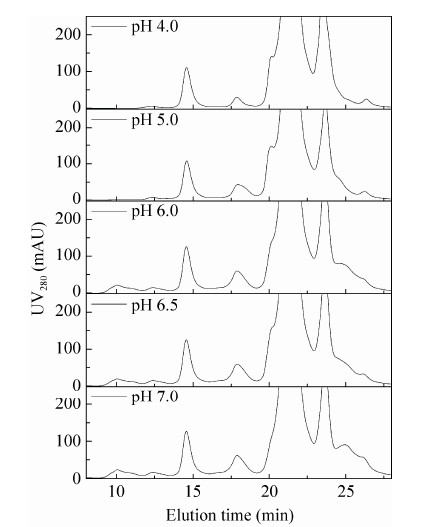 |
| 图5 细胞回收液在不同pH酸性处理后经离心过滤通过尺寸排阻色谱分离 Figure5 SEC of cell culture supernatant titrated to different pHs. |
| 图选项 |
表1 细胞回收液经酸性处理后各种杂质以及IgG回收率Table1 Concentration of each component (DNA,non-histone HCP,histone,heteroaggregates and IgG) in cell culture supernatant after different pH treatment
| IgG (mg/mL) | Recovery (%) | Agg (%) | HCP (ppm) | DNA (ppm) | Histone (ppm) | |
| pH7 | 1.35 | 100 | 18.73 | 395 479 | 20 347 | 12 882 |
| pH6 | 1.35 | 99.86 | 18.4 | 386 487 | 18 446 | 11 708 |
| pH5 | 1.31 | 97.29 | 7.21 | 334 888 | 4 763 | 2 950 |
| pH4 | 1.22 | 92.36 | 3.42 | 299 040 | 1.4 | 283 |
表选项
低pH细胞液处理技术能有效去除各种宿主蛋白,大大减轻后续蛋白纯化的压力,对于未来工艺的简化起到了至关重要的作用。
2.4 不同蛋白A树脂纯化效果对比细胞回收液经不同pH处理后,应用不同蛋白A树脂进行纯化。图 6显示,pH 4.0处理后细胞回收液经由蛋白A纯化后,与pH 7.0 条件细胞回收液直接上样相比,NaOH洗脱峰面积大大减少,进一步证明低pH预处理有效去除大量宿主杂质,减轻了蛋白A树脂生物负载量,对于提高树脂使用寿命将起到有益作用。
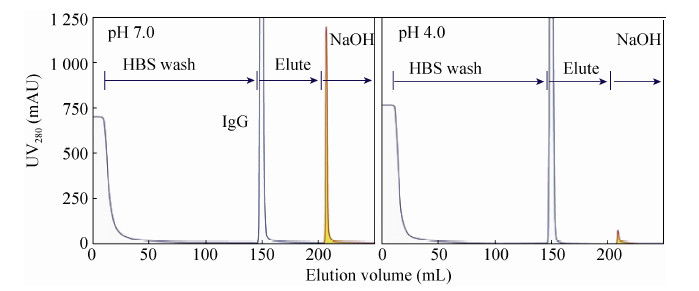 |
| 图6 不同酸性处理后细胞回收液经由MabSelect Sure蛋白A树脂纯化色谱图 Figure6 Toyopearl protein A chromatography loaded with cell culture supernatant treated at different pHs. |
| 图选项 |
表 2比较了不同酸性处理后经由3种蛋白A纯化后单抗蛋白以及残留杂质量。对于3种蛋白A树脂,经过低pH 4.0处理后最终产品非组蛋白宿主杂质蛋白与pH 7.0条件下,均取得10倍左右降低量。DNA、组蛋白降低显著。IgG回收率均取得3%左右提高。
表2 酸性处理细胞回收液经不同蛋白A树脂纯化效果比较Table2 Concentration of each component (DNA,non-histone HCP,histone,heteroaggregates and IgG) in cell culture supernatant treated at different pHs and loaded to protein A columns,1-MabSelect Sure,2-Toyopearl,3-Eshnumo A
| IgG (mg/mL) | Recovery (%) | Agg (%) | HCP (ppm) | DNA (ppm) | Histone (ppm) | |
| 1-pH7 | 4.14 | 95.16 | 3.84 | 728 | 0.161 8 | 13.52 |
| 1-pH6 | 4.14 | 95.19 | 3.60 | 571 | 0.320 1 | 13.29 |
| 1-pH5 | 4.15 | 98.08 | 3.72 | 236 | 0.032 5 | 0 |
| 1-pH4 | 3.89 | 98.54 | 2.83 | 63 | 0.006 5 | 0 |
| 2-pH7 | 4.04 | 92.78 | 3.65 | 557 | 0.020 0 | 25.26 |
| 2-pH6 | 4.03 | 92.67 | 3.80 | 475 | 0.071 28 | 11.17 |
| 2-pH5 | 4.04 | 95.44 | 3.57 | 245 | 0.008 9 | 0 |
| 2-pH4 | 3.80 | 96.18 | 3.36 | 66 | 0.001 8 | 0 |
| 3-pH7 | 4.10 | 94.25 | 3.11 | 561 | 0.016 8 | 18.53 |
| 3-pH6 | 4.10 | 94.48 | 3.80 | 582 | 0.080 8 | 8.52 |
| 3-pH5 | 4.11 | 97.01 | 3.70 | 306 | 0.008 2 | 0 |
| 3-pH4 | 3.84 | 97.38 | 3.42 | 87 | 0.005 9 | 0 |
表选项
在传统的蛋白A亲和层析中,由于大量宿主杂质的非特异性吸附,阻碍了其他抗体蛋白与蛋白A的结合,造成了蛋白动态上样量下降。蛋白A需要低pH (pH 3.0?4.0) 洗脱吸附的单抗蛋白,但同时该条件也会造成吸附在蛋白A上的宿主杂蛋白剥离,使得洗脱下来的抗体蛋白混杂了大量的宿主杂蛋白。同时在蛋白A洗脱抗体蛋白液中和过程中,由于宿主杂质蛋白结合聚集,形成大量微米级的颗粒聚集,是造成抗体纯化洗脱液中浊度提升的主要原因,往往需要很大面积的滤膜去除,对操作产生诸多不便[26]。
我们比较了不同pH条件处理后蛋白A低pH洗脱IgG在回调至中性过程中浊度的变化 (图 7):经过pH 4.0预处理后上样至蛋白A,低pH洗脱蛋白回调后浊度大大降低,减少了滤膜的使用量,大大增加了操作的连续性,简化工艺流程。
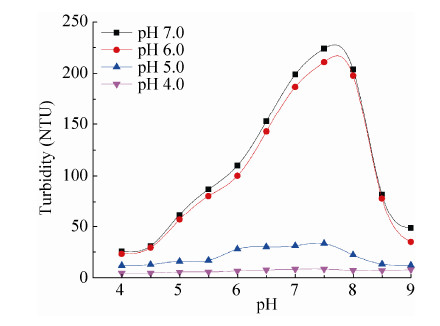 |
| 图7 不同pH处理后细胞回收液经由MabSelect SuRe蛋白A树脂纯化后洗脱蛋白浊度 Figure7 MabSelect SuRe loaded with cell culture supernatant treated at different pHs,eluted IgG was adjusted to different pHs and turbidity was monitored over the neutralization process. |
| 图选项 |
2.5 两步法抗体纯化工艺传统单抗纯化平台包括3-4步色谱纯化,除了蛋白A作为第一步抗体粗纯外,通常需要额外2-3步色谱,诸如阴、阳离子交换树脂,疏水作用树脂进一步去除残留的宿主杂质以及蛋白聚合物 (图 8)。
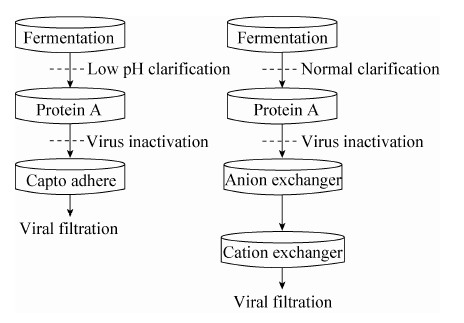 |
| 图8 两步法抗体纯化平台对比三步法抗体纯化 Figure8 Two-step purification platform comprising of protein A and Capto adhere. Traditional IgG purification platform contains protein A and two other polishing steps,such as anion exchanger,cation exchanger,etc. |
| 图选项 |
Capto adhere是GE公司新开发的混合型疏水作用阴离子交换树脂[27],对于去除蛋白聚合物效果明显。蛋白A洗脱抗体调节pH至8.0,NaCl添加至1 mol/L (电导率在90 mS/cm左右),上样至Capto adhere。蛋白洗脱通过降低pH以及电导率,蛋白聚合物吸附能力强于单体IgG,需进一步降低pH以及电导率进行洗脱 (图 9)。洗脱后IgG以及蛋白聚合物部分分别由排阻色谱分离 (图 10),IgG峰纯度高于99.99%,蛋白聚合物小于0.01%。
 |
| 图9 蛋白A洗脱抗体经由Capto adhere纯化 Figure9 IgG purification by Capto adhere. |
| 图选项 |
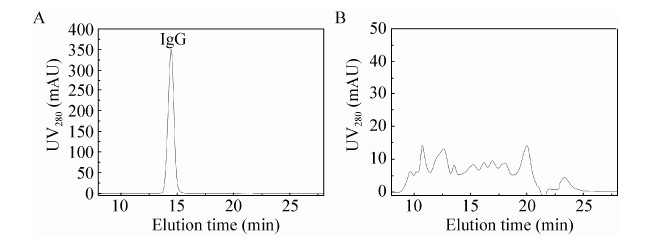 |
| 图10 蛋白A洗脱抗体经由Capto adhere纯化后通过尺寸排阻色谱分离 Figure10 SEC of purified IgG by two-step purification platform comprising. (A) IgG. (B) heteroaggregates. |
| 图选项 |
经过Capto adhere纯化后非组蛋白宿主杂质蛋白降低至4.5 ppm,DNA降低至小于1 ppb,抗体质量好于市场现有商业化产品[16-18],总IgG回收率达到87%。证明经由低pH细胞液处理后大大提高蛋白A以及后续Capto adhere纯化效率 (表 3),有效实现两步法单抗纯化 (图 8)。
表3 细胞回收液酸性与非酸性处理通过蛋白A,Capto adhere纯化效果对比Table3 Capto adhere purification efficiency of cell culture supernatant treated by low pH or not,1-pH 4.0 treatment,2-no pH treatment
| IgG (mg/mL) | Recovery (%) | Agg (%) | HCP (ppm) | DNA (ppm) | Histone (ppm) | |
| 1-Capto adhere | 2.54 | 95.66 | 0.01 | 4.5 | 0.0008 | 0 |
| 2-Capto adhere | 2.65 | 94.89 | 0.01 | 95.6 | 0.0086 | 0 |
表选项
3 结论本研究首先关联了抗体细胞回收液pH、盐浓度对于各种杂质的影响机制。明确了各种杂质包括组蛋白、非组蛋白宿主杂质蛋白、DNA、蛋白聚合物对于不同pH、盐浓度的响应关系,伴随着pH的降低,宿主杂质溶解度下降,造成细胞液浊度上升。而盐浓度的提高则减缓了各种杂质溶解度的下降。
通过对抗体细胞回收液的pH 4.0酸性处理,实现99.99%以上DNA去除,97%以上组蛋白去除,非组蛋白宿主蛋白降低为起始浓度的75%。蛋白聚合物降低至起始的20%。经过蛋白A纯化后,洗脱蛋白回调中性后浊度降低至 5 NTU以下,非组蛋白宿主杂质蛋白降低10倍。蛋白A纯化效率大大提高,抗体蛋白回收率提高3%左右。经过一步Capto adhere纯化,非组蛋白宿主杂质蛋白降低至4.5 ppm,DNA降低至小于1 ppb,组蛋白降低至检测限以下,蛋白聚合物小于0.01%,纯度高于市场现有商业化产品。该两步法抗体蛋白纯化平台实现87%的蛋白回收率,连续性高,具有很好的大规模实际应用价值。
参考文献
| [1] | Nelson AL, Dhimolea E, Reichert JM. Development trends for human monoclonal antibody therapeutics.Nat Rev Drug Discov, 2010, 9(10): 767–774(in Chinese). |
| [2] | Ecker DM, Jones SD, Levine HL. The therapeutic monoclonal antibody market.mAbs, 2015, 7(1): 9–14(in Chinese). |
| [3] | Scott AM, Wolchok JD, Old LJ. Antibody therapy of cancer.Nat Rev Cancer, 2012, 12(4): 278–287(in Chinese). |
| [4] | Guo YJ. Progress in monoclonal antibody-based immunotherapy for cancer treatment.Chin J Biotech, 2015, 31(6): 857–870(in Chinese). 郭亚军. 基于单克隆抗体的肿瘤免疫疗法研究进展.生物工程学报,2015,31(6):857–870. |
| [5] | Guiochon G, Beaver LA. Separation science is the key to successful biopharmaceuticals.J Chromatogr A, 2011, 1218(49): 8836–8858(in Chinese). |
| [6] | Shukla AA, Th?mmes J. Recent advances in large-scale production of monoclonal antibodies and related proteins.Trends Biotechnol, 2010, 28(5): 253–261(in Chinese). |
| [7] | Levy NE, Valente KN, Choe LH, et al. Identification and characterization of host cell protein product-associated impurities in monoclonal antibody bioprocessing.Biotechnol Bioeng, 2014, 111(5): 904–912(in Chinese). |
| [8] | Singh N, Arunkumar A, Chollangi S, et al. Clarification technologies for monoclonal antibody manufacturing processes: current state and future perspectives.Biotechnol Bioeng, 2016: 698–716(in Chinese). |
| [9] | Kelley B. Very large scale monoclonal antibody purification: the case for convertional unit operations.Biotechnol Prog, 2007, 23(5): 995–1008(in Chinese). |
| [10] | Varadaraju H, Schneiderman S, Zhang L, et al. Process and economic evaluation for monoclonal antibody purification using a membrane-only process.Biotechnol Prog, 2011, 27(5): 1297–1305(in Chinese). |
| [11] | Jiang C, Liu J, Rubacha M, et al. A mechanistic study of protein A chromatography resin lifetime.J Chromatogr A, 2009, (31): 5849–5855(in Chinese). |
| [12] | Swinnen K, Krul A, Goidsenhoven I V, et al. Performance comparison of protein A affinity resins for the purification of monoclonal antibodies.J Chromatogr B, 2007, (1): 97–107(in Chinese). |
| [13] | Ho SC, Bardor M, Feng H, et al. IRES-mediated tricistronic vectors for enhancing generation of high monoclonal antibody expressing CHO cell lines.J Biotechnol, 2012, 157(1): 130–139(in Chinese). |
| [14] | Nian R, Zhang W, Tan L, et al. Advance chromatin extraction improves capture performance of protein A affinity chromatography.J Chromatogr A, 2016, 1431(1): 1–7(in Chinese). |
| [15] | Nian R, Chuah C, Lee J, et al. Void exclusion of antibodies by grafted-ligand porous particle anion exchangers.J Chromatogr A, 2013, 1282(1282): 127–132(in Chinese). |
| [16] | Gagnon P, Nian R, Tan L, et al. Chromatin-mediated depression of fractionation performance on electronegative multimodal chromatography media, its prevention, and ramifications for purification of immunoglobulin G.J Chromatogr A, 2014, 1374(1): 145–155(in Chinese). |
| [17] | de Zafra CLZ, Quarmby V, Francissen K, et al. Host cell proteins in biotechnology-derived products: a risk assessment framework.Biotechnol Bioeng, 2015, 112(11): 2284–2291(in Chinese). |
| [18] | Valente KN, Lenhoff AM, Lee KH. Expression of difficult-to-remove host cell protein impurities during extended Chinese hamster ovary cell culture and their impact on continuous bioprocessing.Biotechnol Bioeng, 2015, 112(6): 1232–1242(in Chinese). |
| [19] | Yuk IH, Nishihara J, Walker D Jr, et al. More similar than different: host cell protein production using three null CHO cell lines.Biotechnol Bioeng, 2015, 112(10): 2068–2083(in Chinese). |
| [20] | Zhang S, Daniels W, Salm J, et al. Nature of foulants and fouling mechanism in the protein A MabSelect resin cycled in a monoclonal antibody purification process.Biotechnol Bioeng, 2016, 113(1): 141–149(in Chinese). |
| [21] | Zhang S, Xu K, Daniels W, et al. Structural and functional characteristics of virgin and fouled protein A MabSelect resin cycled in a monoclonal antibody purification process.Biotechnol Bioeng, 2016, 113(1): 367–375(in Chinese). |
| [22] | Levy NE, Valente KN, Lee KH, et al. Host cell protein impurities in chromatographic polishing steps for monoclonal antibody purification.Biotechnol Bioeng, 2015: 1–13(in Chinese). |
| [23] | Wickramasinghe SR, Wu Y, Han B. Enhanced microfiltration of yeast by flocculation.Desalination, 2002: 25–30(in Chinese). |
| [24] | Roush D, Lu Y. Advances in primary recovery: centrifugation and membrane technology.Biotechnol Prog, 2008: 488–495(in Chinese). |
| [25] | Westoby M, Chrostowski J, de Vilmorin P, et al. Effects of solution environment on mammalian cell fermentation broth properties: enhanced impurity removal and clarification performance.Biotechnol Bioeng, 2011, 108(1): 50–58(in Chinese). |
| [26] | Chollangi S, Parker R, Singh N, et al. Development of robust antibody purification by optimizing protein-A chromatography in combination with precipitation methodologies.Biotechnol Bioeng, 2015, 112(11): 2292–2304(in Chinese). |
| [27] | Hou Y, Cramer SM. Evaluation of selectivity in multimodal anion exchange systems: a priori prediction of protein retention and examination of mobile phase modifier effects.J Chromatogr A, 2011, 1218(43): 7813–7820(in Chinese). |
