
 , 堵国成2, 3, 陈坚2, 3
, 堵国成2, 3, 陈坚2, 3 

1. 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122
2. 江南大学生物工程学院,江苏 无锡 214122
3. 江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122
摘要:氨基甲酸乙酯 (Ethyl carbamate,EC) 作为一种潜在致癌物质普遍存在于传统发酵食品中。利用酸性脲酶消除EC前体物质尿素是一种具有潜在重要应用价值的策略。本研究在前期成功实现食品级耐乙醇酸性脲酶高效表达制备的基础上,系统研究了重组酸性脲酶对尿素和EC的水解过程。重组酸性脲酶对模拟体系以及黄酒体系中的尿素具有很好的降解能力 (60 mg/L的尿素在25 h内完全被降解),表明该重组酸性脲酶适用于黄酒中尿素的消除。虽然重组酸性脲酶也具有降解EC的催化活性,但在黄酒中添加重组酸性脲酶对EC的浓度无明显影响。进一步研究发现重组酸性脲酶对尿素和EC的Km值分别为0.714 7 mmol/L和41.32 mmol/L,研究结果为应用定向进化策略改造重组酸性脲酶实现同时水解尿素和EC提供了理论依据。
关键词: 重组酸性脲酶氨基甲酸乙酯尿素食品安全酶法降解
Degradation of urea and ethyl carbamate in Chinese Rice wine by recombinant acid urease
Jianli Zhou1, 2, Zhen Kang1, 2, 3, Qingtao Liu1, 2

 , Guocheng Du2, 3, Jian Chen2, 3
, Guocheng Du2, 3, Jian Chen2, 3

1. Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122,Jiangsu, China
2. School of Biotechnology, Jiangnan University, Wuxi 214122,Jiangsu, China
3. The Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122,Jiangsu, China
Received: March 27, 2015; Accepted: May 21, 2015
Supported by: National Basic Research Program of China (973 Program) (No. 2012CB720802), National High Technology Researchand Development Program of China (863 Program) (No. 2011AA100905), the National Science Foundation for Post-doctoral Scientists ofChina (No. 2013 M540414).
Corresponding authors: Zhen Kang. Tel: +86-510-85918307; Fax: +86-510-85918309; E-mail: zkang@jiangnan.edu.cnJian Chen. Tel: +86-510-85918307; Fax: +86-510-85918309; E-mail: jchen@jiangnan.edu.cn
Abstract: Ethyl carbamate (EC) as a potential carcinogen commonly exists in traditional fermented foods. It is important eliminate urea that is the precursors of EC in many fermented foods, including Chinese Rice wine. On the basis of achieving high-level overexpression of food-grade ethanol-resistant acid urease, we studied the hydrolysis of urea and EC with the recombinant acid urease. Recombinant acid urease showed degraded urea in both the simulated system with ethanol and Chinese Rice wine (60 mg/L of urea was completely degraded within 25 h), indicating that the recombinant enzyme is suitable for the elimination of urea in Chinese Rice wine. Although recombinant acid urease also has degradation catalytic activity on EC, no obvious degradation of EC was observed. Further investigation results showed that the Km value for urea and EC of the recombinant acid urease was 0.7147 mmol/L and 41.32 mmol/L, respectively. The results provided theoretical foundation for realizing simultaneous degradation of urea and EC.
Keywords: recombinant acid ureaseethyl carbamateureafood safetyenzymatic degradation
氨基甲酸乙酯 (Ethyl carbamate,EC),是一种天然存在于所有发酵食品和酒精饮料中的成分,是由尿素和乙醇自发反应生成的具有潜在致癌性的物质[1, 2]。在酒精饮料中尿素含量会间接影响EC的含量,世界各国和国际卫生组织对酒中的EC浓度都有严格的限量标准,因此降低酒精饮料中EC浓度成了至关重要的问题。在酒精饮料中,尿素一部分是由原料自身引入的,另外绝大部分是作为副产物由酵母细胞内的精氨酸分解代谢所产生的[3]。因此消除酒精饮料中的尿素成为减少EC浓度的可行方法之一[4]。
脲酶普遍存在于细菌、真菌和高等植物 中[5, 6],所有已知的不同来源的脲酶在结构上具有高度同源性[7]。酸性脲酶指的是在酸性条件下仍然能够降解尿素的脲酶,因此可以在呈酸性的酒精饮料中发挥作用。酸性脲酶在大鼠胃肠道的乳酸乳杆菌中首次发现[8],目前已经分离出了许多具有酸性脲酶活性的肠道细菌并研究了它们的特性[9, 10, 11],但是所报道的酸性脲酶均表现出高度的专一性,即只能专一地分解尿素,不能分解EC。综上所知,深入研究酸性脲酶及其性质对于酒类行业的发展具有重要意义。本实验室前期在具有乳糖筛选标记的食品级乳酸乳球菌NZ9000中,利用诱导剂乳酸链球菌肽成功表达了来源于罗伊氏乳杆菌的酸性脲酶[12],该酶对尿素和EC均有显色反应,并且具有良好的耐乙醇特性。为进一步分析其在不同体系中对尿素和EC的降解能力,首先对重组酸性脲酶进行分离纯化,研究了纯酶在缓冲液 (pH 4.5) 和市售黄酒中对尿素和EC的降解能力并测定了Km值,为今后分子改造酸性脲酶提供了方向和基础。
1 材料与方法 1.1 材料 1.1.1 菌种和培养基 产酸性脲酶菌株NZ9000-LR(MG1363 pepN::nisRK;harboring pNZ8149-ureABCEFGD;Cmr) 由本实验室构建。种子培养基为M17肉汤培养基,发酵培养基成分为蛋白胨1.5%,酵母抽提物0.1%,葡萄糖5.0%,硫酸镁1.0 mmol/L,硫酸锰0.1 mmol/L。
1.1.2 主要试剂和仪器 M17肉汤培养基、蛋白胨和酵母抽提物购自Oxoid公司;其他化学试剂均为国产分析纯。本研究所使用的仪器主要有:AKTA蛋白纯化系统 (Aamersham pharmacia biotech);SDS-PAGE系统 (Aamersham pharmacia biotech);UV-2450光谱分光光度计 (Shimadzu Co.,Kyoto,Japan);Hitrap DEAE FF弱阴离子柱 (GE Healthcare);Superdex 200 pg凝胶柱 (GE Healthcare)。
1.2 方法 1.2.1 重组酸性脲酶的分离纯化 粗酶液的制备:将单菌落接种至含氯霉素(10 μg/mL) 的M17液体培养基中,30 ℃静置培养16 h;按2.0%的接种量接种于3 L发酵罐中,装液量为1.5 L,培养温度为30 ℃,搅拌转速为100 r/min,当OD600约为0.4时,加入终浓度为10 ng/mL的乳酸链球菌肽,诱导表达8 h。离心收集菌体后,用200 mL的10 mmol/L Tris-HCl (pH 7.4) 溶液洗涤菌体2次并重悬,加入终浓度为5 mg/mL的溶菌酶后30 ℃水浴处理1 h,超声破碎20 min,离心收集上清,加入无水乙醇至不同终浓度 (10%-80%),冰上放置30 min,离心收集沉淀,用10 mmol/L Tris-HCl (pH 7.4)溶液重悬沉淀,测定各乙醇浓度下的酶活大小。
Hitrap DEAE FF柱离子交换层析:将酶活最高的乙醇浓度下的上清液在10 mmol/L Tris-HCl (pH 7.4) 溶液中过夜透析后,加样到 Hitrap DEAE FF柱中,用0-1.0 mol/L NaCl溶液梯度洗脱,流速4.0 mL/min,收集活性部位。
Superdex 200 pg凝胶柱过滤层析:将经过DEAE柱洗脱的活性部位加样到Superdex 200 pg凝胶柱中,用10 mmol/L Tris-HCl (pH 7.4) 溶液洗脱,流速1.0 mL/min,收集洗脱液后经10% SDS-PAGE分析鉴定纯化后的蛋白。
1.2.2 酶活测定方法 分别向两个比色管中加入200 μL酶液和缓冲液。然后加入800 μL 3.0%尿素或EC溶液,在37 ℃水浴反应20 min后,立即加入1.0 mL终止剂 (10%三氯乙酸),振荡混匀后加入1.0 mL显色剂I (15 g苯酚和0.625 g亚硝基铁氰化钠用蒸馏水定容至250 mL) 和1.0 mL显色剂II (13.125 g NaOH和7.5 mL次氯酸钠用蒸馏水定容至250 mL),混匀后37 ℃水浴处理20 min后取出,用蒸馏水定容至25 mL,625 nm处检测吸光值。缓冲液作空白对照。
酶活活力定义:在常压、37 ℃、pH 4.5的条件下,每分钟分解尿素或EC产生1 μmol铵离子的酶量为1个酶活单位U。
1.2.3 重组酸性脲酶在缓冲液中对尿素和EC的降解能力分析 为了分析重组酸性脲酶在缓冲液中对尿素和EC的降解能力,设计了一系列含不同浓度尿素和EC的缓冲液,如表1所示。50 mL的摇瓶中装液量为20 mL,酶的添加量为500 U/L,定时取样,样品中尿素含量采用高效液相色谱方法测定[13],样品中EC含量采用GC-MS测定[14, 15, 16]。
表1 不同浓度尿素和EC的柠檬酸钠缓冲液Table 1 Sodium citrate buffer with different concentration of urea and EC
| Number | Urea (mmol/L) | EC (mmol/L) |
| 1 | 10 | 0 |
| 2 | 10 | 10 |
| 3 | 10 | 100 |
| 4 | 10 | 500 |
| 5 | 0 | 100 |
| 6 | 1 | 100 |
表选项
1.2.4 重组酸性脲酶在黄酒中对尿素和EC的降解能力分析 为了分析重组酸性脲酶在黄酒中对尿素和EC的降解能力,向市售黄酒中分别添加不同浓度的尿素和EC。50 mL摇瓶中装液量为20 mL,酶的添加量分别为50、100、200和500 U/L,定时取样,测定样品中尿素和EC的含量。
1.2.5 重组酸性脲酶对尿素和EC动力学常数Km值的测定 为了初步分析重组酸性脲酶与尿素和EC的结合能力,将纯化后的酶液与含不同浓度的尿素和EC的缓冲液反应,测定不同浓度下的吸光值,使用GraphPad Prism软件计算重组酸性脲酶对尿素和EC的动力学常数Km值。
1.2.6 重组酸性脲酶与尿素和EC的模拟结构分析 利用在线结构模拟网站http://zhanglab.ccmb.med.umich.edu/I-TASSER对UreC进行结构模拟,获得的UreC结构通过http://zhanglab.ccmb.med.umich.edu/BSP-SLIM与尿素和EC进行分子对接,并用Pymol软件对获得的对接结果进行分析。
2 结果 2.1 重组酸性脲酶的分离与纯化 重组酸性脲酶在终浓度为40%-60%的乙醇溶液中沉淀下来。图1为纯化过程中Hitrap DEAE FF柱离子交换层析的色谱图,图2为纯化过程中Superdex 200 pg凝胶柱过滤层析的色谱图。将各阶段纯化的样品进行SDS-PAGE检测,电泳结果如图3所示,其中通道6为已电泳纯的重组酸性脲酶。
 |
| 图1 Hitrap DEAE FF柱离子交换色谱图 Fig.1 Ion Exchange Chromatography of acid urease by Hitrap DEAE FF. (A) Conc. (B) Cond. (C) UV. |
| 图选项 |
 |
| 图2 Superdex 200 pg凝胶柱过滤层析色谱图 Fig.2 Gel filtration chromatography of acid urease by Superdex 200 pg. (A) UV. (B) Cond. |
| 图选项 |
 |
| 图3 SDS-PAGE检测重组酸性脲酶的纯化 Fig.3 SDS-PAGE analysis of the recombinant acid urease. M: protein marker; 1: cell lysis supernatant; 2: 40%-60% ethanol precipitation; 3: penetrating fluid; 4: Hitrap DEAE FF sample; 5: concentrated liquid by Hitrap DEAE FF; 6: superdex 200 pg sample. |
| 图选项 |
2.2 重组酸性脲酶在缓冲液中对尿素和EC的降解能力分析 在含有不同浓度尿素和EC的缓冲液中重组酸性脲酶对尿素和EC的降解情况如图4所示,由各降解曲线可知在缓冲液中酶对尿素有很强的降解能力,6 h时尿素已基本完全降解,而酶对EC的降解能力较微弱,并且尿素的存在对EC的降解没有影响。
 |
| 图4 重组酸性脲酶对不同浓度的尿素和EC降解曲线 Fig.4 The degradation curve of different concentrations of urea and EC. (A) 10 mmol/L urea. (B) 10 mmol/L urea,10 mmol/L EC. (C) 10 mmol/L urea,100 mmol/L EC. (D) 10 mmol/L urea,500 mmol/L EC. (E) 100 mmol/L EC. (F) 1 mmol/L urea,100 mmol/L EC. |
| 图选项 |
2.3 重组酸性脲酶在黄酒中对尿素和EC的降解能力分析 为了分析在黄酒中重组酸性脲酶对尿素和EC的降解能力,在市售黄酒 (pH 4.1,酒精浓度≥15%) 中,添加500 U/L的酶液,同时向市售黄酒中加入50 mg/L的尿素以及400μg/L EC后添加500 U/L的酶液,降解结果如图5所示。检测结果表明,在黄酒中重组酸性脲酶对尿素的降解能力明显,2 h时已基本完全降解,但对EC的降解能力很微弱,基本无降解。
 |
| 图5 黄酒中重组酸性脲酶对尿素和EC的降解曲线 Fig.5 The degradation curve of urea and EC in Chinese Rice wine. (A) Without urea and EC. (B) 50 mg/L urea,400 μg/L EC. |
| 图选项 |
2.4 不同酶量的重组酸性脲酶在黄酒中对尿素的降解能力分析 鉴于在黄酒中重组酸性脲酶对尿素有显著的降解能力,向黄酒中及加入了50 mg/L尿素的黄酒中分别添加50、100、200和500 U/L的酶液,降解结果如图6所示。结果表明,随着酶量的增加,尿素的降解速率也随之加快,酶的最佳添加量为100 U/L。
 |
| 图6 不同酶量的重组酸性脲酶对黄酒中尿素的降解曲线 Fig.6 The degradation curve of urea with different enzyme dosage in Chinese Rice wine. (A) Without urea and EC. (B) 50 mg/L urea |
| 图选项 |
2.5 重组酸性脲酶对尿素和EC的动力学常数Km值的测定 通过分析重组酸性脲酶在缓冲液体系和黄酒体系中对尿素和EC的降解能力,该酶对两者的降解能力不同,进一步测定该酶对尿素和EC的动力学常数Km值。将纯酶分别与不同浓度的尿素和EC反应,测定对应的吸光值,采用GraphPad Prism计算动力学常数Km值,如图7所示。酶对尿素和EC的Km值分别为0.714 7 mmol/L和 41.32 mmol/L。
 |
| 图7 尿素和EC的GraphPad Prism示意图 Fig.7 GraphPad Prism plots of urea and EC. (A) Urea. (B) EC. |
| 图选项 |
2.6 重组酸性脲酶与尿素和EC的模拟结构分析 根据在线模拟结构网站模拟重组酸性脲酶与尿素和EC的结合区域,结果如图8所示。模拟结构显示由于尿素的空间位阻比EC小,尿素更容易与重组酸性脲酶的催化活性中心结合。另一方面,尿素与氨基酸残基Asp365和Ala368形成两个氢键,而EC与氨基酸残基Ser172形成一个氢键,由此推测,尿素与重组酸性脲酶的结合能力比EC强,更容易被降解。
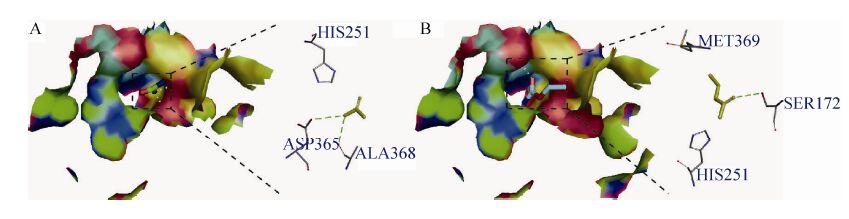 |
| 图8 重组酸性脲酶与尿素和EC的结合区域 Fig.8 The binding domains of urea and EC with the recombinant acid urease. (A) Urea. (B) EC. |
| 图选项 |
3 讨论 由于酸性脲酶能够在酸性条件下将尿素分解为氨和二氧化碳,因此具有降解黄酒中尿素和EC的潜力。目前,人们已经从不同菌属如罗伊氏乳杆菌[17, 18]、发酵乳杆菌[19]、节杆菌属[20]、嗜热链球菌[21, 22, 23, 24]、唾液链球菌[25]以及肠杆菌属[11]等分离纯化出酸性脲酶。而所报道的酸性脲酶对尿素具有高度的催化专一性,对EC没有催化活性[18, 19, 20]。本实验室前期成功构建了表达酸性脲酶的乳酸乳球菌NZ9000-LR[12]。在此基础上,本研究首先对酶进行了分离纯化,初步发现该酶不仅对尿素具有高效的催化活性,对EC也有一定的催化活性。为进一步系统分析该酶在不同体系中对尿素和EC的降解能力,设计了一系列含有不同浓度尿素和EC的缓冲液,检测发现重组酸性脲酶对EC的降解能力相对微弱,但当EC过量存在时 (g/L级别) 有一定的降解效果,并且尿素的存在对EC的降解没有影响。随后初步考察了重组酸性脲酶在黄酒中对尿素和EC的降解应用,结果显示对EC降解相对微弱。
本实验通过在黄酒中添加不同酶量的重组酸性脲酶研究对尿素的降解情况,其中添加 50 U/L酶液1 d内可使60 mg/L尿素完全降解。Yang等[11]添加80 U/L酶液7 d内使25 mg/L尿素降解完全;Kakimoto等添加10 U/L酶液6 d内使50 mg/L尿素降解完全;Miyagawa等[20]添加90 U/L酶液13 d内使50 mg/L尿素降解完全,说明该重组酸性脲酶对黄酒中尿素的降解能力十分显著。另一方面,重组酸性脲酶对尿素和EC的Km值分别为 0.714 7 mmol/L和41.32 mmol/L,对EC的Km值是对尿素Km值的57.8倍,并通过对重组酸性脲酶与尿素和EC的结合区域分析,初步判定该酶对EC的结合能力比尿素弱。尽管如此,该酶对EC的催化能力是之前报道的酸性脲酶所没有的[20, 21, 22, 23, 24, 25, 26]。
综上所述,结合重组酸性脲酶对EC的酶活显色反应以及其在缓冲液和黄酒中对EC的降解能力,该酶对EC具有一定的催化活性,但是由于与EC的结合能力较弱,对低浓度EC的降解能力不明显。这为今后通过分子改造重组酸性脲酶与底物的结合区域或者催化活性区域,筛选具有高效催化EC的酸性脲酶提供了基础和思路,具有广阔的应用前景和较高的潜在 价值。
参考文献
| [1] | Ough CS, Crowell EA, Mooney LA. Formation of ethyl carbamate precursors during grape juice (Chardonnay) fermentation. I. Addition of amino acids, urea, and ammonia: effects of fortification on intracellular and extracellular precursors. Am J Enol Vitic, 1988, 39(3): 243-249. |
| [2] | Schlatter J, Lutz WK. The carcinogenic potential of ethyl carbamate (urethane): risk assessment at human dietary exposure levels. Food Chem Toxicol, 1990, 28(3): 205-211. |
| [3] | Schehl B, Senn T, Lachenmeier DW, et al. Contribution of the fermenting yeast strain to ethyl carbamate generation in stone fruit spirits. Appl Microbiol Biotechnol, 2007, 74(4): 843-850. |
| [4] | Ough CS, Trioli G. Urea removal from wine by an acid urease. Am J Enol Vitic, 1988, 39(4): 303-307. |
| [5] | Mobley HL, Hausinger RP. Microbial ureases: significance, regulation, and molecular characterization. Microbiol Rev, 1989, 53(1): 85-108. |
| [6] | Mobley HL, Island MD, Hausinger RP. Molecular biology of microbial ureases. Microbiol Rev, 1995, 59(3): 451-480. |
| [7] | Qin YJ, Cabral JMS. Review properties and applications of urease. Biocatal Biotransform, 2002, 20(1): 1-14. |
| [8] | Moreau MC, Ducluzeau R, Raibaud P. Hydrolysis of urea in the gastrointestinal tract of "monoxenic" rats: effect of immunization with strains of ureolytic bacteria. Infect Immun, 1976, 13(1): 9-15. |
| [9] | Kakimoto S, Okazaki K, Sakane T, et al. Isolation and taxonomie characterization of acid urease-producing bacteria. Agric Biol Chem, 1989, 53(4): 1111-1117. |
| [10] | Suzuki K, Benno Y, Mitsuoka T, et al. Urease-producing species of intestinal anaerobes and their activities. Appl Environ Microbiol, 1979, 37(3): 379-382. |
| [11] | Yang LQ, Wang SH, Tian YP. Purification, properties, and application of a novel acid urease from Enterobacter sp.. Appl Biochem Biotechnol, 2010, 160(2): 303-313. |
| [12] | Yang YQ, Kang Z, Zhou JL, et al. High-level expression and characterization of recombinant acid urease for enzymatic degradation of urea in rice wine. Appl Microbiol Biotechnol, 2015, 99(1): 301-308. |
| [13] | Clark S, Francis PS, Conlan XA, et al. Determination of urea using high-performance liquid chromatography with fluorescence detection after automated derivatisation with xanthydrol. J Chromatogr A, 2007, 1161(1/2): 207-213. |
| [14] | Lee K-G. Analysis and risk assessment of ethyl carbamate in various fermented foods. Eur Food Res Technol, 2013, 236(5): 891-898. |
| [15] | Zhang J, Liu GX, Zhang Y, et al. Simultaneous determination of ethyl carbamate and urea in alcoholic beverages by high-performance liquid chromatography coupled with fluorescence detection. J Agric Food Chem, 2014, 62(13): 2797-2802. |
| [16] | Huang WH, Geng PL, Cheng HP, et al. Detection of ethyl carbamate in Jiangxiang Baijiu (liquor) by SPE-GC/MS. Liquor-Making Sci Technol, 2014, (8): 105-108 (in Chinese). 黄卫红, 耿平兰, 程化鹏, 等. SPE-GC/MS 法测定酱香型白酒中氨基甲酸乙酯. 酿酒科技, 2014, (8): 105-108. |
| [17] | Kakimoto S, Miyashita H, Sumino Y, et al. Properties of acid ureases from Lactobacillus and Streptococcus strains. Agric Biol Chem, 1990, 54(2): 381-386. |
| [18] | Kakimoto S, Sumino Y, Akiyama IS, et al. Purification and characterization of acid urease from Lactobacillus reuteri. Agric Biol Chem, 1989, 53(4): 1119-1125. |
| [19] | Kakimoto S, Sumino Y, Kawahara K, et al. Purification and characterization of acid urease from Lactobacillus fermentum. Appl Microbiol Biotechnol, 1990, 32(5): 538-543. |
| [20] | Miyagawa K, Sumida M, Nakao M, et al. Purification, characterization, and application of an acid urease from Arthrobacter mobilis. J Biotechnol, 1999, 68(213): 227-236. |
| [21] | Mora D, Fortina M, Parini C, et al. Genetic diversity and technological properties of Streptococcus thermophilus strains isolated from dairy products. J Appl Microbiol, 2002, 93(2): 278-287. |
| [22] | Mora D, Maguin E, Masiero M, et al. Characterization of urease genes cluster of Streptococcus thermophilus. J Appl Microbiol, 2004, 96(1): 209-219. |
| [23] | Mora D, Monnet C, Parini C, et al. Urease biogenesis in Streptococcus thermophilus. Res Microbiol, 2005, 156(9): 897-903. |
| [24] | Zotta T, Ricciardi A, Rossano R, et al. Urease production by Streptococcus thermophilus. Food Microbiol, 2008, 25(1): 113-119. |
| [25] | Chen YYM, Clancy KA, Burne RA. Streptococcus salivarius urease: genetic and biochemical characterization and expression in a dental plaque Streptococcus. Infect Immun, 1996, 64(2): 585-592. |
| [26] | Takebe S, Kobashi K. Acid urease from Lactobacillus of rat intestine. Chem Pharm Bull, 1988, 36(2): 693-699. |
