
 , 叶舟1, 2, 熊永权1, 2, 崔晨宇1, 2, 尹健1, 2, 3
, 叶舟1, 2, 熊永权1, 2, 崔晨宇1, 2, 尹健1, 2, 3 

1. 江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122
2. 江南大学 生物工程学院,江苏 无锡 214122
3. 江南大学 食品安全与营养协同创新中心,江苏 无锡 214122
摘要:聚合物胶束作为药物载体具有良好的稳定性和生物相容性,提高疏水性药物溶解性等优势,是一类很有应用潜力的药物传输系统。本研究以合成的共价键连D-甘露糖的双亲性聚合物分子 (PGMA-Mannose) 为药物载体,包载抗癌药物阿霉素 (DOX) 制备具有甘露糖受体靶向性和pH敏感药物释放特性的新型载药聚合物胶束。利用激光共聚焦显微镜和MTT细胞毒性评价方法对载药胶束的细胞内吞摄取和毒性进行评价。实验结果表明,载药胶束能特异性识别人乳腺癌细胞MDA-MB-231表面过度表达的甘露糖受体,被癌细胞大量摄取并在细胞溶酶体酸性环境内释放药物,而载药胶束在表面甘露糖受体低表达的HEK293细胞中只有少量摄取。与原药DOX相比,该载药胶束对癌细胞的毒性显著提高,而对正常细胞的毒性较低。因此,该PGMA-Mannose聚合物胶束有望成为一种新型的靶向药物输送系统应用于癌症的治疗。
关键词: D-甘露糖聚合物胶束靶向药物输送受体介导的胞吞细胞毒性
D-mannose-conjugated polymeric micelles for targeted drug delivery
Shuting Wang1, 2, Quan Zhang1, 2, 3

 , Zhou Ye1, 2, Yongquan Xiong1, 2, Chenyu Cui1, 2, Jian Yin1, 2, 3
, Zhou Ye1, 2, Yongquan Xiong1, 2, Chenyu Cui1, 2, Jian Yin1, 2, 3

1. The Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China
2. School of Biotechnology, Jiangnan University, Wuxi 214122,Jiangsu, China3 Synergetic Innovation Center of Food Safety and Nutrition, Jiangnan University, Wuxi 214122, Jiangsu, China
3. Synergetic Innovation Center of Food Safety and Nutrition, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: February 5, 2015; Accepted: April 3, 2015
Supported by: National Natural Science Foundation of China (No. 51403081), Natural Science Foundation of Jiangsu Province (No.BK20140137).
Corresponding authors: Quan Zhang. Tel: +86-510-85197039; E-mail: quanzhang@jiangnan.edu.cnJian Yin. Tel: +86-510-85328229; E-mail: jianyin@jiangnan.edu.cn
Abstract: Polymeric micelles have exhibited attractive properties as drug carriers, such as high stability in vivo and good biocompatibility, and been successfully used to dissolve various drugs of poor aqueous solubilities. In this study, we developed a new type of polymeric micelles with mannose-mediated targeting and pH-responsive drug release properties for anticancer drug delivery. The polymeric micelles were prepared from an amphiphilic polymer, poly (glycidyl methacrylate)-g-mannose (PGMA-Mannose). An anticancer drug, doxorubicin (DOX), was encapsulated into the micelles during the micellization, and could be released rapidly under acidic condition. The specificity of cellular uptake of the micelles by two different cell lines was studied using confocal laser scanning microscopy and the MTT assay. DOX-loaded micelles were efficiently trapped by mannose-receptor-overexpressing cancer cells MDA-MB-231, whereas mannose- receptor-poor cells HEK293 showed much lower endocytosis towards the micelles under the same conditions. Thus, DOX-loaded micelles displayed higher cytotoxicity to MDA-MB-231 cancer cells as compared with free DOX. The present study demonstrates that PGMA-Mannose micelles are a promising targeted drug delivery system for cancer therapy.
Keywords: D-mannosepolymeric micellestargeted drug deliveryreceptor-mediated endocytosiscytotoxicity
化疗是目前治疗癌症最有效的方法之一。然而化疗的效果往往不够理想,主要原因在于化疗给药的靶向性差,毒副作用严重,而且长期使用容易产生耐药性[1, 2, 3]。药物载体是实现抗癌药物靶向输送治疗癌症的关键。近年来,许多载体材料如脂质体[4]、聚合物胶束[5, 6]、树枝状大分子[7]和有机无机杂化复合纳米粒子[8, 9]等已经被广泛研究用作抗癌药物的靶向输送载体。
聚合物胶束由双亲性聚合物在水中自组装形成[10],其内核可包载疏水性药物,增加药物在体内的稳定性,延长药物的循环时间。同时,聚合物胶束具有适宜的粒径,可通过增强渗透与滞留 (EPR) 效应被动靶向到肿瘤部位以减少抗癌药对正常细胞的不良反应[11]。但EPR效应不能实现载药胶束对癌细胞生长的选择性抑制作用,故为了进一步增强纳米载体对癌细胞的靶向性,通常在载体表面修饰靶向分子,如抗体[12]、多肽[13]、叶酸[14]等,这些功能性靶向分子能特异性识别癌细胞表面过度表达的受体,使载体能够通过受体识别方式被癌细胞摄取,从而实现载体对癌细胞的选择性药物输送的目的,同时降低抗癌药物的毒副作用。
甘露糖受体属于多凝集素受体,可通过胞外区识别和结合以甘露糖、岩藻糖和N-乙酰氨基葡萄糖为末端的糖类分子。近年来,已经证明将甘露糖分子修饰到药物载体表面能够识别癌细胞表面过度表达的甘露糖受体从而实现靶向药物输送[15, 16],但以甘露糖修饰聚合物胶束实现癌细胞的靶向药物输送同时降低抗癌药物对正常细胞毒副作用的研究尚未见报道。本文以合成的共价键连D-甘露糖的双亲性聚合物分子 (PGMA-Mannose) 为药物载体,包载抗癌药物阿霉素制备具有甘露糖受体靶向性的载药聚合物胶束,考察其理化性质和体外药物释放性能。以甘露糖受体表达丰富的人乳腺癌细胞MDA-MB-231和甘露糖受体低表达的人肾上皮细胞HEK293为细胞模型,研究载药胶束通过甘露糖受体识别作用被MDA-MB-231癌细胞摄取的靶向药物输送性能。
1 材料与方法 1.1 主要试剂和仪器 甲基丙烯酸缩水甘油酯 (GMA,97%)、磷钨酸水合物、2,2’-联吡啶 (Bpy,99%)、芘 (98%)、(+)-L-抗坏血酸钠 (99%)、五水硫酸铜 (98%)、2-溴丙酸甲酯 (MBrP,99%) 购自百灵威科技有限公司;D-甘露糖 (D-Mannose,分析纯) 购自国药集团化学试剂有限公司,溴化亚铜 (CuBr,99%) 购自阿拉丁试剂公司;盐酸阿霉素 (DOX·HCl,99%) 购自北京华奉联博科技有限公司;其他化学试剂均为分析纯。
核磁共振氢谱 (1HNMR) 由德国Bruker公司AVANCE 400M型核磁共振仪测定;聚合物相对分子量及分子量分布的表征用美国Waters公司生产的Waters1515凝胶渗透色谱 (GPC) 系统进行,色谱纯四氢呋喃 (THF) 为流动相;傅立叶变换红外光谱采用美国Nicolet公司Nexus 470红外光谱仪测定;纳米粒径尺寸分布由英国Malvern公司Nano ZS动态光散射仪 (DLS) 测定,每个样品平衡时间为1 min,测试3次,实验数据通过软件Dispersion Technology Software version 6.20处理;临界胶束浓度 (CMC) 采用芘荧光法测定,所用荧光光谱仪为日本日立公司F-7 000。胶束形貌由日本电子株式会社JEM-2 100透射电子显微镜 (TEM) 测定,应用磷钨酸负染法进行观察,加速电压 200 kV;载药胶束的细胞摄取通过尼康激光共聚焦显微镜 (CLSM) 拍摄。
1.2 炔丙基-α-D-吡喃甘露糖的合成 炔丙基-α-D-吡喃甘露糖的合成方法参照文献[17]。
1.3 PGMA-Mannose的合成 准确称取1.5 g的GMA,用2.5 mL 二甲基亚砜 (DMSO) 溶解在50 mL烧瓶中。在氩气保护条件下,先后加入64.4 mg CuBr和189.7 mg Bpy。最后用微量进样器加入81 μL MBrP引发剂,密封氩气保护,40 ℃反应2 h。用10 mL THF终止反应。通过中性氧化铝柱除去铜配体,将滤液浓缩后,在甲醇中沉淀,干燥所得沉淀物为聚甲基丙烯酸缩水甘油酯 (PGMA)。
将100.0 mg的PGMA,68.5 mg叠氮钠,56.0 mg氯化铵和7 mL N,N’-二甲基甲酰胺 (DMF) 加入50 mL烧瓶中,密封,50 ℃油浴反应12 h,过滤除去固体杂质,将滤液浓缩后,在水中沉淀,干燥沉淀物得到叠氮基取代的PGMA (PGMA-N3)。
将60.0 mg PGMA-N3溶于15 mL DMF中,加到50 mL烧瓶中,通氩气15 min去除体系内氧气。另将125.2 mg炔丙基-α-D-吡喃甘露糖和90.5 mg硫酸铜溶于5 mL蒸馏水中,在氩气保护条件下,加入248.1 mg抗坏血酸钠。将上面DMF和水溶液混合,密封,在油浴60 ℃反应24 h,过滤除去不溶物后透析 (MW2 000),冷冻干燥透析袋内溶液得到PGMA-Mannose。
1.4 负载抗癌药物阿霉素 采用透析法制备载药聚合物胶束。将10.0 mg PGMA-Mannose溶于2 mL DMSO中,静置过夜后经0.45 μm有机膜过滤备用。取50.0 mg盐酸阿霉素溶于10 mL水中,按摩尔比1∶3加入三乙胺,避光室温搅拌4 h,用20 mL二氯甲烷萃取3次,合并有机相,旋转蒸发除去溶剂得脱盐后的DOX。取一定量PGMA-Mannose的DMSO溶液及脱盐后的DOX,两者混合后,在剧烈搅拌条件下以一定速度滴加10 mmol/L磷酸盐缓冲液 (PBS,pH 7.4) 2 mL。随后将其移至透析袋中,在同样的PBS体系中透析1 d,浓缩后得到载药胶束溶液 (DOX@PGMA- Mannose)。
1.5 细胞培养 将人乳腺癌细胞MDA-MB-231和人肾上皮细胞HEK293用于载药胶束的细胞评价。在含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM培养液中,置于37 ℃、5% CO2的培养箱中培养,隔天换新鲜培养液,待长至汇合后,用0.25%胰酶消化,含血清的培养液终止消化,并制备细胞悬液[18]。
1.6 载药胶束的细胞内吞 选取对数期生长的两种细胞分别接种于细胞培养皿内,置培养箱孵育24 h使其贴壁。加入含有DOX@PGMA-Mannose (40 μg/mL) 的培养液继续培养一定的时间。弃去培养液,用pH 7.4的磷酸盐缓冲液 (PBS) 清洗2次。将细胞用4.0%甲醛在室温下固定15 min。PBS清洗2次后,用4′,6-二脒基-2-苯基吲哚 (DAPI,1 μg/mL) 染[19]细胞核15 min。用激光共聚焦显微镜观察载药胶束在细胞内部的分布状态,激发波长为405/561,发射波长为417−477/570−1 000。
1.7 细胞毒性评价 采用MTT法考察载药胶束的细胞毒性[20]。将MDA-MB-231或HEK293的细胞悬液种植于96孔板中,每孔10 000个细胞。在培养箱中培养24 h后,用pH 7.4的PBS清洗2次,加入含载药胶束DOX@PGMA-Mannose或原药DOX的培养基,使体系中所含的DOX的质量浓度为2 μg/mL。培养一定的时间后,用pH 7.4的PBS清洗2次,每孔加入100 μL MTT溶液 (1 mg/mL) 继续培养4 h。弃去孔内培养液,每孔加入100 μL DMSO,振荡10 min,应用酶标仪在490 nm处测量各孔的吸光值 (OD),计算细胞存活率。
2 结果与分析 2.1 PGMA-Mannose的合成 PGMA-Mannose的合成路线如图1所示。首先以MBrP作为原子转移自由基聚合引发剂,引发单体GMA聚合制得PGMA[21]。聚合物PGMA的平均分子量可根据1HNMR (图2A) 中聚合物的重复单元和引发剂上氢原子的积分面积估算得到Mn (1HNMR)=6 030。而通过GPC测定的聚合物相对分子量为9 175,分子量分散系数为1.37。接下来,PGMA中环氧基很容易经过叠氮钠开环反应得到PGMA-N3。最后PGMA-N3与炔丙基-α-D-吡喃甘露糖能通过“click”反应形成三氮唑环,从而制得PGMA-Mannose。图2B为PGMA-Mannose的1HNMR,在δ=8.1 ppm处出现的特征峰为PGMA-N3与炔丙基-α-D-吡喃甘露糖进行“click”反应之后所形成三氮唑环上氢原子的特征化学位移值,同时在δ为3.5−4.0 ppm之间出现甘露糖骨架上氢原子的化学位移峰。
 |
| 图1 PGMA-Mannose的合成路线图 Fig.1 Synthesis route of the PGMA-Mannose. |
| 图选项 |
 |
| 图2 聚合物的核磁共振氢谱图 Fig.2 1HNMR spectra of the polymers. (A) PGMA. (B) PGMA-Mannose. |
| 图选项 |
2.2 合成聚合物的FT-IR分析 图3A为PGMA的红外光谱,其在1 720 cm-1处有较强的C=O伸缩振动峰。PGMA中环氧基在经过叠氮钠开环反应后,在2 106 cm-1处出现了明显的叠氮基团伸缩振动峰,证明了PGMA-N3的形成 (图3B)。然后PGMA-N3 在经过“click”反应后,2 106 cm-1处峰消失,同时在1 637 cm-1处出现了三氮唑环的特征吸收 峰[22],另外3 500 cm-1处羟基的伸缩振动峰增强,所有上面实验结果证明了“click”反应的发生和PGMA-Mannose的成功合成 (图3C)。
 |
| 图3 聚合物的红外光谱图 Fig.3 FT-IR spectra of the polymers. (A) PGMA. (B) PGMA-N3. (C) PGMA-Mannose. |
| 图选项 |
2.3 PGMA-Mannose的临界胶束浓度 (CMC) 测定 采用芘荧光探针法测定所合成聚合物PGMA-Mannose在水溶液中的临界胶束浓度,设定激发波长334 nm,以373 nm和384 nm处荧光强度之比对PGMA-Mannose的浓度作 图[23],结果见图4。在PGMA-Mannose浓度很低时,溶液中不存在胶束,芘处于极性环境中,而随着PGMA-Mannose浓度的增加,一直至超过临界胶束浓度,芘通过增溶作用开始进入非极性环境中,其I373/I384的比值发生变化,通过测定I373/I384值与PGMA-Mannose浓度的对应变化可以得出CMC的值,其值为3.2×10-3 mmol/L。
 |
| 图4 PGMA-Mannose浓度对I373/I384比值的影响 Fig.4 The relationship of fluorescence intensity of I373/I384 and the concentration of PGMA-Mannose. |
| 图选项 |
2.4 聚合物胶束在载药前后的TEM与DLS表征 通过TEM磷钨酸负染法观察胶束的形貌以及DLS测定胶束的流体力学直径,结果见图5。图5A显示胶束分布均匀且呈球形。空白胶束在负载DOX后平均粒径增大 (图5B)。取胶束适量,加蒸馏水稀释后用激光粒径分析仪测定胶束在载药前后的流体力学直径变化。结果显示胶束在负载药物后平均流体力学直径从67.2 nm增大到213.4 nm。此外,载药胶束在水溶液中的粒度分布较窄 (PDI=0.281) (图5C和5D)。
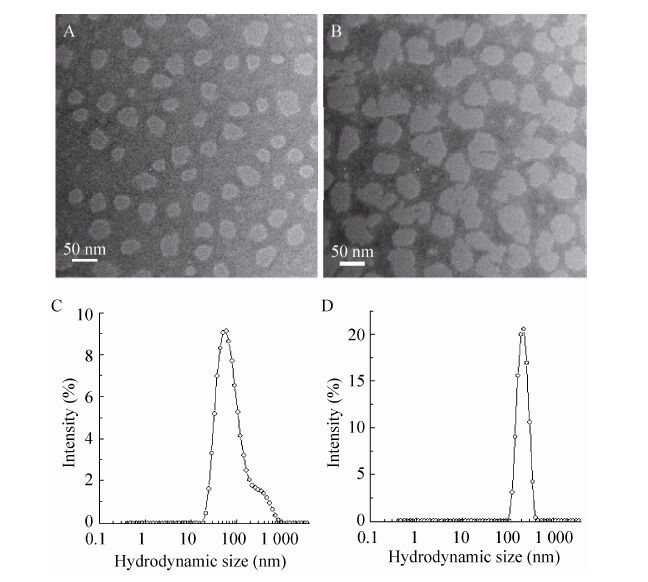 |
| 图5 空白胶束和载药胶束的透射电镜照片及在水溶液中的流体力学直径分布图 Fig.5 TEM images and hydrodynamic size distributions of the micelles. (A) PGMA-Mannose (TEM). (B) DOX@PGMA-Mannose (TEM). (C) PGMA-Mannose (DLS). (D) DOX@PGMA-Mannose (DLS). |
| 图选项 |
2.5 药物释放 精确称取1 mg原药置10 mL容量瓶中,用蒸馏水溶解并定容,配成1 mg/mL的储备液。再用蒸馏水稀释成0.02、0.04、0.06、0.08、0.10 mg/mL的系列浓度溶液。采用荧光分光光度法测定,激发波长478 nm,扫描范围550−610 nm。以荧光强度 (I) 与浓度 (c) 作图,得标准曲线方程I = 75 249c + 74.95,R2 = 0.991。表明药物浓度在0.02−0.10 mg/mL范围内与荧光强度线性关系良好。冻干后的载药胶束,加入1 mL DMF破坏胶束后,根据上面方法测定,即可得到载入胶束疏水核心内的药物浓度,再根据聚合物质量和投药量计算得胶束的载药量为4.8%,包封率为20.6%。载药量和包封率的计算公式分别为:载药量=W1/W0×100%;包封率= W1/W2×100%。其中W0是载药胶束的总质量;W1是实际包载进入胶束的药物质量;W2是投入药物的总质量。
取载药胶束1 mL,转移至透析袋中。分别将透析袋置于pH 7.4、pH 5.0及pH 3.5的缓冲液 25 mL中,37 ℃、72 r/min下振荡。分别于一定的时间取释放介质1 mL (同时补加同温等量相应的新鲜介质),计算累积药物释放率。释放实验的整个操作过程严格避光,平行实验3次,结果见图6,可见在pH 7.4介质中药物释放平缓,48 h累积释放率接近19.2%;在pH 5.0介质中药物释放较快,48 h累积释放率可达52.0%;当介质的pH值降至3.5时,药物快速释放,8 h时累积释放率接近50%,48 h累积释放率达到89.6%。
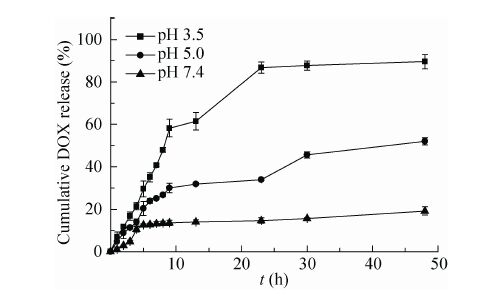 |
| 图6 在37 ℃不同pH条件下载药胶束的药物释放曲线 Fig.6 Drug release curves of the DOX-loading micelles at 37 ℃ under different pH conditions (n=3). |
| 图选项 |
为了考察载药聚合物胶束具有pH敏感药物释放特性的原因,我们测试了空白胶束在不同pH值溶液中的流体力学直径和表面电荷。结果发现,在溶液pH 7.4时,胶束的平均流体力学直径为66.2 nm,而在pH 3.5时胶束的平均直径增大到78.4 nm。此外,随着溶液pH值的降低,胶束zeta电位从-21.8 mV升高至-5.1 mV。这可能是因为在酸性pH值条件下,聚合物胶束结构中的三氮唑环被质子化,胶束内部静电排斥力增大,从而导致胶束流体力学直径的增大。胶束膨胀会促进包载药物扩散速率的增加,导致药物的快速释放。
2.6 甘露糖受体调节的细胞内吞 利用激光共聚焦显微镜对载药胶束的甘露糖受体介导细胞内吞作用进行研究,其结果见图7和图8。载药胶束DOX@PGMA-Mannose分别与两种细胞共培养,一种细胞选择细胞表面甘露糖受体过度表达的MDA-MB-231癌细胞,另一种选择细胞表面甘露糖受体低表达的HEK293正常细胞。细胞核经过DAPI染色呈蓝色,而由于DOX具有红色荧光,所以载药胶束呈红色。由图7可知,载药胶束与细胞培养1 h后,与HEK293细胞相比,在MDA-MB-231癌细胞内出现明显的DOX红色荧光。而载药胶束与细胞培养10 h之后,从蓝色与红色荧光的叠加图中可以看出在MDA-MB-231癌细胞内,大量DOX已经释放并进入细胞核中。对于甘露糖受体低表达的HEK293细胞,由于载药胶束被细胞摄取的量少,导致在细胞内的药物释放量较低,结果见图8。这些实验结果证明了载药胶束能特异性识别MDA-MB-231癌细胞表面的甘露糖受体,被癌细胞大量摄取内吞进入细胞并释放药物,载药胶束在HEK293正常细胞中则只有少量摄取。
 |
| 图7 载药胶束 (40 μg/mL) 分别与MDA-MB-231细胞和HEK293细胞培养1 h的激光共聚焦显微镜照片 Fig.7 CLSM images of the cells incubated for 1 h with DOX@PGMA-Mannose (40 μg/mL) as indicated. (A) MDA-MB-231 cancer cells. (B) HEK293 normal cells. |
| 图选项 |
 |
| 图8 载药胶束 (40 μg/mL) 分别与MDA-MB-231细胞和HEK293细胞培养10 h的激光共聚焦显微镜照片 Fig.8 CLSM images of the cells incubated for 10 h with DOX@PGMA-Mannose (40 μg/mL) as indicated. (A) MDA-MB-231 cancer cells. (B) HEK293 normal cells. |
| 图选项 |
2.7 空白胶束和载药胶束的细胞毒性评价 实验采用MTT法考察空白胶束对细胞的毒性。从图9可见,随空白胶束浓度的增加,HEK293和MDA-MB-231的细胞存活率略有降低。但当胶束的浓度达到500 μg/mL时,两种细胞的存活率仍大于92%,表明空白胶束对正常细胞和癌细胞都无毒性,具有较好的生物相容性。
 |
| 图9 不同浓度的空白胶束分别与两种细胞培养 72 h的细胞存活率 Fig.9 Viability of HEK293 cells and MDA-MB-231 cells incubated with PGMA-Mannose at different concentrations for 72 h. Data represent x±s (n=6). |
| 图选项 |
评价载药聚合物胶束DOX@PGMA- Mannose对癌细胞和正常细胞的毒性,实验结果见图10。由图10A可知,将甘露糖受体过度表达的癌细胞MDA-MB-231分别与相同药物剂量的原药DOX或DOX@PGMA-Mannose共同孵育后,DOX@PGMA-Mannose对癌细胞的毒性大于DOX。这是由于DOX@PGMA-Mannose能通过甘露糖受体介导的内吞作用更易将药物输送进癌细胞内,因此导致载药胶束对癌细胞的毒性比DOX显著提高。而由图10B可知,由于正常细胞HEK293的表面甘露糖受体低表达,DOX@PGMA-Mannose不能通过受体识别的内吞摄取进入HEK293细胞,这样导致DOX@PGMA-Mannose被HEK293细胞摄取的量降低。因此,对于正常细胞HEK293,DOX@ PGMA-Mannose比原药DOX的毒性低。这种载药胶束对癌细胞的选择性抑制作用将有助于提高负载药物的治疗效率,降低其毒副作用。
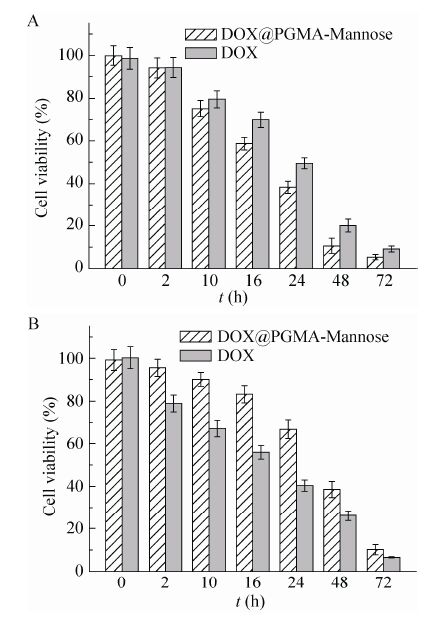 |
| 图10 载药胶束 (40 μg/mL) 和原药分别与两种细胞培养不同时间的细胞存活率 Fig.10 Viability of the cells incubated with DOX@PGMA-Mannose or free DOX at same DOX doses. Data represent x±s (n=6). (A) MDA-MB-231 cancer cells. (B) HEK293 normal cells. |
| 图选项 |
3 讨论 药物输送载体材料在经过合理的设计和构建后能够有效地携带抗癌药物到达肿瘤部位,减少药物在正常组织的分布,降低抗癌药的毒副作用,同时大幅提高药物的生物利用度。因此,抗癌药物靶向输送载体的研究和应用一直是癌症治疗研究领域中备受关注的热点。本研究合成了甘露糖修饰的PGMA,由于PGMA不溶于水,而甘露糖具有亲水性,因此聚合物主链形成疏水核心,而支链甘露糖自由伸展进入水相形成胶束。以阿霉素DOX作为疏水药物,用水包油法制备了载药聚合物胶束DOX@PGMA-Mannose,研究了药物的包埋和释放,考察了DOX@PGMA-Mannose用于抑制癌细胞的药效。结果显示,DOX@PGMA-Mannose能通过甘露糖受体识别的方式被癌细胞MDA-MB-231内吞,并在细胞内释放药物。与原药DOX相比,DOX@PGMA-Mannose对癌细胞的毒性显著提高,而对正常细胞的毒性较低。因此,PGMA-Mannose有望成为一种新型的靶向药物输送载体材料应用于癌症治疗。
参考文献
| [1] | Rosi NL, Mirkin CA. Nanostructures in biodiagnostics. Chem Rev, 2005, 105(4): 1547-1562. |
| [2] | Peer D, Karp JM, Hong S, et al. Nanocarriers as an emerging platform for cancer therapy. Nat Nanotechnol, 2007, 2(12): 751-760. |
| [3] | Danhier F, Feron O, Préat V. To exploit the tumor microenvironment: passive and active tumor targeting of nanocarriers for anti-cancer drug delivery. J Controlled Release, 2010, 148(2): 135-146. |
| [4] | Al-Jamal WT, Kostarelos K. Liposomes: from a clinically established drug delivery system to a nanoparticle platform for theranostic nanomedicine. Acc Chem Res, 2011, 44(10): 1094-1104. |
| [5] | Doshi N, Mitragotri S. Designer biomaterials for nanomedicine. Adv Funct Mater, 2009, 19(24): 3843-3854. |
| [6] | Liu ZJ, Yao P. Versatile injectable supramolecular hydrogels containing drug loaded micelles for delivery of various drugs. Polym Chem, 2014, 5(3): 1072-1081. |
| [7] | Gillies ER, Fréchet JMJ. Dendrimers and dendritic polymers in drug delivery. Drug Discovery Today, 2005, 10(1): 35-43. |
| [8] | Zhang Q, Liu F, Nguyen KT, et al. Multifunctional mesoporous silica nanoparticles for cancer-targeted and controlled drug delivery. Adv Funct Mater, 2012, 22(24): 5144-5156. |
| [9] | Zhang Q, Wang X, Li PZ, et al. Biocompatible, uniform, and redispersible mesoporous silica nanoparticles for cancer-targeted drug delivery in vivo. Adv Funct Mater, 2014, 24(17): 2450-2461. |
| [10] | Su L, Wang CM, Polzer F, et al. Glyco-inside micelles and vesicles directed by protection- deprotection chemistry. ACS Macro Lett, 2014, 3(5): 534-539. |
| [11] | Liu TJ, Liu S, Sheng SH, et al. EPR effect of amphiphilic copolymer micelles observed by fluorescent imaging. Chem Res Chin Univ, 2011, 27(4): 628-634. |
| [12] | Noh TH, Kook YH, Park CY, et al. Block copolymer micelles conjugated with anti-EGFR antibody for targeted delivery of anticancer drug. J Polym Sci, Part A: Polym Chem, 2008, 46(22): 7321-7331. |
| [13] | Danhier F, LeBreton A, Preat V. RGD-based strategies to target alpha(v) beta(3) integrin in cancer therapy and diagnosis. Mol Pharmaceutics, 2012, 9(11): 2961-2973. |
| [14] | Prabaharan M, Grailer JJ, Pila S, et al. Folate-conjugated amphiphilic hyperbranched block copolymers based on Boltorn® H40, poly(l-lactide) and poly(ethylene glycol) for tumor-targeted drug delivery. Biomaterials, 2009, 30(16): 3009-3019. |
| [15] | Brevet D, Gary-Bobo M, Raehm L, et al. Mannose-targeted mesoposous silica nanoparticles for photodynamic therapy. Chem Commun, 2009, 1(12): 1475-1477. |
| [16] | Gary-Bobo M, Mir Y, Rouxel C, et al. Mannose-functionalized mesoporous silica nanoparticles for efficient two-photon photodynamic therapy of solid tumors. Angew Chem Int Ed, 2011, 50(48): 11425-11429. |
| [17] | Zhao JS, Liu YF, Park HJ, et al. Carbohydrate-coated fluorescent silica nanoparticles as probes for the galactose/3-sulfogalactose carbohydrate-carbohydrate interaction using model systems and cellular binding studies. Bioconjugate Chem, 2012, 23(6): 1166-1173. |
| [18] | Wang Z, Luo J, Wang W, et al. Characterization and culture of isolated primary dairy goat mammary gland epithelial cells. Chin J Biotech, 2010, 26(8): 1123?1127 (in Chinese). 王桢, 罗军, 王伟, 等. 奶山羊乳腺上皮细胞的分离、培养及鉴定. 生物工程学报, 2010, 26(8): 1123?1127. |
| [19] | Zhang Q, Luan L, Feng S, et al. Using a bifunctional polymer for the functionalization of Fe3O4 nanoparticles. React Funct Polym, 2012, 72(3): 198-205. |
| [20] | Kong LJ, Ao Q, Xi J, et al. Proliferation and differentiation of MC 3T3-E1 cells cultured on nanohydroxyapatite/chitosan composite scaffolds. Chin J Biotech, 2007, 23(2): 262-267 (in Chinese). 孔丽君, 敖强, 奚静, 等. MC 3T3-E1细胞在纳米羟基磷灰石/壳聚糖复合支架上的增殖和分化. 生物工程学报, 2007, 23(2): 262-267. |
| [21] | Li RQ, Niu YL, Zhao NN, et al. Series of new β-cyclodextrin-cored star like carriers for gene delivery. ACS Appl Mater Interfaces, 2014, 6(6): 3969-3978. |
| [22] | Clavel C, Romuald C, Brabet E, et al. A pH-sensitive lasso-based rotaxane molecular switch. Chem Eur J, 2013, 19(9): 2982-2989. |
| [23] | Meng QB, Kou YY, Ma X, et al. Tunable self-assembled peptide amphiphile nanostructures. Langmuir, 2012, 28(11): 5017-5022. |
