孙成成1,2,3, 王媛1,4, 李俊德1,2,3, 陈卫卫1,2,3, 闵军1,2, 胡晓珂1,2,3


1. 中国科学院烟台海岸带研究所, 海岸带生物学与生物资源利用重点实验室, 山东 烟台 264003;
2. 青岛海洋科学与技术试点国家实验室, 海洋生物学与生物技术功能实验室, 山东 青岛 266237;
3. 中国科学院大学, 北京 100049;
4. 烟台大学海洋学院, 山东 烟台 264003
收稿日期:2021-01-23;修回日期:2021-03-18;网络出版日期:2021-04-07
基金项目:国家自然科学基金(32070112, 32070102, 92051119, 42077305);国家重点研发计划(2020YFD0901003);河北省重点研发计划(19273802D)
*通信作者:胡晓珂, Tel: +86-535-2109127;E-mail: xkhu@yic.ac.cn.
摘要:DDTs(dichlorodiphenyltrichloroethane,1,1,1-三氯-2,2-双氯苯基乙烷)是一种典型的持久性有机污染物,曾在疟疾防治和农业除虫方面被广泛应用。虽然包括我国在内的很多国家已经禁止使用DDTs,但目前对环境中DDTs的检测发现它仍然广泛存在且具有新的输入源。DDTs的持续存在对近海生态系统和人类健康具有一定危害,因此它所造成的环境污染问题仍然值得关注。由于Rieske型芳香羟化双加氧酶能够起始多种持久性污染物的降解,过去的几十年里一直是芳香化合物降解领域的焦点。[目的] 为探讨联苯双加氧酶对DDTs的降解特性及机制,本研究选取了食异生素伯克霍尔德氏菌LB400(Burkholderia xenovorans)联苯双加氧酶及突变体对p,p'-DDT和o,p'-DDT的降解过程进行研究。[方法] 以BphAELB400为亲本,通过两步定点突变将283位的丝氨酸突变为蛋氨酸,获得突变体BphAES283M。通过比较亲本酶与突变体对DDTs的催化性能,模拟突变蛋白结构和分子对接等方法,探究其降解特性及机制。[结果] BphAELB400和突变体BphAES283M都无法降解对位的p,p'-DDT,但突变体BphAES283M可以代谢o,p'-DDT并产生2个立体异构体。对接p,p'-DDT的BphAELB400和BphAES283M的结构分析表明,BphAELB400和BphAES283M中p,p'-DDT的反应环均不与原晶体结构中的联苯反应环重合。而对接o,p'-DDT的BphAES283M的结构分析表明o,p'-DDT的反应环与晶体结构中的联苯反应环距离很近,且2、3位的碳原子与单核铁原子催化中心的距离在0.5 nm以内,此外,BphAES283M的催化腔表面积和体积比BphAELB400更大,这很可能有助于BphAES283M与o,p'-DDT的结合。[结论] 283位氨基酸是影响BphAELB400对DDTs的催化代谢能力的关键氨基酸残基,它可以通过调节反应碳原子与催化中心的距离以及催化腔的大小来影响底物特异性。本次研究进一步阐明了283位氨基酸残基的影响机理,为更有效修复DDTs污染提供理论依据和技术支持。
关键词:DDTs联苯双加氧酶Burkholderia xenovorans LB400底物特异性
The degradation of DDTs by Burkholderia xenovorans LB400 biphenyl dioxygenase and mutants
Chengcheng Sun1,2,3, Yuan Wang1,4, Junde Li1,2,3, Weiwei Chen1,2,3, Jun Min1,2, Xiaoke Hu1,2,3


1. Key Laboratory of Coastal Biology and Bio-resource Utilization, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, Shandong Province, China;
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, Shandong Province, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Ocean School, Yantai University, Yantai 264003, Shandong Province, China
Received: 23 January 2021; Revised: 18 March 2021; Published online: 7 April 2021
*Corresponding author: Xiaoke Hu, Tel: +86-535-2109127; E-mail: xkhu@yic.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (32070112, 32070102, 92051119, 42077305), by the National Key Research and Development Program (2020YFD0901003) and by the Key Research and Development Program of Hebei Province (19273802D)
Abstract: Dicholodiphenyltrichloroethanes (DDTs) is probably the best known and typical persistent organic pollutant in the world, which has been widely used in malaria control and agricultural deworming. They are still detected in various environmental matrices and has new input sources although their usage in agriculture has been banned in China and others. Numerous concerns have arisen over the past decades about the adverse environmental impacts(including harm to offshore ecosystem and human health) of DDTs. There has been a considerable interest over the last decades for the Rieske-type arylhydroxylating dioxygenases (RHDs) as they are seen as potentially capable of initiating their degradation. [Objective] In order to explore the degradation characteristics and mechanism of biphenyl dioxygenase(BPDO) on DDTs, we selected Burkholderia xenovorans LB400 biphenyl dioxygenase and its mutants to explore the degradation process of p, p'-DDT and o, p'-DDT. [Methods] Using BphAELB400 as parent, the mutant BphAES283M was obtained by two-step site-directed mutagenesis from Ser to Met. The degradation characteristics and mechanism of wild type and mutant were explored by comparing the catalytic performance of wild type and mutant to DDTs, simulating the structure of mutant protein and molecular docking. [Results] The data showed that BphAELB400 and BphAES283Mcould not be degraded p, p'-DDT, but BphAES283M metabolized o, p'-DDT and produced two stereoisomers. The structural analysis of BphAELB400 and BphAES283M showed that the reaction ring of p, p'-DDT did not coincide with the biphenyl reaction ring in the original crystal structure. In the o, p'-DDT-BphAES283M conformation, the proximal ring did not fit the biphenyl reactive ring as well, but its orientation toward the catalytic Fe2+ places two vicinal atoms at a distance(within 0.5 nm) that would allow a catalytic reaction. In addition, the surface area and volume of the catalytic cavity of BphAES283M is larger than that of BphAELB400, which is likely to contribute to the combination of BphAES283M and o, p'-DDT. [Conclusion] 283 is the key amino acid residue that affects the catalytic metabolism of BPDO to DDTs. It can affect the substrate specificity by adjusting the distance between the reaction carbon atom and the catalytic center and the size of the catalytic cavity. This will provide better insights about the bases for BPDO broad substrate range and about the mechanisms by which the enzyme evolves to change or expand its substrate range and its stereo- and regiospecificity.
Keywords: DDTsBPDOBurkholderia xenovorans LB400substrate specificity
DDTs (dichlorodiphenyltrichloroethane,1, 1, 1-三氯-2, 2-双氯苯基乙烷)是世界上最常见和最有效的有机氯杀虫剂之一,自1945年以来一直用于农业抗虫,后期也用于疟疾等病媒传播疾病的控制[1]。2001年,DDTs成为斯德哥尔摩公约首批公布的12种持久性有机污染物之一,继而被大多数国家禁止使用。然而,世界卫生组织在2006年允许在一些热带国家重新引入DDTs,以控制虫媒传播的疾病[2]。由于其特殊的物理化学性质,特别是长达30年的半衰期使得DDTs仍对近海生态系统和人类健康具有潜在威胁[3-5]。尽管DDTs自1983年起在中国被禁止用作农业化学品,但在各种环境介质中都监测到了高浓度的DDTs。Chen等2014年对黄海北部沿岸的环境调查中发现部分软体动物体内DDTs含量超过食用标准(200 ng/gd·w) 2倍[6]。其他几项研究也证明了沉积物或动物组织中的DDTs残留量很高,并且国内DDTs具有新的输入源[7-10]。因此,DDTs所造成的环境污染问题仍然值得关注。
DDTs作为工业化的产物,在自然界中缺乏有效的酶降解系统。在过去的几十年里,Rieske型芳香羟化双加氧酶(RHDs,rieske-type aryl hydroxylating dioxygenases)是芳香化合物降解领域的焦点。Rieske型芳香羟化双加氧酶包括联苯双加氧酶(BPDO,biphenyl dioxygenase)、萘双加氧酶(NDO,naphthalene dioxygenase)等,这些酶是多种持久性有机污染物好氧降解途径的起始降解酶。Nadeau等通过产碱杆菌A5好氧降解DDTs阐明了其好氧降解途径,在A5联苯双加氧酶催化下,在DDTs邻位加入两个氧原子生成2, 3-二氢二醇-DDT (图 1),后者进一步降解为4-氯苯甲酸[11]。在Kamanavalli和Ninekar的一项研究中,发现假单胞菌可以在添加了0.05% (W/V) DDTs的联苯中生长。该菌将DDTs降解生成2, 3-二羟基DDT,再通过间位裂解途径生成4-氯苯甲酸[12]。众多研究表明,DDTs与多氯联苯好氧降解的中心途径基本相同,可以通过联苯双加氧酶起始降解[11-14]。
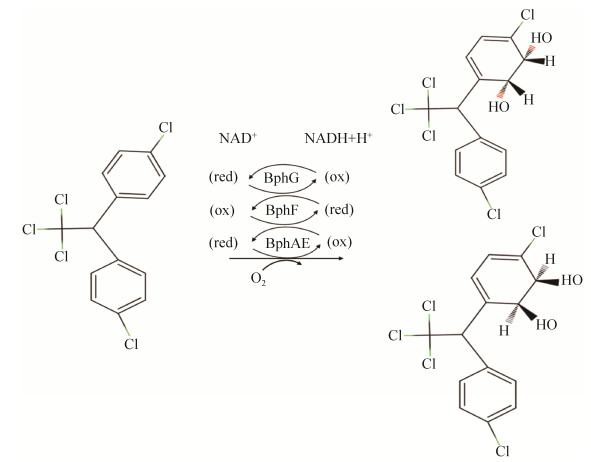 |
| 图 1 联苯双加氧酶催化DDTs的氧化图 Figure 1 The oxidation of DDTs catalyzed by biphenyl dioxygenase. |
| 图选项 |
Burkholderia xenovorans LB400联苯双加氧酶(图 2)是底物范围最广的RHD之一。它是由末端氧化酶(BphAE)、铁氧还蛋白(BphF,Mr=12000)和铁氧还蛋白还原酶(BphG,Mr=43000)组成的多组分酶[15-16]。其中,末端氧化酶BphAE 与底物直接相互作用,催化底物的氧化反应。Pandoraea pnomenusa B356与Burkholderia xenovorans LB400联苯双加氧酶都是底物范围较广的降解酶,本实验室初步实验结果显示BphAEB356在DDTs降解方面比BphAELB400更加优异。这两种联苯双加氧酶在DDTs降解过程中所表现出的差异可能与末端氧化酶的α亚基有关。之前的许多研究表明,底物范围和区域特异性主要由位于末端氧化酶α亚基C末端的残基决定,总共分为4个区域[17]。有****对Ⅲ、Ⅳ区域氨基酸的功能进行了研究,但目前对Ⅰ、Ⅱ区域氨基酸残基功能研究较少。确定影响底物分子与酶相互作用的氨基酸残基,了解其作用机理,有助于阐明联苯双加氧酶与底物有效结合的机制。因此,本研究选取了多氯联苯降解模式菌株Burkholderia xenovorans LB400的联苯双加氧酶作为研究对象,并通过晶体结构解析确定位于酶催化口袋入口处Ⅱ区域的283位氨基酸为影响BphAELB400与DDTs结合的关键氨基酸残基,将BphAELB400 283位的Ser突变为BphAEB356 283位的Met,获得了酶突变体BphAES283M。通过比较BphAELB400和BphAES283M分别以p, p'-DDT和o, p'-DDT为底物时的代谢产物、酶动力学参数、结构分析以及分子对接分析,试图探讨联苯双加氧酶对DDTs的催化机理即283位氨基酸残基的影响机理并以此提高BphAELB400的底物范围和对DDTs的催化代谢能力。同时为如何扩大其他BPDO的底物范围和提高降解率的机制研究奠定理论基础,进而为更有效修复DDTs污染提供理论依据和技术支持。
 |
| 图 2 联苯结合形式的联苯双加氧酶三维模型图 Figure 2 The model of biphenyl-bounded forms of BPDO. |
| 图选项 |
1 材料和方法 1.1 突变体构建和酶纯化 利用两步位点定向突变方案[18],以BphAELB400为亲本,构建其Ser283Met单突变的突变体。突变体构建过程中,利用上游引物a (5' GAGCCGGG CACGCTCCTGGCG 3')和突变引物b (5' GGGGTA CCCCCTAGAAGAACATGCT 3')扩增含有突变位点及其上游序列的DNA片段;利用下游引物d (5'CGGGATCCGATGAGTTCAGCAATCA3')和突变引物c (5'GGGGTACCCCCTAGAAGAA CATGCT 3')扩增含有突变位点及其下游序列的DNA片段;利用上游引物a和下游引物d对上述扩增片段进行第3次PCR,得到目标突变基因。将获得的目标突变基因片段和表达载体pET14b分别进行双酶切(Mlu I和Avr II),选取酶切成功的片段进行进一步纯化[18]。将酶切后的目标突变基因片段和pET14b进行连接,最后导入感受态Escherichia coli C41细胞进行异源表达。
为获得足量的酶,将含有表达载体的Escherichia coli C41细胞依次进行活化、扩增培养和IPTG诱导。首先,将冻存于–80 ℃的工程菌接种至100 mL含有氨苄的LB液体培养基中进行活化,然后将活化的菌液进行摇床培养(37 ℃,200 r/min)。培养12 h后,取7–8 mL菌液至500 mL新的含有氨苄的LB液体培养基中继续进行扩增培养。培养3 h后,加入1 mmol/L IPTG诱导表达16–18 h (温度为20 ℃,转速为120 r/min)。诱导结束后,在4 ℃条件下离心(8000 r/min,15 min)收集菌体。收集后的菌体使用Hepes缓冲液(pH 7.0,50 mmol/L)清洗2次。然后加入溶菌酶裂解,超声破碎获得破裂液。在11000 r/min和4 ℃条件下离心1 h,然后将上清转移至50 mL离心管中,加入镍柱,利用镍柱进行吸附(4 ℃,1 h),后离心(4 ℃,2000 r/min)收集镍柱。分别用20 mmol/L和40 mmol/L咪唑洗去镍柱中的杂质,后用300 mmol/L咪唑进行洗脱。将得到的酶液按照用量,一部分分装到PCR管中,以便后续实验使用;另一部分进行SDS-PAGE实验。
1.2 代谢产物测定 在含有500 nmol底物的50 mmol/L吗啉磺酸[MES,2-(N-Morpholino) ethanesulfonic acid hydrate]缓冲液中依次加入4.8 nmol FeSO4(NH4)2、400 nmol NADH、1.2 nmol BphG、2.4 nmol BphF以及2.4 nmol重组的His标记的BphAE,补加MES缓冲液,至总体积为1 mL。实验组中加入相应的丙酮溶解的底物,对照组加入丙酮作为对照。将实验组和对照组置于37 ℃摇床中缓慢转速孵育30 min。孵育完成后,将EP管中溶液转移至5 mL玻璃试管中。用乙酸乙酯萃取3次,然后将乙酸乙酯萃取液于氮气低温环境下挥发,氮吹至500 μL。吸取500 μL乙酸乙酯溶液转移至装有内衬管的色谱瓶中,氮气低温环境下吹干。然后向内衬管中加入250 μL丙酮和10 μL 25 mmol/L的硼酸耦合剂,室温下摇床中缓慢转速孵育1 h[19]。利用氮吹仪将内衬管吹干,加入50 μL正己烷,轻轻混匀[13]。最后,利用GC-TOF-MS和安捷伦7890A气相色谱进行代谢产物分析。
1.3 酶动力学参数测定 联苯双加氧酶由铁氧还蛋白还原酶、铁氧还蛋白和末端氧化酶三部分组成。在反应时,由NADH作为电子供体,电子依次由BphG和BphF传递到BphAE,进而结合氧气与底物发生催化反应。本研究利用液相氧电极测定联苯双加氧酶催化过程中对氧气的消耗,继而测定联苯双加氧酶的动力学参数,并参考Michel等的研究[20]建立了氧谱法来研究联苯双加氧酶对DDTs的特异性及其对O2的稳态利用。在Oxygraph反应室中模拟特定温度下酶体系的反应,通过液相氧电极测定氧化还原反应的参数。具体步骤为:组装Oxygraph仪器,并连接水浴装置,保持恒温。后向反应室中加入超纯水,建立空气线。设置转子转速为900 r/min,待信号线稳定后,吸出超纯水,向反应室中缓缓充入氮气,使信号值下降至10左右建立零氧线,保存校正结果。再按照反应体系依次加入MES、Fe2+、NADH、铁氧还原蛋白还原酶、铁氧还原蛋白和底物,观察信号变化;待信号线平稳后,记录最大耗氧速率,最终根据不同底物浓度测定的最大反应速率利用米氏方程来计算动力学参数Vmax和Km[20]。在双加氧酶的反应中,1 mol的底物与双加氧酶反应,将消耗1 mol的氧气。因此,可以通过液相氧电极监测氧气的消耗,来确定酶和底物的最大反应速率。
1.4 分子对接和结构分析 去除共结晶的配体和水后,以BphAELB400 (PDB: 2XRX)的二聚体AB为对接靶标。利用PRODRG server (http://davapc1.bioch.dundee.ac.uk/prodrg/)上的JME编辑器绘制了DDTs,并对其结构进行了优化[21-22]。在AutoDockTools中,配体被随机放置在单核铁附近的活性位置作为起始位置。配体的搜索空间以单核铁为中心,x、y、z方向均设置为1.8 nm (18 Å)[21-23]。然后用拉马克遗传算法(LGA,lamarckian genetic algo-rithm)作为搜索方法,在Autodock4.2中实现了自动对接。同时增加LGA运行的数量,以产生20个对接结果,用于进一步的结构分析。利用软件Pymol准备移除了Fe2+的BphAEs三维结构文件,利用软件Discovery Studio 2019准备底物DDTs的三维结构文件,将BphAEs的结构及底物三维结构文件导入DoGSiteScorer工具(https://proteins.plus/),计算BphAELB400和BphAES283M的催化活性空腔体积。
2 结果和分析 2.1 突变体构建和酶纯化 将载有pET14b[LB400-S283M-bphAE]的Escherichia coli C41培养富集过夜,转接后诱导表达,纯化蛋白。将纯化的蛋白按照30倍稀释,利用SDS-PAGE分析,结果如图 3。结果表明,凝胶中存在两条条带,它们分别与α亚基(BphA,Mr=51000)和β亚基(BphE,Mr=22000)相对应。另外,分别载有pET14b[LB400-S283M-bphAE]、pET14b[LB400-bphG]和pET14b[LB400-bphF]的Escherichia coli C41经多次诱导表达,蛋白表达比较稳定,这表明构建的含有bphAE、bphF、bphG的Escherichia coli C41可以为后续大量的酶学实验提供保障。同时,本次实验结果与Mahmood等用Escherichia coli C41以相同方法表达的BphAEP4、BphAERR41、BphAET335A/F336M/N338Q等突变体[24]的条带大小相似。这表明在IPTG诱导的所有表达这些突变体的大肠杆菌克隆中,BphAE的表达水平相似。
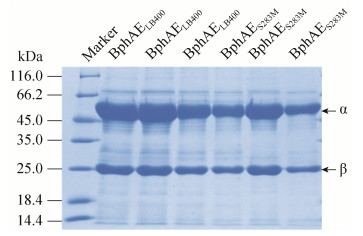 |
| 图 3 BphAELB400及其突变蛋白SDS-PAGE图 Figure 3 SDS-PAGE of BphAELB400 and BphAES283M. |
| 图选项 |
2.2 代谢产物测定与分析 本次实验中分别以p, p'-DDT和o, p'-DDT为底物,通过酶与单底物实验得到产物色谱质谱峰图如图 4所示。在BphAELB400和突变体BphAES283M对p, p'-DDT的降解产物色谱质谱峰图中,未发现二羟基产物的特征离子峰和特定保留时间的色谱峰,这与之前****的研究结果一致[24]。从分子构型来看,p, p'-DDT两个苯环间以三氯乙基连接,这意味着相较于联苯以及多氯联苯,p, p'-DDT对酶催化口袋的体积提出了更高的要求。另外,郭莉等在多氯联苯降解过程中发现对称结构的单体不利于降解[25],这说明p, p'-DDT难以被降解可能与其对称性也密切相关。对于o, p'-DDT,BphAELB400仍然无法降解,然而突变体BphAES283M可以产生2种二羟基的产物且2种产物的峰面积基本相同。这与C. oxalaticus A5对DDTs的降解明显不同,该菌株降解DDTs往往只产生一种代谢产物[26]。通过对产物质谱进行分析,发现在m/z=454处有一个分子离子峰,产物硼酸化衍生物的重要碎片离子峰在335处为M-HCCl3、299处为M-HCCl4、235处为M-HCCl3-nBuBO2、199处为M-HCCl4-nBuBO2。代谢物I的质谱特征与代谢物II非常相似,但其GC保留时间不同。通过Bruno L’Abbée等对BphAEB356降解DDTs的研究[24],可以推测代谢物I与代谢物II应互为手性对映体。
 |
| 图 4 DDTs代谢产物色谱质谱合图 Figure 4 Total ion chromatograms and mass spectra of metabolites produced from DDTs. A: Chromatogram of metabolites: BphAES283M-p, p'-DDT, BphAES283M-o, p'-DDT, BphAELB400-p, p'-DDT, BphAELB400-o, p'-DDT; B: Mass spectrum of metabolites: BphAES283M-o, p'-DDT. |
| 图选项 |
2.3 酶动力学参数测定与分析 BphAELB400及其突变蛋白对于DDTs的动力学参数通过液相氧电极对氧气的消耗来测定。BphAELB400及其突变蛋白对o, p'-DDT的动力学参数测定结果归纳总结于表 1。实验结果显示,以o, p'-DDT为底物时,亲本BphAELB400并不能测得相关参数,说明BphAELB400不能降解o, p'-DDT或反应极其微弱,这与代谢产物分析结果一致。经Ser283Met替换的突变体Km值约为4.6 μmol/L,kcat值为0.1/s,说明突变体与DDTs间的结合能力增强,同时实现了催化效率的突破;从整体kcat/Km来看,突变体约为24.3 L/(μmol·s) (表 1),这表明283位的突变增强了联苯双加氧酶对o, p'-DDT的催化代谢能力。此外,Dhindwal和Bruno L’Abbée等利用突变体BphAE II9和BphAE III52降解DDTs时,测得kcat/Km值分别约为2.2和6 L/(μmol·s)[24, 27],该值远低于24.3 L/(μmol·s)。BphAES283M较同类催化酶催化效率更高,进一步说明283位氨基酸残基是BphAELB400催化代谢DDTs的关键氨基酸残基。
表 1. BphAEs对o, p'-DDT的动力学参数分析 Table 1. Steady-state kinetic parameters of BphAE o, p'-DDT
| Substrate/Enzymes | Km/(μmol/L) | kcat/(1/s) | (kcat/Km)/(L/(μmol·s)) |
| BphAELB400 | ND | ND | ND |
| BphAES283M | 4.6±0.9 | 0.1±0.0 | 24.3±0.5 |
| BphAE III52a | 16±1a | 0.1±0.01a | 6±2a |
| BphAE II9b | – | – | 2.2±0.5b |
| ND: not determined; a: The kinetic parameters were from [24]; b: The kinetic parameters were from [27]; –: means no corresponding data. | |||
表选项
2.4 分子对接和结构分析 以BphAELB400的晶体结构为模板,通过建模软件构建BphAES283M的三级结构,结果如图 5所示。BphAE是由3个α亚基(Mr=51000)和3个β亚基(Mr=22000)组成的异源多聚体[24],同时由静电势图可知该蛋白表面有多处负电势位点。如前文所述,α亚基被认为是影响底物特异性的关键亚基。它由两个结构域组成,一个是从BphF接收电子的2Fe-2S Rieske结构域,另一个是包含单核铁原子催化中心的催化结构域。
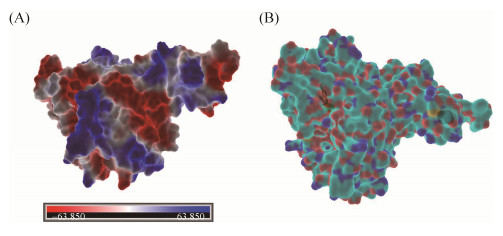 |
| 图 5 BphAES283M表面静电势图和BphAES283M-o, p'-DDT嵌合模型图 Figure 5 The electrostatic potential diagram and model diagram of BphAES283M. A: The electrostatic potential diagram of BphAES283M; B: The model of o, p'-DDT-bounded forms of BphAES283M. |
| 图选项 |
同源建模结果表明,BphAE催化口袋如图 6所示。Kumar等研究发现BphAELB400的Thr335可以通过控制与底物接触的蛋白质氨基酸残基的空间分布来限制该酶可以氧化的多氯联苯的范围;将Thr335突变为Ala解除了对Gly321的限制,使这种残基在底物与酶结合时发生偏移,从而增加了容纳较大底物如2, 6-二氯联苯的空间[18-19]。而远离催化中心的338位可以通过影响蛋白的组装调整联苯双加氧酶的底物范围[18]。本研究发现,283位于催化口袋入口处,Ser283Met的突变可能影响DDTs反应环到酶催化中心的距离,进而影响联苯双加氧酶的底物专一性。
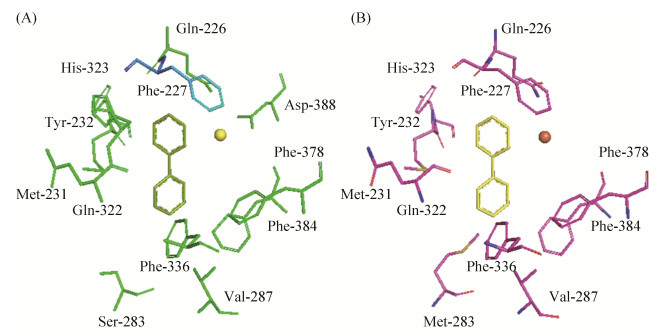 |
| 图 6 BphAE催化腔入口图 Figure 6 The catalytic chamber entrance of BphAE. A: BphAE LB400; B: BphAE S283M. |
| 图选项 |
整个联苯双加氧酶与底物反应中,电子是从NAD(P)H传至BphG,再由BphG传至BphF最后传至BphAE[15]。值得注意的是,在同一个α亚基内部,Rieske结构域和催化结构域由于距离较远而无法相互作用,因此催化反应中的电子转移是从铁氧还蛋白到联苯双加氧酶一个α亚基的Rieske结构域,然后再到邻近α亚基的催化结构域。这意味着电子通过两个α亚基的界面进行转移,同时也要求Rieske结构域的反应临界原子必须与邻近催化结构域的反应临界原子正确对准。在本次实验分子对接分析中,这就要求DDTs分子必须尽可能地与晶体中的联苯分子重合。
当把p, p'-DDT叠加到联苯结合的BphAELB400上时,在催化空腔内观察到两个构象簇,但在所有情况下,最接近催化中心Fe2+的反应环的取向与晶体结构中联苯的反应环取向明显不同。图 7-A显示了对接在BphAELB400中的DDT分子的取向。在最容易发生反应的构象中,底物分子p, p'-DDT的反应环与联苯分子反应环形成超过45°的夹角,且更加远离催化中心;而三氯乙基中的3个氯原子靠近催化中心,这使得BphAELB400不能代谢p, p'-DDT。同时也将p, p'-DDT通过对接插入到联苯结合的BphAES283M中。当它们被叠加到联苯结合的BphAES283M上时,p, p'-DDT的反应环与联苯分子的反应环也不重合,如图 7-B。
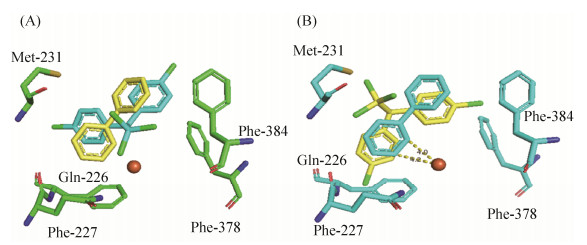 |
| 图 7 p, p'-DDT分子对接分析 Figure 7 Superposition of catalytic center residues of the p, p'-DDT-docked. A: p, p'-DDT-BphAELB400; B: p, p'-DDT-BphAES283M. |
| 图选项 |
然而,当把o, p'-DDT叠加到联苯结合的BphAES283M上时,在排名靠前的对接分子构象中的反应环也不与联苯反应环重合,但它朝向催化中心方向的反应环的两个邻近碳原子与单核铁原子催化中心的距离分别为0.44 nm (4.4 ?)和0.46 nm (4.6 ?) (图 8-B)。这满足催化反应所需的距离并且两个反应碳原子与单核铁原子催化中心的距离差也很小。而把o, p'-DDT叠加到联苯结合的BphAELB400上时,可以观察到苯环上的氯原子影响了2、3位的羟基化反应(图 8-A),这使得BphAELB400仍然无法降解o, p'-DDT。
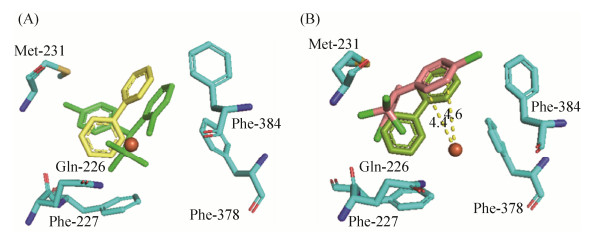 |
| 图 8 o, p'-DDT分子对接分析 Figure 8 Superposition of catalytic center residues of the o, p'-DDT-docked. A: o, p'-DDT-BphAELB400; B: o, p'-DDT-BphAES283M. |
| 图选项 |
通过DoGSiteScorer工具计算BphAELB400和BphAES283M催化活性空腔体积。BphAE催化活性空腔示意图见图 9。实验数据显示,相比于BphAELB400 (图 9-A),BphAES283M (图 9-B)的催化活性口袋体积增大。催化口袋体积的增大有助于BphAES283M结合不同分子构型或者分子构象所占空间体积较大的底物。联苯双加氧酶的催化反应十分复杂,不仅受三组分体系对电子传递的影响,还受到末端氧化酶本身结构域的分布、催化腔的大小以及亚基组装等因素的影响。因此,在探究联苯双加氧酶的催化机制时,要在结合生理生化数据的基础上,进行结构方面的综合分析。
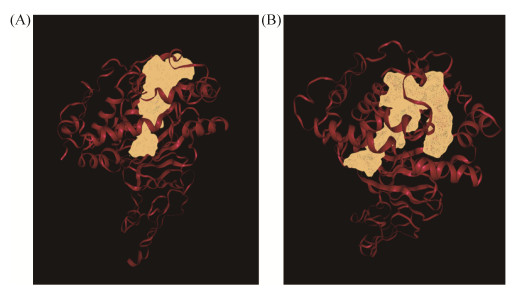 |
| 图 9 BphAEs催化活性空腔 Figure 9 The catalytic cavity of BphAEs. A: BphAELB400; B: BphAES283M. |
| 图选项 |
3 结论 通过比较野生型联苯双加氧酶与突变体对DDTs的催化性能、模拟突变蛋白结构和分子对接分析,得到的结论主要如下:(1) 对于对位的p, p'-DDT,BphAELB400和突变体BphAES283M都无法降解。然而对于o, p'-DDT的降解二者明显不同,BphAELB400仍然无法找到代谢产物;突变体BphAES283M可以产生2种二羟基的产物且2种产物的峰面积基本相同,这可以证明283位氨基酸残基是影响联苯双加氧酶降解DDTs的原因之一。(2) 通过酶动力学实验可以发现283位的突变增强了联苯双加氧酶对o, p'-DDT的催化代谢能力,突变体与o, p'-DDT间的结合能力增强,同时实现了催化效率的突破。(3)当把p, p'-DDT对接到BphAELB400和BphAES283M上时,BphAELB400和BphAES283M中p, p'-DDT的反应环均不与原晶体结构中的联苯反应环重合。而对接o, p'-DDT的BphAES283M的结构分析表明o, p'-DDT的反应环与晶体结构中的联苯反应环距离很近且2、3位的碳原子与单核铁原子催化中心的距离在0.5 nm(5 ?)以内。同时,相比于BphAELB400,BphAES283M的催化活性空腔体积增大,这很可能有助于BphAES283M与o, p'-DDT的有效结合。
目前,有关联苯双加氧酶降解DDTs的研究较少,但由于DDTs与多氯联苯等芳香化合物结构类似,联苯双加氧酶也是DDTs降解酶系的重要补充。本研究首次揭示了末端氧化酶(BphAE)Ⅱ区域氨基酸残基的突变对BPDO催化降解DDTs的影响及可能的机制,确定了283位氨基酸残基是影响联苯双加氧酶对DDTs降解的关键氨基酸残基。这为增强其他Rieske型芳香羟化双加氧酶对DDTs的降解能力提供了借鉴,为更有效修复DDTs污染提供了理论依据和技术支持。对于与BphAELB400结构特征相似的DDTs降解酶以及联苯双加氧酶,结合晶体结构解析将其Ⅱ区域关键氨基酸残基如283位点进行定点突变或将是进一步增强其DDTs催化活性的有效策略。
References
| [1] | Mansouri A, Cregut M, Abbes C, Durand MJ, Landoulsi A, Thouand G. The environmental issues of DDT pollution and bioremediation: a multidisciplinary review. Applied Biochemistry and Biotechnology, 2017, 181(1): 309-339. DOI:10.1007/s12010-016-2214-5 |
| [2] | Purnomo AS, Mori T, Kamei I, Kondo R. Basic studies and applications on bioremediation of DDT: a review. International Biodeterioration & Biodegradation, 2011, 65(7): 921-930. |
| [3] | Aislabie JM, Richards NK, Boul HL. Microbial degradation of DDT and its residues-A review. New Zealand Journal of Agricultural Research, 1997, 40(2): 269-282. DOI:10.1080/00288233.1997.9513247 |
| [4] | Adeleye AO, Sosan MB, Oyekunle JAO. Occurrence and human health risk of dichlorodiphenyltrichloroethane (DDT) and hexachlorocyclohexane (HCH) pesticide residues in commonly consumed vegetables in southwestern Nigeria. Journal of Health & Pollution, 2019, 9(23): 190909. |
| [5] | Jayaseelan VP, Ramesh A, Arumugam P. Breast cancer and DDT: putative interactions, associated gene alterations, and molecular pathways. Environmental Science and Pollution Research, 2021: 1-12. DOI:10.1007/s11356-021-12489-6 |
| [6] | Chen J, Chen LL, Liu DY, Zhang GS. Organochlorine pesticide contamination in marine organisms of Yantai Coast, northern Yellow Sea of China. Environmental Monitoring and Assessment, 2014, 186(3): 1561-1568. DOI:10.1007/s10661-013-3473-z |
| [7] | Luan XL, Qiao TF, Lyu M, Liao CY, Wang DQ, Liu DY, Chen LX. Sediment records of DDTs in intertidal sediment core of Daliao River Estuary and their responses to anthropogenic activities in the past century. Environmental Chemistry, 2020, 39(1): 119-127. (in Chinese) 栾晓琳, 乔田峰, 吕敏, 廖春阳, 王东启, 刘东艳, 陈令新. 近百年来大辽河口潮间带中滴滴涕(DDTs)的沉积记录及其对人类活动的响应. 环境化学, 2020, 39(1): 119-127. |
| [8] | Klumpp DW, Hong HS, Humphrey C, Wang XH, Codi S. Toxic contaminants and their biological effects in coastal waters of Xiamen, China.: I. Organic pollutants in mussel and fish tissues. Marine Pollution Bulletin, 2002, 44(8): 752-760. DOI:10.1016/S0025-326X(02)00053-X |
| [9] | Wong MH, Leung AOW, Chan JKY, Choi MPK. A review on the usage of POP pesticides in China, with emphasis on DDT loadings in human milk. Chemosphere, 2005, 60(6): 740-752. DOI:10.1016/j.chemosphere.2005.04.028 |
| [10] | Ma Y, Yun XT, Ruan ZY, Lu CJ, Shi Y, Qin Q, Men ZM, Zou DZ, Du XM, Xing BS, Xie YF. Review of hexachlorocyclohexane (HCH) and dichlorodiphenyltrichloroethane (DDT) contamination in Chinese soils. Science of the Total Environment, 2020, 749: 141212. DOI:10.1016/j.scitotenv.2020.141212 |
| [11] | Nadeau LJ, Menn FM, Breen A, Sayler GS. Aerobic degradation of 1, 1, 1-trichloro-2, 2-bis(4-chlorophenyl) ethane (DDT) by Alcaligenes eutrophus A5. Applied and Environmental Microbiology, 1994, 60(1): 51-55. DOI:10.1128/aem.60.1.51-55.1994 |
| [12] | Kamanavalli CM, Ninnekar HZ. Biodegradation of DDT by a Pseudomonas species. Current Microbiology, 2004, 48(1): 10-13. DOI:10.1007/s00284-003-4053-1 |
| [13] | Ito K, Mahmood A, Kataoka R, Takagi K. Dichlorodiphenyltrichloroethane (DDT) degradation by Streptomyces sp. isolated from DDT contaminated soil. Bioremediation Journal, 2021, 3: 1-14. |
| [14] | Al-Rashed S, Marraiki N, Syed A, Elgorban AM, Prasad KS, Shivamallu C, Bahkali AH. Bioremediation characteristics, influencing factors of dichlorodiphenyltrichloroethane (DDT) removal by using non-indigenous Paracoccus sp.. Chemosphere, 2021, 270: 129474. DOI:10.1016/j.chemosphere.2020.129474 |
| [15] | Ferraro DJ, Gakhar L, Ramaswamy S. Rieske business: Structure-function of Rieske non-heme oxygenases. Biochemical and Biophysical Research Communications, 2005, 338(1): 175-190. DOI:10.1016/j.bbrc.2005.08.222 |
| [16] | Overwin H, Standfu?-Gabisch C, González M, Méndez V, Seeger M, Reichelt J, Wray V, Hofer B. Permissivity of the biphenyl-specific aerobic bacterial metabolic pathway towards analogues with various steric requirements. Microbiology: Reading, England, 2015, 161(9): 1844-1856. DOI:10.1099/mic.0.000138 |
| [17] | Mondello FJ, Turcich MP, Lobos JH, Erickson BD. Identification and modification of biphenyl dioxygenase sequences that determine the specificity of polychlorinated biphenyl degradation. Applied and Environmental Microbiology, 1997, 63(8): 3096-3103. DOI:10.1128/aem.63.8.3096-3103.1997 |
| [18] | Vézina J, Barriault D, Sylvestre M. Family shuffling of soil DNA to change the regiospecificity of Burkholderia xenovorans LB400 biphenyl dioxygenase. Journal of Bacteriology, 2007, 189(3): 779-788. DOI:10.1128/JB.01267-06 |
| [19] | Kumar P, Mohammadi M, Viger JF, Barriault D, Gomez-Gil L, Eltis LD, Bolin JT, Sylvestre M. Structural insight into the expanded PCB-degrading abilities of a biphenyl dioxygenase obtained by directed evolution. Journal of Molecular Biology, 2011, 405(2): 531-547. DOI:10.1016/j.jmb.2010.11.009 |
| [20] | Sylvestre M, Massé R, Ayotte C, Messier F, Fauteux J. Total biodegradation of 4-chlorobiphenyl (4 CB) by a two-membered bacterial culture. Applied Microbiology and Biotechnology, 1985, 21(3/4): 192-195. |
| [21] | Schüttelkopf AW, van Aalten DMF. PRODRG: a tool for high-throughput crystallography of protein-ligand complexes. Acta Crystallographica Section D, 2004, 60(8): 1355-1363. DOI:10.1107/S0907444904011679 |
| [22] | Dalal V, Dhankhar P, Singh V, Singh V, Rakhaminov G, Golemi-Kotra D, Kumar P. Structure-based identification of potential drugs against FmtA of Staphylococcus aureus: virtual screening, molecular dynamics, MM-GBSA, and QM/MM. The Protein Journal, 2021: 1-18. |
| [23] | L'Abbée JB, Tu YB, Barriault D, Sylvestre M. Insight into the metabolism of 1, 1, 1-trichloro-2, 2-bis(4-chlorophenyl) ethane (DDT) by biphenyl dioxygenases. Archives of Biochemistry and Biophysics, 2011, 516(1): 35-44. DOI:10.1016/j.abb.2011.09.016 |
| [24] | Mohammadi M, Viger JF, Kumar P, Barriault D, Bolin JT, Sylvestre M. Retuning Rieske-type oxygenases to expand substrate range. The Journal of Biological Chemistry, 2011, 286(31): 27612-27621. DOI:10.1074/jbc.M111.255174 |
| [25] | 郭莉. Rhodococcus biphenylivorans TG9对多氯联苯的降解特性研究. 浙江大学硕士学位论文, 2018. |
| [26] | Nadeau LJ, Sayler GS, Spain JC. Oxidation of 1, 1, 1-trichloro-2, 2-bis(4-chlorophenyl)ethane (DDT) by Alcaligenes eutrophus A5. Archives of Microbiology, 1998, 171(1): 44-49. DOI:10.1007/s002030050676 |
| [27] | Dhindwal S, Gomez-Gil L, Neau DB, Pham TTM, Sylvestre M, Eltis LD, Bolin JT, Kumar P. Structural basis of the enhanced pollutant-degrading capabilities of an engineered biphenyl dioxygenase. Journal of Bacteriology, 2016, 198(10): 1499-1512. DOI:10.1128/JB.00952-15 |
