魏维, 方杰, 李根, 陈旭, 李博, 李辉信, 胡锋, 武俊


南京农业大学资源与环境学院, 江苏 南京 210095
收稿日期:2017-01-03;修回日期:2017-02-17;网络出版日期:2017-05-11
基金项目:国家自然科学基金(31470551);中央高校基本科研业务费(KYZ201409,KYTZ201404)
*通信作者:武俊, Tel/Fax: +86-25-84395815; E-mail:wujun2013@njau.edu.cn
摘要:[目的]研究对硝基苯酚(PNP)对大肠杆菌和铜绿假单胞菌产生持留菌的影响,并对转录组进行分析,阐明对硝基苯酚影响持留菌形成的相关机制。[方法]采用氧氟沙星抗生素探究对硝基苯酚对细菌产生持留菌的影响,并通过检测细菌自溶情况和呼吸抑制剂羰酰氰氯苯腙(CCCP)对持留菌比例的影响,然后通过转录组分析其相关基因的表达,最后通过实时荧光定量PCR和反义核酸进行相关功能基因的验证。[结果]PNP可以通过抑制大肠杆菌和铜绿假单胞菌的呼吸作用使其产生持留菌的比例增加,PNP不同浓度、作用不同时间和作用不同生长时期的菌体都会影响细菌产生持留菌的比例。PNP和呼吸抑制剂CCCP均能够抑制2个菌体的自溶情况,包括溶解氧含量的变化、蛋白质降解情况、细胞尺寸的变化和RNA完整性。转录组分析和实时荧光定量PCR实验结果表明加入PNP后,cyoA、appC两个基因在大肠杆菌和铜绿假单胞菌中的表达量均显著下降,再通过反义核酸抑制cyoA、appC的表达发现持留菌的比例和原始菌株相比均有所增加。[结论]PNP可以通过抑制细胞呼吸作用来增加细菌产生持留菌的比例。
关键词: 持留菌 大肠杆菌 铜绿假单胞菌 对硝基苯酚 细胞呼吸
Influence of p-nitrophenol on bacteria persisters
Wei Wei, Jie Fang, Gen Li, Xu Chen, Bo Li, Huixin Li, Feng Hu, Jun Wu


College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China
Received 3 January 2017; Revised 17 February 2017; Published online 11 May 2017
*Corresponding author: Jun Wu, Tel/Fax: +86-25-84395815; E-mail:wujun2013@njau.edu.cn
Supported by the National Natural Science Foundation of China (31470551) and by the Central University Basic Scientific Research Service Charge (KYZ201409, KYTZ201404)
Abstract: [Objective]To study the effect of p-nitrophenol (PNP) on persisters of Escherichia coli and Pseudomonas aeruginosa and to analyze the transcriptome to illustrate the impact of PNP on persister formation.[Methods]Ofloxacin was used to determine the bacteria persisters number. Cell self-digestion assay was done and the effect of respiratory inhibitors carbonyl cyanide chlorobenzene hydrazone (CCCP) on bacteria persisters was studied as well. Based on analysis of bacterial transcriptome, two genes (cyoA and appC) associated with the formation of persistence were screened. Their expressions were confirmed by Real-time Fluorescence Quantitative Polymerase Chain Reaction (PCR). The association between the two genes and the formation of persistence was also checked by antisense oligodeoxynucleotide assay.[Results]PNP inhibited the respiration of E. coli and P. aeruginosa, thus increased the proportion of bacterial persisters. PNP concentration, PNP function time and the bacterial growth period affected the proportion of bacteria persisters. PNP and CCCP inhibited the self-digestion of E. coli and P. aeruginosa, including the changes in dissolved oxygen, protein degradation and cell size, and the integrity of RNA. The results from transcriptome analysis and Real-time fluorescent quantitative PCR showed that PNP addition decreased the expression of cyoA and appC in E. coli and P. aeruginosa. Through the antisense oligodeoxynucleotide inhibitory expression of cyoA and appC was found that bacteria persister proportion increased compared with the original strain.[Conclusion]PNP can increase the proportion of bacteria persisters by inhibiting the cellular respiration.
Key words: persisters Escherichia coli Pseudomonas aeruginosa nitrophenol cell respiration
持留菌是某个细菌群体中一定比例表型异化的小亚群,它可通过临时休眠或缓慢生长来耐受致死浓度抗菌药物的作用[1]。持留菌主要通过“休眠-生长-增殖”的模式来应对逆境的胁迫,从而维持自身生存和菌体结构稳定。细菌耐药持留现象最早由Bigger在治疗金黄色葡萄球菌(Staphylococcus aureus)感染时发现,随后在大肠埃希菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)和结核分枝杆菌(Mycobacterium tuberculosis)等细菌中证实了持留菌的存在[2-5]。由于细菌持留与反复感染、慢性感染的治疗失败等密切相关,且持留菌的长期存在增加了菌株不断获得外源基因(耐药基因)的几率,所以有关持留菌及其形成机制长期以来引起科学工作者们的广泛关注。
近年来,一些外源化合物(例如氰化钾、一氧化氮、吲哚)对持留菌影响的相关机制研究越来越受到重视。在大肠杆菌中,氰化钾通过抑制呼吸作用或者在厌氧条件下均可以减少持留菌的数量1000倍[6];一氧化氮也可以通过抑制呼吸作用减少持留菌的数量[7];吲哚可以通过上调氧化应激及噬菌体休克通路的相关基因来增加持留菌的产生[8]。在铜绿假单胞菌中,吩嗪绿脓菌素和AIN-3-氧代十二烷酰-高丝氨酸内酯在菌体对数生长期中都可以显著提高细菌产生持留菌的比例[9],而对大肠杆菌中的持留菌并没有显著变化。前期研究对一些有机污染物是否影响持留菌比例进行验证,结果证明PNP会显著增加持留菌比例。PNP是美国环保局分类的一种优先控制污染物之一,广泛用于有机合成工业和生产杀虫剂[10],不断地在废水、河流、湖泊、土壤、空气和地下水中检出,在废水中对硝基苯酚含量为3000-8000 mg/L[11],严重威胁人体健康和水体安全[12],并且PNP对细菌产生持留菌的影响还未见报道。
因此,本研究的目的是探究PNP对大肠杆菌和铜绿假单胞菌产生持留菌的影响及其相关机制。在本研究中,首先比较了PNP对两种菌体的持留菌比例的影响,并对其在不同浓度、不同作用时间和细菌生长不同时期下的持留菌比例的变化做出分析。然后,通过CCCP和PNP对细胞自溶情况的检测,推测可能是PNP对细胞呼吸有抑制作用,最后通过转录组分析、实时荧光定量PCR和反义核酸进一步验证PNP影响持留菌比例的相关机制。
1 材料和方法 1.1 菌株、质粒和培养基 本实验所用的菌株和质粒见表 1。大肠杆菌、铜绿假单胞菌均用LB培养基培养,并在必要情况下在培养基中添加抗生素,抗生素选择庆大霉素,其浓度为50 mg/L。
表 1. 本实验所用菌株和质粒 Table 1. Bacterial strains and plasmids used in this study
| Strains/plasmids | Characteristics | Source |
| E. coli O157:H7 | Wild type strain | This study |
| P. aeruginosa PAO1 | Wild type strain | This study |
| E. coli DH5α | Plasmid vector | TaKaRa |
| Plasmid MCS5 | Cloning vector | This study |
| Plasmid MCS5-RFP | Expression plasmid containing RFP, Gmr | This study |
表选项
1.2 大肠杆菌和铜绿假单胞菌生长曲线的测定 从-80℃冰箱中将冻存的大肠杆菌和铜绿假单胞菌复苏,挑取单菌落接种到3 mL LB培养基中,置于恒温摇床上37℃、250 r/min过夜培养12 h后测定OD600。将菌液以1:100的比例接种到新鲜的LB培养基中,以接种时为零点,每隔2 h测定1次菌液的OD600值。
1.3 试管二倍稀释法对铜绿假单胞菌和大肠杆菌最低抑菌浓度(MIC值)的测定 排列无菌试管2列,每列10管。除第1管加入菌液1.5 mL外,其余各管均加入1.0 mL,然后向第1管加入氧氟沙星抗生素0.5 mL,混匀后吸出1.0 mL加入第2管中,用同法依次2倍稀释至第9管,弃去1.0 mL,第10管为生长对照,每种菌重复2次。37℃培养16-18 h后观察结果。如果试管澄清透明,摇匀后仍透明,认为试管无菌生长,若试管呈现浑浊状态,表明有菌生长,以无菌生长的最低浓度为MIC[13]。
1.4 持留菌的测定 首先,将划有大肠杆菌的平板,挑取单菌落接种到3 mL LB试管中,过夜培养后以5%接种量接种到盛有40 mL LB液体培养基的100 mL三角瓶中,37℃、250 r/min培养到对数生长中期。然后转移3 mL培养液到LB试管中,加入DMSO溶解的PNP (100 mg/L)。同时取3 mL培养液,加入等量的DMSO作为对照,37℃培养1 h,稀释涂板计数。最后向剩余的培养液中加入氧氟沙星5 mg/L (100×MIC),于37℃、250 r/min继续培养3 h,用稀释涂板的计数方法定量存活的持留菌(通常认为抗生素处理敏感菌后存活的细胞为持留菌)[6]。
将划有铜绿假单胞菌的平板挑取单菌落接种到3 mL LB试管中,与大肠杆菌不同的是,在培养过程中菌体以1%的接种量接种至盛有100 mL LB液体培养基的250 mL三角瓶中,37℃、250 r/min条件下培养至对数生长中期,加入PNP、DMSO (100 mg/L)后对菌落进行计数,再加入氧氟沙星5 mg/L (50×MIC),继续培养3 h,稀释涂板计数[9]。
1.5 蛋白质降解 重新构建的大肠杆菌和铜绿假单胞菌携带MCS5-RFP质粒,引物序列为RFP (FRFP:5′-GGggtacc ATGGTGAGCAAGGGCGAGGAGGATA-3′,RRFP:5′-CCCaagcttCTACTTGTACAGCTCGTCCATGCCG-3′)。菌体过夜培养,大肠杆菌按5%的接种量、铜绿假单胞菌按1%的接种量分别接种至40 mL和100 mL LB液体培养基,待培养到对数生长中期时加入PNP (100 mg/L)和1 mmol/L IPTG继续培养1 h,细胞用PBS缓冲液稀释到OD600=0.1时,然后使用酶标仪在558/583 nm吸收波长/发射波长测量其吸光度[6-7],并且以PBS缓冲液做为对照。
1.6 RNA提取 Trizol法提取RNA:(1)取2-3 mL菌液于12000 r/min、4℃离心5 min后收集沉淀,加入1 mL Trizol Reagent反复抽吸混匀。(2)于12000 r/min、4℃离心10 min,将上清转入2 mL新管后于15-30℃静置5 min,然后加入1/5体积量的氯仿(约0.2 mL),大力摇15 s后于室温静置2-3 min。(3)将样品置于4℃、12000 r/min离心15 min后转水相至1.5 mL离心管,于15-30℃下加入等体积异丙醇,轻轻上下颠倒混匀10 min。(4)然后置于12000 r/min、4℃离心10 min,去上清,加入1 mL 75%预冷乙醇,混匀。(5)置于7500 r/min、4℃离心5 min后去上清,室温放置5-10 min (可倒置于纸巾上,使得乙醇挥发)后加入30-50μL RNase-free水重溶,-80℃保存备用。
1.7 溶解氧量测定 采用YSI 550A溶氧仪测定溶解氧浓度(用%饱和度来标定)。首先,打开仪器预热15-20 min,将探头放入待测样中,待测样为PNP (100 mg/L)和DMSO处理后的菌液离心上清液,并持续搅拌或在水样中晃动探头,待温度和溶解氧读数稳定后观察记录读数。
1.8 转录组分析 大肠杆菌和铜绿假单胞菌在对数生长中期分别用等量的PNP (100 mg/L)和DMSO处理1 h,送上海美吉生物医药科技有限公司进行转录组分析,其操作流程为:(1)提取RNA。利用Nanodrop2000对所提RNA的浓度和纯度进行检测,单次建库要求RNA总量5μg。浓度200 ng/μL,OD260/298介于1.8-2.2之间。(2)去除核糖体RNA。不同于真核生物mRNA 3′末端具有polyA尾,原核生物不能利用Oligo dT与ployA进行A-T碱基配对,从总RNA中分离出mRNA。一般采用去除rRNA的方式,用于分析转录组信息。(3)片段化mRNA。Illumina平台是针对短序列片段进行测序,去除rRNA得到的mRNA是完整的RNA序列,平均长度达几kb,因此需要对其进行随机打断。利用金属离子可以将mRNA随机断裂成200 bp左右的小片段。(4)反转合成cDNA。在逆转录酶的作用下,利用随机引物,以mRNA为模板反转合成一链cDNA,随后进行二链合成,形成稳定的双链结构。(5)连接adaptor。双链的cDNA结构为粘性末端,加入End Repair Mix将其补成平末端,随后在3′末端加上一个A碱基,用于连接Y字形的接头。(6) Illumina测序。先文库构建,PCR扩增15个cycles,再用2%琼脂糖胶回收目的条带,TBS380定量,按数据比例混合上机,cBot上进行桥式PCR扩增,生成clusters,最后再用IlluminaHiseq4000测序。
1.9 荧光定量PCR分析 把用PNP (100 mg/L)和等量的DMSO分别处理过的大肠杆菌和铜绿假单胞菌样品的总RNA利用PrimeScript? RT reagent Kit (Perfect real time)购于(TaKaRa公司)反转录试剂盒合成cDNA第一链。利用UltraSYBR Mixture (With ROX)试剂盒(购于CWBIO公司)在Bio-Rad公司的荧光定量PCR仪上采用SYBR green Ⅰ荧光染料法进行qRT-PCR。采用CFX ManagerTM 1.6软件,在铜绿假单胞菌中以nadB基因为内参,在大肠杆菌中以gapA基因为内参,采用相对定量法进行结果分析。利用Primer 5.0和Oligo 6.0软件设计基因的引物序列appC (FappC:5′-TCCTCGCCACTCA CTCATTAG-3′,RappC:5′-AGCCCAGGTCACCTTC CAG-3′)、cyoA (FcyoA:5′-TGATGCGACAGAAGA ACA-3′,RcyoA:5′-ATGGCAATCCAAGGTAAT-3′)、cydA (FcydA:5′-GTTGCGAACGGCTGGAT-3′,RcydA:5′-TTTAGCGAAGGCGAAGTCA-3′),委托Invitrogen公司合成引物。反义核酸基因的荧光定量以上述同样的方法,但是不加入PNP,在铜绿假单胞菌中以nadB基因为内参,在大肠杆菌中以gapA基因为内参,基因的引物序列为appCantisense(FappCantisense:5′-CCCaagcttGCCACTCACTCATTAGA TAAACCC-3′,RappCantisense:5′-GGggtaccGGCTCAC GATTGCCTTGC-3′)、cyoAantisense (FcyoAantisense:5′-CC CaagcttCGGAACAGGGCTTTGCT-3′,RcyoAantisense:5′-GGggtaccTGGCGGAGATACCGTCATA-3′)。
1.10 反向克隆法构建appC、cyoA基因反义核酸原核表达载体MCS5/appCantisense、MCS5/cyoAantisense 以铜绿假单胞菌PAO1做为模板,appC (FappC:5′-TCCTCGCCACTCACTCATTAG-3′,RappC:5′-AG CCCAGGTCACCTTCCAG-3′)、cyoA (FcyoA:5′-TG ATGCGACAGAAGAACA-3′,RcyoA:5′-ATGGCAA TCCAAGGTAAT-3′)做为引物,进行PCR循环。PCR产物及载体MCS5经Hind Ⅲ和Kpn Ⅰ双酶切后,凝胶回收试剂盒回收大片段,二者大片段用T4连接酶连接。另基因上游引物的酶切位点与质粒载体插入位点的下游酶切位点保持一致,下游引物的酶切位点和质粒载体插入位点的上游酶切位点亦一致,基因的引物序列为appCantisense (FappCantisense:5′-CCCaagcttGCCACTCACTCATTAG ATAAACCC-3′,RappCantisense:5′-GGggtaccGGCTCA CGATTGCCTTGC-3′)、cyoAantisense(FcyoAantisense:5′-C CCaagcttCGGAACAGGGCTTTGCT-3′,RcyoAantisense:5′-GGggtaccTGGCGGAGATACCGTC ATA-3′),这样appC、cyoA基因就反向插入质粒MCS5中,从而获得MCS5/appCantisense、MCS5/cyoAantisense[14]。
1.11 载体转化、筛选及鉴定 载体经电转化法转化至大肠杆菌和铜绿假单胞菌中[15],转化产物均匀涂布含50 mg/L庆大霉素培养基培养,取转化子接种于50 mg/L庆大霉素的LB培养基中培养,试剂盒提取质粒,质粒经PCR鉴定,最后通过测序确定序列。
2 结果和分析 2.1 PNP不同浓度、不同时间及不同生长时期对细菌产生持留菌比例的影响 用200、400、600、800 mg/L浓度的PNP处理对数生长时期的大肠杆菌和铜绿假单胞菌,持留菌的比例均显著增加,不同浓度的PNP会对持留菌比例有不同的影响。当PNP浓度为400 mg/L时,大肠杆菌的持留菌比例变化最为显著(图 1-A);当PNP浓度为200 mg/L的时候,铜绿假单胞菌的持留菌比例变化最为显著(图 1-B);用100 mg/L浓度的PNP分别处理对数生长时期的大肠杆菌、铜绿假单胞菌,在其作用的1、3、5、7 h测定持留菌存活比例。PNP作用的1-7 h对2个菌持留菌的比例均有显著增加,但以1 h时持留菌的比例增幅最大(图 1-C,D);用100 mg/L浓度的PNP分别处理大肠杆菌和铜绿假单胞菌生长的不同时期,PNP对两种菌体持留菌比例变化趋势一致。PNP对大肠杆菌和铜绿假单胞菌的不同生长时期持留菌比例的影响不同:在菌体生长初期,持留菌比例未见明显变化,待细菌至对数生长期,持留菌比例有显著增加;当细菌生长至稳定期时,持留菌比例增幅减小(图 1-E,F)。
 |
| 图 1 PNP不同浓度(A,B)、作用不同时间(C,D)和菌体不同生长状况(E,F)对细菌产生持留菌比例的影响 Figure 1 Effect of different concentration of PNP (A, B) and PNP at different time (C, D) bacterial at different growth phases (E, F) on the proportion of bacterial persisters. All samples were treated with 5 mg/L ofloxacin. A, C, E: the levels of persister in E. coli; B, D, F: the levels of persister in P. aeruginosa. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
2.2 PNP和CCCP对细菌自溶现象的影响 用100 mg/L PNP、20 μmol/L呼吸抑制剂CCCP处理对数生长时期的大肠杆菌和铜绿假单胞菌。与对照组相比,PNP和CCCP均可以增加大肠杆菌和铜绿假单胞菌持留菌比例至少2个数量级(图 2-A),同时二者均可以增加RNA的完整性(图 2-B)、增加细胞尺寸(图 2-C)、抑制蛋白质降解(图 2-D),细胞尺寸均增加至少1.5倍,溶解氧含量均会增加,在大肠杆菌中增加约2倍,在铜绿假单胞菌中增加约6倍(图 2-E)。实验结果验证了PNP和呼吸抑制剂有相同作用,均可以抑制细菌自溶现象,推测可能是PNP对菌体呼吸作用有抑制。
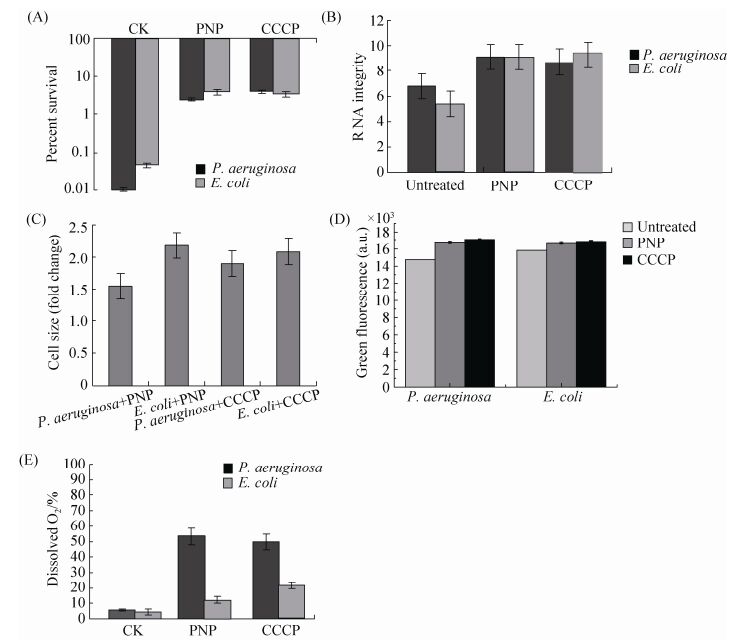 |
| 图 2 PNP和CCCP对细菌产生持留菌比例(A)和对RNA完整性(B)、细胞尺寸(C)、蛋白质降解(D)、溶解氧含量(E)的影响 Figure 2 Effects of PNP and CCCP on proportion of bacteria persisters (A), RNA integrity (B), cell size (C), protein levels (D) and dissolved oxygen (E). E. coli and P. aeruginosa were all treated with 100 mg/L PNP and 20 μmol/L CCCP. |
| 图选项 |
2.3 PNP对细菌持留菌影响的转录组分析 上述实验的结果推测可能是PNP对菌体呼吸作用有抑制。为了验证这个推测,将PNP处理组和对照组样品进行转录组分析,结果表明,加入PNP后,与细胞呼吸相关通路K00425基因表达量显著降低(图 3),其中appC、cyoA、cydA三个基因为铜绿假单胞菌和大肠杆菌共同调控。
 |
| 图 3 PNP对信号通路基因表达的影响 Figure 3 Effect of PNP on signaling pathway gene expression. E. coli and P. aeruginosa were all treated with 100 mg/L PNP. |
| 图选项 |
2.4 PNP对细菌持留菌影响的功能基因的实时荧光定量PCR分析 通过转录组分析,筛选出与细胞呼吸相关的3个功能基因。通过荧光定量PCR进一步验证PNP对细胞呼吸是否有抑制作用,结果表明与对照组相比,PNP处理组appC、cyoA在大肠杆菌和铜绿假单胞菌中的表达量均显著下降(P<0.05),而cydA在加入PNP后差异均并不显著(图 4-A,B)。
 |
| 图 4 在大肠杆菌和铜绿假单胞菌中的荧光定量PCR分析(A,B) Figure 4 qPCR analyses in E. coli (A) and P. aeruginosa (B). In E. coli, housekeeping gene is gapA; in P. aeruginosa, housekeeping gene is nadB. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
2.5 PNP对细菌持留菌影响的功能基因验证 PNP分别处理大肠杆菌和铜绿假单胞菌后,与细胞呼吸相关的2个基因appC、cyoA表达量显著减少。为了进一步验证PNP是通过抑制细胞呼吸而增加持留菌比例,敲除基因appC、cyoA发现会导致细菌死亡,该现象可能与这2个基因控制细胞呼吸有关,于是选择反义核酸来抑制基因的表达。荧光定量PCR分析结果表明,在大肠杆菌和铜绿假单胞菌中,反义核酸基因appCantisense、cyoAantisense与原始的appC、cyoA基因表达量相比均显著下降(P<0.05)(图 5-A,B),并且携带2个反义核酸基因的大肠杆菌和铜绿假单胞菌的持留菌比例和原始菌株相比至少上升2个数量级(图 6),表明appC和cyoA两个基因与持留菌比例的变化有关。
 |
| 图 5 在大肠杆菌(A)和铜绿假单胞菌(B)中的荧光定量PCR分析 Figure 5 qPCR analyses in E. coli (A) and P. aeruginosa (B). In E. coli, housekeeping gene is gapA; in P. aeruginosa, housekeeping gene is nadB. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
 |
| 图 6 携带反义核酸基因的大肠杆菌和铜绿假单胞菌对持留菌比例的影响 Figure 6 The influence of E. coli and P. aeruginosa carrying antisense gene on the proportion of bacterial persisters. All samples were treated with 5 mg/L ofloxacin. |
| 图选项 |
3 讨论 持留菌自1944年被发现后,近几十年来因其在慢性持续性感染和生物膜感染中的重要作用而得到越来越多的重视,已有研究结果表明,持留菌的形成分子机制极为复杂,很多因素比如全局调控因子、毒素抗毒素系统(TA系统)、群体感应系统(QS)、抗氧化反应等[16-21]。虽然不同细菌的持留机制有一定的形似性和保守性,但不同细菌的持留机制也存在差异,如毒素-抗毒素系统在大肠埃希菌(E. coli)中的过度激活可导致持留菌增加,但在金黄色葡萄球菌(Staphylococcus aureus)中却无相同作用[22]。
本研究结果表明,PNP可以同时增加大肠杆菌和铜绿假单胞菌持留菌的比例,PNP作用菌体不同时间、不同生长时期和PNP不同浓度都会对持留菌的比例产生不同影响,当PNP作用2个菌体的对数生长时期、时间为1 h、浓度为200 mg/L的时候,持留菌比例增加是最大的。由于PNP毒性强且难降解,当它作用菌体较长时间、浓度过大时,会把大部分细菌直接杀死,从而导致持留菌的比例减小。已有研究结果表明,氰化钾作用大肠杆菌6 h可以减少持留菌比例1000倍,在对数生长中期时对持留菌比例影响最大,并且浓度为0.52 mmol/L时可以大幅度减少持留菌比例1000倍。这是由于当氰化钾作用菌体时,可以产生特定的代谢产物杀死持留菌,当作用时间和浓度不同时所产生的效果不同,从而引起持留菌比例的不同变化[6]。在铜绿假单胞菌中,吩嗪绿脓菌素和AIN-3-氧代十二烷酰-高丝氨酸内酯可以显著提高细菌产生持留菌的比例,当菌体在对数生长时期且绿脓菌素浓度在2 mmol/L时,AIN-3-氧代十二烷酰-高丝氨酸内酯浓度为0.1 mmol/L即能够增加至少5个数量级的持留菌数量[9]。
本实验研究结果表明,PNP可以抑制细菌自溶现象,我们推测可能是PNP对细胞呼吸有抑制作用。通过转录组分析结果表明,与细胞呼吸有关的基因appC、cyoA在PNP处理大肠杆菌和铜绿假单胞菌的样本中表达量较低,这2个基因与细胞色素氧化酶有关,并且此酶是把呼吸底物的电子经过细胞色素系统直接传递给分子态氧(即具有自动氧化作用),在细胞呼吸中处于细胞色素系统的末端;荧光定量PCR结果进一步验证了PNP处理组与对照组相比appC、cyoA表达量会显著降低;通过反义核酸抑制2个基因的表达,并检测持留菌比例的变化,结果发现当基因受到抑制的同时持留菌的比例上升至少2个数量级。实验结果说明了PNP是通过抑制细胞呼吸作用增加持留菌比例。此外,外源化合物也可以通过抑制呼吸作用减少持留菌的比例,例如,氰化钾、一氧化氮均可以通过抑制呼吸作用减少持留菌的数量1000倍[6-7],同时也可以抑制细胞的自溶现象,增加溶解氧含量80倍,抑制蛋白质降解3倍,增加细胞尺寸2倍。细胞呼吸会造成代谢损伤,例如RNA降解、蛋白质降解,然而,细胞自溶现象是呼吸被抑制情况下的一种生理状态,可以通过蛋白质降解、RNA完整性、细胞尺寸、溶解氧含量的变化情况来检测细胞自溶情况,所以,当细胞呼吸被抑制,代谢损伤会消失,从而会抑制细胞的自溶现象[6, 17]。一氧化氮通过代谢解毒酶减少大肠杆菌持留菌数量,敲除与解毒酶相关的3个基因hmp、norV、nsrR,持留菌数量上升;氰化钾通过TCA循环酶减少大肠杆菌持留菌比例,敲除与TCA循环酶有关的3个基因sucB、mdh、ubiF,持留菌数量上升;绿脓菌素会增加铜绿假单胞菌持留菌数量,phz1、phz2两个基因控制绿脓菌素的产生,但是敲除2个基因,并不会影响持留菌的数量,超表达LasR,会增加群体感应信号分子3-OC12-HSL的产生,从而增加持留菌的数量[9]。
探究持留菌的形成分子机制和多药耐性对于治疗顽固的长期感染疾病具有重大意义,然而,持留菌的形成机制很复杂,仍有许多问题值得我们深入探讨。本研究结果表明,PNP可以通过抑制细胞呼吸作用减少大肠杆菌和铜绿假单胞菌持留菌的比例,深入研究这一现象将对持留菌形成机制提供重要依据。
References
| [1] | Jiang B, Li S. New progresses of research methods and achievements on persisters. Journal of Medical Postgraduates, 2014, 27(6): 665-668. (in Chinese) 姜北, 黎庶. 持留菌研究方法的新进展. 医学研究生学报, 2014, 27(6): 665-668. |
| [2] | Dhar N, McKinney JD. Microbial phenotypic heterogeneity and antibiotic tolerance. Current Opinion in Microbiology, 2007, 10(1): 30-38. DOI:10.1016/j.mib.2006.12.007 |
| [3] | Mulcahy LR, Burns JL, Lory S, Lewis K. Emergence of Pseudomonas aeruginosa strains producing high levels of persister cells in patients with cystic fibrosis. Journal of Bacteriology, 2010, 192(23): 6191-6199. DOI:10.1128/JB.01651-09 |
| [4] | Maisonneuve E, Shakespeare LJ, J?rgensen MG, Gerdes K. Bacterial persistence by RNA endonucleases. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(32): 13206-13211. DOI:10.1073/pnas.1100186108 |
| [5] | Levin BR, Rozen DE. Non-inherited antibiotic resistance. Nature Reviews Microbiology, 2006, 4(7): 556-562. DOI:10.1038/nrmicro1445 |
| [6] | Orman MA, Brynildsen MP. Inhibition of stationary phase respiration impairs persister formation in E. coli. Nature Communications, 2014, 6: 7983. |
| [7] | Orman MA, Brynildsen MP. Persister formation in Escherichia coli can be inhibited by treatment with nitric oxide. Free Radical Biology and Medicine, 2016, 93: 145-154. DOI:10.1016/j.freeradbiomed.2016.02.003 |
| [8] | Vega NM, Allison KR, Khalil AS, Collins JJ. Signaling-mediated bacterial persister formation. Nature Chemical Biology, 2012, 8(5): 431-433. DOI:10.1038/nchembio.915 |
| [9] | M?ker N, Dean CR, Tao JS. Pseudomonas aeruginosa increases formation of multidrug-tolerant persister cells in response to quorum-sensing signaling molecules. Journal of Bacteriology, 2010, 192(7): 1946-1955. DOI:10.1128/JB.01231-09 |
| [10] | Melgoza RM, Chew M, Buitrón G. Start-up of a sequential anaerobic/aerobic batch reactor for the mineralization of p-nitrophenol. Water Science and Technology, 2000, 42(5/6): 289-292. |
| [11] | Li QB, Shi ZJ. Macroporous resin for treatment of p-nitrophenol wastewater. Guangdong Chemical Industry, 2010, 37(6): 198-199. (in Chinese) 李启本, 时召俊. 大孔树脂在处理对硝基苯酚废水中的应用. 广东化工, 2010, 37(6): 198-199. |
| [12] | Wan NS, Gu JD, Huang JH, Gao CD. Isolation of Achromobacter xylosoxidans NS12 and Degradation of nitrophenols. Environmental Science, 2007, 28(2): 422-426. (in Chinese) 万年升, 顾继东, 黄锦辉, 高传德. Achromobacter xylosoxidans NS12的分离和对硝基苯酚的降解. 环境科学, 2007, 28(2): 422-426. |
| [13] | Meng JS, Yuan JG, Ma H. Research on antibacterial activity of taraxacum mongolicum hand in vitro. Hebei Chemical Industry, 2013, 36(3): 29-31. (in Chinese) 孟静思, 袁进罡, 马辉. 中草药蒲公英的体外抑菌试验. 河北化工, 2013, 36(3): 29-31. |
| [14] | Zhang L, Zhou JL, Li JM, Liao F. Construction of prokaryotic expression vectors of antisense nucleic acid of LasR gene and its effect on the virulence of Pseudomonas aeruginosus. Progress in Biochemistry and Biophysics, 2007, 34(10): 1049-1054. (in Chinese) 张玲, 周俊立, 李静铭, 廖芳. 铜绿假单胞菌LasR基因反义核酸原核表达载体的构建及对该菌毒力的影响. 生物化学与生物物理进展, 2007, 34(10): 1049-1054. DOI:10.3321/j.issn:1000-3282.2007.10.007 |
| [15] | Zhu SK, Huang L, Li YF, Zhong WH, Xu ZN. Preparation of efficient electrotransformation competent cells of Escherichia coli and condition of electrotransformation. Biotechnology Bulletin, 2011, 27(10): 206-209. (in Chinese) 朱森康, 黄磊, 李燕飞, 钟卫鸿, 徐志南. 制备高效大肠杆菌电转化感受态细胞和电转化条件的研究. 生物技术通报, 2011, 27(10): 206-209. |
| [16] | Ma C, Sim S, Shi WL, Du LJ, Xing DM, Zhang Y. Energy production genes sucB and ubiF are involved in persister survival and tolerance to multiple antibiotics and stresses in Escherichia coli. FEMS Microbiology Letters, 2010, 303(1): 33-40. DOI:10.1111/fml.2010.303.issue-1 |
| [17] | Li YF, Zhang Y. PhoU is a persistence switch involved in persister formation and tolerance to multiple antibiotics and stresses in Escherichia coli. Antimicrobial Agents and Chemotherapy, 2007, 51(6): 2092-2099. DOI:10.1128/AAC.00052-07 |
| [18] | Shi WL, Zhang XL, Jiang X, Yuan HM, Lee JS, Barry Ⅲ CE, Wang HH, Zhang WH, Zhang Y. Pyrazinamide inhibits trans-translation in Mycobacterium tuberculosis. Science, 2011, 333(6049): 1630-1632. DOI:10.1126/science.1208813 |
| [19] | Starosta AL, Lassak J, Jung K, Wilson DN. The bacterial translation stress response. FEMS Microbiology Reviews, 2014, 38(6): 1172-1201. DOI:10.1111/1574-6976.12083 |
| [20] | Brantl S. Bacterial type Ⅰ toxin-antitoxin systems. RNA Biology, 2012, 9(12): 1488-1490. DOI:10.4161/rna.23045 |
| [21] | Leplae R, Geeraerts D, Hallez R, Guglielmini J, Drèze P, van Melderen L. Diversity of bacterial type Ⅱ toxin-antitoxin systems:a comprehensive search and functional analysis of novel families. Nucleic Acids Research, 2011, 39(13): 5513-5525. DOI:10.1093/nar/gkr131 |
| [22] | Syed MA, Lévesque CM. Chromosomal bacterial type Ⅱ toxin-antitoxin systems. Canadian Journal of Microbiology, 2012, 58(5): 553-562. DOI:10.1139/w2012-025 |
