华婷1, 李雅楠2, 王凯凯1, 涂涛1, 黄火清1

 , 罗会颖1, 姚斌1
, 罗会颖1, 姚斌1 1.中国农业科学院饲料研究所, 北京 100081;
2.广州医科大学-中国科学院广州生物医药与健康研究联合生命科学学院, 广东 广州 510006
收稿日期:2017-02-09;修回日期:2017-03-16;网络出版日期:2017-04-11
基金项目:国家高技术研究发展计划(2014AA021301)
*通信作者:黄火清, E-mail:huanghuoqing@caas.cn
摘要:[目的]在毕赤酵母中高水平表达蓝状菌(Talaromyces leycettanus JCM12802)来源的高温果胶甲酯酶,并对其进行酶学性质研究,具有高催化效率的高温果胶甲酯酶有望能广泛应用于低甲氧基果胶的生产,优化生产工艺,提高转化率,降低生产成本。[方法]利用RT-PCR的方法,以蓝状菌(T.leycettanus JCM12802)总RNA为模板,克隆得到果胶甲酯酶基因(PmeT)的cDNA。将其插入表达载体pPIC9K,并转化毕赤酵母(Pichia pastoris)菌株GS115,高活性的阳性转化子进行高密度发酵研究。[结果]重组酵母的果胶甲酯酶表达水平达到428 U/ml,并进一步鉴定了重组果胶甲酯酶的酶学性质。该酶的最适反应温度为75℃,且在85℃以下具有较好的热稳定性。最适反应pH为4.0,在pH 2.0-7.0之间有较好的稳定性。[结论]用重组毕赤酵母可高效表达蓝状菌来源的高温果胶甲酯酶,为其今后在工业上的应用奠定了基础。
关键词: 果胶 果胶甲酯酶 高温真菌 毕赤酵母
High-level expression and characterization of pectin methylesterase PmeT from Talaromyces leycettanus JCM12802 in Pichia pastoris
Ting Hua1, Yanan Li2, Kaikai Wang1, Tao Tu1, Huoqing Huang1

 , Huiying Luo1, Bin Yao1
, Huiying Luo1, Bin Yao1 1.Institute of Feed Research, Chinese Academy of Agricultural Sciences, Beijing 100081, China;
2.College of Life Science, Guangzhou Institutes of Biomedicine and Health, Chinese Academy of Sciences, Guangzhou Medical University, Guangzhou 510006, Guangdong Province, China
Received 9 February 2017; Revised 16 March 2017; Published online 11 April 2017
*Corresponding author: Huoqing Huang, E-mail:huanghuoqing@caas.cn
Supported by the National High-tech R&D Program (2014AA021301)
Abstract: [Objective]We highly expressed the high temperature resistant pectin methylesterase from Talaromyces leycettanus JCM12802 in Pichia pastoris and studied its enzymatic properties. Pectin methylesterase with high catalytic efficiency at high temperature was expected to be widely used in the production of low-methoxyl pectin, for an optimal production process and conversion rate with reduced production cost.[Methods]We cloned the cDNA of pectin methylesterase gene (PmeT) from the total RNA of T. leycettanus JCM12802 as template by RT-PCR, which was inserted into the expression vector pPIC9K and transformed into P. pastoris GS115. We cultivated the high activated positive transformant for high-density fermentation.[Results]The recombinant pectin methylesterase (r-PmeT) expression level reached 428 U/mL. We have identified the enzymatic properties of r-PmeT. The optimum reaction temperature of r-PmeT was 75℃, and its thermostability was below 85℃. The optimum pH was 4.0, and it was stable between pH 2.0 and 7.0.[Conclusion]The recombinant Pichia pastoris could express high level pectin methylesterase from T. leycettanus JCM12802, which shows excellent application potential in its future industrial.
Key words: pectin pectin methylesterase high temperature fungi Pichia pastoris
果胶是由不同酯化程度的多聚半乳糖醛酸以α-1, 4-糖苷键聚合而成的带负电荷的复杂高分子多糖,其侧链还连有鼠李糖、阿拉伯糖、半乳糖等多种碳水化合物,其分子量通常为50000–300000[1]。作为自然界中目前唯一报道的酸性带负电荷的多糖类物质,果胶具有良好的增稠、胶凝、乳化等作用,已被广泛应用于药品、食品、印刷、日用化妆品等各个领域。
目前果胶的生产主要从柑橘皮、甜菜渣等植物中提取[2],通常从自然界中直接获得的果胶主要为高甲氧基果胶,而相比于高甲氧基果胶,低甲氧基果胶具有凝胶条件简单、容易调节操作、成胶几乎不需要蔗糖等优点,使其具有重要的应用前景。我国生产低甲氧基果胶的技术主要是化学方法,此法会造成环境极大污染。与传统化学法相比,酶法是利用果胶甲脂酶将高甲氧基果胶脱脂转化生产低甲氧基果胶,具有环保、条件温和、产品质量高和低成本等优点[3]。但该技术尚处于起步阶段,主要由于:一方面目前已报道的果胶甲酯酶热稳定性差,催化效率低不能满足生产工艺的需求;另一方面,果胶甲酯酶表达量低,价格高昂也严重限制了它在低甲氧基果胶生产中的应用。
果胶甲酯酶(Pectin methylesterase,PME,EC 3.1.1.11)属于碳水化合物酯酶第8家族的羧酸酯酶,对甲酯化程度较高的果胶有最高酶活,能高效催化果胶的甲氧酯水解,生成甲醇和果胶酸[4]。PME在生物界中的分布很广泛,细菌、真菌、植物,甚至昆虫中都有发现[5]。大多数果胶甲酯酶的分子量为35–50 kDa,最适pH为4.0–8.0之间,最适温度为40–50 ℃[6]。通常情况下,真菌来源的PME对底物的特异性有着更广的适应范围,以一种随机的方式降解果胶甲基。而植物的PME属于多基因家族,能够线性作用于半乳糖醛酸链以产生游离的羧基[4]。工业上,果胶甲酯酶除了用于低甲氧基果胶的生产,还可以应用于食品、化妆品和制药行业等[7]。
本研究选用毕赤酵母(Pichia pastoris)表达系统,克隆表达了一株来自于耐热菌蓝状菌T. leycettanus JCM12802的PmeT基因。重组表达的果胶甲酯酶(r-PmeT)最适反应温度为75 ℃,且在85 ℃以下具有较好的热稳定性;最适反应pH为4.0,pH 2.0?7.0时有较好的稳定性;发酵液表达效价高达428 U/mL,是用于酶法生产低甲氧基果胶的最好候选者之一,为PME的产业化奠定了基础。其优越的性质也为扩充PME的应用范围和工业前景提供了可能。
1 材料和方法 1.1 材料
1.1.1 菌株与质粒: 蓝状菌T. leycettanus JCM12802菌株购自日本微生物保藏中心(JCM RIKEN BRC)。用于基因克隆的大肠杆菌Escherichia coli Trans-T1和质粒pEASY-T3均购自北京全式金生物公司。P. pastoris GS115菌株和pPIC9K购自Invitrogen公司。
1.1.2 主要试剂和仪器: 实验所用的限制性内切酶购自TaKaRa公司;真菌DNA提取试剂盒,质粒提取和胶回收试剂盒购自Omega生物公司;SV总RNA纯化系统和cDNA合成试剂盒购自TOYOBO (Tokyo,Japan);蛋白质Marker,FastPfu DNA Polymerase购自全式金公司;其他试剂均为国产分析纯。PCR仪购自伯乐公司(BioRad),离心机购自日立(HITACHI)公司,小型发酵罐购自瑞士比欧(Bioengineering AG)。
1.1.3 培养基和培养条件: 大肠杆菌培养基LB、酵母生长培养基YPD、转化培养基MD以及诱导表达培养基BMGY、BMMY、发酵培养基10×Basal Salts、微量盐溶液PTM1均根据Invitrogen公司操作手册配制。
1.2 果胶甲酯酶基因PmeT的克隆 耐热真菌蓝状菌T. leycettanus JCM12802已由上海美吉公司完成基因组的草图测序,经注释分析其中含有一个典型的果胶甲酯酶基因PmeT。采用GENSCAN软件(http://genes.mit.edu/GENSCAN.html)和SignalP 4.0 (http://www.cbs.dtu.dk/services/SignalP/)分别预测分析了PmeT基因的内含子、外显子,以及其蛋白的信号肽序列,根据分析结果设计了用于扩增PmeT基因成熟蛋白编码区的一对扩增引物PmeT-12802-F:5’-GCGCGAATTCGCAAG TCGAATAACTGCCCCAGCTG-3’;PmeT-12802-R:5’-GCAGGCGGCCGCCTAAGAGAGATAGCTCGTATCGACC-3’ (下划线显示的酶切位点EcoR Ⅰ和NotⅠ)。
为了获得PmeT基因的cDNA序列,将T. leycettanus JCM12802菌株在黄豆粉培养基中45℃培养3–5 d,收集菌丝并在液氮中研磨成细粉,用SV总RNA纯化系统提取总RNA,并用TOYOBO反转录试剂盒合成cDNA第一条链。以此为模板,用引物PmeT-12802-F和PmeT-12802-R进行PCR扩增,产物经纯化回收连接到载体pEASY-T3上,并转化至E. coli Trans-T1菌株中测序。
1.3 果胶甲酯酶基因PmeT的序列分析 基因的序列特征分析主要通过Vector NTI Advance 10软件(Invitrogen)进行,一致性及新颖性分析通过BLAST (http://blast.ncbi.nlm.nih.gov/Blast/)进行比对。酶蛋白的特征修饰如信号肽、糖基化位点、定位信号等均采用在线分析(http://www.cbs.dtu.dk/services/)完成。蛋白的多序列比对通过ClustalW (http://www.ebi.ac.uk/clustalW/)软件实现。
1.4 重组表达质粒的构建、转化与筛选 将测序正确的PmeT基因和质粒pPIC9K同时用EcoR Ⅰ和NotⅠ进行双酶切,分别胶回收基因和载体片段,然后过夜连接,转化E. coli Trans1感受态细胞,涂布于LB氨苄抗性平板培养过夜,挑取单菌落进行菌落PCR验证,验证正确的克隆于25 mL氨苄抗性的LB液体培养基中培养12 h左右,抽提质粒测序验证,得到正确的重组表达载体并命名为pPIC9K-PmeT。
采用BglⅡ酶切表达载体pPIC9K-PmeT对其线性化,电转化至毕赤酵母GS115感受态细胞,用1 mol/L的山梨醇重悬并涂布于MD平板,30 ℃培养3 d至长出单菌落。随机挑取大量转化子直接转移到高浓度G418 (600 μg/mL)的YPD平板,30 ℃培养1 d。
挑选10个能在高浓度G418平板上生长迅速的单菌落接种于3 mL BGMY培养基中30 ℃生长2 d,离心收集细胞,换入1 mL BMMY培养基30 ℃诱导培养2 d。对诱导上清液进行的果胶甲酯酶的酶活,从中筛选出果胶甲酯酶活性高的转化子。
果胶甲酯酶活性测定方法为NaOH滴定法[8]。反应体系包括1 mL恰当稀释的酶液和25 mL 0.1% (W/V)橘皮果胶(pH 5.0),底物中加入NaCl至终浓度为117 mmol/L,40 ℃反应10 min。反应体系通过20 mmol/L NaOH溶液自动滴定,保持一定的pH。单位酶活(U)的定义如下:上述标准条件下,每分钟释放1 μmol酸所消耗的酶量。
1.5 发酵罐水平果胶甲酯酶的表达及活性测定 选取摇床水平果胶甲酯酶活性高的转化子,对其在发酵罐条件下进行果胶甲酯酶的表达。重组酵母的发酵为高细胞密度补料发酵,发酵过程分为菌株培养阶段、碳源饲喂阶段和诱导表达阶段,具体方法见Invitrogen操作手册。发酵过程分为4个阶段。(1)菌株培养阶段:发酵培养基10×Basal Salts接种前首先加入氨水使培养基的pH达到5.0 (氨水同时也作为菌株生长的氮源),再按每升培养基加4.37 mL的量加入PTM1。5%–10%接种种子液,通气搅拌培养18–24 h;(2)碳源添加阶段:流加25%葡萄糖(每升中含12 mL PTM1),流加量为36 mL/(h·L),培养4 h。(3)碳源-甲醇混合添加阶段:流加25%葡萄糖:甲醇(8:1)培养4 h,流加量为9 mL/(h·L)。(4)诱导表达阶段:加入诱导剂甲醇(每升中含12 mL PTM1),使甲醇终浓度维持在0.3%。在诱导过程中每隔24 h取样1次测定表达的果胶甲酯酶的活性,并同时进行SDS-PAGE,监测表达量的累积情况。
1.6 重组果胶甲酯酶r-PmeT的纯化 下罐的发酵培养液首先经过4 ℃、8000 r/min离心15 min,然后通过0.2 μm孔径的中空纤维膜组件(天津膜天膜公司)进行除菌处理,得到无菌无不溶杂质的发酵液。其次利用6 kDa的Vivaflow超滤膜包(Vivascience,Hannover,Germany)对发酵液进行浓缩,浓缩液用30%–80%的硫酸铵分级沉淀,室温下12000 r/min离心20 min,沉淀物用20 mmol/L柠檬酸-磷酸氢二钠缓冲液(pH 6.5)重悬。
粗酶液用5 mL HiTrapTM脱盐柱进行脱盐处理,进一步用预先经缓冲液平衡的HiTrap Q Sepharose XL 5 mL FPLC柱子(GE Healthcare,Uppsala,Sweden)进行纯化,洗脱液使用同种缓冲液,NaCl浓度从0–1.0 mol/L呈线性梯度递增,流速控制在1.0 mL/min。有果胶甲酯酶活性的洗脱液通过12% SDS-PAGE验证。蛋白浓度以牛血清白蛋白为底物利用蛋白定量试剂盒(Bio-Rad,Hercules,CA,USA)测定。
1.7 重组果胶甲酯酶r-PmeT酶学性质的测定 分别配制pH 3–7的不同pH的底物,并用不同pH的缓冲液稀释r-PmeT,在40 ℃的条件下反应10 min,测定纯化的r-PmeT在不同pH条件下的果胶甲酯酶活力,并绘制pH对重组果胶甲酯酶r-PmeT的影响曲线。最适pH条件反应10 min,分别测定20–90 ℃不同温度下的酶活力,绘制温度对重组果胶甲酯酶r-PmeT的影响曲线;将r-PmeT在65、75、85 ℃下保温不同时间(2、5、10、20、30、60 min)测定剩余相对酶活力,绘制温度稳定性曲线。在酶促反应体系中加入不同的金属离子和化学试剂,终浓度为1 mmol/L,在最适反应条件下测定果胶甲酯酶相对酶活力。
分别配制0.1%、0.2%、0.4%、0.5%、0.6%、0.8%、1.0%浓度的底物,在酶反应最适条件下反应1 min,根据反应曲线,记录30 s (一级反应时间)时的NaOH消耗体积,计算相应的反应速率。利用Michaelis-Menten为模型计算出Km和Vmax。
酶的比活单位指的是每毫克酶蛋白所表现出的酶活性单位(U)。通过Bradford法,测定纯化的果胶甲酯酶蛋白含量,同时在最适pH 4.0和40 ℃条件下,测定果胶甲酯酶r-PmeT活性,由此得到酶的比活(U/mg酶蛋白)。
2 结果和分析 2.1 果胶甲酯酶基因pmeT的克隆和序列分析 根据T. leycettanus JCM12802基因组草图中果胶甲酯酶基因PmeT序列,发现pmeT基因全长为1422 bp,含有6个内含子(121–189、327–404、485–555、700–773、835–894、1090–1163 bp,cDNA全长为996 bp,推导编码332个氨基酸和一个终止密码子,前18个氨基酸为信号肽序列。本实验先提取了在黄豆粉培养基生长的T. leycettanus JCM12802菌株的总RNA,反转录得到cDNA,并以此为模板,直接扩增获得果胶甲酯酶基因PmeT的成熟基因,并连接到pEASY-T3上,测序结果表明与理论预测的序列一致。PmeT基因完整的序列已经提交至GenBank数据库,序列号为KY070588。
推导的PmeT氨基酸序列与来源于T. stipitatus ATCC 10500的假定的果胶甲酯酶基因(XP_002484603.1)的一致性为76%,与Aspergillus luchuensis来源的果胶甲酯酶(GAT29911.1)一致性为62%。经预测,成熟蛋白的分子量为35.1 kDa,等电点为4.6,含有一个可能的N-糖基化位点N226N227S228。多序列比对结果显示果胶甲酯酶可能的催化残基D159、D180和R246位点,在PmeT序列中也完全保守[9]。
2.2 重组毕赤酵母的构建及筛选 分别用EcoR Ⅰ和Not Ⅰ双酶切测序正确的重组质粒pEASY-T3-PmeT和表达质粒pPIC9k,回收片段和载体,并连接转化E. coli Trans-T1,构建表达载体pPIC9k-PmeT。用限制性内切酶EcoR Ⅰ和Not Ⅰ进行酶切验证,得到大小950 bp和9 kb的片段,酶切结果正确。表达载体pPIC9K-PmeT经gl Ⅱ线性化后通过电击转化导入P. pastoris GS115感受态细胞,其转化液涂布于MD平板上,30 ℃培养3 d。获得的转化子中,挑取300个转化子直接转接到高浓度的G418 (600 μg/ml)平板上,继续培养1 d,挑选出10个明显比其他克隆生长快速的菌株。对以上10个克隆,通过甲醇诱导72 h取样,按照方法1.4所述对诱导液上清进行果胶甲酯酶活力的测定,结果表明5#号转化子酶活性最高,达到了1.6 U/mL。
2.3 重组酵母菌发酵罐水平果胶甲酯酶的表达 选择摇床水平对表达量高的毕赤酵母重组菌株5#号进行3.7 L发酵罐(Bioengineering AG)发酵研究,发酵过程具体的操作方法见Invitrogen操作手册。在甲醇诱导表达阶段,每24 h取样检测果胶甲酯酶的酶活性,并进行SDS-PAGE分析。随着甲醇的诱导,上清中果胶甲酯酶活力显著增加,分泌的酶蛋白不断积累(图 1)。经甲醇诱导120 h后,重组表达的果胶甲酯酶r-PmeT的活力达到最高,发酵效价为428 U/mL。经Bradford法测得发酵液总蛋白浓度为3.2 mg/mL,BioRad的Gel Doc? XR+软件扫描显示目的蛋白为2.98 mg/mL,占发酵总蛋白的93.1%。
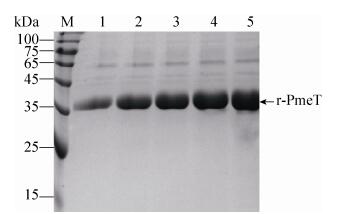 |
| 图 1 3.7 L发酵罐表达果胶甲酯酶不同时间取样的SDS-PAGE Figure 1 SDS-PAGE of expressed pectin esterase in the 3.7 L fermentor with different induction time. M: standard protein molecular weight; lanes 1–5: the expression of r-PmeT after induced 24, 48, 72, 96, 120 h by methanol, respectively |
| 图选项 |
2.4 重组表达果胶甲酯酶r-PmeT的纯化 取诱导5 d的发酵液,经离心、硫酸铵沉淀和离子交换层析之后得到电泳纯,在SDS-PAGE显示单一的条带(图 2),重组酶表观分子为37 kDa,比理论分子量35.1 kDa稍大,推测可能因为存在糖基化修饰。
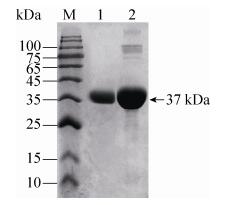 |
| 图 2 重组酶r-PmeT纯化的SDS-PAGE Figure 2 SDS-PAGE analysis of purified r-PmeT. M: standard protein molecular weight; lane 1: the purified r-PmeT; lane 2: precipitate of the culture supernatant after addition of ammonium sulfate |
| 图选项 |
2.5 表达产物果胶甲酯酶r-PmeT的酶学性质测定
2.5.1 pH和温度对果胶甲酯酶r-PmeT的影响: 纯化后的r-PmeT在40 ℃下测定的最适pH为4.0 (图 3-A),pH 3.0–5.0均具有较高的酶活力,保持最大酶活力的60%以上,当pH≥5.0时,酶活迅速降低,在pH 7.0时几乎检测不到酶活性。pH 4.0时r-PmeT的最适温度为75 ℃ (图 3-B),r-PmeT具有非常宽的温度作用范围,酶活在45–80 ℃时仍能保持最大活力的60%。即使在20–40 ℃较低的温度时,仍然具有相对高的活性,大于40%,甚至在85 ℃时,仍能检测到最高的酶活力的30%。热稳定性分析表明r-PmeT在65 ℃下处理1 h,相对酶活力能保持在90%左右(图 4),75 ℃热处理时,前20 min内酶活持续下降,酶活降至70%之后酶活变化不大,保持70%左右,85 ℃处理5 min时,酶活迅速下降至50%,之后酶活缓慢下降,30 min后酶活保持在20%左右。
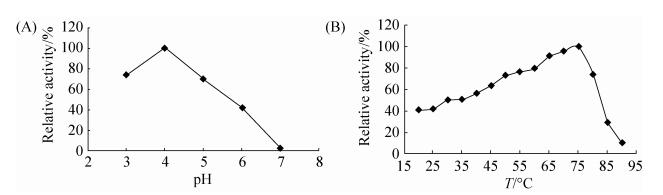 |
| 图 3 pH和温度对重组酶r-PmeT活力的影响 Figure 3 Effect of pH and temperature on recombinant enzyme activity. A: effect of pH activity; B: effect of temperature on activity |
| 图选项 |
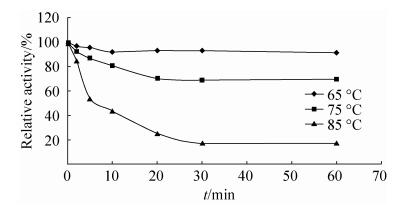 |
| 图 4 热稳定性曲线 Figure 4 Thermostability of r-PmeT at 65, 75, 85 ℃ |
| 图选项 |
2.5.2 金属离子和化学试剂对果胶甲酯酶r-PmeT的影响: 通过对测定数据(表 1)分析可知,在1 mmol /L的浓度情况下,化学试剂(EDTA、SDS、β-Mercaptoethanol)和大多数的金属离子(Na+、K+、Mn2+、Ag+、Mg2+、Ca2+)对该酶都没有明显影响,而Co2+、Cr3+、Cu2+、Ni+、Fe3+、Zn2+离子对纯化r-PmeT有增强作用,酶活力的增强幅度10%–20%不等。表明该果胶甲酯酶对金属离子和化学试剂均具有较好的抵抗能力,适合在工业环境条件下应用。
表 1. 1 mmol/L浓度的金属离子及相关化学试剂对r-PmeT的影响 Table 1. Effects of metal ions and chemicals at 1 mmol/L on the activity of r-PmeT
| Reagent | Relativity activity/% |
| None | 100.0 |
| Na+ | 91.9 |
| K+ | 104.5 |
| Ca2+ | 105.1 |
| Co2+ | 116.1 |
| Cr3+ | 119.7 |
| Ag+ | 108.2 |
| Ni+ | 119.3 |
| Mg2+ | 105.1 |
| Fe3+ | 118.1 |
| Zn2+ | 112.8 |
| Mn2+ | 96.3 |
| Cu2+ | 114.8 |
| EDTA | 95.8 |
| SDS | 91.6 |
| β-mercaptoethanol | 90.9 |
表选项
2.5.3 果胶甲酯酶r-PmeT的Km和Vmax测定: 标准条件下,通过对不同浓度底物反应的测定,经Michaelis-Menten模型计算出Km和Vmax的数值分别为2.4 mmol/L和31.07 mmol/(min·mg),比活性为140 U/mg。
3 讨论 低甲氧基果胶是一种在食品、工业、医疗等行业中广泛应用的物质[10],但目前国内生产方法仍停留在化学酸水解,产率低,能源利用率低,无法满足生产需求,导致其价格上涨[11]。果胶甲酯酶可以迅速对果胶分子进行去甲基化反应,从而达到将从植物中提取的高甲氧基果胶高效转化为低甲氧基果胶的目的,由此,酶法生产低甲氧基果胶法亟需规模化。本文从嗜热真菌T. leycettanus JCM12802中首次分离得到了酸性耐高温的果胶甲酯酶PmeT,并在毕赤酵母中进行了高效表达研究。
一般来说,天然微生物产果胶甲酯酶的同时也产多聚半乳糖醛酸酶和果胶裂解酶,其发酵的粗酶液水解果胶酯键的同时也会在果胶主链的α-1, 4-糖苷键发生水解作用或消去作用,缩短果胶主链。本研究从从嗜热真菌T. leycettanus JCM12802中克隆出的单一的果胶甲酯酶基因,构建毕赤酵母基因工程菌株,该菌株能够分泌单一的果胶甲酯酶,特异性水解果胶酯键,克服天然微生物同时产多种果胶酶的问题,优化了低甲氧基果胶的生产加工过程。
Jiang等[12]和Pan等[13]分别实现了黑曲霉和产黄青霉的果胶甲酯酶Pme基因在毕赤酵母中异源高效表达,表达量分别为10.2 mg/L和1.09 U/mL。陈献忠等[14]通过在酿酒酵母表面展示表达果胶甲酯酶可达到2.6 U/g干酵母,相比这些报道的研究结果而言,本文重组果胶甲酯酶r-PmeT表达量达到428 U/mL,远高出此前报道中的产量。果胶甲酯酶在酵母中的高效表达为其在低甲氧基果胶生产、饲料和食品等行业的工业化大规模应用提供了前提。
目前所发现的果胶甲酯酶最适温度介于40–50 ℃[6],作用温度均偏低,高于50 ℃时稳定性非常差,严重降低了酶法生产的效率。本文中重组果胶甲酯酶的最适作用温度为75 ℃,并且在75 ℃时非常稳定,处理1 h仍然能保留60%以上的活性。该酶除了耐热性质好以外,在低温区也能保持40%以上的酶活,有着很宽的温度适应性。提高酶法生产低甲氧基果胶的作用温度,可使高甲氧基果胶能够低成本、无污染地快速转化为低甲氧基果胶,能够满足各个行业生产的需要。
总的来说,本研究首次获得了一个酸性耐热的果胶甲酯酶基因,并实现了在毕赤酵母中的高水平表达,高温果胶甲酯酶表达量达到了3 g/L,在75 ℃条件下仍然非常稳定,比活性达到了140 U/mg。其优良的性质拓宽了甲酯酶的应用领域,突破了低温的限制,为扩充果胶甲酯酶的应用范围和工业前景提供了可能,具有很好的工业前景。在接下来的实验中,将会深入研究该酶的耐热机理,并进行改造提高表达量与酶活力。
References
| [1] | Harholt J, Suttangkakul A, Vibe Scheller H. Biosynthesis of pectin. Plant Physiology, 2010, 153(2): 384-395. DOI:10.1104/pp.110.156588 |
| [2] | Tu GY, Wang ZW, Wang ZN. Preparation and application of pectin. Food and Drug, 2007, 9(6): 50-55. (in Chinese) 涂国云, 王正武, 王仲妮. 果胶的制备与应用. 食品与药品, 2007, 9(6): 50-55. |
| [3] | Ren JH, Xu YQ. Study on application of low methoxyl pectin. Food Engineering, 2006(2): 19-20, 26. (in Chinese) 任建辉, 徐雅琴. 低甲氧基果胶的研究概况. 食品工程, 2006(2): 19-20, 26. |
| [4] | Micheli F. Pectin methylesterases:cell wall enzymes with important roles in plant physiology. Trends in Plant Science, 2001, 6(9): 414-419. DOI:10.1016/S1360-1385(01)02045-3 |
| [5] | Pelloux J, Rustérucci C, Mellerowicz EJ. New insights into pectin methylesterase structure and function. Trends in Plant Science, 2007, 12(6): 267-277. DOI:10.1016/j.tplants.2007.04.001 |
| [6] | Sakai T, Sakamoto T, Hallaert J, Vandamme EJ. Pectin, pectinase, and protopectinase:production, properties, and applications. Advances in Applied Microbiology, 1993, 39: 213-294. DOI:10.1016/S0065-2164(08)70597-5 |
| [7] | Kashyap DR, Vohra PK, Chopra S, Tewari R. Applications of pectinases in the commercial sector:a review. Bioresource Technology, 2001, 77(3): 215-227. DOI:10.1016/S0960-8524(00)00118-8 |
| [8] | Fries M, Ihrig J, Brocklehurst K, Shevchik VE, Pickersgill RW. Molecular basis of the activity of the phytopathogen pectin methylesterase. The EMBO Journal, 2007, 26(17): 3879-3887. DOI:10.1038/sj.emboj.7601816 |
| [9] | Jenkins J, Mayans O, Smith D, Worboys K, Pickersgill RW. Three-dimensional structure of Erwinia chrysanthemi pectin methylesterase reveals a novel esterase active site. Journal of Molecular Biology, 2001, 305(4): 951-960. DOI:10.1006/jmbi.2000.4324 |
| [10] | Li C, Shan Y, Li GY. Optimization on enzymatic preparation of low-methoxy pectin. Food & Machinery, 2010(2): 110-114. (in Chinese) 李川, 单杨, 李高阳. 酶法制备低甲氧基果胶的工艺优化研究. 食品与机械, 2010(2): 110-114. |
| [11] | Liu YD, Zhang L, Chen GG. The present situation of low methoxyl pectin producing technology and its prospect. Academic Periodical of Farm Products Processing, 2008(1): 57-58, 85. (in Chinese) 刘忆冬, 张磊, 陈国刚. 低甲氧基果胶生产工艺现状及其发展前景. 农产品加工, 2008(1): 57-58, 85. |
| [12] | Jiang XP, Chen P, Yin ML, Yang Q. Constitutive expression, purification and characterisation of pectin methylesterase from Aspergillus niger in Pichia pastoris for potential application in the fruit juice industry. Journal of the Science of Food and Agriculture, 2013, 93(2): 375-381. DOI:10.1002/jsfa.5771 |
| [13] | Pan X, Tu T, Wang LW, Luo HY, Ma R, Shi PJ, Meng K, Yao B. A novel low-temperature-active pectin methylesterase from Penicillium chrysogenum F46 with high efficiency in fruit firming. Food Chemistry, 2014, 162: 229-234. DOI:10.1016/j.foodchem.2014.04.069 |
| [14] | Chen XZ, Xiao Y, Shen W, Fan Y. Surface display of pectinesterase on Saccharomyces cerevisiae for efficient bioethanol production from sweet potato starch. Acta Microbiologica Sinica, 2016, 56(6): 922-931. (in Chinese) 陈献忠, 肖艳, 沈微, 樊游. 表面展示表达果胶酯酶的重组酿酒酵母构建及乙醇发酵. 微生物学报, 2016, 56(6): 922-931. |
