朱青, 陆震鸣

 , 李华祥, 史劲松, 许正宏
, 李华祥, 史劲松, 许正宏

江南大学药学院, 粮食发酵工艺与技术国家工程实验室, 工业生物技术教育部重点实验室, 江苏 无锡 214122
收稿日期:2017-02-27;修回日期:2017-03-29;网络出版日期:2017-05-12
基金项目:国家自然科学基金(31401931)
*通信作者:陆震鸣, Tel/Fax:+86-510-85918206;E-mail:zmlu@jiangnan.edu.cn
许正宏, Tel/Fax:+86-510-85918206;E-mail:zhenghxu@jiangnan.edu.cn
摘要:[目的]采用双向电泳(2DE)、质谱技术和实时荧光定量PCR(RT-qPCR)技术分析樟芝无性孢子萌发相关蛋白。[方法]分别提取培养0 h和24 h的樟芝孢子总蛋白并进行双向电泳分离,再用PDQuest软件进行差异蛋白分析,并用MALDI-TOF-MS技术对差异蛋白进行鉴定;其次将鉴定成功的蛋白与孢子萌发相关蛋白的本地数据库进行比对,获得樟芝中的孢子萌发相关蛋白信息,最后用RT-qPCR技术对相关基因的转录水平进行分析。[结果]两组样品共有32个差异蛋白点,其中在24 h表达量上调的蛋白25个,下调的蛋白7个。将32个差异蛋白点挖取鉴定,成功鉴定24个。其中,与孢子萌发相关的蛋白有10个,分别为GerO、Ubc1、Cat-1、Snf1、Cas2、SfaD、Chaperonin、Fad5、Tyrosine-P和ChiA。[结论]该研究结果为进一步解析樟芝无性孢子萌发的分子机制提供了理论依据。
关键词: 樟芝 孢子萌发 双向电泳 荧光定量PCR
Analysis of germination-related proteins in Antrodia camphorata athroconidia by two-dimensional electrophoresis and mass spectrum
Qing Zhu, Zhenming Lu

 , Huaxiang Li, Jinsong Shi, Zhenghong Xu
, Huaxiang Li, Jinsong Shi, Zhenghong Xu

National Engineering Laboratory for Cereal Fermentation Technology, Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received 27 February 2017; Revised 29 March 2017; Published online 12 May 2017
*Corresponding author: Zhenming Lu, Tel/Fax: +86-510-85918206; E-mail:zmlu@jiangnan.edu.cn
Zhenghong Xu, Tel/Fax: +86-510-85918206;E-mail:zhenghxu@jiangnan.edu.cn
Supported by the National Natural Science Foundation of China (31401931)
Abstract: [Objective]Germination-related proteins in Antrodia camphorata athroconidia were analyzed by two-dimensional gel electrophoresis (2DE), mass spectrum, and real time fluorescent quantitative PCR (RT-qPCR).[Methods]We used 2DE to analyze total proteins of Antrodia camphorata arthroconidia after 0 h and 24 h of incubation. We identified differential proteins by PDQuest software and MALDI-TOF-MS. Then, we obtained germination-related proteins in Antrodia camphorata arthroconidia by matching the amino acid sequences of identified proteins to a local protein database. Finally, we used RT-qPCR to quantify relative expression levels of germination-related genes.[Results]A total of 32 differential expressed proteins, of which 25 up-regulated and 7 down-regulated, existed between non-germinated (0 h) and germinated (24 h) arthroconidia. Among these differential proteins, 24 proteins were successfully identified, and 10 proteins were involved in arthroconidial germination including GerO, Ubc1, Cat-1, Snf1, Cas2, SfaD, Chaperonin, Fad5, Tyrosine-P, and ChiA.[Conclusion]The results provide a theoretical basis for understanding of molecular mechanisms of athroconial germination of Antrodia camphorata.
Key words: Antrodia camphorata arthroconidial germination 2D gel electrophoresis RT-qPCR
樟芝(Antrodia camphorata)是生长于台湾地区特有牛樟树腐朽树干内壁的一种药食用真菌,传统用于解酒保肝、治疗腹泻等。樟芝含有包括三萜、多糖及甾体在内的多种有效成分[1],具有抗肿瘤、抗炎及抗氧化活性等药理活性[2-3]。樟芝具有宿主专一性,野生子实体数量稀少且生长速度缓慢,因此樟芝市场价格昂贵。深层发酵技术由于具有生产周期短、产品质量及批次稳定性好等优点,已成为目前规模化生产樟芝的主要方式之一[4]。
樟芝深层发酵后期在适宜的营养条件下可产生大量无性孢子[5]。樟芝无性孢子作为发酵接种物,能够在培养基中快速萌发[6]。进一步根据樟芝的无性繁殖过程(孢子→菌丝→菌球→孢子)建立了液体深层循环发酵工艺,该工艺可以免除樟芝发酵过程中的种子制备步骤,缩短生产周期,高效生产活性代谢产物[7]。虽然采用新一代测序技术破译了樟芝的全基因组序列,但对樟芝孢子在发酵过程中快速萌发的分子机制尚缺少深入研究[8]。
本研究采用双向电泳技术分析孢子萌发不同时期的蛋白表达水平差异,鉴定与孢子萌发相关的功能基因,并进一步采用实时荧光定量PCR (RT-qPCR)技术对功能基因的转录水平进行检测,为解析孢子萌发的分子机制提供理论基础,也为樟芝的发酵生产提供理论指导。
1 材料和方法 1.1 实验材料
1.1.1 主要材料: 樟芝菌株购买于美国模式菌种保藏中心,保藏编号为ATCC200183。磷酸、丙三醇、丙酮、三氯乙酸及培养基成分均来源于国药集团;溴酚蓝、苯甲基磺酰氟(PMSF)、考马斯亮蓝G-250、2D电泳样品提取液Ⅲ、30% (W/V)丙烯酰胺/甲叉双丙稀酰胺溶液(29:1)、改良型Bradford蛋白浓度测定试剂盒、UNIQ-10柱式Trizol总RNA抽提试剂盒、M-MuLV第一链cDNA合成试剂盒及引物合成等均为上海生工生物工程产品;尿素、二硫苏糖醇(DTT)、碘乙酰胺(IAM)、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、甘氨酸、两性电解液、过硫酸铵(APS)、四甲基乙二胺(TEMED)、低熔点覆盖琼脂糖及IPG胶条(24 cm,pH 3–10)、等购自美国伯乐公司(Bio-Rad);SYBR荧光染料购自Life Technologies公司。
1.1.2 实验仪器: NanoDrop 2000C分光光度计购自Thermo Scientific公司;等电聚焦仪(Ettan IPGphor 3 Isoelectric Focusing Unit)、垂直电泳设备(Ettan DALTsix Electrophoresis Unit)及扫描仪购自GE Healthcare公司;RT-qPCR仪(CFX Connect Optics Module Real-Time System)购自Bio-Rad公司。
1.1.3 培养基及溶液配制: PDA斜面培养基(g/L):马铃薯200,葡萄糖20,琼脂20,pH自然。种子培养基(g/L):葡萄糖20,酵母粉1.0,KH2PO4 3.0,MgSO4 1.5,pH 4.5。发酵培养基(g/L):葡萄糖20.0,酵母粉2.0,KH2PO4 3.0,MgSO4 1.5,pH 4.5。平衡液母液:尿素36 g,SDS 2 g,甘油20 mL,1.5 mol/L Tris-HCl (pH 8.8) 25 mL,以ddH2O定容至100 mL,于–20 ℃保存。平衡液Ⅰ:临用加入0.2 g DTT;平衡液Ⅱ:临用加入0.25 g碘乙酰胺。
1.2 樟芝节孢子萌发率测定 将PDA斜面培养樟芝菌株菌丝块接种于种子培养基,于26 ℃、150 r/min培养15 d,获得樟芝种子液。将孢子以1.0×106个/mL终浓度接种于发酵培养基,于26 ℃、150 r/min培养9 d,获得含无性孢子的樟芝发酵液。发酵液以四层无菌纱布及三层无菌擦镜纸过滤,获得樟芝孢子悬浮液。樟芝孢子液以0.9%生理盐水洗涤2次,以血球计数器计数孢子浓度。将孢子接种到发酵培养基,使孢子终浓度为1.0×106个/mL,培养24 h。每个样品设置3个平行,采集0 h未萌发孢子及培养24 h孢子样品显微拍照,以Image J软件测量孢子长度并计算孢子萌发率。当孢子长度大于其初始长度2倍时视为已萌发[6]。萌发率(%)=(已萌发孢子数/孢子总数)×100%。
1.3 总蛋白及RNA提取 采集的樟芝孢子样品,用pH 8.0的TE缓冲液洗涤至上清液澄清后,液氮研磨成细粉。根据文献[9-10]采用TCA/丙酮沉淀法提取樟芝孢子的总蛋白,以Bradford蛋白浓度测定试剂盒测定蛋白浓度。利用UNIQ-10柱式Trizol总RNA抽提试剂盒提取樟芝孢子中的总RNA,并以NanoDrop 2000C分光光度计对总RNA浓度及质量进行检测。
1.4 双向电泳及质谱鉴定 参照文献[9-10]的操作方法,每个样品的蛋白上样量为450 μg,胶条被动水化16 h,设置聚焦程序为:100 V 40 min,250 V 1.0 h,500 V 1.2 h,1000 V 1.5 h,5000 V 2.0 h,10000 V 2.0 h,10000 V 8.5 h,聚焦完毕,依次用平衡液Ⅰ及平衡液Ⅱ平衡15 min。将IPG胶条转移至SDS胶面上,以琼脂糖覆盖,进行第二向SDS-PAGE电泳。程序为:2 W/gel 2 h;16 W/gel 4 h。每个样品3个生物学重复,电泳实验重复3次。将凝胶以固定液固定2 h,清洗固定液,加入适量G-250染色液,过夜染色,用ddH2O漂洗至蛋白点清晰,用扫描仪采集图像。每个样品分离效果较好的3张图像用PDQuest 8.0软件进行蛋白点分析,将差异蛋白点(较对照组变化2倍以上的点)从凝胶上切下后进行质谱分析。获得的肽段信息分别与樟芝基因组数据库[8]及NCBI的樟芝EST序列数据库(https://www.ncbi.nlm.nih.gov/nucest/)进行匹配,蛋白得分≥35被认为匹配成功。
1.5 生物信息学分析 采用查阅文献和检索NCBI数据库(https://www.ncbi.nlm.nih.gov/)的方式,收集与孢子萌发功能相关的蛋白序列,以孢子萌发功能相关蛋白的FASTA序列建立本地数据库。运用BioEdit将本地数据库与双向电泳鉴定得到蛋白序列进行比对,E值≤10–8被认为匹配成功,获得樟芝孢子萌发相关蛋白点信息。未匹配上孢子萌发相关蛋白的序列进行BLASTp分析,从而获得蛋白功能信息。选取与孢子萌发相关的差异蛋白点,根据NCBI的樟芝EST序列及樟芝全基因组和氨基酸序列获得对应的cDNA序列,运用Beacon Designer 7设计RT-qPCR引物,引物序列见表 1。
表 1. 实时荧光定量PCR引物 Table 1. Primers used for RT-qPCR
| Gene names | Forwards (5’→3’) | Reverses (5’→3’) | Sizes/bp |
| gerO | AGAAGTTGAGGAGCAGAT | CACATTGAGCAGTTAGCA | 92 |
| ubc1 | TTCGCACTGTACTCTTATC | GCTCGTTCTCCTTGTAG | 99 |
| cat-1 | GCAGATTCACTTCATCAAG | TACCATAGTCAGGATTATCAC | 89 |
| chaperonin | GAATCGTCGGTCATTGT | TTGCTCGCATCATATCC | 80 |
| tyrosine-p | ATGCTATCCTGCGTATTG | GTGGTGTGGAACTGGTA | 91 |
| snf1 | CACCTCCGAAGCAACTC | TTCTCCACACCCTCCAT | 100 |
| chiA | CAGAGCACCGAGCAATG | GCGAATGAGCACGATGT | 90 |
| cas2 | GCAGACGACAACATCCT | GTTCTCCTCGACGAGCT | 228 |
| sfaD | ACCTGTGCCTACTCACCATCC | CTTGACATTGTTGCCTTCCTTCG | 102 |
| fad5 | GTCCAGGTCAAGAAGAAG | GATAACAGGTCCGTATGC | 117 |
| 18S rRNA | GCTGGTCGCTGGCTTCTTAG | CGCTGGCTCTGTCAGTGTAG | 123 |
表选项
1.6 RT-qPCR 通过分光光度计检测总RNA浓度和质量(1.8 < OD260/OD280 < 2.0)并稀释到适宜浓度,用M-MuLV第一链cDNA合成试剂盒进行逆转录,获得cDNA模板。RT-qPCR反应体系为:SYBR染料8.5 μL,正向引物0.5 μL,反向引物0.5 μL,cDNA模板1.5 μL,ddH2O 6.0 μL;反应程序为:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,45个循环。以樟芝18 rRNA基因序列为内参,未萌发的樟芝孢子样品为对照组,用2-ΔΔCt法计算基因的转录水平,每个样品做3个重复。
2 结果和分析 2.1 樟芝节孢子萌发率测定 摇瓶培养0 h及24 h樟芝孢子如图 1所示。未萌发节孢子呈短棒状,大小约为Φ3 μm×(4–10) μm。随着萌发的进行,孢子长度逐渐增加。培养24 h樟芝孢子样品萌发率为36.17%。
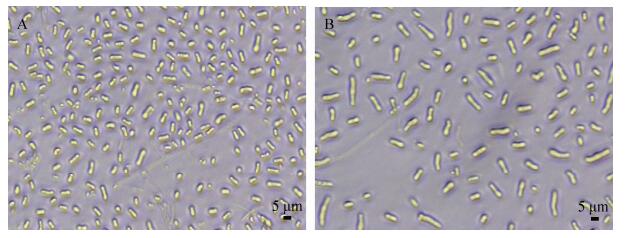 |
| 图 1 培养0 h (A)和24 h (B)的樟芝孢子形态 Figure 1 Morphology of Antrodia camphorata arthroconidia after 0 h (A) and 24 h (B) of incubation |
| 图选项 |
2.2 双向电泳图 双向电泳结束,获得不同萌发状态下的樟芝孢子总蛋白分离图谱(图 2)。其中,0 h樟芝孢子样品分离得到466个蛋白点,培养24 h樟芝孢子样品分离得到535个蛋白点,以0 h樟芝孢子样品为对照组,分析得到32个差异蛋白点,其中培养24 h孢子样品中有25个蛋白上调,7个蛋白下调,对差异蛋白点进行质谱鉴定,其中24个蛋白点鉴定成功。
 |
| 图 2 培养0 h (A)和24 h (B)樟芝孢子蛋白双向电泳分离图谱 Figure 2 2-DE maps and identification spots of the proteins extracted from arthroconidia after 0 h (A) and 24 h (B) of incubation |
| 图选项 |
将质谱获得肽段信息用Mascot软件在樟芝全基因组序列及NCBI提供的全部樟芝EST序列进行搜库,获得24个蛋白点氨基酸序列信息。运用BioEdit软件将获得蛋白点氨基酸序列与建立的本地数据库进行比对,获得樟芝孢子萌发相关基因10个,分别为:gerO、ubc1、cat-1、snf1、cas2、sfaD、chaperonin、fad5、tyrosine-P及chiA(表 2)。通过BLASTp分析获得其余14个蛋白点的功能信息(表 2),主要涉及能量代谢和遗传物质传递,包含酶类,如丙酮酸脱羧酶、烯醇化酶、锰超氧化物歧化酶、ATP依赖的DNA解旋酶及磷酸激酶等,其次包含一些结合蛋白,如RNA结构域结合蛋白和多聚腺苷酸结合蛋白等。
表 2. 差异蛋白的质谱分析结果 Table 2. Mass spectrometric analysis of differentially expressed proteins
| Gene name | Protein ID | Genome ID | Accession no. | Gene description | E-value |
| gerO | 3513 | ACg007192 | CAC17476.1 | Alpha tubulin | 1e-102 |
| ubc1 | 3007 | ACg007554 | CAA39812.1 | Ubiquitin-conjugating enzyme | 2e-032 |
| cat-1 | 7704 | ACg008952 | XP_956234.1 | Catalase-1 | 2e-089 |
| chaperonin | 3511 | ACg005546 | XP_007371274.1 | Chaperonin GroL | 0 |
| tyrosine-p | 4013 | ACg000101 | O13632.1 | Tyrosine-protein phosphatase | 1e-094 |
| snf1 | 3516 | ACg008567 | XP_011318803.1 | Carbon catabolite derepressing | 1e-019 |
| chiA | 7403 | ACg003863 | BAA36223.1 | Chitinase | 1e-008 |
| cas2 | 0112 | ACg002103 | CAT00781.1 | Beta class carbonic anhydrase | 2e-027 |
| sfaD | 5715 | ACg002995 | AAC33436.1 | G-protein beta subunit | 1e-157 |
| fad5 | 8707 | ACg003460 | AAC72755.1 | Delta-5 fatty acid desaturase | 1e-011 |
| – | 0041 | ACg001210 | KZT54586.1 | Galactose-1-phosphate uridyl transferase | 8e-23 |
| – | 0603 | ACg000543 | OCH88307.1 | RNA-binding domain-containing protein | 7e-152 |
| – | 1313 | ACg006078 | OJT10567.1 | Ran-specific GTPase-activating protein | 1e-098 |
| – | 2504 | ACg000216 | EMD41187.1 | Acyl-CoA dehydrogenase mitochondrial | 0 |
| – | 3407 | ACg008919 | KYQ38588.1 | Cytochrome b-c1 complex subunit 2 | 0 |
| – | 4615 | ACg004531 | KZT73975.1 | Pyruvate decarboxylase | 0 |
| – | 5013 | ACg008396 | KZT65455.1 | Nucleoside diphosphate kinase | 7e-104 |
| – | 5609 | ACg003161 | KZT01185.1 | Enolase | 0 |
| – | 5801 | ACg002270 | KZT07582.1 | Thiamin diphosphate-binding protein | 0 |
| – | 5819 | ACg006349 | EMD34998.1 | Aconitate hydratase | 0 |
| – | 8002 | ACg003890 | OKY66263.1 | Cytochrome c oxidase polypeptide 5 | 1e-83 |
| – | 8035 | ACg006010 | AAK82369.1 | Manganese superoxide dismutase | 2e-128 |
| – | 8703 | ACg000739 | KZT07931.1 | ATP-dependent DNA helicase | 0 |
| – | 9311 | ACg007343 | OCH93422.1 | Polyadenylate binding protein | 0 |
表选项
2.3 RT-qPCR分析 根据蛋白序列及功能分析结果,将与樟芝孢子萌发相关的10个基因,根据其cDNA序列设计引物进行RT-qPCR,验证萌发相关基因的转录表达水平在孢子萌发过程中的变化(图 3)。结果表明,6个萌发相关基因(gerO、ubc1、cat-1、chaperonin、fad5、chiA)在24 h mRNA表达水平显著上调,而基因snf1、cas2、sfaD及tyrosine-p的表达水平下调。
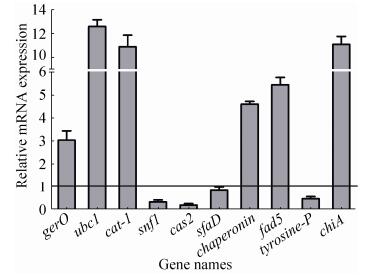 |
| 图 3 培养24 h樟芝孢子萌发相关基因表达量 Figure 3 The expression levels of the relative genes of Antrodia camphorata arthroconidia at 24 h. Expression levels of germination-related genes in the control group (Antrodia camphorata arthroconidia at 0 h) is 1 |
| 图选项 |
3 讨论 本实验将不同萌发状态下的樟芝孢子进行双向电泳及生物信息学分析,获得10个樟芝孢子萌发相关功能基因(gerO、ubc1、cat-1、snf1、cas2、sfaD、chaperonin、fad5、tyrosine-P、chiA)。其中,SfaD为G蛋白β亚基,与GanB(Gα)及GpgA(Gγ)亚基组成三聚体,能应答葡萄糖信号,并通过cAMP/PKA信号通路控制构巢曲霉分生孢子萌发,且SfaD、GpgA亚基对GanB的活化至关重要[11]。基因gerO编码α-微管蛋白,在萌发状态蛋白表达量升高。据Hu等报道[12],同源基因FaTUA1及FaTUA2编码α-微管蛋白,FaTUA2突变体孢子萌发率下降,在FaTUA2突变体过表达FaTUA1基因能部分恢复孢子萌发率,说明此对同源基因具有部分功能互换并与孢子萌发息息相关。Tyrosine-p能对粘菌肌动蛋白的酪氨酸进行磷酸化,并影响肌动蛋白在细胞内的定位,而休眠包囊萌发和肌动蛋白磷酸化之间具有一定的关联性[13]。同时,本实验检测到分子伴侣Chaperonin GroL,据Keiko Saegusaa等报道,分子伴侣为微管蛋白和肌动蛋白的折叠负责[14]。另外,检测到的基因snf1、fad5及cas2与能量代谢相关。?-5脂肪酸脱氢酶基因在高山被孢霉孢子萌发期间大量表达,为花生四烯酸的利用提供物质基础[15]。Snf1在调节葡萄糖阻遏基因转录方面发挥着重要作用,该基因突变体对碳源利用率降低并延迟孢子萌发进程[16]。Cas2在真菌中为线粒体碳酸酐酶,可催化二氧化碳和碳酸氢盐互变,调节细胞器内pH,辅助能量代谢正常进行,在大孢粪壳菌中Cas2突变体导致孢子萌发延迟[17]。在构巢曲霉中,几丁质酶(Chitinase)在孢子萌发期间大量表达,通过锚定在菌丝的顶点、分支点和孢子萌发管并合成几丁质使真菌细胞壁重构或成熟[18]。Cat-1为过氧化氢解毒酶,其缺失突变体孢子萌发率降低,对H2O2的敏感性高于野生型[19]。Ubc1泛素结合酶也在大豆疫霉游动孢子萌发期间表达量上调[20]。
针对10个孢子萌发相关功能基因,采用RT-qPCR技术对其转录水平进行了分析,发现其中8个基因的表达水平(gerO、ubc1、cat-1、cas2、chaperonin、fad5、tyrosine-P、chiA)在萌发24 h时上调,而snf1和sfaD的表达水平在萌发24 h时下调。gerO、ubc1、cat-1、chaperonin、fad5及chiA的蛋白及mRNA表达量在孢子萌发期间表达量均上调,这与文献报道一致[12, 14-15, 18-20]。另外,cas2及tyrosine-P蛋白表达水平上调,但mRNA表达水平却下调。据文献报道,RNA的转录与蛋白的翻译不一定同时到达峰值,其关联性甚至低于50%[21],蛋白质到达峰值时,可能RNA的转录达到谷底(存在auto feedback loop)。根据本研究蛋白及转录数据结果,推测外界营养条件改变可刺激受体偶联的GanB(Gα)、SfaD(Gβ)及GpgA(Gγ)组成三聚体,并通过cAMP/PKA途径调节孢子萌发。脂肪酸脱氢酶fad5可利用预存的脂肪酸为孢子萌发提供能量,而线粒体中的碳酸酐酶可调节能量代谢产生的细胞器pH异常,过氧化氢酶可确保各种代谢反应产生的过氧化氢的清除,从而确保萌发过程顺利进行。在孢子萌发过程中,参与运动的微管蛋白和构成细胞成分的蛋白大量表达,如gerO编码的微管蛋白、负责微管蛋白折叠的分子伴侣及chiA编码的用于构成细胞壁的几丁质酶,这些蛋白的表达为萌发过程中孢子增长及孢子结构的变化奠定了物质基础。
References
| [1] | Ao ZH, Xu ZH, Lu ZM, Xu HY, Zhang XJ, Dou WF. Niuchangchih (Antrodia camphorata) and its potential in treating liver diseases. Journal of Ethnopharmacology, 2009, 121(2): 194-212. DOI:10.1016/j.jep.2008.10.039 |
| [2] | Wu H, Pan CL, Yao YC, Chang SS, Li SL, Wu TF. Proteomic analysis of the effect of Antrodia camphorata extract on human lung cancer A549 cell. Proteomics, 2006, 6(3): 826-835. DOI:10.1002/(ISSN)1615-9861 |
| [3] | Geethangili M, Tzeng YM. Review of pharmacological effects of Antrodia camphorata and its bioactive compounds. Evidence-Based Complementary and Alternative Medicine, 2011, 2011: Article ID 212641. |
| [4] | Lu MC, El-Shazly M, Wu TY, Du YC, Chang TT, Chen CF, Hsu YM, Lai KH, Chiu CP, Chang FR, Wu YC. Recent research and development of Antrodia cinnamomea. Pharmacology and Therapeutics, 2013, 139(2): 124-156. DOI:10.1016/j.pharmthera.2013.04.001 |
| [5] | Geng Y, He Z, Lu ZM, Xu HY, Xu GH, Shi JS, Xu ZH. Antrodia camphorata ATCC 200183 sporulates asexually in submerged culture. Applied Microbiology and Biotechnology, 2013, 97(7): 2851-2858. DOI:10.1007/s00253-012-4513-2 |
| [6] | Lu ZM, He Z, Li HX, Gong JS, Geng Y, Xu HY, Xu GH, Shi JS, Xu ZH. Modified arthroconidial inoculation method for the efficient fermentation of Antrodia camphorata ATCC 200183. Biochemical Engineering Journal, 2014, 87: 41-49. DOI:10.1016/j.bej.2014.03.020 |
| [7] | Li HX, Lu ZM, Geng Y, Gong JS, Zhang XJ, Shi JS, Xu ZH, Ma YH. Efficient production of bioactive metabolites from Antrodia camphorata ATCC 200183 by asexual reproduction-based repeated batch fermentation. Bioresource Technology, 2015, 194: 334-343. DOI:10.1016/j.biortech.2015.06.144 |
| [8] | Lu MYJ, Fan WL, Wang WF, Chen T, Tang YC, Chu FH, Chang TT, Wang SY, Li MY, Chen YH, Lin ZS, Yang KJ, Chen SM, Teng YC, Lin YL, Shaw JF, Wang TF, Li WH. Genomic and transcriptomic analyses of the medicinal fungus Antrodia cinnamomea for its metabolite biosynthesis and sexual development. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(44): E4743-E4752. DOI:10.1073/pnas.1417570111 |
| [9] | Lin YL, Wen TN, Chang ST, Chu FH. Proteomic analysis of differently cultured endemic medicinal mushroom Antrodia cinnamomea T.T. Chang et W.N. Chou from Taiwan. International Journal of Medicinal Mushrooms, 2011, 13(5): 473-481. DOI:10.1615/IntJMedMushr.v13.i5 |
| [10] | Xu WN, Wang JJ, Li Q. Comparative proteome and transcriptome analysis of lager brewer's yeast in the autolysis process. FEMS Yeast Research, 2014, 14(8): 1273-1285. DOI:10.1111/fyr.2014.14.issue-8 |
| [11] | Lafon A, Seo JA, Han KH, Yu JH, D'Enfert C. The heterotrimeric G-protein GanB(α)-SfaD(β)-GpgA(γ) is a carbon source sensor involved in early cAMP-dependent germination in Aspergillus nidulans. Genetics, 2005, 171(1): 71-80. DOI:10.1534/genetics.105.040584 |
| [12] | Hu WQ, Zhang XP, Chen X, Zheng JW, Yin YY, Ma ZH. α1-Tubulin FaTuA1 plays crucial roles in vegetative growth and conidiation in Fusarium asiaticum. Research in Microbiology, 2015, 166(3): 132-142. DOI:10.1016/j.resmic.2015.01.001 |
| [13] | Budniak A, O'Daya DH. Tyrosine phosphorylation of actin during microcyst formation and germination in Polysphondylium pallidum. Protist, 2011, 162(3): 490-502. DOI:10.1016/j.protis.2010.11.004 |
| [14] | Saegusa K, Sato M, Sato K, Nakajima-Shimada J, Harada A, Sato K. Caenorhabditis elegans chaperonin CCT/TRiC is required for actin and tubulin biogenesis and microvillus formation in intestinal epithelial cells. Molecular Biology of the Cell, 2014, 25(20): 3095-3104. DOI:10.1091/mbc.E13-09-0530 |
| [15] | Lounds C, Eagles J, Carter AT, MacKenzie DA, Archer DB. Spore germination in Mortierella alpina is associated with a transient depletion of arachidonic acid and induction of fatty acid desaturase gene expression. Archives of Microbiology, 2007, 188(4): 299-305. DOI:10.1007/s00203-007-0248-3 |
| [16] | Lee SH, Lee J, Lee S, Park EH, Kim KW, Kim MD, Yun SH, Lee YW. GzSNF1 is required for normal sexual and asexual development in the ascomycete Gibberella zeae. Eukaryotic Cell, 2009, 8(1): 116-127. DOI:10.1128/EC.00176-08 |
| [17] | Elleuche S, P?ggeler S. β-Carbonic anhydrases play a role in fruiting body development and ascospore germination in the filamentous fungus Sordaria macrospora. PLoS ONE, 2009, 4(4): e5177. DOI:10.1371/journal.pone.0005177 |
| [18] | Yamazaki H, Tanaka A, Kaneko J, Ohta A, Horiuchi H. Aspergillus nidulans ChiA is a glycosylphosphatidylinositol (GPI)-anchored chitinase specifically localized at polarized growth sites. Fungal Genetics and Biology, 2008, 45(6): 963-972. DOI:10.1016/j.fgb.2008.02.008 |
| [19] | Wang NY, Yoshida Y, Hasunuma K. Loss of Catalase-1(Cat-1) results in decreased conidial viability enhanced by exposure to light in Neurospora crassa. Molecular Genetics and Genomics, 2007, 277(1): 13-22. |
| [20] | Li YG, Yang MX, Li Y, Liu WW, Wen JZ, Li YH. Differential gene and protein expression in soybean at early stages of incompatible interaction with Phytophthora sojae. Agricultural Sciences in China, 2011, 10(6): 902-910. DOI:10.1016/S1671-2927(11)60075-8 |
| [21] | King HC, Sinha AA. Gene expression profile analysis by DNA microarrays:promise and pitfalls. JAMA:The Journal of the American Medical Association, 2001, 286(18): 2280-2288. DOI:10.1001/jama.286.18.2280 |
