张继冉1,2, 方芳1,2, 陈坚1,2,4, 堵国成2,3,4


1.江南大学工业生物技术教育部重点实验室, 江苏 无锡 214122;
2.食品安全与营养协同创新中心, 江苏 无锡 214122;
3.糖化学与生物技术教育部重点实验室, 江苏 无锡 214122;
4.江南大学粮食发酵工艺与技术国家工程实验室, 江苏 无锡 214122
收稿日期:2015-09-06;修回日期:2015-12-07;网络出版日期:2016-06-04
资助课题:国家自然科学基金(31371821),国家“973计划”(2012CB720802);广东省科技计划项目(2015B020205002)
通信作者:Tel:+86-510-85918307;Fax:+86-510-85918309;E-mail:gcdu@jiangnan.edu.cn
摘要: [目的]研究鲁氏接合酵母氮源代谢特性,确定鲁氏接合酵母氮源代谢与酱油中氨基甲酸乙酯前体物瓜氨酸和尿素积累的关系。 [方法] 通过单一氮源培养、偏好型氮源培养和盐胁迫培养,检测不同条件下鲁氏接合酵母对精氨酸、瓜氨酸和尿素的代谢能力。[结果] 通过对鲁氏接合酵母氨基酸利用能力的分析,确定了甘氨酸、丙氨酸和天冬酰胺3种氨基酸为鲁氏接合酵母的偏好型氮源。在偏好型氮源存在时,鲁氏接合酵母对尿素和瓜氨酸的利用并不受到抑制,丙氨酸和甘氨酸还能够促进对二者的利用。鲁氏接合酵母在单一氮源培养条件下不会降解精氨酸而积累尿素和瓜氨酸,反而可以大量利用氨基甲酸乙酯的前体物尿素和瓜氨酸。但在盐胁迫下,鲁氏接合酵母利用尿素和瓜氨酸受到阻遏,从而造成酱油中氨基甲酸乙酯前体物不能被充分利用而积累。[结论]盐胁迫阻遏了鲁氏接合酵母对瓜氨酸和尿素的利用,从而造成酱油发酵过程中耐盐细菌所产生的氨基甲酸乙酯前体物的积累。
关键词: 鲁氏接合酵母 瓜氨酸 尿素 氨基甲酸乙酯 氮代谢阻遏 盐胁迫 偏好型氮源
Metabolism of ethyl carbamate precursors in soy sauce by Zygosaccharomyces rouxii ZQ02
Jiran Zhang1,2, Fang Fang1,2, Jian Chen1,2,4, Guocheng Du2,3,4


1.Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China;
2.Synergetic Innovation Center of Food Safety and Nutrition, Wuxi 214122, Jiangsu Province, China;
3.The Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, China National Engineering, Wuxi 214122, Jiangsu Province, China;
4.Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Supported by the National Natural Science Foundation of China (31371821), by the Major State Basic Research Development Program of China (2012CB720802) and by the Technology Research Program of Guangdong, China (2015B020205002)
Abstract: [Objective] To study nitrogen metabolism of Zygosaccharomyces rouxii and its relationship with the formation of soy sauce ethyl carbamate precursors. [Methods] Z. rouxii ZQ02 was cultivated with single source of nitrogen, preferred nitrogen sources or under salt stress, to investigate its ability of using arginine, citrulline and urea.[Results] Alanine, glycine and asparaginate were confirmed to be the preferred nitrogen sources of Z. rouxii ZQ02. Addition of preferred nitrogen sources did not inhibit the use of urea and citrulline, on the contrary, the consumption of urea and citrulline by Z. rouxii ZQ02 was stimulated with the addition of alanine and glycine. Z. rouxii ZQ02 did not accumulate any citrulline and urea from degradation of arginine. Urea and citrulline were used by Z. rouxii ZQ02 in the medium with single source of nitrogen. However, use of citrulline and urea by Z. rouxii ZQ02 was strongly inhibited under saline stress, resulting in the incomplete use of ethyl carbamate precursors.[Conclusion] Use of citrulline and urea by Z. rouxii ZQ02 was strongly inhibited under high salt stress, resulting in the accumulation of ethyl carbamate precursors produced by other microorganisms during soy sauce fermentation.
Key words: Zygosaccharomyces rouxii citrulline urea ethyl carbamate nitrogen catabolite repression salt stress preferred nitrogen sources
鲁氏接合酵母(Zygosaccharomyces rouxii)是酱油酿造主发酵期的增香酵母,具有极强的耐盐性(15%-20%),并在生长过程中产生乙醇、3-甲硫基丙醇、琥珀酸等风味物质。日式酱油酿造中,已经将添加鲁氏接合酵母作为常规酱油生产工艺[1-2]。关于鲁氏接合酵母的研究报道主要集中在其耐盐性及其耐盐机制[3-6],以及对酿造的增香等作用方面[7-8]。最新的研究结果表明鲁氏接合酵母与酱油中致癌副产物氨基甲酸乙酯的积累具有密切的联系[9]。
氨基甲酸乙酯(Ethyl carbamate,简称EC)是发酵食品(乳酪、酱油等)和酒精饮料(如葡萄酒、苹果酒、中国黄酒等)生产过程中产生的副产物[10-13],是一种2A级的致癌物[14]。氨基甲酸乙酯主要是通过前体物(尿素、瓜氨酸、氨甲酰磷酸等)和乙醇反应产生,加热和光照会加速反应。在韩国酱油生产中,鲁氏接合酵母对氨基甲酸乙酯产生的贡献主要是通过糖酵解途径产生少量乙醇(约2%)以及通过精氨酸脱亚氨基(ADI)途径积累了前体物瓜氨酸[9]。而Liu等的研究结果表明,ADI途径仅存在于原核生物及少量原生动物中[15],真核生物鲁氏接合酵母中不应存在ADI途径。对鲁氏接合酵母的全基因组测序(Accession: CU928173,CU928174,CU928175,CU928176,CU928177,CU928178,CU928179),结果也表明其中不存在ADI途径。Koh等证明了鲁氏接合酵母中不存在精氨酸酶活性[9],这表明鲁氏接合酵母不能通过尿素循环分解精氨酸而积累尿素。因此鲁氏接合酵母与氨基甲酸乙酯前体物瓜氨酸和尿素的产生关系尚待证明。酿酒酵母由于偏好型氮源(如谷氨酰胺,天冬酰胺等)的存在会导致其非偏好型氮源(如尿素,瓜氨酸,脯氨酸等)的利用被阻断,这种效应被称为氮代谢阻遏(NCR)效应。NCR效应是多种酒类饮料中氨基甲酸乙酯产生的重要原因[16]。而鲁氏接合酵母在偏好型氮源存在的情况下,尿素及瓜氨酸的积累趋势还未有研究报道。因此,确定Z. rouxii ZQ02是否因氮代谢阻遏积累尿素,及其对瓜氨酸产生的影响是非常必要的。
本研究主要考察了盐胁迫以及偏好型氮源对Z. rouxii ZQ02氮源利用的影响。通过考察鲁氏接合酵母对酱油中EC积累的关键前体氮源(瓜氨酸和尿素)的代谢方式,为寻找有效的调控方法,降低酱油中EC前体物积累,减少EC的产生和提高食品安全质量提供参考和依据。
1 材料和方法 1.1 材料
1.1.1 试剂与仪器: 精氨酸,瓜氨酸及尿素均购于中国上海生工生物工程有限公司,邻苯二甲醛(OPA)购自上海SIGMA试剂公司,乙腈和甲醇(色谱纯)均购自中国上海默克化工技术有限公司。其他试剂均为国产分析纯。UV2450型紫外、可见光分光光度计购于上海岛津有限公司。酱油样品取自广州珠江桥生物科技有限公司。
1.1.2 菌种及培养基: Z. rouxii ZQ02 为广州珠江桥生物科技有限公司保藏菌株。斜面保存培养基为YM (yeast extract-malt extract)琼脂培养基,种子培养基为YM培养基(购自Difco公司),发酵培养基为YNB (yeast nitrogen base without amino acids) 培养基(购自上海生工生物工程有限公司)。
1.2 Z. rouxii ZQ02的培养
1.2.1 种子液的培养: 从甘油管中吸取500 μL Z. rouxii ZQ02菌液,接种到含有25 mL YM培养基的250 mL三角瓶中,30 °C、200 r/min振荡培养48 h。
1.2.2 菌体分批培养: 从种子液中吸取1 mL转接至含有新鲜的25 mL YM培养基的250 mL三角瓶中,30 °C、200 r/min振荡培养24 h。将获得的菌液分装至2个15 mL离心管中,4 °C、8000 r/min低温离心10 min沉淀菌体,弃上清,pH 7.0 PBS缓冲液反复清洗菌体3次,加入10 mL生理盐水重悬浮菌体。
1.2.3 单一氮源利用情况的培养: 分别吸取1 mL重悬浮菌液加入含有精氨酸、瓜氨酸和尿素(5 g/L)的YNB(添加2%葡萄糖)培养基中,30 °C、200 r/min振荡培养48 h。
1.2.4 NaCl胁迫条件下单一氮源利用情况的培养: 分别吸取1 mL重悬浮菌液加入含有精氨酸、瓜氨酸和尿素(5 g/L)的YNB(添加2%葡萄糖)培养基(含18% NaCl)中,30 °C、200 r/min振荡培养48 h。
1.2.5 确定鲁氏接合酵母偏好型氮源的培养: 吸取1 mL重悬浮菌液加入含有20种混合氨基酸(每种氨基酸浓度 5 mmol/L)的YNB(添加2%葡萄糖)培养基中,30 °C、200 r/min振荡培养24 h
1.2.6 偏好型氮源存在条件下对单一氮源利用情况的培养: 分别吸取1 mL重悬浮菌液加入含有瓜氨酸和尿素(20 mmol/L)并分别混合有优势氮源(20 mmol/L)的YNB(添加2%葡萄糖)培养基中,30 °C、200 r/min振荡培养24 h。
1.3 取样及液相样品的处理 每间隔6 h或12 h取样1 mL置于1.5 mL离心管中待测,从中吸取200 μL稀释涂布于YM琼脂平板检测菌浓度变化情况,剩余800 μL菌液于10000 r/min离心5 min,取上清于新的洁净的离心管中。样品置于-20 °C保存。
样品前处理:取200 μL上清液样品与800 μL 5%三氯乙酸均匀混合,使用0.22 μm水性滤膜过滤。将过滤得到的溶液10000 r/min离心10 min,处理后的样品于-20 °C保存。
1.4 ODS柱前衍生化法测定氨基酸含量 衍生化试剂OPA溶液:取OPA 80 mg,加入0.4 mol/L硼酸缓冲液(pH 10.2) 7 mL、乙腈1 mL、巯基丙酸125 μL,混匀,4 °C保存)。色谱柱:ODS-2 hypersil柱(4.6 mm×250 mm,5 μm);流动相A:0.05 mol/L乙酸钠溶液-三乙胺-四氢呋喃(950:0.14:5,用2%乙酸调至pH 6.8);流动相B:0.16 mol/L乙酸钠溶液(用2%酸调至pH 6.8)-甲醇-乙腈(200:400:400),梯度洗脱;检测波长338 nm (0-26 min)/262 nm (26 min后),柱前衍生化及进样程序使用安捷伦公司氨基酸测定的AAAVWD方法[17]。
1.5 尿素的检测 尿素的测定方法为Clark所采用的高效液相色谱法[18],检测器为FLD检测器。
2 结果和分析 2.1 Z. rouxii ZQ02 偏好型氮源的确定 通过Z. rouxii ZQ02对20种氨基酸利用情况的研究,确定了Z. rouxii ZQ02的偏好氮源。如图 1所示,Z. rouxii ZQ02对20种氨基酸的利用率存在明显的差异,根据其转化率可以将氮源的利用分为3组。偏好型氮源(利用率大于40%),非偏好型氮源(利用率小于40%)以及积累型氮源。Z. rouxii ZQ02在相同的培养时间内对甘氨酸,丙氨酸和天冬酰胺的利用率超过了40%,这三者为Z. rouxii ZQ02的偏好型氮源。在非偏好型氮源中,作为尿素和瓜氨酸前体物的精氨酸未被消耗,且伴随其他氨基酸的代谢还被微量的合成。这说明Z. rouxii ZQ02在代谢过程中不消耗精氨酸,还会将代谢导向精氨酸的合成。
 |
| 图 1. Z. rouxii ZQ02对20种氨基酸的利用率 Figure 1. Consumption of 20 amino acids by Z. rouxii ZQ02. |
| 图选项 |
2.2 偏好型氮源对Z. rouxii ZQ02代谢积累氨基甲酸乙酯前体物的影响 通过向单一氮源培养基(含有瓜氨酸或尿素)中分别添加3种偏好型氮源,发现3种偏好型氮源对Z. rouxii ZQ02利用瓜氨酸和尿素的能力均无抑制作用。在3种偏好型氮源中,天冬酰胺对Z. rouxii ZQ02瓜氨酸及尿素的利用能力没有影响。而甘氨酸和丙氨酸对前体物的消耗还具有促进的作用。由图 2-A可知,在甘氨酸存在的条件下,尿素的利用效率被显著提高,消耗10 mmol/L的尿素的时间由未添加甘氨酸的18 h降低至6 h。而由图 2-B可以看出,丙氨酸促进了Z. rouxii ZQ02对瓜氨酸的利用,相同培养时间内,瓜氨酸的利用率提高了3倍,菌体的生长速率为未添加丙氨酸的1.6倍。
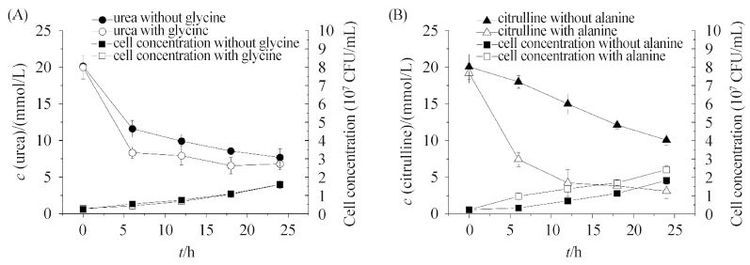 |
| 图 2. 偏好型氮源对Z. rouxii ZQ02代谢氨基甲酸乙酯前体物尿素(A)和瓜氨酸(B)的能力的影响 Figure 2. Effect of preferred nitrogen sources on the utilization of EC precursors urea (A) and citrulline (B) by Z. rouxii ZQ02. Error bars represent standard deviations (n = 3). |
| 图选项 |
2.3 盐胁迫对 Z. rouxii ZQ02 精氨酸、瓜氨酸、尿素代谢的影响 在酱油发酵过程中,一种常规的工艺是通过添加18% NaCl来抑制杂菌的生长。但高浓度的NaCl在抑制杂菌生长的同时,也显著影响了耐盐酵母的代谢活动。从Z. rouxii ZQ02对精氨酸的利用情况(图 3-A)可以得知,Z. rouxii ZQ02在以精氨酸为唯一氮源的培养基中,不消耗精氨酸,同时随着培养时间的增加,在培养结束时期还能够生成微量的精氨酸。说明Z. rouxii ZQ02在代谢过程中不利用精氨酸,并且能够通过自身的代谢作用将其他氮源合成精氨酸,从而满足自身的生长需要。同时,在添加精氨酸的情况下,菌体并没有通过尿素循环将精氨酸转化成尿素以及瓜氨酸,使尿素和瓜氨酸积累,反而消耗掉了培养基中原有的少量尿素。由此可以得知,精氨酸的加入不会造成Z. rouxii ZQ02对尿素和瓜氨酸的积累。
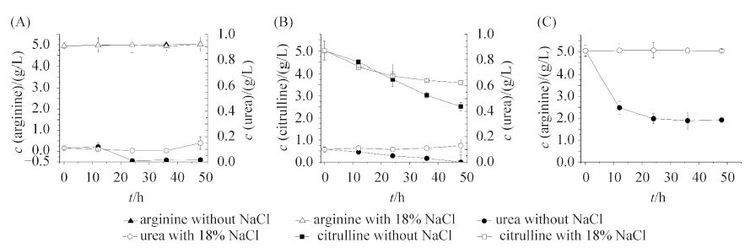 |
| 图 3. Z. rouxii ZQ02对精氨酸(A)、瓜氨酸(B)、尿素(C)的利用 Figure 3. Utilization of arginine (A), citrulline (B) and urea (C) by Z. rouxii ZQ02. Error bars represent standard deviations (n = 3). |
| 图选项 |
与对精氨酸的低利用率不同,Z. rouxii ZQ02 在不添加NaCl培养的情况下,对瓜氨酸保持了较高的利用率。如图 3-B所示,在48 h的培养过程中,共消耗了2.5 g/L的瓜氨酸。而在18% NaCl存在的情况下,Z. rouxii ZQ02在相同培养时间内对瓜氨酸的利用率下降了40%。这说明盐胁迫抑制了Z. rouxii ZQ02对瓜氨酸的利用。
如图 3-C所示,Z. rouxii ZQ02在正常培养的情况下,对尿素具有比瓜氨酸更高的利用率,在48 h的培养过程中,共利用了2.9 g/L的尿素。而在加入18% NaCl的条件下,尿素含量在整个培养过程中保持不变,说明Z. rouxii ZQ02对尿素的利用在18% NaCl的胁迫下完全被抑制。
2.4 酱油发酵过程游离氨基酸的变化 鲁氏接合酵母是酱油发酵过程中被用来增加风味的最常用的耐盐酵母。研究酱油发酵过程中游离氨基酸的变化趋势,尤其是与氨基甲酸乙酯前体物相关的氨基酸的变化趋势(精氨酸,瓜氨酸),有助于验证Z. rouxii ZQ02的氮源代谢特性及其与前体物积累的关系。如表 1所示,酱油中的游离氨基酸随着发酵过程逐步从原料中释放出来,总游离氨基酸量在盐水与成曲混合后的前7 d保持持续的增长。而发酵第7天到第21天中,谷氨酸、丝氨酸、组氨酸和甘氨酸以及半胱氨酸的浓度均出现了下降,总氨基酸含量也随之降低。与此同时,瓜氨酸的浓度也出现了小幅降低。这表明随着Z. rouxii ZQ02的加入,酱油发酵过程中所积累的瓜氨酸被其部分消耗。
表 1. 酱油发酵过程中游离氨基酸的变化 Table 1. Amino acids released (g/L) during soy sauce fermentation
| Amino acids | t/d | ||||||
| 0 | 1 | 4 | 7 | 21 | 69 | 140 | |
| Asp | 0.21 | 1.01 | 1.94 | 2.60 | 2.78 | 6.20 | 6.40 |
| Glu | 0.43 | 2.15 | 4.57 | 10.49 | 6.39 | 11.42 | 11.58 |
| Ser | 0.01 | 0.17 | 0.25 | 2.07 | 0.40 | 0.22 | 0.18 |
| His | 0.05 | 0.43 | 0.70 | 0.96 | 0.84 | 1.56 | 1.48 |
| Gly | 0.02 | 0.38 | 0.83 | 1.17 | 1.08 | 2.03 | 2.11 |
| Thr | 0.17 | 0.82 | 1.19 | 1.65 | 1.75 | 3.07 | 2.90 |
| Cit | 0.01 | 0.51 | 1.68 | 2.28 | 1.50 | 2.28 | 2.22 |
| Arg | 0.16 | 1.50 | 0.97 | 1.10 | 2.31 | 3.21 | 1.44 |
| Ala | 0.16 | 0.88 | 1.30 | 1.70 | 1.77 | 3.56 | 3.58 |
| Tyr | 0.12 | 0.83 | 1.05 | 1.07 | 1.33 | 0.98 | 0.91 |
| Cys | 0.01 | 0.03 | 0.09 | 0.21 | 0.10 | 0.14 | 0.10 |
| Val | 0.12 | 0.84 | 1.20 | 1.65 | 1.85 | 4.11 | 3.98 |
| Met | 0.05 | 0.29 | 0.36 | 0.44 | 0.53 | 1.04 | 0.93 |
| Phe | 0.15 | 0.73 | 1.15 | 1.48 | 1.99 | 3.74 | 3.32 |
| Ile | 0.10 | 0.77 | 1.03 | 1.60 | 1.67 | 4.11 | 3.87 |
| Leu | 0.21 | 1.62 | 1.63 | 2.40 | 2.97 | 6.25 | 5.76 |
| Lys | 0.17 | 1.54 | 2.45 | 2.78 | 2.84 | 4.65 | 4.13 |
| Pro | 0.01 | 0.45 | 0.74 | 1.66 | 1.96 | 2.47 | 2.57 |
| Total | 2.30 | 15.37 | 23.14 | 37.24 | 34.06 | 61.05 | 57.47 |
| Underlined amino acids: amino acids that were most related to EC precursors. | |||||||
表选项
2.5 酱油发酵过程中尿素的积累 在之前的研究中,通过酵母的氮代谢活动积累的尿素被确定为酒精饮料中氨基甲酸乙酯的主要前体物。因此,对酱油发酵过程中的尿素含量进行考察,以确定酱油中酵母的氮代谢活动与尿素积累的关系。鲁氏接合酵母在酱油中的作用时期为从发酵开始的第7天持续至第69天。在这段发酵时期中,酱油中尿素的积累随着发酵时间的延长呈线性积累,其增长趋势不随着酵母的添加而改变,且在酵母添加前,就有约36%的尿素代谢产生(图 4)。这一结果表明酱油中的尿素的积累是由于原料的水解,或是在发酵过程中由于其他细菌的氮代谢作用而产生的,而并非由Z. rouxii ZQ02通过尿素循环而产生[9-19]。
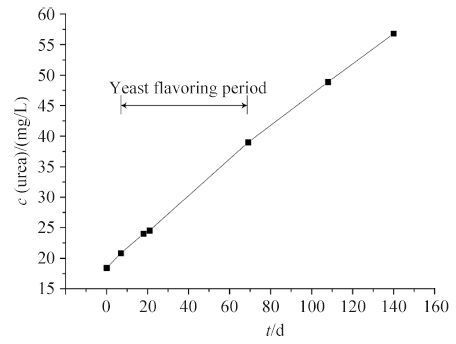 |
| 图 4. 酱油发酵过程中尿素的变化 Figure 4. Tracking the urea concentration during soy sauce fermentation. |
| 图选项 |
3 讨论 不同于酿酒酵母的氮代谢阻遏效应,Z. rouxii ZQ02在有偏好型氮源丙氨酸、甘氨酸和天冬酰胺存在的情况下,对尿素和瓜氨酸的利用没有阻遏,丙氨酸和甘氨酸还对瓜氨酸和尿素的利用有促进作用,这意味着Z. rouxii氮代谢调控机制与酿酒酵母存在着明显的不同。盐胁迫被证明对尿素、瓜氨酸的利用有明显的阻遏效应,这可能是由于NaCl的存在影响了膜表面通道蛋白的活性导致氮源的转运活性被降低,从而导致利用率的降低[20-21]。
瓜氨酸已被证明是酱油中氨基甲酸乙酯的主要前体物质[22],而精氨酸是ADI途径中产生瓜氨酸的前体物质。Z. rouxii ZQ02在代谢过程中几乎不消耗精氨酸,这也就意味着Z.rouxii ZQ02不可能在酱油生产过程中通过ADI途径大量积累瓜氨酸。相反,在酱油生产中,当添加Z.rouxii ZQ02之后,瓜氨酸浓度出现了小幅度降低,说明Z. rouxii ZQ02能够利用瓜氨酸。但随着盐胁迫以及发酵时间的延长,Z. rouxii ZQ02的代谢活力逐步降低,逐渐低于瓜氨酸的生成速率,造成了瓜氨酸的再次积累。
参考文献
| [1] | Cui RY, Zheng J, Wu CD, Zhou RQ. Effect of different halophilic microbial fermentation patterns on the volatile compound profiles and sensory properties of soy sauce moromi. European Food Research and Technology, 2014, 239(2): 321-331. |
| [2] | Meng Q, Hatakeyama M, Sugawara E. Formation by yeast of 2-furanmethanethiol and ethyl 2-mercaptopropionate aroma compounds in Japanese soy sauce. Bioscience, Biotechnology, and Biochemistry, 2014, 78(1): 109-114. |
| [3] | Dakal TC, Solieri L, Giudici P. Adaptive response and tolerance to sugar and salt stress in the food yeast Zygosaccharomyces rouxii. International Journal of Food Microbiology, 2014, 185: 140-157. |
| [4] | Hou LH, Wang M, Wang C, Wang CL, Wang HY. Analysis of salt-tolerance genes in Zygosaccharomyces rouxii. Applied Biochemistry and Biotechnology, 2013, 170(6): 1417-1425. |
| [5] | Iwaki T, Higashida Y, Tsuji H, Tamai Y, Watanabe Y. Characterization of a second gene (ZSOD22) of Na+/H+ antiporter from salt-tolerant yeast Zygosaccharomyces rouxii and functional expression of ZSOD2 and ZSOD22 in Saccharomyces cerevisiae. Yeast, 1998, 14(13): 1167-1174. |
| [6] | Wei YH, Wang C, Wang M, Cao XH, Hou LH. Comparative analysis of salt-tolerant gene HOG1 in a Zygosaccharomyces rouxii mutant strain and its parent strain. Journal of the Science of Food and Agriculture, 2013, 93(11): 2765-2770. |
| [7] | Hecquet L, Sancelme M, Bolte J, Demuynck C. Biosynthesis of 4-hydroxy-2,5-dimethyl-3(2H)-furanone by Zygosaccharomyces rouxii. Journal of Agricultural and Food Chemistry, 1996, 44(5): 1357-1360. |
| [8] | van der Sluis C, Tramper J, Wijffels RH. Enhancing and accelerating flavour formation by salt-tolerant yeasts in Japanese soy-sauce processes. Trends in Food Science & Technology, 2001, 12(9): 322-327. |
| [9] | Koh E, Kim YKL, Kwon H. Arginine metabolism by Bacillus subtilis and Zygosaccharomyces rouxii isolated from Korean soysauce. Food Science and Biotechnology, 2003, 12(1): 62-66. |
| [10] | Riachi LG, Santos ?, Moreira RFA, de Maria CAB. A review of ethyl carbamate and polycyclic aromatic hydrocarbon contamination risk in cacha?a and other Brazilian sugarcane spirits. Food Chemistry, 2014, 149: 159-169. |
| [11] | Wang PH, Sun JY, Li XM, Wu DH, Li T, Lu J, Chen J, Xie GF. Contribution of citrulline to the formation of ethyl carbamate during Chinese rice wine production. Food Additives & Contaminants: Part A, 2014, 31(4): 587-592. |
| [12] | Weber JV, Sharypov VI. Ethyl carbamate in foods and beverages: a review//Lichtfouse E. Climate change, intercropping, pest control and beneficial microorganisms. Netherlands: Springer, 2009, 429-452. |
| [13] | Wu PG, Cai CG, Shen XH, Wang LY, Zhang J, Tan Y, Jiang W, Pan XD. Formation of ethyl carbamate and changes during fermentation and storage of yellow rice wine. Food Chemistry, 2014, 152: 108-112. |
| [14] | Beland FA, Benson RW, Mellick PW, Kovatch RM, Roberts DW, Fang JL, Doerge DR. Effect of ethanol on the tumorigenicity of urethane (ethyl carbamate) in B6C3F1 mice. Food and Chemical Toxicology, 2005, 43(1): 1-19. |
| [15] | Liu SQ, Pilone GJ. A review: Arginine metabolism in wine lactic acid bacteria and its practical significance. Journal of Applied Microbiology, 1998, 84(3): 315-327. |
| [16] | Messenguy F, Dubois E. Genetic evidence for a role for MCM1 in the regulation of arginine metabolism in Saccharomyces cerevisiae. Molecular and Cellular Biology, 1993, 13(4): 2586-2592. |
| [17] | Heinrikson RL, Meredith SC. Amino acid analysis by reverse-phase high-performance liquid chromatography: precolumn derivatization with phenylisothiocyanate. Analytical Biochemistry, 1984, 136(1): 65-74. |
| [18] | Clark S, Francis PS, Conlan XA, Barnett NW. Determination of urea using high-performance liquid chromatography with fluorescence detection after automated derivatisation with xanthydrol. Journal of Chromatography A, 2007, 1161(1/2): 207-213. |
| [19] | 陈可. 酱油中氨基甲酸乙酯的定量分析与形成条件初探. 江南大学硕士学位论文, 2012. |
| [20] | Jiang W, Xu Y, Li CS, Lv X, Wang DF. Effect of inorganic salts on the growth and Cd2+ bioaccumulation of Zygosaccharomyces rouxii cultured under Cd2+ stress. Bioresource Technology, 2013, 128: 831-834. |
| [21] | Li CS, Xu Y, Jiang W, Dong XY, Wang DF, Liu BJ. Effect of NaCl on the heavy metal tolerance and bioaccumulation of Zygosaccharomyces rouxii and Saccharomyces cerevisiae. Bioresource Technology, 2013, 143: 46-52. |
| [22] | Matsudo T, Aoki T, Abe K, Fukuta N, Higuchi T, Sasaki M, Uchida K. Determination of ethyl carbamate in soy sauce and its possible precursor. Journal of Agricultural and Food Chemistry, 1993, 41(3): 352-356. |
