赵龙飞1

 , 徐亚军1, 常佳丽2, 李敏1, 张艳玲1, 党永杰1, 王梦思1, 程亚稳1, 张斌月1
, 徐亚军1, 常佳丽2, 李敏1, 张艳玲1, 党永杰1, 王梦思1, 程亚稳1, 张斌月1 1.河南省高校植物与微生物互作重点实验室, 商丘师范学院生命科学学院, 河南 商丘 476000;
2.清华大学环境学院, 水环境保护研究所, 北京 100084
收稿日期:2015-09-26;修回日期:2015-12-06;网络出版日期:2016-06-04
资助课题:国家自然科学基金(U1204301);河南省高等学校青年骨干教师项目(2012GGJS166)
通信作者:Tel:+86-370-3115317;Fax:+86-370-2595979;E-mail:hnzhaolongfei@163.com
摘要: [目的] 从大豆根瘤中筛选具ACC (1-氨基环丙烷-1-羧基)脱氨酶活性的内生细菌,对活性菌株的抗盐碱性、系统分类地位以及代表菌株的促生长作用进行研究,为发掘和应用抗逆、促生优良菌种资源提供理论基础。[方法] 以ACC作为唯一氮源测定菌株产ACC 脱氨酶特性,采用标准曲线法测定α-丁酮酸含量,比色法定量测定ACC脱氨酶活力,固体平板筛选法对活性菌株进行抗性分析,通过菌体形态及生理生化特性测定、16S rRNA基因序列同源性分析鉴定菌株分类地位,采用盆栽试验验证代表菌株的促生作用。[结果] 从河南省13个市(地区)36个点采集的大豆根瘤中筛选出8株ACC脱氨酶内生细菌,其中菌株DD132的酶活性最高(15.712 U/mg)。筛选菌株可耐受4%-6% NaCl, 其中菌株DD165、DD132可耐受9% NaCl盐浓度。在pH 11时5株(DD14、DD132、DD67、DD141、DD131)生长良好,说明这些菌株有较强耐碱性。8株产ACC脱氨酶菌株分属于4属,即芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、寡养单胞菌属(Stenotrophomonas)和泛菌属(Pantoea)。接种试验表明内生菌DD132对小麦幼苗生长具有明显促生长作用。[结论] 大豆根瘤内具ACC脱氨酶高活性菌株有较强耐盐碱性,其中菌株DD132对小麦幼苗生长有明显促生长作用。为发掘和应用抗逆、促生的优良菌种资源提供理论基础。
关键词: ACC脱氨酶 根瘤内生菌 抗性 系统发育 促生作用
Screening, resistance and growth-promoting effect of endophytic bacteria with ACC deaminase activity isolated from soybean nodules
Longfei Zhao1

 , Yajun Xu1, Jiali Chang2, Min Li1, Yanling Zhang1, Yongjie Dang1, Mengsi Wang1, Yawen Cheng1, Binyue Zhang1
, Yajun Xu1, Jiali Chang2, Min Li1, Yanling Zhang1, Yongjie Dang1, Mengsi Wang1, Yawen Cheng1, Binyue Zhang1 1.Henan Province Key Laboratory of Plant-Microbe Interactions, College of Life Sciences, Shangqiu Normal University, Shangqiu 476000, Henan Province, China;
2.Division of Water Environment, School of Environment, Tsinghua University, Beijing 100084, China
Support by the National Natural Science Foundation of China (U1204301) and by Youth Backbone Teachers Project of Henan Provincial Universities (2012GGJS166)
Abstract: [Objective] We screened endophytic bacteria containing ACC (1-aminocyclopropane-1-carboxylate) deaminase from soybean nodules, and evaluated salt-alkaline resistance, phylogenetic status and the growthpromoting of representative strain.[Methods] The features of strains producing ACC deaminase were determined by using the ACC as a sole nitrogen source, adopting standard curve method, colorimetric method, solid medium screening method, bacterial morphology, physio-biochemical characteristics, similarity analysis of 16S rRNA gene, inoculation tests.[Results] Eight endophytic bacteria containing ACC deaminase were screened from soybean nodules collected from 36 points of 13 cities (regions)in Henan province. Enzymaticactivity of DD132 was the highest (15.712 U/mg). Screened strain tolerated to medium of 4%-6% NaCl concentration. Among of them, DD165 and DD132 could tolerate 9% NaCl concentration. Five bacteria growing well under pH 11, showing that these strains had stronger alkali resistance. Eight strains containing ACC deaminase activity were affiliated to four genera: Bacillus, Enterobacter, Stenotrophomonas and Pantoea. Inoculation test showed that DD132 had a significant growthpromoting effect on wheat seedlings.[Conclusion] Endophytic bacteria containing high ACC deaminase activity from soybean nodules have stronger salt-alkaline resistance. DD132 has obvious growth-promoting effect on wheat seedlings.
Key words: 1-aminocyclopropane-1-carboxylate deaminase nodule endophytic bacteria resistance phylogeny growth-promoting effect
工业化肥大量施用和盐碱化面积不断扩增,造成我国农田大面积土壤板结、环境污染以及投资成本增大等系列问题,严重影响土壤微环境生态平衡和农作物健康生长[1]。植物根际蕴藏丰富的微生物资源,对这些资源进行开发和利用为解决上述问题提供了新的思路。一些根际微生物代谢产物如ACC脱氨酶,可增强宿主植物吸收养分、提高抗逆性和促进植物生长,还兼有抗病原微生物效应及联合修复功能,达到农业增产、生物防治和环境治理效果[2]。因此,筛选和研究ACC脱氨酶活性菌株具有重要科学价值和应用潜力。ACC脱氨酶是一种能有效降低逆境乙烯含量的外源促生物质,在干旱、盐胁迫及重金属污染等逆境条件下可显著增强作物抗逆性和产量[2]。ACC脱氨酶能把乙烯的前体ACC水解成α-丁酮酸和氨,从而抑制植物体内乙烯合成,降低其含量进而减少过量乙烯对植物生长发育造成的不利影响[3],同时可增加根际土壤中C源和N源[4],这种双重作用机制可协助植物耐受不良环境,间接对植物生长起到关键促进作用。许多研究表明,从小麦、燕麦、紫花苜蓿、鹰嘴豆、油菜、茄子、番茄、草莓、芥菜等作物[3, 5]及植物根际或组织分离ACC脱氨酶活性细菌,用菌液接种法和菌液浸种均有促进植物生长功能[6-7]。尤其是对玉米和番茄种子生根、株高等方面有显著增强作用[4]。内生菌假单胞菌(Pseudomonas sp.)可促进油菜幼苗根伸长[8],显著提高翅碱蓬抗盐抗旱抗涝性,大大提高燕麦和黑麦草生长;证明内生菌产生ACC脱氨酶是主要促生因素而非IAA[9]。盐碱胁迫是导致农业减产的主要问题之一,ACC脱氨酶能通过降低植物体内乙烯水平来调节并刺激植物根系生长[10],提高植物对养料和水分的吸收及利用率,增强宿主抗性。如接种ACC脱氨酶活性菌株能使豌豆幼苗生殖生长期干物质成分明显增高,推迟果实成熟期[10],提高水分利用率[11]。ACC脱氨酶活性耐盐菌对草籽生长具促生作用,可增加豆科植物结瘤数量[12];拮抗玉米轮斑病菌(Pestalo-tiopsis theae)和弯孢叶斑病菌(Curvularia lunata)[13]及病原细菌[14]。以上研究均已证实ACC脱氨酶既对宿主植物有促生长作用,又能增强宿主植物的抗逆性。因此,筛选并研究ACC脱氨酶内生菌成为目前研究的热点。截至目前,对具ACC脱氨酶活性的大豆根瘤内生菌的筛选、抗逆性及促生作用的研究报道却很少见。大豆和小麦都属于大宗作物,在河南均有较大种植面积,而大豆根部有特殊组织--根瘤,在根瘤微环境内根瘤菌和宿主形成共生固氮体系,与其共处微环境的还存在着丰富内生菌资源,本研究以分离自河南省13个市(地区)36个采样点的根瘤样品分离的内生细菌为研究对象,以ACC脱氨酶活性为研究指标,系统分析产ACC脱氨酶菌株,研究其生理生化特性及系统发育地位和促生特性。筛选高活性ACC脱氨酶菌株,探索产生ACC脱氨酶菌株的遗传多样性,分析其系统发育地位和促生作用,对进一步发掘和应用抗逆、促生的优良菌种资源具有重要意义。
1 材料和方法 1.1 材料 大豆根瘤样品于2012年7-8月采集于河南省部分地区。小麦品种采用周麦18(国家审定品种,广泛种植黄淮流域,由周口市农业科学院殷贵鸿博士馈赠)。
无氮培养基:MnSO4·7H2O 0.2 g,CaCO3 1 g,蔗糖 10 g,K2HPO4·3H2O 0.5 g,NaCl 0.12 g,蒸馏水1000 mL,pH 7.2。
DF盐培养基(1 L): MnSO4·7H2O 0.2 g,KH2PO4 4.0 g,Na2HPO4 6.0 g,柠檬酸2.0 g,葡萄糖2.0 g,葡萄糖酸钠2.0 g,组分一与组分二溶液各取0.1 mL,H2O 1000 mL,pH 7.2。(组分一的配方:CuSO4·5H2O 78.22 mg,MoO3 10 mg,H3BO3 10 mg,ZnSO4·7H2O 124.6 mg,MnSO4·H2O 11.9 mg,以上溶解于100 mL无菌蒸馏水中。组分二的配方:FeSO4·7H2O 100 mg,将其溶于10 mL已灭菌的蒸馏水中,充分振荡。注:组分一和组分二均置于-4℃保存备用。)
ADF培养基:把ACC溶于超纯水,用细菌过滤器过滤灭菌,加入到不含有(NH4)2SO4且预先灭菌的DF盐培养基中,pH 7.2。ACC添加的终浓度为3.0 mmol/L。
1.2 ACC 脱氨酶活性菌株的筛选 将冰箱中保藏的菌株活化后,参照文献[15-16]方法,接入5 mL无氮培养基,30 ℃ 130 r/min振荡培养24 h,吸取上述培养菌液2 mL接种到60 mL 培养液中,30 ℃、130 r/min培养24-48 h,12000r/min离心10 min收集菌体。用不含(NH4)2SO4的DF液体培养基离心、洗涤2次(12000r/min,5 min,每管加1 mL DF),将菌体重悬于ADF培养基中(30 ℃振荡培养24 h,每管加1mL ADF),收集菌体并称重量。用0.1 mol/L Tris-HCl缓冲液(pH 7.6)12000 r/min,离心5 min、洗涤2次(-20 ℃储存)。取菌重悬于1 mL 0.1 mol/L Tris-HCl缓冲液中(pH 7.6),12000 r/min离心5 min收集菌体,重悬于600 μL 0.1 mol/L Tris-HCl缓冲液(pH 8.5)中,添加30 μL甲苯迅速振荡30 s以破碎细胞,取100 μL粗酶液4 ℃储存用于测定蛋白浓度。另取粗酶液200 μL并加入20 μL 0.5 mol/L ACC混匀进行水浴(30 ℃,15 min),以不添加ACC的空白作对照。同时加入1 mL 0.56 mol/L HCl终止此反应,12000 r/min离心5 min。取上清液1 mL加入800 μL 0.56 mol/L HCl和300 μL 0.2% 2,4-二硝基苯肼溶液,使其充分溶解,30 ℃恒温30 min,再加入2 mL 2 mol/L NaOH混匀,540nm测吸光度值。
1.3 ACC 脱氨酶活力测定
1.3.1 绘制α-丁酮酸标准曲线: 利用0.1 mol/L Tris-HCl(pH 8.5)缓冲液,配制100 mmol/L的α-丁酮酸母液。将该浓度的母液稀释为10 mmol/L的α-丁酮酸溶液,将其加入试管中,用0.1 mol/L Tris-HCl缓冲液(pH 8.5)补加至1 mL,α-丁酮酸浓度范围为0.024-0.293 μmol/mL。以吸光度值(OD540)为纵坐标,以α-丁酮酸的浓度(mmol/L)为横坐标绘制标准曲线。
1.3.2 ACC脱氨酶比活力计算: 参照Bradford法[17]比色测定细胞提取液中总蛋白质含量,以牛血清白蛋白作为标准物,绘制牛血清白蛋白标准曲线。参考Saleh等[18]的方法,以反应体系中每毫克菌体蛋白酶每小时催化ACC脱氨生成 α-丁酮酸的μmol量表示ACC脱氨酶活力,其酶活力单位为α-丁酮酸μmol/(mg·h),酶活性测定设置空白对照。测定结果为3次重复值。
1.4 活性菌株的抗性分析
1.4.1 菌株耐盐能力测定: 分别配制含NaC1浓度(M/V) 为4%、5%、6%、7%、8%、9%的YMA固体培养基,将筛选菌株接种在不同浓度NaC1的YMA培养基上,其中浓度为0.01%的YMA培养基为对照,每一个处理3次重复。在28 ℃下培养3-5 d观察生长情况,生长记为“+”,不生长记为“-”。长势的好坏用“+”多少表示。
1.4.2 菌株耐酸碱能力测定: 设置pH值分别为5、6、7、8、9、10、11的YMA培养基,以pH 7的基础培养基为对照,每个处理3次重复。用1 mol/L的NaOH或HCl将YMA培养基调至设定pH值,高温灭菌后再次调节pH值至设定值,而后制成平板。将筛选菌株接种在不同pH值的YMA培养基上,置于28 ℃恒温培养,3-5d后观察生长状况并记录结果[19]。
1.5 形态、生理生化测试 对高产ACC脱氨酶活性菌株进行菌体形态及生理生化特性测定,方法参见《常见细菌系统鉴定手册》[20]。
1.6 16S rRNA 基因序列测定及系统发育分析 提取大豆根瘤内生细菌总DNA[21],并进行16S rRNA 基因 PCR 扩增。所用引物、扩增体系、反应条件见参考文献[22],扩增产物送北京奥科鼎盛生物科技有限公司测序,根据测序结果,在GenBank中进行BLAST分析,用DNAMAN 6.0软件进行序列相似性分析,通过Clustal-X2.1和TREECONW软件(version 1.3b),以Neighbor-Joining方法构建系统发育树,用Bootstrap (1000次重复)进行检验。
1.7 小麦幼苗促生长试验 以周麦18为研究材料,在人工气候室进行盆栽接种试验。菌体接种在YM液体培养基内28℃培养3-4 d,12000 r/min离心8 min,收集菌体,使用无菌水调整OD≈1(约109 CFU/mL),备用。挑选饱满、无霉变、大小均一、无破损的小麦种子,先用无菌水冲洗表面灰尘,再用无水乙醇进行表面消毒16-20 s以去除表面蜡纸,3%-5%次氯酸钠进行表面消毒2-3 min,用无菌水冲洗5-8次。最后一次冲洗的无菌水取100 μL涂布在牛肉膏蛋白胨固体培养基上,倒置恒温培养48h,观察培养基表面是否有菌落形成,来验证小麦表面消毒的彻底性。按照预先制备菌悬液和无菌水的比例:1: 2、1: 1、2: 1,无菌水作为对照处理(CK),分别在烧杯中浸泡消毒过的小麦种子3-4h,使种子充分吸胀,而后过滤掉菌悬液,用浸润无菌水的纱布盖在种子表面,使种子保持潮湿环境,置于25-30℃恒温培养箱,直到种子露白。
把露白种子播种在直径为13 cm、深10 cm盛有190 g无菌蛭石的花盆中,保持播种深度约1 cm,每盆播种40粒种子,而后每盆喷洒5 mL无菌水,置于14 h光周期22 ℃,暗周期20 ℃,相对湿度为65%的温室环境。培养3 d苗子均一长出,每隔1d接种菌悬液30 mL,每3 d浇1次无菌水以保持盆内的相对湿度。未接种菌悬液组作为对照处理,每个处理3个重复。3周后测定小麦苗子的株高、根长、鲜重、叶绿素含量[23]等指标。用SPSS 11.0 软件统计分析,评价接种内生菌对幼苗植株生长的影响。
2 结果和分析 2.1 产 ACC 脱氨酶 内生菌株的地理来源 对分离自大豆根瘤的276株内生菌经ACC脱氨酶活性筛选,其中8株具有ACC脱氨酶活性,其地理来源如表 1所示。
表 1. 大豆根瘤ACC脱氨酶活性菌株的地理来源 Table 1. Geographicorigins of strains with ACC deaminase activity isolated from soybean root nodules
| Strains | Geographic origins | Strains | Geographic origins |
| DD 14 | Farmland in northern suburb of Liangyuan district, Shangqiu city (商丘市梁园区北郊农田) | DD 132 | Farmland in Banpodian town of Kaifeng county, Kaifeng city (开封市开封县半坡店乡农田) |
| DD 31 | Farmland in northern suburb of Liangyuan district, Shangqiu city (商丘市梁园区北郊农田) | DD 141 | Farmland in Jishi town of Zhaoling district, Luohe city (漯河市召陵区姬石镇农田) |
| DD 67 | Botanic garden of Shangqiu normal university in Suiyang district, Shangqiu city (商丘市睢阳区商丘师院植物园) | DD 165 | Farmland in Guotan town of Tanghe county, Nanyang city (南阳市唐河县郭滩镇农田) |
| DD 131 | Farmland in Huahe town of Shangshui county, Zhoukou city (周口市商水县化河镇农田) | DD 248 | Farmland in Zhifang town of Xihua county, Zhoukou city (周口市西华县址坊镇农田) |
表选项
2.2 ACC 脱氨酶活性测定结果 以含ACC的ADF培养基为唯一氮源筛选出8株具有ACC脱氨酶活性的大豆根瘤内生细菌(表 2)。酶活测定结果表明各菌株酶活力差异较大,其中DD132酶活性最高(15.712 U/mg),其次是DD31 (9.654 U/mg)和DD14为4.965(U/mg),DD248最小(0.935 U/mg),DD141、DD67、DD165、DD131 酶活力相当,但是都远低于DD132和DD31。
表 2. 8株具ACC脱氨酶活性内生菌的酶活力 Table 2. Enzyme activity of eight positive strains with ACC deaminase
| Strains | ACC deaminase activity/(U/mg) |
| DD132 | 15.712±0.002A |
| DD31 | 9.654±0.002B |
| DD14 | 4.965±0.002C |
| DD141 | 1.577±0.001D |
| DD67 | 1.405±0.001E |
| DD165 | 1.315±0.001F |
| DD131 | 1.156±0.001G |
| DD248 | 0.935±0.001H |
| Data are mean±SD in table, different letters behind data in the same column show significant difference at P<0.01 level. | |
表选项
2.3 活性菌株的抗性测定
2.3.1 耐盐能力: 对具有ACC脱氨酶活性的8株内生细菌,进行耐盐能力测试。由表 3可见,8株菌均可耐受4%-6% NaCl盐浓度,7株菌可耐受7%盐浓度,5株菌 (DD165、DD132、DD14、DD31、DD67)可耐受8%盐浓度,其中2株菌(DD165、DD132)可耐受9%盐浓度。说明筛选出的ACC脱氨酶活性内生菌在4%-6% NaCl浓度培养基上具有较强耐受性,最大可耐受含9%的盐浓度。
表 3. 内生菌对不同NaCl浓度耐受性 Table 3. Tolerance of endophytic bacteria to different concentration of NaCl
| NaCl concentration (M/V)/% | Survival strains | Proportion/% |
| 4 | 8 | 100 |
| 5 | 8 | 100 |
| 6 | 8 | 100 |
| 7 | 7 | 87.5 |
| 8 | 5 | 62.5 |
| 9 | 2 | 25.0 |
表选项
2.3.2 耐酸碱能力: 将具有ACC脱氨酶活性的8株内生菌接种在pH 5-11培养基上(表 4),培养3 d后观察,7株菌在pH 6-10培养基上均能很好生长,在pH 5时菌株DD131、DD141、DD31、DD67、DD165均可生长,仅次于对照,说明这些菌株有一定耐酸能力。在pH 11时菌株DD14、DD132、DD67、DD141、DD131均生长良好,仅次于对照,其余3株菌(DD31、DD165、DD248)能存活,说明具ACC脱氨酶活性内生菌株具有较强耐碱性。
表 4. pH对具ACC脱氨酶内生菌生长的影响 Table 4. The effect of pH on growth of endophytes with ACC deaminase
| pH | DD14 | DD31 | DD132 | DD67 | DD165 | DD141 | DD248 | DD131 |
| 5 | + | ++ | – | ++ | +++ | ++ | – | ++ |
| 6 | ++ | +++ | +++ | ++ | ++ | ++ | ++ | ++ |
| 8 | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ |
| 9 | +++ | ++ | +++ | +++ | +++ | +++ | +++ | +++ |
| 10 | +++ | ++ | ++ | +++ | +++ | +++ | +++ | +++ |
| 11 | ++ | + | ++ | ++ | + | ++ | + | ++ |
| CK | +++ | +++ | +++ | +++ | +++ | +++ | +++ | +++ |
| “+++” means strains grow very good, “++” means strains grow well, “+” means strains survive, “–” mean strains can not survive. | ||||||||
表选项
2.4 具ACC脱氨酶活性大豆根瘤内生菌的理化特性和菌体特征 理化特性试验结果(表 5)表明,8株菌接触酶、VP试验、肉汤反应均为阳性,D-葡萄糖产酸除DD165外反应均为阳性;L-阿拉伯糖产酸只有DD67、DD141、DD248反应阳性;D-甘露醇除DD14、DD148外其余菌株反应均为阳性;木糖试验只有DD67、DD165、DD248为阳性;淀粉酶反应除DD67外均为阳性,苯丙氨酸脱氨酶反应只有DD132、DD141为阳性,硝酸还原酶除DD67、DD132外均为阳性反应;卵黄磷脂酶、柠檬酸盐利用、酪氨酸水解除DD67外均为阳性反应。菌体DD14、DD31、DD132呈革兰氏染色阳性,有芽孢生成,菌体呈杆状或短杆状,大小(0.7-1.2) μm×(2.0-5.0) μm;DD67、DD165、DD141、DD24、 DD131均为革兰氏阴性菌、无芽孢,菌体大小(0.3-1.2) μm×(0.6-7.0) μm,无芽孢。8株的分裂方式均为二分裂。结合理化特性和细胞特征,查阅《常见细菌系统鉴定手册》发现:DD14、DD31和DD132符合芽孢杆菌属Bacillus特征,DD67、DD165符合寡养单胞菌属Stenotrophomonas特征,DD141、DD248符合泛菌属 Pantoea特征,DD131符合肠杆菌属Enterobacter特征。
表 5. 筛选菌株的理化特性 Table 5. Physiological and biochemical characteristics of screened strains
| Physiological and biochemical characteristics | DD14 | DD31 | DD132 | DD67 | DD165 | DD141 | DD248 | DD131 |
| Catalase test | + | + | + | + | + | + | + | + |
| V-P test | + | + | + | + | + | + | + | + |
| D-glucose acid yield | + | + | + | + | – | + | + | + |
| L-Arab sugar acid yield | – | – | – | + | – | + | + | – |
| D-mannitol | – | + | + | + | + | + | – | + |
| Xylose | – | – | – | + | + | – | + | – |
| Broth (pH 5.0) | + | + | + | + | + | + | + | + |
| Amylase | + | + | + | – | + | + | + | + |
| Phenylalanine deaminase | – | – | + | – | – | + | – | – |
| Lecithinase | + | + | + | – | + | + | + | + |
| Nitrate reductase | + | + | – | – | + | + | + | + |
| Casein decomposition | + | + | – | + | + | + | + | + |
| Citrate utilization | + | + | + | – | + | + | + | + |
| Tyrosine hydrolysate | + | + | + | – | + | + | + | + |
| Morphology | Short rod | Rod | Rod | Rod | Rod | Rod | Rod | Short rod |
| Strain size/μm | (1.0–1.2)× (3.0–5.0) | (1.0–1.2)× (3.0–5.0) | (0.7–0.8)× (2.0–3.0) | (1.0–1.2)× (2.5–7.0) | (0.3–0.4)× (0.6–1.5) | (0.5–1.0)× (1.0–3.0) | (0.5–1.0)× (1.0–3.0) | (0.6–1.1)× (1.2–1.5) |
| Gram strain | G+ | G+ | G+ | G– | G– | G– | G– | G– |
| Spore forming | + | + | + | – | – | – | – | – |
| +: positive, –: negative | ||||||||
表选项
2.5 菌株 16S rRNA 基因的系统发育分析 对8株内生细菌基因组DNA进行PCR扩增,扩增出片段大小为 1.5 kb的单一DNA条带,并对PCR产物进行DNA测序。将所得序列与GenBank数据库中的核酸数据库进行BLAST同源性比对,结果显示:这8株具ACC脱氨酶活性的大豆根瘤内生菌16S rRNA 基因序列与GenBank数据库中已报道相关菌株16S rRNA 基因序列的相似性均达到97.3%以上。系统发育树(图 1)显示,DD131、DD141和DD248位于分支I,菌株DD141、DD248的最相似菌株为模式株成团泛菌P. agglomerans JCM1236T (AB004691),同源性分别为98.0%、97.6%。而DD131的最相似菌株为模式菌株路德维希肠杆菌E. ludwigii EN-119T (AJ853891),同源性为98.8%。DD67和DD165位于分支II的小支上,与模式株微嗜酸寡养单胞菌S. acidaminiphila AMX 19T (NR_025104)和嗜麦芽寡养单胞菌S. humi R-32729 T (AM403587)的同源性最高,均达到97.3%。DD14、DD31和DD132位于分支Ⅲ,其中DD14和DD31在同一小支上,DD14与蜡状芽孢杆菌B. cereus 55-3 (KM187654)同源性达100%,DD31与蜡状芽孢杆菌B. cereus Ni10( AB824732)同源性达100%。DD132与模式株阿氏芽孢杆菌B. aryabhattai B8W22T(EF114313)位于同一小分支,且二者同源性为100%。结合菌体的理化特性和菌体特征,菌株DD14、DD31初步鉴定为B. cereus,DD132为B. aryabhattai;DD67、DD165分别为S. acidaminiphila 和S. humi,DD141和DD248为P. agglomerans,DD131为E. ludwigii。因此,大豆根瘤中具ACC脱氨酶活性内生细菌存在丰富的种属多样性。其中DD132的ACC脱氨酶活力最高,是最理想的筛选对象。
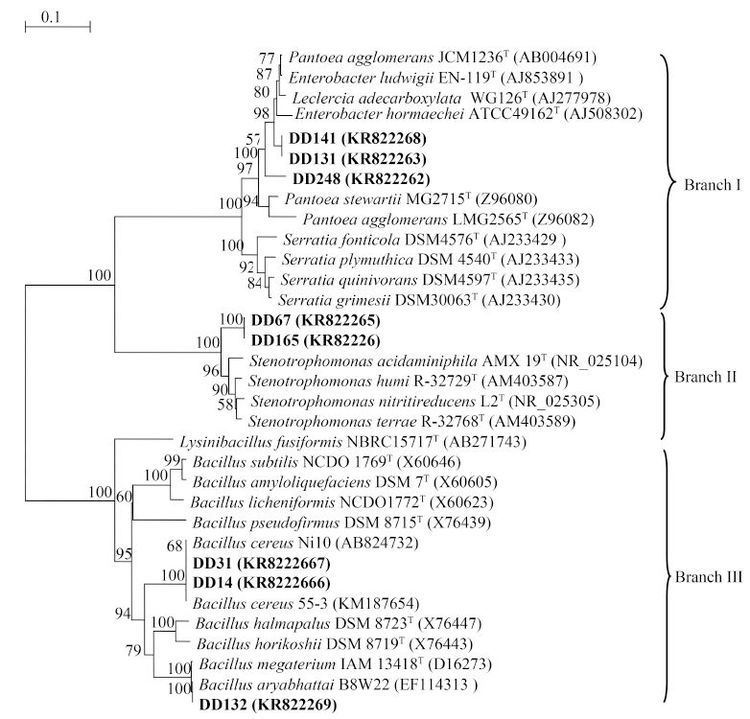 |
| 图 1. 具ACC脱氨酶活性的大豆根瘤内生菌16S rRNA 基因序列系统发育树 Figure 1. Phylogenetic tree generated by the Neighbor-Joining method based on their 16S rRNA gene sequences of ACC deaminase-producing endophytic bacteria isolated from soybean nodules. Numbers in parentheses represent the sequences’ accession number in GenBank. Bootstrap values (1000 replicates) above 50% are indicated above the branches. Strains tested are labeled in bold. Scale bar indicates 0.05% substitution of nucleotide. |
| 图选项 |
2.6 对小麦幼苗的促生长作用 选择ACC脱氨酶活性代表菌株DD132进行接种研究,由图 2可知,DD132菌悬液和无菌水比例为1: 2时,苗高、根长、鲜重、叶绿素含量与其他比例相比均显示出最高值,分别高出对照组(CK)的68.11%、46.52%、55.5%、101.41%。总体上,接种处理组不同比例的各项生长指标都明显高于CK,但增长量不同,说明菌悬液和无菌水比例也是影响幼苗生长各项指标的重要因素之一。因此,接种内生菌DD132对小麦幼苗生长具有促进作用。
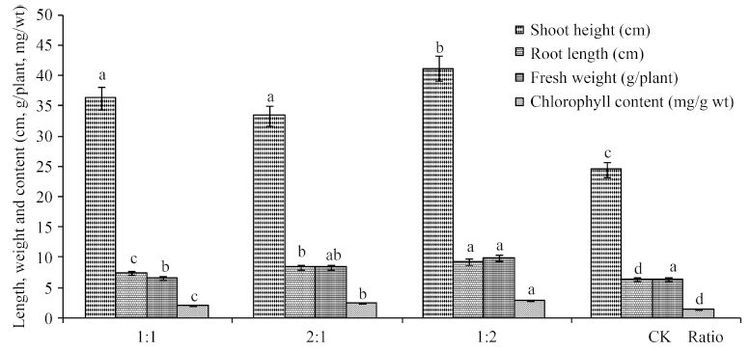 |
| 图 2. 接种DD132对小麦幼苗生长的影响 Figure 2. The effect on wheat seedling growth inoculated with strain DD132. Small letters upon histogram mean difference level at the same index, different small letters mean significant difference at P<0.05 level. |
| 图选项 |
3 讨论 ACC脱氨酶能把乙烯前体ACC水解成α-丁酮酸和氨,从而有效抑制乙烯的生物合成,在干旱、盐胁迫及重金属污染等逆境条件下可显著增强作物的抗逆性和产量。从276株大豆根瘤内生菌中,筛选出8株具有ACC脱氨酶活性菌株,仅占2.89%。菌株DD132酶活力最高,为15.712 (U/mg),DD248最低为0.935 (U/mg)。菌株DD132的ACC脱氨酶活力比从紫花苜蓿土壤中分离菌株ACC30脱氨酶活力(0.217 U/mg)高出两个数量级[3],高于国外报道的5-10 U/mg[24],与孙建光[16]的报道基本一致,表现极高的ACC脱氨酶活性内生菌株,说明具有很强的抗逆、促生潜能。魏素娜[25]从旱地小麦根际筛出的2株具ACC脱氨酶菌株霍氏肠杆菌Enterobacter hormaechei AS和变形斑沙雷氏菌Serratia proteamaculans CS,酶比活力分别为0.018 6 U/mg 和0.016 7 U/mg。张越己等[26]从麻疯树根际分离28株,有46%的菌株具ACC脱氨酶活性,最高为128 U/mg 。秦宝军等[27]从小麦中分离60株菌,有9株具ACC脱氨酶活性,仅占15%,其酶活性在0.87-9.32 U/mg,酶活性最高者初步鉴定为假单胞菌Pseudomonas sp.。综上可知,菌株ACC脱氨酶活性高低受多种综合因素影响,如分离菌株种类差异、菌株来源地、土壤养分状况以及该酶在实验中所处的温度和酸碱度 (pH)等都可影响ACC脱氨酶活性的高低,这与姚军朋等[28]、窦雅静等[29]、侯俊杰[30]研究结论相一致。以广闽赣3省8个市县采集的黑木相思根瘤中获174株供试菌,筛出151株具ACC脱氨酶的活性菌株,占分离菌株数的86.78%,但活性差异较大。
利用ACC为唯一氮源筛选出8株具高ACC脱氨酶活性的大豆根瘤内生细菌,属于4个不同属,即芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、寡养单胞菌属(Stenotrophomonas) 和泛菌属(Pantoea),这些菌株还兼有较强耐盐碱能力。有报道[31]证实,部分内生菌的ACC脱氨酶基因可能在不同属种间发生ACC脱氨酶基因的横向转移。但有关从大豆根瘤中筛选获得ACC脱氨酶活性内生细菌的研究目前仍未见报道。这些菌株特性可能与菌株的种属特性以及生活特殊微环境有关。菌株DD132、DD31、DD14属于芽孢杆菌属,由于可形成芽孢,对不利环境具有特殊的抵抗力。关于芽孢杆菌在生物防治方面的研究和报道已有很多。杜传英[32]表明阿氏芽孢杆菌Bacillus aryabhattai J-6有一定的耐盐性。本研究中DD132属于阿氏芽孢杆菌 B. aryabhattai,具有耐盐碱特性,试验结果表明接种内生菌DD132对小麦幼苗生长具有促进作用。Bangash等[33]研究支持了本研究结果,产生ACC脱氨酶的内生菌接种小麦可显著降低干旱胁迫对小麦生长所造成的负面影响;刘佳莉等[34]也印证了本结果,从盐碱土壤中筛选出具ACC脱氨酶活性的菌株A-2和A-4,对燕麦种子进行处理,其株高、鲜重、根长和根鲜重均明显增加,具ACC脱氨酶活性菌株对黄瓜均有不同程度的促生作用,活性越高促生效果愈显著[35]。菌株DD31和DD14属于蜡状芽孢杆菌B. cereus,都有较强分泌ACC脱氨酶的能力,还具有一定的抗盐碱胁迫能力。有研究[36]表明蜡样芽孢杆菌对番茄灰霉病菌有明显的生物防治效果,且有较强抗重金属镉的能力。因此,菌株DD31和DD14可用于增强宿主植物抗逆性研究,但生物防治效果需要进一步研究。
DD141和DD248属于成团泛生菌Pantoea agglomerans。分离自植物根际的成团泛生菌在无菌条件下能促进油菜、冰豆、豌豆、甘蔗的生长[37],并且依赖色氨酸能产生IAA,有些成团泛菌有自生固氮作用,促进根的生长以及苗重[38];还能增加番茄叶绿素含量,使番茄增产。Feng等[39]已证实水稻内生成团泛菌P. agglomerans YSl9能分泌4种不同植物生长激素,在无氮培养基里水稻苗生物量提高63.4%,在有氮培养基里水稻苗生物量提高18.7%。腾松山等[40]从盐生植物碱蓬分离出具ACC脱氨酶活性的内生菌成团泛菌,还兼有溶磷、产生铁载体、产IAA等特性。谭志远等[41]分离自普通野生稻的内生菌固氮菌成团泛菌Ls8,具有ACC脱氨酶活性,接种试验表明该菌株具有明显促进水稻生长作用。因此,具有ACC脱氨酶的内生菌成团泛菌 (P. agglomerans)具有潜在的抗逆促生潜能。
DD67和DD165属于寡养单胞菌属(Stenotrophomonas sp.),该属菌株具有一定溶磷特性,能促进植物对磷元素的利用,还能将硝酸盐还原为亚硝酸盐,对污水和土壤污染治理效果明显。解磷嗜麦芽寡养单胞菌P2,能迅速分解无机磷,为植物生长提供充足的磷元素,提高肥料利用率从而促进植物生长发育[42]。此外,有研究筛出嗜微酸寡养单胞能降解石油烃中部分组分(芴、芘、萘、菲、蒽等)[43],可用于环境治理。肠杆菌属(Enterobacter)也是植物根际促生菌的重要组成部分,分离自黑麦草根部E. ludwigii BNM0357具有溶解磷酸三钙、固氮作用、产生IAA的能力,抑制腐皮镰刀菌菌丝和孢子萌发作用,且具有促进黑麦草根系发育的作用[44]。Yousaf等[45]表明E. ludwigii能够降解意大利黑麦草、百脉根、苜蓿根际的材油,有效定殖在根际和植物组织内,促进植物生长。分离自雷公藤的肠杆菌属内生菌LG3和LY4具有ACC脱氨酶活性,对小麦根和茎的伸长具有促进作用[46]。DD131属于路德维希肠杆菌(Enterobacter ludwigii),具ACC脱氨酶活性和耐盐碱特性,有望开发为耐盐促生菌株,该研究需要进一步研究。这些优良特性菌株的获得丰富了ACC脱氨酶细菌的寄主来源,为研究菌株功能和宿主间相互作用奠定了基础。
4 结论 从河南13个市(地区)36个点采集的大豆根瘤中筛出8株ACC脱氨酶内生细菌,其中菌株DD132酶活性最高(15.712 U/mg)。筛选菌株在4%-6% NaCl浓度培养基上具有较强耐受性,其中菌株DD165、DD132可耐受含9%盐浓度。在pH 11下5株菌(DD14、DD132、DD67、DD141、 DD131)均生长良好,说明这些菌株有较强耐碱性。产ACC脱氨酶菌株属于4个属,即Bacillus、Enterobacter、Stenotrophomonas和Pantoea。内生菌DD132对小麦幼苗生长具有明显促生长作用。筛选产ACC脱氨酶高活性菌株DD132兼有较强耐盐碱能力,存在抗逆促生潜能,为发掘和应用抗逆、促生的优良菌种资源提供理论基础。
参考文献
| [1] | Sgroy V, Cassán F, Masciarelli O, Del Papa MF, Lagares A, Luna V. Isolation and characterization of endophytic plant growth-promoting (PGPB) or stress homeostasis-regulating (PSHB) bacteria associated to the halophyte Prosopis strombulifera. Applied Microbiology and Biotechnology, 2009, 85(2): 371-381. |
| [2] | Zhang YF, He LY, Chen ZJ, Wang QY, Qian M, Sheng XF. Characterization of ACC deaminase-producing endophytic bacteria isolated from copper-tolerant plants and their potential in promoting the growth and copper accumulation of Brassica napus. Chemosphere, 2011, 83(1): 57-62. |
| [3] | Glick BR, Penrose DM, Li JP. A model for the lowering of plant ethylene concentrations by plant growth-promoting bacteria. Journal of Theoretical Biology, 1998, 190(1): 63-68. |
| [4] | Dobbelaere S, Vanderleyden J, Okon Y. Plant growth-promoting effects of diazotrophs in the rhizosphere. Critical Reviews in Plant Sciences, 2003, 22(2): 107-149. |
| [5] | Belimov AA, Hontzeas N, Safronova VI, Demchinskaya SV, Piluzza G, Bullitta S, Glick BR. Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.). Soil Biology & Biochemistry, 2005, 37(2): 241-250. |
| [6] | Tian L, Jiang Y, Chen CQ, Zhang GJ, Li T, Tong B, Xu P. Screening and identification of an endophytic bacterium with 1-aminocyclopropane-1-carboxylate deaminase activity from Panax ginseng and its effect on host growth. Acta Microbiologica Sinica, 2014, 54(7): 760-769. (in Chinese)田磊, 姜云, 陈长卿, 张冠军, 李桐, 佟斌, 许朋. 一株人参内生1-氨基环丙烷-1-1羧酸(ACC)脱氨酶活性细菌的筛选、鉴定及其对宿主生长的影响. 微生物学报, 2014, 54(7): 760-769. |
| [7] | Bai HB, Das S, Dangar TK, Adhya TK. ACC deaminase and IAA producing growth promoting bacteria from the rhizosphere soil of tropical rice plants. Journal of Basic Microbiology, 2013, 53(12): 972-984. |
| [8] | Penrose DM, Glick BR. Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria. Physiologia Plantarum, 2003, 118(1): 10-15. |
| [9] | Ji YX, Huang XD. Effects of plant growth-promoting rhizobacteria on the seedling growth of oat and annual ryegrass at various salt concentrations. Soils and Fertilizer Sciences in China, 2008, (2): 65-68. (in Chinese)吉云秀, 黄晓东. 不同盐分条件下植物促生菌对燕麦和黑麦草幼苗的促生效应. 中国土壤与肥料, 2008, (2): 65-68. |
| [10] | Arshad M, Shaharoona B, Mahmood T. Inoculation with Pseudomonas spp. containing ACC-deaminase partially eliminates the effects of drought stress on growth, yield, and ripening of pea (Pisum sativum L.). Pedosphere, 2008, 18(5): 611-620. |
| [11] | Belimov AA, Dodd IC, Hontzeas N, Theobald JC, Safronova VI, Davies WJ. Rhizosphere bacteria containing 1-aminocyclopropane-1-carboxylate deaminase increase yield of plants grown in drying soil via both local and systemic hormone signalling. New Phytologist, 2009, 181(2): 413-423. |
| [12] | Shaharoona B, Arshad M, Zahir ZA. Effect of plant growth promoting rhizobacteria containing ACC-deaminase on maize (Zea mays L.) growth under axenic conditions and on nodulation in mung bean (Vigna radiata L.). Letters in Applied Microbiology, 2006, 42(2): 155-159. |
| [13] | Gandhi PM, Narayanan KB, Naik PR, Sakthivel N. Characterization of Chryseobacterium aquaticum strain PUPC1 producing a novel antifungal protease from rice rhizosphere soil. Journal of Microbiology and Biotechnology, 2009, 19(1): 99-107. |
| [14] | Gong FJ, Entomack B, Zhang YF, Wulumuhan N. Isolation and antibacterial activity of ACC deaminase-containing endophytic bacteria from Eucommia ulmoides Oliver. Microbiology China, 2011, 38(10): 1526-1532. (in Chinese)龚凤娟, 恩特马克布拉提白, 张宇凤, 吾鲁木汗·那孜尔别克. 具有ACC脱氨酶活性的杜仲内生细菌的分离鉴定及其抗菌活性. 微生物学通报, 2011, 38(10): 1526-1532. |
| [15] | Honma M, Shimomura T. Metabolism of 1-aminocyclopropane-1-carboxylic acid. Agricultural and Biological Chemistry, 1978, 42(10): 1825-1831. |
| [16] | Sun JG, Hu HY, Liu J, Chen Q, Gao M, Xu J, Zhou YQ. Growth promotion potential and distribution features of nitrogen-fixing bacteria in field environments. Scientia Agricultura Sinica, 2012, 45(8): 1532-1544. (in Chinese)孙建光, 胡海燕, 刘君, 陈倩, 高淼, 徐晶, 周义清. 农田环境中固氮菌的促生潜能与分布特点. 中国农业科学, 2012, 45(8): 1532-1544. |
| [17] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [18] | Saleh SS, Glick BR. Involvement of gacS and rpoS in enhancement of the plant growth-promoting capabilities of Enterobacter cloacae CAL2 and UW4. Canadian Journal of Microbiology, 2001, 47(8): 698-705. |
| [19] | Zhao LF, Xu YJ, Cao DJ, Li Y, Li JJ, Lv JM, Zhu ZY, Qin SS, He XL. Screening, resistance, phylogeny and growth promoting of phosphorus solubilizing bacteria isolated from soybean root nodules. Acta Ecologica Sinica, 2015, 35(13): 4425-4435. (in Chinese)赵龙飞, 徐亚军, 曹冬建, 李源, 厉静杰, 吕佳萌, 朱自亿, 秦珊珊, 贺学礼. 溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生. 生态学报, 2015, 35(13): 4425-4435. |
| [20] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001: 320-418. |
| [21] | Compant S, Duffy B, Nowak J, Clément C, Barka EA. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects. Applied and Environmental Microbiology, 2005, 71(9): 4951-4959. |
| [22] | Zhao LF, Xu YJ, Sun R, Deng ZS, Yang WQ, Wei GH. Identification and characterization of the endophytic plant growth prompter Bacillus cereus strain mq23 isolated from Sophora Alopecuroides root nodules. Brazilian Journal of Microbiology, 2011, 42(2): 567-575. |
| [23] | Rajendran G, Sing F, Desai AJ, Archana G. Enhanced growth and nodulation of pigeon pea by co-inoculation of Bacillus strains with Rhizobium spp.. Bioresource Technology, 2008, 99(11): 4544-4550. |
| [24] | Belimov AA, Dodd IC, Safronova VI, Hontzeas N, Davies WJ. Pseudomonas brassicacearum strain Am3 containing 1-aminocyclopropane-1-carboxylate deaminase can show both pathogenic and growth-promoting properties in its interaction with tomato. Journal of Experimental Botany, 2007, 58(6): 1485-1495. |
| [25] | Wei SN, Jiang S, Huang XY, Wei GH, Liu XP. Isolation and identification of wheat rhizosphere bacteria producing 1-aminocyclopropane-1-carboxylate (ACC) deaminase from drought soil. Microbiology China, 2011, 38(5): 722-728. (in Chinese)魏素娜, 蒋帅, 黄锡云, 韦革宏, 刘西平. 旱地小麦根际细菌中产生1-氨基环丙烷-1-羧酸(ACC)脱氨酶菌株的分离和鉴定. 微生物学通报, 2011, 38(5): 722-728. |
| [26] | Zhang YJ, Qin S, Bian GK, Fei SM, Li Q, Cao CL, Wang LH, Jiang JH. Isolation, screening and phylogenetic analysis of plant growth-promoting rhizobacteria (PGPR) containing ACC deaminase from Jatropha curcas L. Microbiology China, 2012, 39(7): 901-911. (in Chinese)张越己, 秦盛, 卞光凯, 费世明, 李钦, 曹成亮, 王乐辉, 蒋继宏. 具有ACC脱氨酶活性的麻疯树根际促生菌(PGPR)的分离筛选及系统发育分析. 微生物学通报, 2012, 39(7): 901-911. |
| [27] | Qin BJ, Luo Q, Gao M, Hu HY, Xu J, Zhou YQ, Sun JG. Isolation of wheat endophytic diazotrophs and determination of 1-aminocyclopropane-1-carboxylate deaminase. Scientia Agricultura Sinica, 2012, 45(6): 1066-1073. (in Chinese)秦宝军, 罗琼, 高淼, 胡海燕, 徐晶, 周义清, 孙建光. 小麦内生固氮菌分离及其ACC脱氨酶测定. 中国农业科学, 2012, 45(6): 1066-1073. |
| [28] | Yao JP, Yao T, Wang XL. Research progress and application of 1-aminocyclopropane-1-carboxylate deaminase. Biotechnology, 2010, 20(2): 87-91. (in Chinese)姚军朋, 姚拓, 王小利. ACC脱氨酶的应用研究进展与评述. 生物技术, 2010, 20(2): 87-91. |
| [29] | Dou YJ, Kang LH, Lu JK, Hou JJ, Zhu YJ. ACC deaminase activity of Rhizobia associated with Acacia melanoxylon. Journal of Central South University of Forestry & Technology, 2014, 34(11): 77-83. (in Chinese)窦雅静, 康丽华, 陆俊锟, 侯俊杰, 朱亚杰. 黑木相思根瘤菌ACC脱氨酶活性的研究. 中南林业科技大学学报, 2014, 34(11): 77-83. |
| [30] | Hou JJ, Kang LH, Lu JK, Zhu YJ, Wang SK. Growth-promoting effect of Bacillus strains on Eucalyptus seedling and their ACC deaminase activity. Microbiology China, 2014, 41(10): 2029-2034. (in Chinese)侯俊杰, 康丽华, 陆俊锟, 朱亚杰, 王胜坤. 芽孢杆菌对桉树幼苗的促生效果及其ACC脱氨酶活性的研究. 微生物学通报, 2014, 41(10): 2029-2034. |
| [31] | Hontzeas N, Richardson AO, Belimov A, Safronova V, Abu-Omar MM, Glick BR. Evidence for horizontal transfer of 1-aminocyclopropane-1-carboxylate deaminase genes. Applied and Environmental Microbiology, 2005, 71(11): 7556-7558. |
| [32] | Du CY, Li HT, Liu RM, Xie BJ, Zhang JB, Gao JG. Isolation and primary identification of salt-tolerant Bacillus in Northeast of China. Biotechnology Bulletin, 2014, (10): 179-187. (in Chinese)杜传英, 李海涛, 刘荣梅, 谢滨娇, 张金波, 高继国. 东北的饱杆菌筛选统计及初步鉴定. 生物技术通报, 2014, (10): 179-187. |
| [33] | Bangash N, Khalid A, Mahmood T, Siddique MT. Screening rhizobacteria containing ACC-deaminase for growth promotion of wheat under water stress. Pakistan Journal of Botany, 2013, 45(S1): 91-96. |
| [34] | Liu JL, Fang F, Shi XH, Chen HY, Yao L, Guo CH. Isolation and characterization of PGPR from the rhizosphere of the Avena sativa in saline-alkali soil. Acta Prataculturae Sinica, 2013, 22(2): 132-139. (in Chinese)刘佳莉, 方芳, 史煦涵, 陈红艳, 姚琳, 郭长虹. 2株盐碱地燕麦根际促生菌的筛选及其促生作用研究. 草业学报, 2013, 22(2): 132-139. |
| [35] | Wu M, Li L, Yang HY, Liu JQ, Liu YJ. Screening the growth-promoting strains of salt resistant and the producing conditions of ACC deaminase. Journal of Shenyang Agricultural University, 2013, 44(6): 837-840. (in Chinese)吴铭, 李玲, 杨红艳, 刘家麒, 刘延吉. ACC脱氨酶耐盐促生菌株的筛选及产酶条件研究. 沈阳农业大学学报, 2013, 44(6): 837-840. |
| [36] | Liu HJ, Dang Z, Zhang H, Yi XY, Liu CQ. Characterization of heavy metal resistance and Cd-accumulation on a Bacillus cereus strain. Journal of Agro-Environment Science, 2010, 29(1): 25-29. (in Chinese)刘红娟, 党志, 张慧, 易筱筠, 刘丛强. 蜡状芽孢杆菌抗重金属性能及对镉的累积. 农业环境科学学报, 2010, 29(1): 25-29. |
| [37] | Quecine MC, Araújo WL, Rossetto PB, Ferreira A, Tsui S, Lacava PT, Mondin M, Azevedo JL, Pizzirani-Kleiner AA. Sugarcane growth promotion by the endophytic bacterium Pantoea agglomerans 33.1. Applied and environmental microbiology, 2012, 78(21): 7511-7518. |
| [38] | Sergeeva E, Hirkala DLM, Nelson LM. Production of indole-3-acetic acid, aromatic amino acid aminotransferase activities and plant growth promotion by Pantoea agglomerans rhizosphere isolates. Plant and Soil, 2007, 297(1/2): 1-13. |
| [39] | Feng Y, Shen D, Song W. Rice endophyte Pantoea agglomerans YSl9 promotes host plant growth and affects allocations of host photosynthates. Journal of Applied Microbiology, 2006, 100(5): 938-945. |
| [40] | Teng SS, Liu YP, Zhao L. Isolation, identification and characterization of ACC deaminase-containing endophytic bacteria from halophyte Suaeda salsa. Acta Microbiologica Sinica, 2010, 50(11): 1503-1509. (in Chinese)滕松山, 刘艳萍, 赵蕾. 具ACC脱氨酶活性的碱蓬内生细菌的分离、鉴定及其生物学特性. 微生物学报, 2010, 50(11): 1503-1509. |
| [41] | Tan ZY, Peng GX, Xu PZ, Ai SY, Tang SH, Zhang GX, Zeng FY. Diversity and high nitrogenase activity of endophytic diazotrophs isolated from Oryza rufipogon Griff. Chinese Science Bulletin, 2009, 54(16): 2839-2848. (in Chinese)谭志远, 彭桂香, 徐培智, 艾绍英, 唐拴虎, 张国霞, 曾凤云. 普通野生稻(Oryza rufipogon)内生固氮菌多样性及高固氮酶活性. 科学通报, 2009, 54(13): 1885-1893. |
| [42] | Tian J, Peng XW, Li X, Sun YJ, Feng HM, Jiang ZP. Isolation and characterization of two bacteria with heavy metal resistance and phosphate solubilizing capability. Environmental Science, 2014, 35(6): 2334-2340. (in Chinese)田江, 彭霞薇, 李霞, 孙雅君, 冯红梅, 江泽平. 重金属抗性解磷细菌的磷溶解特性研究. 环境科学, 2014, 35(6): 2334-2340. |
| [43] | Tang YB, Wang XC, Chen FY, Ma SS, Yang X. Screening, identification and degradation characteristics of a dominant fluorene-degrading strain. China Evironmental Science, 2010, 30(8): 1086-1090. (in Chinese)唐玉斌, 王晓朝, 陈芳艳, 马姗姗, 杨旭. 芴降解优势菌的筛选鉴定及降解特性研究. 中国环境科学, 2010, 30(8): 1086-1090. |
| [44] | Shoebitz M, Ribaudo CM, Pardo MA, Cantore ML, Ciampi L, Curá JA. Plant growth promoting properties of a strain of Enterobacter ludwigii isolated from Lolium perenne rhizosphere. Soil Biology and Biochemistry, 2009, 41(9): 1768-1774. |
| [45] | Yousaf S, Afzal M, Reichenauer TG, Brady CL, Sessitsch A. Hydrocarbon degradation, plant colonization and gene expression of alkane degradation genes by endophytic Enterobacter ludwigii strains. Environmental Pollution, 2011, 159(10): 2675-2683. |
| [46] | Xu JJ, Song P, Feng L, Hong W, Wu CZ, Li GQ, Zhao XJ, Ge HY. Growth-promoting effect and triptolide production regulation of endophytic bacteria from Tripterygium wilfordii. Chinese Journal of Applied Ecology, 2014, 25(6): 1681-1687. (in Chinese)许进娇, 宋萍, 封磊, 洪伟, 吴承祯, 李国庆, 赵希俊, 葛恒懿. 雷公藤内生细菌的促生作用及其对雷公藤甲素生成的影响. 应用生态学报, 2014, 25(6): 1681-1687. |
