李星硕1,2, 朱玥明2, 管于平2, 柏玮2, 贾士儒1, 孙媛霞2


1.天津科技大学生物工程学院, 天津 300457;
2.中国科学院天津工业生物技术研究所, 天津 300308
收稿日期:2015-10-10;修回日期:2015-12-03;网络出版日期:2015-01-25
资助课题:国家“863计划”(2013AA102105);天津市科技支撑计划重点项目(132C2DSY05600)
通信作者:Tel/Fax:+86-22-84861960;E-mail:sun_yx@tib.cas.cn
摘要: [目的] 从肉联厂附近土壤中筛选出新型的胶原酶菌种,并通过提高其产酶量后研究其胶原酶的纯化方法,进一步研究该胶原酶对胶原蛋白的降解效率。[方法] 经形态特征、生理生化特征以及16SrRNA基因进化树分析鉴定该菌株,并对该菌株产酶发酵条件进行优化,最终利用强阴离子交换树脂对该菌株所产的胶原酶进行分离纯化。[结果] 该菌株鉴定为蜡样芽孢杆菌(Bacillus cereus)。对该菌株的产酶发酵条件进行优化,结果表明最适碳源为2.0%葡萄糖、最适氮源为1.5%胰蛋白胨、最适无机盐为0.005% Ca2+;初始发酵液pH 7.5、发酵温度37 ℃,在最适条件下,该菌株发酵液的酶活为(65.81±2.06)U/mL,相比优化前(26.7±1.9) U/mL,酶活提高约1.5倍。对该菌株所产的胶原酶进行分离纯化,得到1个分子量约为100 kDa、纯度大于90%的胶原酶,其比酶活力约为(7615.0±78.7) U/mg。[结论] 该研究所发现的胶原酶酶活较高,能够使胶原蛋白在短时间内被有效地降解为具有生物活性的胶原短肽,在食品、医疗、保健品、化妆品等领域具有较广泛的应用前景。
关键词: 胶原蛋白酶 蜡样芽孢杆菌 筛选 纯化 发酵优化
Screening, identification and fermentation optimization of a collagenase-producing strain and purification of the collagenase
Xingshuo Li1,2, Yueming Zhu2, Yuping Guan2, Wei Bai2, Shiru Jia1, Yuanxia Sun2


1.College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China;
2.National Engineering Laboratory for Industrial Enzymes, Tianjin Institute of Industrial Biotechnology, Tianjin 300308, China
Supported by the National High Technology Research and Development of China (2013AA102105) and by the Key Project ofTianjin Science and Technology Support Grogram (132C2DSY05600)
Abstract: [Objective] The purpose of this study was to isolate novel strains from the soil nearby meat processing factories to produce collagenase. After the yield of collagenase from the strain improved, the collagenase was purified and used for hydrolyzing collagen.[Methods] The strain was identified based on morphological features, physiological and biochemical characteristics and 16S rRNA gene phylogenetic tree analysis. The yield of collagenase was increased by optimizing the fermentation condition, and the collagenase isolated from the fermentation supernatant of the strain was finally purified with strong anion exchange resins.[Results] The collagenase-producing strain was identified as Bacillus cereus. The optimized fermentation conditions of the strain were: 2.0% glucose as optimum carbon source, 1.5% tryptone as optimum nitrogen source, 0.005% of Ca2+ as optimum metal ion. The optimum temperature and pH were 37 ℃ and 7.5, respectively. Under the optimum conditions, the enzyme activity of collagenase was (65.81±2.06) U/mL, 1.5-fold increased than that before the optimization. After purified with strong anion exchange resins, a collagenase with the purity higher than 90%, the molecular weight about 100 kDa, and the specific activity of 7615.0±78.7 U/mg was obtained. [Conclusion] The activity of Bacillus cereus collagenase was higher than the reported collagenases. Using this novel collagenase, collagen could be degraded into short biological peptides in a short time. Hence, this collagenase has application prospects in many fields, such as food, medical, health care products and cosmetics.
Key words: collagenase Bacillus cereus screening purification fermentation optimization
我国水域面积广阔,水产品丰富,养殖业蓬勃发展的同时,也造成了各种副产品的浪费[1],例如鱼皮中含有丰富的胶原蛋白[2-4]。以鱼皮等工业加工废弃物为原料,开发生产新型高活性的胶原多肽逐渐成为研究热点[5-7]。相比酸碱水解方式,胶原酶降解技术更为人们所认可和研究。胶原酶(Collagenase)是指能在适宜的pH和温度条件下特异性的水解天然胶原蛋白或明胶,而不损伤其他蛋白质和组织的酶类[8]。其特异水解胶原蛋白的产物胶原三肽,相比大分子的胶原蛋白则在消化吸收、营养、功能特性等方面都会得到显著的提高[9-10]。另外,胶原酶在医疗方面也具有极高的应用价值,它可以用于治疗腰椎间盘突出、杜普伊特伦症、瘢痕疙瘩等异常增生,也在细胞研究、环境保护等方面具有极高的应用价值[11]。
胶原酶来源广泛,多种微生物及动物的许多组织细胞都可以产生胶原蛋白酶[12]。其中,微生物来源的胶原酶具有产量高,可分泌到胞外,便于提取等优点。目前研究较多的产胶原酶菌株为溶组织梭菌(Clostridium histolyticum)[13]、产气荚膜梭菌(Clostridium perfringens)[14]和溶藻弧菌(Vibrio alginolyticus)[15]等,其制备的胶原酶已做为商品酶进行出售。并且随着对微生物胶原酶研究的不断深入,大量新来源的胶原酶被报道。
本文以肉联厂附近土壤为样品,筛选出1株生产胶原酶的菌株Col15,经鉴定为蜡样芽孢杆菌(Bacillus cereus)。为进一步提高该菌株的产酶量,我们对其发酵条件进行优化研究,同时从发酵液中分离纯化得到了1种胶原酶,为进一步研究该胶原酶的性质提供了可能。
1 材料和方法 1.1 实验材料
1.1.1 试剂: 样品来自天津肉联厂附近的土样。主要试剂为胶原蛋白粉末,本实验室自制。其他试剂均为国产分析纯。
1.1.2 仪器与设备: SW-CJ-2FD超净工作台(苏净集团苏州安泰空气技术有限公司);IS-RSD3台式恒温振荡器(广州市深华生物技术有限公司);DHP-9082电热恒温培养箱(上海一恒科技仪器有限公司);岛津UV-1800双光束紫外可见分光光度计[岛津(广州)检测技术有限公司];Microtron振荡培养箱[伊孚森生物技术(中国)有限公司];GelDoc XR+ Bio-Rad全自动凝胶成像系统[伯乐生物医学产品(上海)有限公司];AKTA Apurifier10快速纯化液相色谱系统(通用电气医疗生物科学中国有限公司);T100 PCR仪(美国伯乐公司);SQ510C高压蒸汽灭菌器(雅马拓科技贸易上海有限公司)。
1.1.3 主要培养基: (1) 种子培养基(g/L):牛肉膏5.000,胰蛋白胨 10.000,NaCl 5.000,调整pH 7.5;(2) 初筛培养基(g/L):胰蛋白胨5.000,NaCl 0.100,明胶20.000,KH2PO4 0.500,MgSO4·7H2O 0.200,调整pH 7.5;(3) 发酵培养基(g/L):葡萄糖 20.000,酵母粉 1.500,胰蛋白胨 10.000,CaCl2 0.050,MgCl2·6H2O 0.165,K2HPO4·3H2O 2.500,NaH2PO4·2H2O 0.500,调整pH 7.5;(4) 固体培养基:在上述液体培养基中加入1.5%-2.0% 琼脂,即制得相应固体培养基。
1.2 产胶原酶菌株的筛选 采集的土样以1:1 (质量比)的比例混合无菌水和鸡蛋清,加入小片猪皮和鱼皮,25-30 °C富集培养3个月;无菌水悬浮煮沸后,梯度稀释涂布于初筛培养基平板上,在菌落周围滴加酸性汞试剂,选择透明圈直径与菌落直径之比较大的菌落[16];以发酵培养基培养对菌株的胶原酶酶活力进行测定(酸性汞试剂:HgCl2 15 g,浓盐酸20 g,溶于蒸馏水,定容至100 mL)。
1.3 产胶原酶菌株的鉴定 参考《常见细菌系统鉴定手册》和《伯杰氏菌株鉴定手册》对菌株进行形态特征及生理生化特征的研究。 以细菌基因组DNA抽提试剂盒(天根生化科技有限公司)提取的菌株Col15基因组DNA为模板,以细菌16S rRNA基因通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′,对该菌株的16S rRNA基因进行扩增,PCR反应体系为:DNA模板(2 ng/μL) 1 μL、PCR引物(10 nmol/μL)各2.5 μL、Q5酶(40 U/mL) 1 μL、10×PCR buffer 5 μL、10 mmol/L dNTPs 1 μL,加灭菌双蒸水至50 μL。PCR反应条件为:98 °C 30 s;98 °C 10 s,55 °C 20 s,72 °C 1 min,35个循环;72 °C 2 min。PCR产物用0.8%的琼脂糖凝胶电泳进行检测,纯化后连接到pEASY-Blunt clonning vector。16S rRNA基因测序委托苏州金维智生物科技有限公司完成。
1.4 产酶发酵条件优化 取冻藏菌种接种于50 mL种子培养基上,37 °C、200 r/min培养过夜到菌种的对数期,制得活化的种子液。以1%接种量接种于含有50 mL发酵培养基的250 mL无菌三角瓶中,37 °C、200 r/min培养54 h,测定酶活力,所有实验设计3次平行,分别对发酵培养基成分以及发酵培养条件进行单因素研究。
1.5 胶原酶的分离纯化 将菌种发酵液离心,取发酵液上清过0.22 μm中空纤维膜过滤,除尽菌体后的上清液过截留分子量为30 kDa的切向流超滤器(Vivaflow 50)进行浓缩,然后以50 mmol/L Tris-HCl (pH 7.5,含5 mmol/L CaCl2)的缓冲液反复清洗浓缩液,即得胶原酶粗酶液。然后以同样的缓冲液平衡强阴离子交换柱(Source 15Q),将粗酶液上样后以含有1 mmol/L NaCl的相同缓冲液进行线性梯度洗脱,洗脱时流速1 mL/min,洗脱时间180 min,收集活性部分,以SDS-PAGE电泳进行纯度分析。
1.6 酶解胶原蛋白产物的SDS-PAGE分析 提取鳕鱼鱼皮胶原蛋白[17-18],以50 mmol/L Tris-HCl (pH 7.5,含5 mmol/L CaCl2)的缓冲液制得终浓度为10 mg/mL的胶原蛋白底物,加入纯化的胶原酶液,并以加热灭活的胶原酶液作为对照,37 °C水浴反应30 min,酶解液进行SDS-PAGE分析。
1.7 测定指标与方法
1.7.1 胶原酶酶活力的测定方法: 采用茚三酮显色法[19]对胶原酶酶活力进行测定。制备鳕鱼皮胶原蛋白,以50 mmol/L Tris-HCl (pH 7.5,含5 mmol/L CaCl2)的缓冲液制得终浓度为5 mg/mL的胶原蛋白底物。取0.3 mL胶原蛋白底物,加入5 μL胶原酶,37 °C水浴反应30 min,加入0.3 mL 30%三氯乙酸(TCA)以终止反应,同时以先加入终止液的、含有灭活胶原酶的相同反应体系为对照,然后依次加入0.6 mL 2 mol/L乙酸缓冲液和0.6 mL茚三酮显色液,混匀后于沸水浴中煮沸15 min,冷却后加入1.8 mL 60%乙醇稀释反应液,混匀后于570 nm处比色,测定反应所释放出的水溶性氨基酸、短肽的量。 酶活力单位定义为:37 °C,pH 7.5条件下,每分钟水解胶原蛋白产生相当于1 μg甘氨酸的酶量为1个酶活力单位(U)。
1.7.2 蛋白浓度的测定方法: 以BCA蛋白浓度测定试剂盒[20]测定样品中的蛋白含量,其中标准品为牛血清白蛋白。
1.7.3 蛋白纯度及分子量的测定方法: 以Bollineni[21]等的SDS-PAGE方法对样品的蛋白大小及蛋白纯度进行测定,其中分离胶浓度为12.5%,浓缩胶浓度为5.0%。
2 结果和分析 2.1 产胶原酶菌株的筛选 本实验以天津肉联厂附近采集的7份土样样品作为基质,富集培养3个月;经梯度稀释涂布到初筛培养基上,37 °C恒温箱培养48 h,滴加酸性汞试剂到菌落周围,共得到17株胶原酶产生菌;选择形成的透明圈直径与菌落直径比值较大的菌株,接种到发酵培养基上,经摇床发酵54 h后,测定胶原降解活力,其中有6株酶活力在15 U/mL以上,选择编号为Col15的酶活力最高为(26.7±1.9) U/mL的菌株作为研究对象。
2.2 产胶原酶菌株的鉴定 经形态特征观察,菌株Col15菌落为白色(菌落中央有微量红点),不透明,表面光滑,边缘整齐;在光学显微镜下,菌体为杆状,产芽孢,孢子中生或近中生,孢子囊无明显膨大。对菌株Col15的主要生理生化特征进行鉴定后表明:葡萄糖、乳糖、蔗糖、木糖、甘露糖、阿拉伯糖、NaCl (5%、10%)、pH (5.7、7.5、9.0)、革兰氏反应、明胶液化试验为阳性;淀粉水解、酪素水解、柠檬酸利用、乙酰甲基甲醇试验为阴性。
对该菌株16S rRNA基因进行扩增和测序,结果表明16S rRNA基因序列长度为1438 bp,通过与数据库比对,BLAST结果表明其与芽孢杆菌属的蜡样芽孢杆菌(Bacillus cereus)相似性极高,最高达到99%以上。选取部分芽孢杆菌属以及其它产胶原酶菌株的16S rRNA基因序列,利用MEGA 6.06软件分析构建系统发育树。结果显示,菌株Col15与蜡样芽孢杆菌的亲缘关系最近,如图1所示。结合该菌株的形态学和生理学特征,该菌株被鉴定为蜡样芽孢杆菌(Bacillus cereus)。该菌株的16S rRNA基因序列已经提交GenBank (No. KT726339)。
 |
| 图 1. 以16S rRNA基因为基础的菌株Col15系统进化发育树 Figure 1. Phylogenetic tree of the strain Col15 based on 16S rRNA gene sequence |
| 图选项 |
2.3 菌株产酶发酵优化结果
2.3.1 不同碳源对菌体产酶的影响: 在发酵培养基中分别加入2.0%的不同碳源,而其它成分不变。经摇瓶发酵培养54 h后测定酶活力。结果如表1,影响菌株Col15产酶的最适碳源为葡萄糖,其它碳源对菌株Col15的产酶能力影响较弱,说明菌株Col15能较好的吸收利用葡萄糖,并且以组成型表达分泌胶原酶。
表 1. 不同碳源对菌体产酶的影响 Table 1. Effect of various carbon sources on the production of collagenase
| Carbon sources | Enzyme activity/(U/mL) | Biomass (OD600) |
| D-Glucose | 35.82±4.54 | 4.32±0.11 |
| Mannitol | 31.38±4.32 | 4.19±0.09 |
| Maltose monohydrate | 11.04±0.50 | 4.99±0.18 |
| Lactose monohydrate | 15.70±2.46 | 4.86±0.18 |
| Sucrose | 20.82±0.82 | 4.77±0.37 |
表选项
2.3.2 培养基碳源浓度的确定: 在发酵培养基中分别加入不同浓度的葡萄糖,而其它成分不变。经摇瓶发酵培养54 h后测定酶活力。结果如图2,其中菌株Col15产酶的最适葡萄糖浓度为2.0%。葡萄糖浓度较低时,无法提供菌体生长所需的碳源,不利于菌体的生长,同时也不利于菌体的产酶;葡萄糖浓度较高时,菌体生长初期较旺盛,营养物质消耗快,使得后期菌体产酶量低。
 |
| 图 2. 葡萄糖浓度对菌株产酶的影响 Figure 2. Effect of glucose concentration on the production of collagenase |
| 图选项 |
2.3.3 不同氮源对菌体产酶的影响: 在发酵培养基中,分别加入终浓度为1.0%的不同氮源。经摇瓶发酵培养54 h后测定酶活力,结果如表2所示,胰蛋白胨对菌种产酶的影响较大,更有利于菌种的生长和产酶。
表 2. 不同氮源对菌体产酶的影响 Table 2. Effect of various nitrogen sources on the production of collagenase
| Nitrogen sources | Enzyme activity/(U/mL) | Biomass (OD600) |
| Tryptone | 38.02±1.64 | 4.78±0.19 |
| Yeasy extract | 5.54±4.12 | 0.89±0.01 |
| Beef extract | 15.94±3.28 | 2.91±0.09 |
| Gelatin | 3.72±2.46 | 0.07±0.01 |
| Carbamide | 28.72±8.22 | 0.24±0.01 |
| (NH4)2SO4 | 4.88±2.46 | 0.06±0 |
表选项
2.3.4 培养基胰蛋白胨浓度的确定: 鉴于在不同氮源对菌种的发酵影响时,胰蛋白胨对菌种产酶的促进作用最大。于是在发酵培养基中,分别加入不同浓度的胰蛋白胨,而其它成分不变。经摇瓶发酵培养54 h后测定酶活力,结果如图3所示,其中最适Col15菌株产酶的胰蛋白胨浓度为1.5%。
 |
| 图 3. 胰蛋白胨浓度对菌株产酶的影响 Figure 3. Effect of tryptone concentration on the production of collagenase |
| 图选项 |
2.3.5 不同无机盐对菌体产酶的影响: 在发酵培养基中,分别加入不同种类的无机盐,由于不同种类无机盐的水溶性不同,尤其是ZnCl2,其低浓度水溶液即能形成沉淀,因此Ca2+、Mn2+、Mg2+、Fe2+浓度为0.5 mmol/L,Zn2+浓度0.03 mmol/L,而其它成分不变。经摇瓶发酵培养54 h后测定酶活力。结果如表3所示,其中促进菌株Col15产酶量较大的是Ca2+。
表 3. 不同无机盐对菌体产酶的影响 Table 3. Effect of various mineral salts on the production of collagenase
| Mineral salts | Enzyme activity/(U/mL) | Biomass (OD600) |
| Ca2+ | 23.95±2.47 | 6.77±0.13 |
| Mg2+ | 9.13±2.47 | 6.76±0.13 |
| Zn2+ | 8.26±2.47 | 7.18±0.04 |
| Mn2+ | 19.59±3.70 | 6.60±0.60 |
| Fe2+ | 10.00±9.87 | 8.05±0.25 |
表选项
2.3.6 培养基无机盐浓度的确定: 参考上一步无机盐对菌种发酵产酶的影响,Ca2+能更好的有利于菌种产酶,因此在发酵培养基中,分别加入不同浓度的Ca2+,而其它成分不变。经摇瓶发酵培养54 h后测定酶活力。结果如图4所示,其中Ca2+的最适浓度为0.5 mmol/L,Ca2+过低和过高都会抑制菌体的生长,适宜浓度的Ca2+有利于菌种的产酶。
 |
| 图 4. Ca2+浓度对菌种产酶的影响 Figure 4. Effect of Ca2+concentration on the production of collagenase |
| 图选项 |
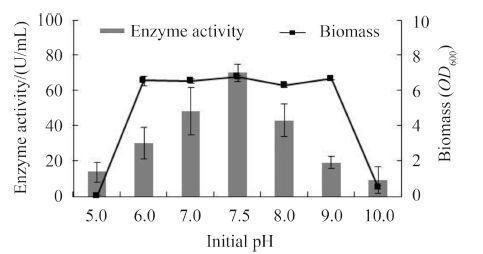
2.3.7 发酵初始pH的确定: 在发酵培养前,调节不同发酵培养基的初始pH值,摇瓶发酵54 h后测定酶活力。结果如图5,发现Col15菌株pH值的适应范围很广泛,为6.0-9.0,pH过于偏酸或者偏碱,将不利于菌体的生长,进而影响菌体的产酶。
 |
| 图 5. 初始pH值对菌种产酶的影响 Figure 5. Effect of initial pH on the production of collagenase |
| 图选项 |
2.3.8 发酵最适温度的确定: 调节不同的发酵温度,摇瓶发酵54 h后测定酶活力。结果见图6,发现菌株Col15产酶的最适温度为37 °C。在低温下虽然使得菌体生长,但不利于菌体的产酶;温度过高将不利于菌体的生长,进而影响菌体的产酶量。
 |
| 图 6. 不同发酵温度对菌种产酶的影响 Figure 6. Effect of different culture temperature on the production of collagenase |
| 图选项 |
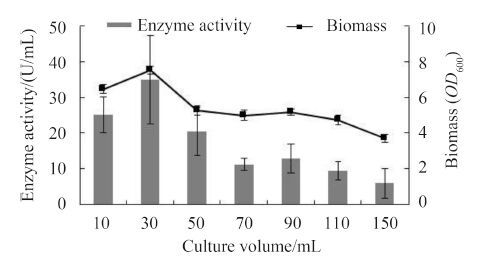
2.3.9 装液量对菌种产酶的影响: 在250 mL三角瓶中,加入不同含量的培养基,以1.0%的接种量摇瓶发酵54 h,测定酶活如图7所示。装液量较少时,培养基中溶氧量较大,但营养成分少,消耗快,在菌体生长后期不利于其生长和产酶;随着装液量的增加,培养基中溶氧量减少,菌体生长不好,进而影响产酶量不高。同时也说明了该产酶菌株为好氧型。
 |
| 图 7. 不同装液量对菌种产酶的影响 Figure 7. Effect of different culture volume on the production of collagenase |
| 图选项 |
2.4 胶原酶的分离纯化 经过中空纤维膜过滤、切向流超滤器浓缩和强阴离子交换树脂层析,对菌株Col15发酵液中的蛋白进行分离,最终得到1个具有胶原酶活性的蛋白。经测定,纯化得到的胶原酶的比酶活力为(7133.5±53.6) U/mg,最终分离纯化得到的胶原酶样品经SDS-PAGE检测如图8-A所示,可以看出纯化得到的胶原酶分子量约为100 kDa,约占总蛋白的90%以上。
 |
| 图 8. 菌株Col15表达胶原酶(A)及酶解反应(B)的SDS-PAGE Figure 8. SDS-PAGE analysis of expression (A) and hydrolysis (B) of collagenase from strain Col15. M: marker |
| 图选项 |
通过本次筛选鉴定,从土壤中得到1株产胶原酶的蜡样芽孢杆菌(Bacillus cereus),也是首次尝试利用鱼皮等含有胶原蛋白的物质富集筛选得到的,使得菌株更能特异性的水解天然胶原蛋白物质(表4)。同时该菌株无需诱导,即能生产并胞外分泌胶原酶,使得该胶原酶的纯化方式更加方便简单。经过纯化,从其发酵液中得到1个分子量约为100 kDa的胶原酶,该酶的比酶活力为(7615.0±78.7) U/mg,为目前所报道的,酶活力较高的胶原酶。
表 4. 不同胶原酶菌种及酶活比较 Table 4. Comparison of different strains and enzyme activity of collagenase
| Strains | Enrichment | Collagenase/kDa | Specific activity/(U/mg) |
| Bacillus cereus | Collagen | 100.00 | 7615.00 |
| Bacillus subtilis[16] | Collagen | – | – |
| Grimontia(Vibrio)hollisae[22] | – | 84.00 | 5314.00 |
| Bacillus licheniformis[23] | Gelatin | – | – |
| Serratiaentomophila[24] | Gelatin | 57.50 | – |
| Streptomyces parvulus[25] | – | 52.00 | 938.00 |
| Bacillus cereus[26] | – | 114.00 | 271.50 |
| Stenotrophomonasmaltophilia[27] | Gelatin | <80.00 | – |
| Pseudomonas aeraginosa[28] | Gelatin | – | – |
| Bacillus pumilus[29] | Gelatin | 58.64 | 6549.75 |
表选项
2.5 胶原蛋白的水解 为了进一步了解胶原酶降解胶原蛋白的酶解能力和酶解产物,在300 μL 10 mg/mL的鱼皮胶原蛋白中添加5 μL 0.2 mg/mL的胶原酶,37 °C水浴反应30 min,以相同的反应加入灭活的酶作为对照。将其反应后的样品进行SDS-PAGE检测,结果如图8-B所示,胶原酶可以在30 min内快速的降解胶原蛋白,其降解产物分子量较小,并呈连续分布的状态。
胶原酶在短时间内快速的降解胶原蛋白,其降解产物经LC-MS检测,分子量主要分布在400-1500 Da之间。胶原酶在降解胶原蛋白时,直接作用于胶原蛋白的特征序列(X-Y-G)n中的Y与G之间,进而将胶原蛋白大分子降解为胶原三肽或多肽,其中G为Glycine,通常X、Y分别指的是Proline和Hydroxyproline[22]。其降解产物有利于机体的吸收和利用,利用体内其它蛋白酶进一步降解胶原三肽成游离氨基酸,以补充机体所必需的氨基酸,使胶原蛋白得到更好地利用。另外,富含胶原蛋白的水产加工副产物,利用胶原酶水解能获得具有生理活性的胶原短肽,可以提高其附加值。
3 结论 本研究从土壤中筛选到1株产胶原酶的蜡样芽孢杆菌(Bacillus cereus),该菌株的产酶活性为(26.7±1.9) U/mL。通过对该菌株发酵培养基成分及培养条件进行优化,结果表明:培养基最适碳源为2.0%葡萄糖,氮源为1.5%胰蛋白胨,无机盐为0.5 mmol/L Ca2+;最适发酵培养温度为37 °C,pH值为7.5,250 mL三角瓶中添加30 mL发酵培养基有利于菌种的产酶。在最适发酵培养条件下,该菌株产酶活性为(65.81±2.06) U/mL,相比优化前,酶活提高约1.5倍。对其发酵液进行分离纯化,得到一个分子量约为100 kDa的胶原酶,该酶的比酶活力为(7615.0±78.7) U/mg,并能在短时间内快速的降解胶原蛋白为短肽产物。因此,获得的菌株以及其所产生的胶原酶将在食品、化妆品、医疗等领域具有广阔的应用前景。
参考文献
| [1] | Zheng GB, Yao HY. Marine medicine industry development present situation and prospect and countermeasures of China. Review of Economic Research, 2003, (33): 23-29. (in Chinese)郑贵斌, 姚海燕. 我国海洋药物产业的发展现状、展望与对策. 经济研究参考, 2003, (33): 23-29. |
| [2] | Lin L. Studies on preparation of collagen and bioactivities of collagen polypeptide from the skins of aquatic animals. Doctor Dissertation of Ocean University of China, 2006. (in Chinese)林琳. 鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究. 中国海洋大学博士学位论文, 2006. |
| [3] | 蒋挺大. 胶原与胶原蛋白. 北京: 化学工业出版社, 2006: 2. |
| [4] | Ogawa M, Moody MW, Portier RJ, Bell J, Schexnayder MA, Losso JN. Biochemical properties of black drum and sheepshead seabream skin collagen. Journal of Agricultural and Food Chemistry, 2003, 51(27): 8088-8092. |
| [5] | Olsen D, Yang CL, Bodo M, Chang R, Leigh S, Baez J, Carmichael D, Per?l? M, H?m?l?inen ER, Jarvinen M, Polarek J. Recombinant collagen and gelatin for drug delivery. Advanced Drug Delivery Reviews, 2003, 55(12): 1547-1567. |
| [6] | Gelse K, P?schl K, Aigner T. Collagens-structure, function, and biosynthesis. Advanced Drug Delivery Reviews, 2003, 55(12): 1531-1546. |
| [7] | Horn MM, Martins VCA, de Guzzi Plepis AM. Interaction of anionic collagen with chitosan: effect on thermal and morphological characteristics. Carbohydrate Polymers, 2009, 77(2): 239-243. |
| [8] | Chung L, Dinakarpandian D, Yoshida N, Lauer-Fields JL, Field GB, Visse R, Nagase H. Collagenase unwinds triple-helical collagen prior to peptide bond hydrolysis. The EMBO Journal, 2004, 23(15): 3020-3030. |
| [9] | Chen SJ, Zeng MY, Dong SY. Progress in the study of collagen and active peptide of fisheries. Fisheries Science, 2004, 23(6): 44-46. (in Chinese)陈胜军, 曾名勇, 董士远. 水产胶原蛋白及其活性肽的研究进展. 水产科学, 2004, 23(6): 44-46. |
| [10] | Guo HB, Zeng QZ. Research progress of fish skin collagen and collagen active polypeptides. Food and Drug, 2007, 9(8): 43-46. (in Chinese)郭恒斌, 曾庆祝. 鱼皮胶原蛋白及胶原活性多肽的研究进展. 食品与药品, 2007, 9(8): 43-46. |
| [11] | Li WJ, Guo XK, Jiang XC. Microbiological collagenase. Journal of Microbiology, 2004, 24(2): 32-37. (in Chinese)李文俊, 郭晓奎, 姜叙诚. 微生物胶原酶. 微生物学杂志, 2004, 24(2): 32-37. |
| [12] | Li Y, Gao RJ, Yang XP. Progress of type IV collagenase and its inhibitors in anti-tumor research. Journal of Capital Normal University (Natural Science Edition), 2011, 32(3): 23-29. (in Chinese)李钰, 高瑞娟, 杨秀萍. IV型胶原酶及其抑制剂在抗肿瘤研究中的进展. 首都师范大学学报(自然科学版), 2011, 32(3): 23-29. |
| [13] | Brazzelli M, Cruickshank M, Tassie E, McNamee P, Robertson C, Elders A, Fraser C, Hernandez R, Lawrie D, Ramsay C. Collagenase Clostridium histolyticum for the treatment of dupuytren’s contracture: systematic review and economic evaluation. Health Technology Assessment, 2015, 19(90): 1-202. |
| [14] | Obana N, Nomura N, Nakamura K. Structural requirement in Clostridium perfringens collagenase mRNA 5’ leader sequence for translational induction through small RNA-mRNA base pairing. Journal of Bacteriology, 2013, 195(12): 2937-2946. |
| [15] | Lu YS, Feng JM, Wu ZH, Jian JH. Genotype analysis of collagenase gene by PCR-SSCP in Vibrio alginolyticus and its association with virulence to marine fish. Current Microbiology, 2011, 62(6): 1697-1703. |
| [16] | Sun JJ, Wang HY, Qian SRGL, Chang K. Screening of collagenase-producing Bacillus strain. Journal of Dalian Polytechnic University, 2010, 29(4): 248-250. (in Chinese)孙佳佳, 王红英, 钱斯日古楞, 常凯. 产胶原蛋白酶枯草芽孢杆菌的筛选. 大连工业大学学报, 2010, 29(4): 248-250. |
| [17] | Muyonga JH, Cole CGB, Duodu KG. Characterisation of acid soluble collagen from skins of young and adult Nile Perch (Lates nilotieus). Food Chemistry, 2004, 85(1): 81-89. |
| [18] | Bae I, Osatomi K, Yoshida A, Osako K, Yamaguchi A, Hara K. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes. Food Chemistry, 2008, 108(1): 49-54. |
| [19] | Kang SI, Jang YB, Choi YJ, Kong JY. Purification and properties of a collagenolytic protease produced by marine bacterium Vibrio vulnificus CYK279H. Biotechnology and Bioprocess Engineering, 2005, 10(6): 593-598. |
| [20] | Cao YH. To determine protein in Shenqiling granules by BCA. China Practical Medicine, 2008, 4(7): 43-44. (in Chinese)曹玉华. BCA法测神奇灵颗粒剂中蛋白含量. 中国实用医药, 2008, 4(7): 43-44. |
| [21] | Bollineni RC, Guldvik IJ, Gr?nberg H, Wiklund F, Mills IG, Thiede B. A differential protein solubility approach for the depletion of highly abundant proteins in plasma using ammonium sulfate. Analyst, 2015, 140(24): 8109-8117. |
| [22] | Teramura N, Tanaka K, Iijima K, Hayashida O, Suzuki K, Hattori S, Irie S. Cloning of a novel collagenase gene from the gram-negative bacterium Grimontia (Vibrio) hollisae 1706B and its efficient expression in Brevibacillus choshinensis. Journal of Bacteriology, 2011, 193(12): 3049-3056. |
| [23] | Jin M, Wang ZY, Hu C, Yuan Z, Hu YS. Studes on the Bacillus licheniformis screening of collagenase strain and the conditions for enzyme production. Journal of Sichuan University (Natural Science Edition), 2000, 37(5): 764-767. (in Chinese)金敏, 王忠彦, 胡承, 袁铸, 胡永松. 产胶原酶地衣芽孢杆菌菌种的分离、筛选及发酵条件研究. 四川大学学报(自然科学版), 2000, 37(5): 764-767. |
| [24] | Ma L. Isolation and enzyme characteristics of a strain producing collagenase. Master Dissertation of Dalian Polytechnic University, 2012. (in Chinese)马蕾. 产胶原酶微生物的筛选及其酶性质的研究. 大连工业大学硕士学位论文, 2012. |
| [25] | Sakurai Y, Inoue H, Nishii W, Takahashi T, Iino Y, Yamamoto M, Takahashi K. Purification and characterization of a major collagenase from Streptomyces parvulus. Bioscience Biotechnology, and Biochemistry, 2009, 73(1): 21-28. |
| [26] | Zhang XX, Li Y, Wang YH, Du KL, Zhang Z, Ruan HH. Expression, purification and enzymatic characterization of ColR75E collagenase of Bacillus cereus R75E. China Biotechnology, 2015, 35(10): 44-52. (in Chinese)张西轩, 李晔, 王亚航, 杜康龙, 张真, 阮海华. 蜡样芽孢杆菌ColR75E胶原酶的表达、纯化及酶学性质研究. 中国生物工程杂志, 2015, 35(10): 44-52. |
| [27] | Zhou QQ. Screening of collagenase-producing strain and studying on the characteristics of collagenase. Master Dissertation of Jilin University, 2009. (in Chinese)周强强. 胶原蛋白酶产生菌的筛选及其产酶特性研究. 吉林大学硕士学位论文, 2009. |
| [28] | Yang GY, Xie J, Xu N, Li L, Zhang YZ. Isolation and characterization of collagenolytic enzyme-producing strain from Rotten Hides and primary analysis of the enzyme property. Microbiology China, 2004, 31(5): 43-48. (in Chinese)杨光垚, 谢君, 徐宁, 李灵, 张义正. 具胶原蛋白酶活性铜绿假单胞菌的筛选. 微生物学通报, 2004, 31(5): 43-48. |
| [29] | Li C. Purification and characterization of a collagenase from Bacillus pumilus. Master Dissertation of Sichuan Agricultural University, 2008. (in Chinese)李陈. 一种新的短小芽孢杆菌胶原蛋白酶的分离、纯化及酶学性质研究. 四川农业大学硕士学位论文, 2008. |
