柏琴琴1, 3, 杨永春2, 3, 陆承平3

1. 南华大学公共卫生学院, 湖南 衡阳 421001;
2. 浙江农林大学动物科技学院, 浙江 临安 311300;
3. 南京农业大学世界动物卫生组织猪链球菌病参考实验室, 农业部动物细菌学重点实验室, 江苏 南京 210095
收稿日期: 2015-08-26; 修回日期: 2015-09-30; 网络出版日期: 2015-10-21
通信作者: Tel/Fax: +86-25-84396517; E-mail: Lucp@njau.edu.cn
摘要: [目的] 分离鉴定噬菌体,对其生物学特性进行研究,并筛选候选毒株为防控牛源无乳链球菌的感染提供依据。[方法] 分别采用从牛奶或环境中分离、溶原菌诱导两种方法分离鉴定无乳链球菌噬菌体,利用双层琼脂平板法纯化。将新分离鉴定毒株与前期已分离鉴定的源自乳腺炎牛奶的无乳链球菌噬菌体JX01进行分析和比较,包括噬菌体透射电镜形态观察、对55株无乳链球菌和其他细菌的宿主谱鉴定、噬菌体基因EcoR I、Sal I、Xba I或Pst I的酶切图谱、最适MOI、吸附曲线和一步生长曲线、不同保存条件下的稳定性等。[结果] 分离鉴定的3株噬菌体LYGO9、HZ04和pA11 (诱导自牛源菌株HAJL2011070601)与JX01比对分析,结果显示,4株噬菌体均为长尾噬菌体;EcoR I、Sal I、Xba I、Pst I的酶切图谱分获4、3、3或2种带型,显示4株噬菌体为不同毒株;均特异性裂解牛源无乳链球菌,对42株牛源无乳链球菌的裂解率如下:LYGO9为28.6% (12/42)、pA11为31% (13/42)、HZ04为47.6% (20/42)、JX01为54.8% (23/42);同时,LYGO9与pA11、HZ04和JX01分别有共同宿主11、12和11株;HZ04与JX01有共同宿主18株,提示它们具有同源性。LYGO9感染宿主的潜伏期短,仅5 min,平均裂解量为30。分离株在SM液中4 ℃至少可保存1个月。[结论] 分离鉴定的3株牛源无乳链球菌噬菌体均为长尾噬菌体,其中LYGO9潜伏期短、裂解量较大。
关键词: 牛源无乳链球菌噬菌体分离生物学特性
Isolation and characterization of siphovirus phages infecting bovine Streptococcus agalactiae
Qinqin Bai1, 3, Yongchun Yang2, 3, Chengping Lu3

1. College of Public Health, University of South China, Hengyang 421001, Hunan Province, China;
2. College of Animal Science and Technology, Zhejiang A&F University, Lin'an 311300, Zhejiang Province, China;
3. OIE Reference Laboratory of Swine Streptococcosis, Key Laboratory of Animal Bacteriology, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China
Received: 26 August 2015; Revised: 30 September 2015; Published online: 21 October 2015
Corresponding author. Tel/Fax: +86-25-84396517; E-mail: Lucp@njau.edu.cn
Abstract:[Objective] To isolate and identify Streptococcus agalactiae phages and screen candidate phages to control infection caused by bovine S. agalactiae. [Methods] We used two methods for isolation of S. agalactiae phages, namely (1) isolation of phages from milk and environmental samples, and (2) isolation of phages via induction of lysogens with Mitomycin C. Double-layer agar culture method was used to purify phages. Then the newly obtained phages, with S. agalactiae phage JX01 isolated from mastitis milk, were comparatively analyzed in the following aspects: morphology of phages by transmission electron microscopy, host range of phages to 55 S. agalactiae strains and other Streptococcus strains, phages DNA using EcoR I, Xba I, Pst I and Sal I, the optical multiplicity of infection, absorption curve and one step growth curve, and the stability of phages at different storage conditions. [Results] The comparative analysis of the 3 novel phages LYGO9, HZ04 and pA11 (induced from S. agalctiae bovine clinical isolate HAJL2011070601) with JX01 showed that the 4 phages were classified as the member of Siphovirdae family. EcoR I, Sal I, Xba I and Pst I separately digested the 4 phages DNA provided 4, 3, 3 and 2 profiles, respectively. This suggested that they were different strains. All the 4 phages specifically infected bovine S. agalactiae isolates. LYGO9, pA11, JX01 and HZ04 could lyse 12, 13, 20 and 23 of 42 tested bovine S. agalctiae isolates, respectively. This clearly indicated that these 4 phages are closely related. [Conclusion] The 3 new phages which specifically lyse bovine S. agalactiae isolates are siphovirus phages. Phage LYGO9 was shown having a short latent period and a larger burst size.
Key words: bovine Streptococcus agalactiaephageisolationbiological characteristic
无乳链球菌(Streptococcus agalactiae)是重要的人兽共患病原菌,革兰氏阳性球菌,兰氏分群为B群,可引起新生儿肺炎、脑膜炎和脓毒症[1],也可引起奶牛乳腺炎、罗非鱼链球菌病等重要动物疫病,造成的经济损失巨大[2, 3]。
噬菌体是感染细菌等原核生物的病毒[4],根据其生活周期分烈性噬菌体和温和噬菌体两种。其中,烈性噬菌体具有严格宿主特异性,能在感染宿主体内增殖,在生物防控细菌感染,尤其是多重耐药病原菌感染方面,具有潜在的应用价值[5]。带有温和噬菌体基因组的细菌被称为溶原菌,整合于宿主基因组中的噬菌体则称前噬菌体[6],是基因水平转移的重要工具,与细菌的遗传进化及致病性密切相关[7]。
Russell等1969年首次分离到牛源无乳链球菌噬菌体[8],而后Mee-Marquet等[9]报道了3个前噬菌体基因F5 (编码末端转移酶大亚基)、F7 (裂解酶基因)和F10 (转录调控因子ArpU家族),在109株人源菌株的检出率分别为21%、23%和50%。Domelier等[10]用丝裂霉素C从114株人源无乳链球菌中诱导获得36株噬菌体,并对其分子特征、进化关系和裂解活性进行了分析。在无乳链球菌基因组中存在大量前噬菌体基因,前噬菌体基因大约占无乳链球菌所有特异性基因的10%左右[11, 12]。至今关于牛源无乳链球菌噬菌体的报道寥寥无几,生物学特性和基因组信息明确的牛源无乳链球菌噬菌体仅1株,即本实验室前期分离鉴定的牛源无乳链球菌噬菌体JX01 (GenBank登录号:JX409895)[13] 。因此,有必要继续分离鉴定牛源无乳链球菌的噬菌体并对其特性进行分析。
1 材料和方法 1.1 材料1.1.1菌株:无乳链球菌、猪链球菌、海豚链球菌等为本实验室保存菌株。无乳链球菌参考菌株ATCC 13813、ATCC 12403 (NEM316)、ATCC BAA-611 (2603V/R)、ATCC BAA-1138 (A909)、海豚链球菌参考株ATCC 29177购自美国菌种保藏中心。
1.1.2主要试剂和仪器:培养基为Trypto Soy broth (TSB,MO BIO,USA);蛋白酶K、RNase A、DNaseⅠ、PEG8000等试剂购自北京鼎国昌盛生物技术有限责任公司;限制性内切酶购自大连TaKaRa生物工程公司;SM液(5.8 g/L NaCl,2 g/L MgSO4?7H2O,50 mmol/L Tris-HCl,0.1 g/L明胶,pH 7.5)。透射电镜(H_7650,HITACHI,日本),生物安全柜(AIRTECH,苏净安泰),高速冷冻离心机(Eppendorf,centrifuge 5415 R)。
1.2 噬菌体的分离与纯化1.2.1从环境样本中分离噬菌体:采集奶牛养殖场污水、土壤和牛奶等样本分离牛源无乳链球菌的噬菌体。污水和土壤样品参照Clokie和Kropinski主编的噬菌体实验指南进行处理[14];牛奶样品按下述方法处理:取1 mL奶样加到5 mL TSB中,补充0.2 mL多株无乳链球菌混合物,37 °C培养过夜,用于富集噬菌体;4 °C、4000×g离心10min 去沉淀,上清经4 °C、8000×g离心10 min后用0.45μm滤膜过滤,收集滤液4 °C保存。采用点滴法检测噬菌体[15],若点滴滤液的区域出现透明的抑制圈或者噬菌斑,则将对应的样品用SM液进行10倍比稀释用双层琼脂平板法进行纯化[16]。
1.2.2从溶原菌中诱导噬菌体:参照Domelier等的方法[10],略有改动,随机挑选10株无乳链球菌牛源分离株平板划线接种于含5%绵羊血的TSA平板上,挑取单菌落于5 mL TSB中,37 °C培养至OD600为0.1–0.2,加入终浓度为 1 μg/mL的丝裂霉素C,继续振荡培养4 h,取培养物4 °C、4000×g 离心10 min,收集上清用0.45 μm滤膜过滤,滤液4 °C保存备用。滤液中噬菌体的分离和纯化见1.2.1。
1.3 电镜观察和宿主范围测定取少量噬菌体的增殖滤液用2%磷钨酸负染后使用H_7650 (HITACHI,Japan)透射电镜在80kV观察,记录噬菌体的形态。采用点滴法测定宿主范围,分别以无乳链球菌牛源、鱼源分离株及人源参考菌株、海豚链球菌、猪链球菌、金黄色葡萄球菌作为指示菌测定纯化的噬菌体对上述菌株的裂解能力。
1.4 无乳链球菌的荚膜多糖分型无乳链球菌的荚膜多糖分型采用Imperi等[17] 报道的多重PCR法鉴定。分型数据见Yang等[18]和Liu等[12]的报道。
1.5 噬菌体核酸的提取和限制性酶切图谱分析噬菌体用NaCl-PEG8000沉淀的方法进行沉淀,核酸提取参照Sambrook等的方法[19]。提取的噬菌体核酸分别用EcoR I、Sal I、Xba I和Pst I于37°C酶切4 h,酶切产物用0.8%的琼脂糖进行琼脂糖凝胶电泳分析。
1.6 最适感染复数测定参照马玉玲等报道的方法[16],略有改动,取对数生长早期(OD600=0.3,约1.0×108 CFU/mL)宿主菌TZ201102和噬菌体LYGO9滤液各100 μL按照感染复数分别为0.001、0.01、0.1、1、10、100和1000的比例混合,再加入800 μL TSB液体培养基使各管总体积相同。37 °C、180 r/min振荡培养3.5h。测定悬浮液中噬菌体滴度,以产生最高噬菌体滴度的为最佳感染复数。
1.7 吸附曲线测定参照Clokie和Kropinski主编的噬菌体实验指南进行[14],简述如下:取1 mL 37 °C水浴锅中保温的噬菌体LYGO9滤液(1.0-3.0×105 PFU/mL)加入到9mL OD600 为0.2–0.3的宿主菌TZ201102中混匀,37°C孵育。每隔2.5 min取50 μL加至950μL冰浴的TSB中,剧烈涡旋振荡10 s后,4°C、10000×g 离心10 min。用双层琼脂平板法测定上清中游离的噬菌体滴度,同时设不含宿主菌的对照。以时间为横坐标,未吸附的游离的噬菌体的百分率为纵坐标,绘制吸附曲线。
1.8 一步生长曲线测定参照Kutter等的方法[15],并略作修改,取10mL 2×108 CFU/mL的 TZ201102菌悬液与1 mL 2×108 PFU/mL 噬菌体LYGO9的滤液(MOI=0.1)混合均匀,37 °C作用15 min,然后取出0.1 mL加至10 mL 37 °C保温的TSB中混匀,再从中取0.2mL 加入到20 mL保温的TSB中混匀,37 °C、180r/min振荡培养。从0时刻开始每隔一段时间取出适量样品,4 °C、10000×g离心2 min去除细菌,用双层琼脂平板法测定上清中噬菌体的滴度。以取样时间为横坐标,噬菌体的滴度的对数为纵坐标,绘制一步生长曲线。
1.9 最适保存条件的确定噬菌体增殖后分别用3种方法保存,即加入终浓度为30%的甘油置于4 °C保存;加入终浓度为7%的DMSO置于-70 °C保存;增殖好的滤液直接置4 °C保存。1个月后测定滴度,比较3种保存条件下噬菌体的滴度。
2 结果和分析 2.1 分离结果和形态观察从采自连云港和杭州奶牛场乳腺炎牛奶样品中各分离到一株噬菌体,分别命名为LYGO9和HZ04,二者均能显著裂解菌株TZ201102,其他样品中均未分离到噬菌体。牛源分离株HAJL2011 070601加入丝裂霉素C培养4 h后,培养物变得清亮,且试管底部有絮状沉淀,对照管均匀浑浊。点滴法检测滤液发现对菌株TZ201102有明显的抑制现象,双层琼脂平板法进一步验证,能形成透明,边缘整齐的噬菌斑,表明该菌株诱导出噬菌体,纯化后命名为pA11。3株噬菌体裂解菌株TZ201102均形成圆形、透明、边缘整齐的噬菌斑,直径约0.5–1.0 mm (图 1)。
 |
| 图 1. LYGO9的噬斑形态 Figure 1. Plaques formed by phage LYGO9 infected S. agalactiae strain TZ201102. |
| 图选项 |
电镜观察,LYGO9、HZ04和pA11与之前报道的无乳链球菌噬菌体JX01相似[13],均具有长尾噬菌体科(Siphoviridae)成员的特点,头部呈二十面体对称,直径约50 nm,尾部无伸缩性,长度约200 nm (图 2)。
 |
| 图 2. 4株噬菌体的电镜图 Figure 2. Electron micrographs of 4 S. agalactiae phages. A, LYG-09; B, JX01; C, HZ04; D, PA11 |
| 图选项 |
2.2 宿主范围选取55株无乳链球菌(包括牛源菌株42株、鱼源菌株10株和人源菌株3株)、2株金黄色葡萄球菌、3株猪链球菌、2株海豚链球菌,用于比较LYGO9、HZ04和pA11与噬菌体JX01宿主范围。结果显示,与JX01一样,这3株噬菌体均特异性裂解无乳链球菌牛源菌株。LYGO9、pA11、HZ04和JX01分别裂解42株牛源无乳链球菌的12株(28.6%)、13株(31%)、20株(47.6%)和23株(54.8%)。同时,LYGO9与pA11、HZ04和JX01分别有共同宿主11、12和11株,HZ04与JX01有共同宿主18株。对LYGO9和pA11敏感的菌株都能被HZ04裂解,绝大多数对LYGO9和pA11敏感的菌株同时也对JX01敏感(表 1)。结合Yang等[18]和Liu等[12]报道的无乳链球菌荚膜多糖分型和MLST 分型数据分析,发现4株噬菌体宿主的荚膜多糖分型几乎都为Ⅰa型,相对应的MLST分型包括568和103,而8株荚膜多糖分型为Ⅱ型的菌株均不被裂解。
表 1. 4株无乳链球菌噬菌体的宿主范围 Table 1. Host range of 4 S. agalactiae phages
| Bacteria | Strains | Hosta | STa | Capsular genotypea | lysisb | |||
| LYGO9 | pA11 | JX01 | HZ04 | |||||
| a : “N” ,host, ST or Capsular genotype unknown. b:+, Plaques formed; –, no plaque formed. | ||||||||
| S. agalactiae | CH201101 | cow | N | N | + | + | + | + |
| CH201102(JSCH201102) | cow | 568 | Ⅰa | – | – | + | + | |
| CH201103 | cow | N | N | + | + | – | + | |
| TQ201101 | cow | N | N | – | – | + | + | |
| TQ201103 | cow | N | N | – | – | + | + | |
| TQ201108 | cow | N | N | – | – | + | + | |
| TQ201109 | cow | N | N | + | – | + | + | |
| TQ2011010 | cow | N | N | – | – | + | + | |
| XG201103 | cow | 568 | Ⅰa | – | – | – | – | |
| NJZJ2011050502 | cow | 570 | Ⅱ | – | – | – | – | |
| TZ201102 | cow | 568 | Ⅰa | + | + | + | + | |
| TZ201105 | cow | N | N | – | + | + | + | |
| TZ201107 | cow | 568 | Ⅰa | + | + | + | + | |
| TZ201108 | cow | 568 | Ⅰa | – | + | + | + | |
| ZH201103 | cow | N | N | + | + | – | + | |
| ZJ201101 | cow | 568 | Ⅰa | + | + | + | + | |
| ZJ201102 | cow | 568 | Ⅰa | + | + | + | + | |
| ZJ201106 | cow | 568 | Ⅰa | – | – | + | + | |
| LYG201101 | cow | N | N | – | – | – | – | |
| HAJL2011070601 | cow | 568 | Ⅰa | – | – | – | – | |
| HAJL2011070602 | cow | 301 | Ⅱ | – | – | – | – | |
| XC201101 | cow | 103 | Ⅰa | + | + | + | + | |
| XC201102 | cow | N | N | + | + | + | + | |
| XC201106 | cow | 103 | Ⅰa | + | + | + | + | |
| XC201107 | cow | 67 | Ⅰa | – | – | – | – | |
| XC201109 | cow | 67 | Ⅱ | – | – | – | – | |
| XC201113 | cow | 103 | Ⅰa | + | + | + | + | |
| XY201101 | cow | N | N | – | – | – | – | |
| XY201103 | cow | 301 | Ⅱ | – | – | – | – | |
| XY201104 | cow | 301 | Ⅱ | – | – | – | – | |
| XY201107 | cow | 313 | Ⅱ | – | – | – | – | |
| BH201101 | cow | 103 | Ⅰa | – | – | + | – | |
| BH201105 | cow | 103 | Ⅰa | – | – | + | – | |
| BH201106 | cow | 103 | Ⅰa | – | – | + | – | |
| BH201116 | cow | 103 | Ⅰa | – | – | + | – | |
| BA201108 | cow | 103 | Ⅰa | – | – | + | – | |
| BA201110 | cow | 67 | Ⅱ | – | – | – | – | |
| SH2011010 | cow | 103 | Ⅰa | – | – | – | – | |
| SH2011018 | cow | 103 | Ⅰa | – | – | – | – | |
| NC201103 | cow | 103 | Ⅰa | – | – | – | – | |
| 1886 | cow | N | N | – | – | – | – | |
| ATCC13813 | cow | 337 | Ⅱ | – | – | – | – | |
| ATCC12403(NEM316) | human | 23 | Ⅲ | – | – | – | – | |
| ATCCBAA-611(2603V/R) | human | 110 | Ⅴ | – | – | – | – | |
| A909 | human | 7 | Ⅰa | – | – | – | – | |
| GD201008-001 | fish | 7 | Ⅰa | – | – | – | – | |
| GD201008-008 | fish | N | N | – | – | – | – | |
| GD201008-014 | fish | N | N | – | – | – | – | |
| GD201008-015 | fish | N | N | – | – | – | – | |
| GD201008-018 | fish | N | N | – | – | – | – | |
| GD201008-021 | fish | N | N | – | – | – | – | |
| SD201009 | fish | N | N | – | – | – | – | |
| GDMM | fish | N | N | – | – | – | – | |
| HN-2 | fish | N | N | – | – | – | – | |
| HN-9 | fish | N | N | – | – | – | – | |
| S. aureus | ATCC25923 | N | N | N | – | – | – | – |
| ATCC29213 | N | N | N | – | – | – | – | |
| S. iniae | ATCC29217 | fish | N | N | – | – | – | – |
| ZH201101 | fish | N | N | – | – | – | – | |
| S. suis | HA9801 | pig | N | N | – | – | – | – |
| ZY05719 | pig | N | N | – | – | – | – | |
| T15 | pig | N | N | – | – | – | – | |
表选项
2.3 限制性酶切图谱分析用限制性内切酶EcoR I、Sal I、Xba I和PstI分析LYGO9、pA11、JX01和HZ04的DNA得到不同的酶切图谱。EcoR I酶切得到4种带型;Sal I酶切后得到3种带型(JX01和HZ04的带型相似);Xba I酶切后亦得到3种带型(LYGO9和HZ04的带型相似);Pst I酶切后得到2种带型(LYGO9、JX01和HZ04的带型相似)。根据酶切图谱,推算4株噬菌体的基因组大小约为38–45 kb (图 3、4、5、6)。
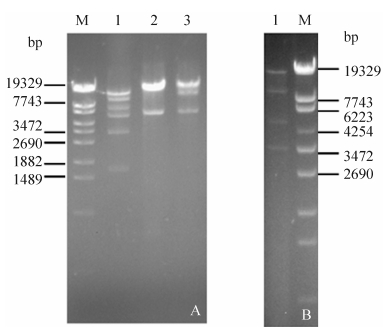 |
| 图 3. 限制性酶切分析噬菌体LYGO9的DNA Figure 3. Restriction enzyme analysis phage LYGO9 DNA. A: LYGO9 DNA was digested with EcoR I (lane 1), Sal I (lane 2), Pst I (lane 3); B: LYGO9 DNA was digested with Xba I (lane 1); M: λ- EcoT14Ⅰdigest DNA Marker. |
| 图选项 |
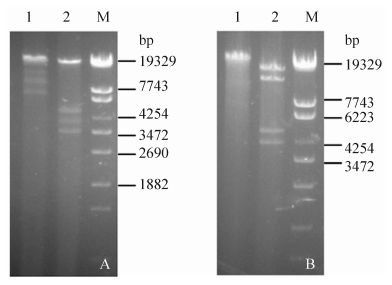 |
| 图 4. 限制性酶切分析噬菌体pA11的DNA Figure 4. Restriction analysis phage pA11 DNA. A: pA11 DNA was digested with EcoR I (lane 1), Xba I (lane 2); B: pA11 DNA was digested with Pst I (lane 1), Sal I (lane 2); M: λ- EcoT14Ⅰdigest DNA Marker. |
| 图选项 |
 |
| 图 5. 限制性酶切分析噬菌体JX01的DNA Figure 5. Restriction analysis phage JX01 DNA. A: JX01 DNA was digested with EcoR I (lane 1), Pst I (lane 2); B: JX01 DNA was digested with Sal I (lane 1); C: JX01 DNA was digested with Xba I (lane 1); M: λ- EcoT14Ⅰdigest DNA Marker. |
| 图选项 |
 |
| 图 6. 限制性酶切分析噬菌体HZ04的DNA Figure 6. Restriction analysis phage HZ04 DNA. A: HZ04 DNA was digested with Xba I (lane 1), EcoR I (lane 2); B: HZ04 DNA was digested with Sal I (lane 1); C: HZ04 DNA was digested with Pst I (lane 1); M: λ- EcoT14Ⅰdigest DNA Marker. |
| 图选项 |
2.4 噬菌体LYGO9的最适感染复数测定感染复数为0.01时,产生的子代噬菌体的滴度最高,因此噬菌体LYGO9感染宿主菌TZ201102 的最适感染复数为0.01(表 2)。
表 2. 噬菌体LYGO9最适感染复数测定 Table 2. Determination of optimal multiplicity of infection (MOI)
| Tube No. | Number of bacteria/(CFU/mL) | Number of bacteriophage/(PFU/mL) | MOI | Titer at 3.5 h/(PFU/mL) |
| 1 | 1.0×105 | 1.0×108 | 1000 | 1.25×105 |
| 2 | 1.0×106 | 1.0×108 | 100 | 1.00×106 |
| 3 | 1.0×107 | 1.0×108 | 10 | 1.11×106 |
| 4 | 1.0×108 | 1.0×108 | 1 | 8.38×107 |
| 5 | 1.0×108 | 1.0×107 | 0.1 | 5.85×107 |
| 6 | 1.0×108 | 1.0×106 | 0.01 | 1.18×108 |
| 7 | 1.0×108 | 1.0×105 | 0.001 | 5.79×107 |
表选项
2.5 噬菌体LYGO9吸附曲线测定噬菌体LYGO9与宿主菌TZ201102,37 °C作用2.5 min,吸附率可达60%左右,作用15 min,吸附率可达90%以上(图 7)。
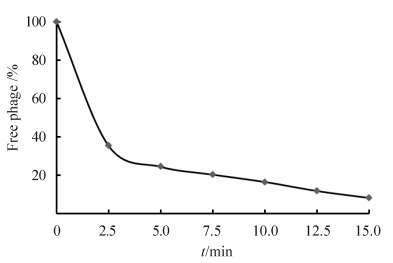 |
| 图 7. 噬菌体LYGO9对TZ201102的吸附 Figure 7. The adsorption of LYGO9 to TZ201102 cells. |
| 图选项 |
2.6 噬菌体LYGO9一步生长曲线测定LYGO9感染宿主菌TZ201102的潜伏期5 min,生长期为25 min,平均裂解量为30 (图 8)。
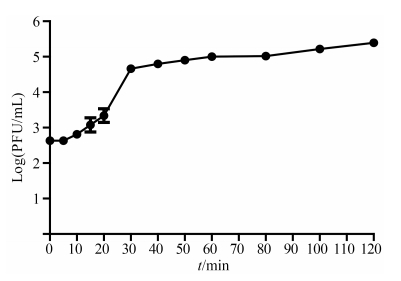 |
| 图 8. LYGO9的一步生长曲线 Figure 8. The one step growth curve of LYGO9. |
| 图选项 |
2.7 最适保存条件噬菌体LYGO9通过双层琼脂平板法增殖的滤液,分别加入终浓度为30%的甘油置4 °C和终浓度为7%的DMSO置液氮中,保存1个月后,滴度明显下降,由原来的109 PFU/mL下降至105PFU/mL。用SM液漂洗下来的噬菌体离心过滤后置4 °C保存1个月后,仍然有108 PFU/mL的滴度。保存2个月后,其滴度为107 PFU/mL左右。其他几株噬菌体用这种方法保存2个月后滴度仍然有107PFU/mL。故SM液4 °C保存时,噬菌体较稳定(表 3)。
表 3. 不同保存条件下噬菌体LYGO9的稳定性 Table 3. Stability of phage LYGO9 on different storage conditions
| Storage conditions | Original titer/(PFU/mL) | Titer after a month/(PFU/mL) |
| Stored at 4 °C in SM buffer | 2.17×109 | 3.5×108 |
| Stored at 4 °C in 30% glycerol | 2.17×109 | 4.0×105 |
| Stored with 7% DMSO in the liquid nitrogen vapor | 2.17×109 | 5.5×105 |
表选项
3 讨论尽管噬菌体广泛存在自然环境中,然而分离某种细菌的噬菌体时,却困难重重,因此常常需要将样品进行富集[14]。为有效分离噬菌体,除了常规的用单个菌株作为指示菌分离噬菌体的方法,加入宿主菌的混合物共同培养进行富集的方法被证明亦非常有效[20]。作者所采集的污水、土壤样本均未分离到无乳链球菌的噬菌体,仅患乳腺炎的牛奶样中分离到3株噬菌体,本实验室前期获得的噬菌体JX01亦是源自乳腺炎牛奶,而健康的牛奶样本中没有分离到噬菌体,这与牛源无乳链球菌寄生的部位相符。
目前已报道的无乳链球菌噬菌体均为长尾噬菌体[8, 10, 13]。Domelier等根据噬菌体尾部长度,将36株自114株人源无乳链球菌中诱导的噬菌体分为A、B、C三种形态,其尾部长度分别为108± 10nm、145±10 nm和215±10nm[10]。本实验室前后获得的4株噬菌体尾部均较长,约为200 nm,这与Domelier报道的C型噬菌体相似。
据报道,大约65%基因组测序的细菌中整合有前噬菌体[21],在丝裂霉素C等诱导下,宿主DNA受到损伤,激发宿主SOS反应,导致前噬菌体从宿主基因组上切离下来,进入溶菌周期[14]。人源无乳链球菌中溶原菌的比例较高[10]。作者从随机挑选的10株牛源分离株中,用丝裂霉素C诱导获得一株温和噬菌体pA11,表明牛源株与人源株类似,亦有一定比例的溶原菌。
LYGO9与pA11、JX01与HZ04的宿主谱较接近,而且能被LYGO9和pA11裂解的菌株都能被HZ04裂解,因此,推测这4株噬菌体具有一定的同源性。同时,作者根据JX01的基因组序列(GenBank登录号:JX409895)设计引物分别扩增主要衣壳蛋白(Major capsid protein,MCP)、尾蛋白(Major tail protein,MTP)和末端转移酶大亚基基因(Terminase large subunit,TerL),在LYGO9和pA11中均能检出这3个基因(数据待发表),进一步证明彼此之间有一定的同源性。
噬菌体LYGO9吸附至宿主菌TZ201102的速率较JX01慢,达到90%以上的吸附,LYGO9需15min,而JX01只需2.5 min。LYGO9感染TZ201102 的潜伏期为5 min,生长期为25 min,平均裂解量为30;而JX01感染TZ201102的潜伏期为30 min,生长期为20 min,平均裂解量为20[13]。相比较而言,LYO9的潜伏期更短、裂解量稍大。
参考文献
| [1] | Wang XM. Purulent meningitis caused by group B Streptococcus: report of two cases. Chinese Journal of Contemporary Pediatrics, 2015, 17(6): 574-576. (in Chinese)王晓敏. 无乳链球菌感染致化脓性脑膜炎2例报道. 中国当代儿科杂志, 2015, 17(6): 574-576. |
| [2] | Li HS, Yu J, Luo JY, Li XP, Xu JY, Wang XR, Zhang LH. Serotype distribution of bovine Streptococcus agalactiae and its drug resistance to antibiotics in China. China Animal Husbandry & Veterinary Medicine, 2012, 39(1): 164-167. (in Chinese) 李宏胜, 郁杰, 罗金印, 李新圃, 徐继英, 王旭荣, 张礼华. 牛源性无乳链球菌血清型分布及抗生素耐药性研究. 中国畜牧兽医, 2012, 39(1): 164-167. |
| [3] | Lu MX, Li J, Ye X, Deng GC, Jiang XY, Tian YY, Lai CL. Identification and characterizations of Streptococcus agalactiae isolated from Tilapia cultured in Guangdong and Hainan provinces. Microbiology China, 2010, 37(5): 766-774. (in Chinese) 卢迈新, 黎炯, 叶星, 邓国成, 江小燕, 田园园, 赖翠玲. 广东与海南养殖罗非鱼无乳链球菌的分离、鉴定与特性分析. 微生物通报, 2010, 37(5): 766-774. |
| [4] | 陆承平. 兽医微生物学. 第5版. 北京: 中国农业出版社, 2013: 48. |
| [5] | Kutateladze M, Adamia R. Bacteriophages as potential new therapeutics to replace or supplement antibiotics. Trends in Biotechnology, 2010, 28(12): 591-595. |
| [6] | Li S, Hu FQ. Prophages. Microbiology China, 2009, 36(3): 432-438. (in Chinese)黎庶, 胡福泉. 前噬菌体. 微生物学通报, 2009, 36(3): 432-438. |
| [7] | Brüssow H, Canchaya C, Hardt WD. Phages and the evolution of bacterial pathogens: from genomic rearrangements to lysogenic conversion. Microbiology and Molecular Biology Reviews, 2004, 68(3): 560-602. |
| [8] | Russell H, Norcross NL, Kahn DE. Isolation and characterization of Streptococcus agalactiae bacteriophage. Journal of General Virology, 1969, 5(2): 315-317. |
| [9] | vander Mee-Marquet N, Domelier AS, Mereghetti L, Lanotte P, Rosenau A, van Leeuwen W, Quentin R. Prophagic DNA fragments in Streptococcus agalactiae strains and association with neonatal meningitis. Journal of Clinical Microbiology, 2006, 44(3): 1049-1058. |
| [10] | Domelier AS, van der Mee-Marquet N, Sizaret PY, Héry-Arnaud G, Lartigue MF, Mereghetti L, Quentin R. Molecular characterization and lytic activities of Streptococcus agalactiae bacteriophages and determination of lysogenic-strain features. Journal of Bacteriology, 2009, 191(15): 4776-4785. |
| [11] | Tettelin H, Masignani V, Cieslewicz MJ, Donati C, Medini D, Ward NL, Angiuoli SV, Crabtree J, Jones AL, Durkin AS, DeBoy RT, Davidsen TM, Mora M, Scarselli M, Margarit y Ros I, Peterson JD, Hauser CR, Sundaram JP, Nelson WC, Madupu R, Brinkac LM, Dodson RJ, Rosovitz MJ, Sullivan SA, Daugherty SC, Haft DH, Selengut J, Gwinn ML, Zhou LW, Zafar N, Khouri H, Radune D, Dimitrov G, Watkins K, O'Connor KJB, Smith S, Utterback TR, White O, Rubens CE, Grandi G, Madoff LC, Kasper DL, Telford JL, Wessels MR, Rappuoli R, Fraser CM. Genome analysis of multiple pathogenic isolates of Streptococcus agalactiae: implications for the microbial ""pan-genome"". Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(39): 13950-13955. |
| [12] | Liu GJ, Zhang W, Lu CP. Comparative genomics analysis of Streptococcus agalactiae reveals that isolates from cultured Tilapia in China are closely related to the human strain A909. BMC Genomics, 2013, 14: 775. |
| [13] | Bai QQ, Zhang W, Yang YC, Tang F, Nguyen X, Liu GJ, Lu CP. Characterization and genome sequencing of a novel bacteriophage infecting Streptococcus agalactiae with high similarity to a phage from Streptococcus pyogenes. Archives of Virology, 2013, 158(8): 1733-1741. |
| [14] | Clokie MRJ, Kropinski AM. Bacteriophages: methods and protocols, Volume 1: isolation, characterization, and interactions. New York: Humana Press, 2009: 15-151. |
| [15] | Kutter E, Sulakvelidze A. Bacteriophages: biology and application. Boca Raton: CRC Press, 2005: 458-482. |
| [16] | Ma YL, Lu CP. Isolation and identification of a bacteriophage capable of infecting Streptococcus suis type 2 strains. Veterinary Microbiology, 2008, 132(3/4): 340-347. |
| [17] | Imperi M, Pataracchia M, Alfarone G, Baldassarri L, Orefici G, Creti R. A multiplex PCR assay for the direct identification of the capsular type (Ia to IX) of Streptococcus agalactiae. Journal of Microbiological Methods, 2010, 80(2): 212-214. |
| [18] | Yang YC, Liu YL, Ding YL, Yi L, Ma Z, Fan HJ, Lu CP. Molecular characterization of Streptococcus agalactiae isolated from bovine mastitis in Eastern China. PLoS One, 2013, 8(7): e67755. |
| [19] | Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual. 2nd Edition. New York: Cold Spring Harbor Laboratory Press, 1989: 195–198. |
| [20] | Jamalludeen N, Johnson RP, Friendship R, Kropinski AM, Lingohr EJ, Gyles CL. Isolation and characterization of nine bacteriophages that lyse O149 enterotoxigenic Escherichia coli. Veterinary Microbiology, 2007, 124(1/2): 47–57. |
| [21] | Canchaya C, Fournous G, Brüssow H. The impact of prophages on bacterial chromosomes. Molecular Microbiology, 2004, 53(1): 9–18. |
