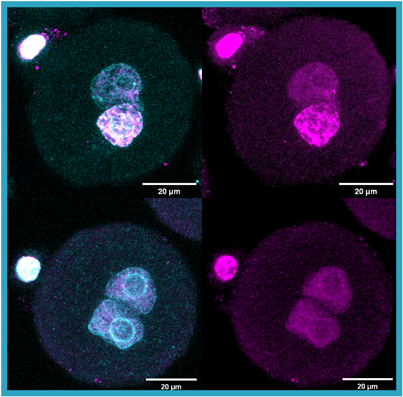
图1 小鼠正常合子(上)及p.R442Q突变型Chk1过表达合子(下)的免疫荧光染色。蓝绿色指示细胞核着色(DAPI);粉色显示DNA损伤标记蛋白(γ-H2AX)着色。p.R442Q突变型Chk1过表达的合子丧失发育过程中雄原核应有的DNA损伤标记。
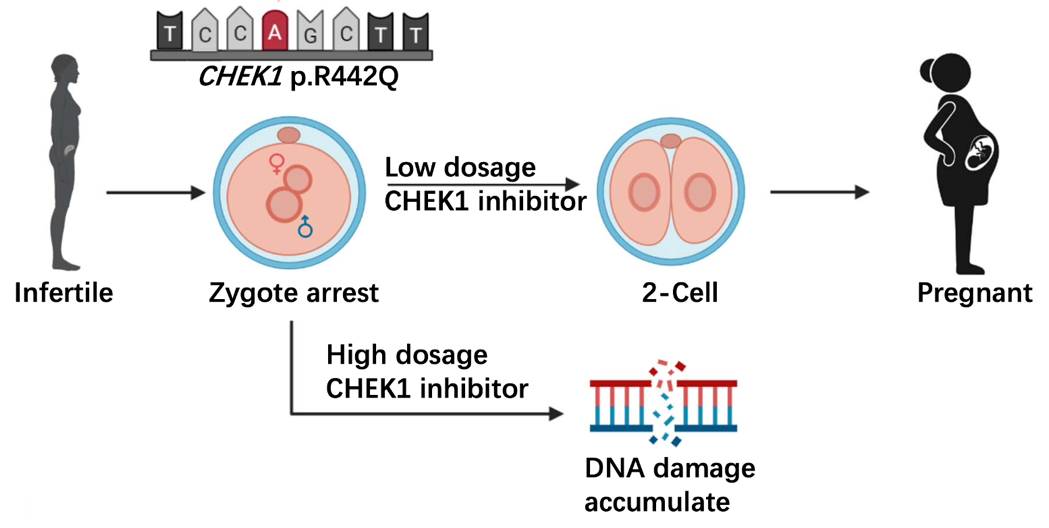
图2 CHEK1 p.R442Q杂合突变导致合子卵裂阻滞,低剂量CHEK1抑制剂可使部分合子进一步发育
5月4日,清华大学医学院那洁副教授课题组与安徽医科大学曹云霞教授和章志国教授课题组及首都医科大学附属北京妇产医院助理研究员李琳,于生物医学领域期刊《蛋白质和细胞》(Protein & Cell)在线发表题为“人类合子中CHEK1基因杂合突变造成卵裂阻滞”(Maternal heterozygous mutation in CHEK1 leads to mitotic arrest in human zygotes)的论文。研究团队报道了因CHEK1基因错义突变导致的女性不育家系,在动物模型中的研究发现,CHEK1 p.R442Q位点的突变造成了CHEK1激酶活性增强,进而阻滞了受精卵的第一次有丝分裂。利用低剂量CHEK1抑制剂对阻滞的受精卵短时间处理,显著回复了突变造成的阻滞作用,使受精卵顺利发育并产生健康子代。该研究解释了因CHEK1突变造成的雌性不育的机制并寻找到了潜在的治疗方法,为遗传因素造成的不孕症诊断和治疗提供了新思路。
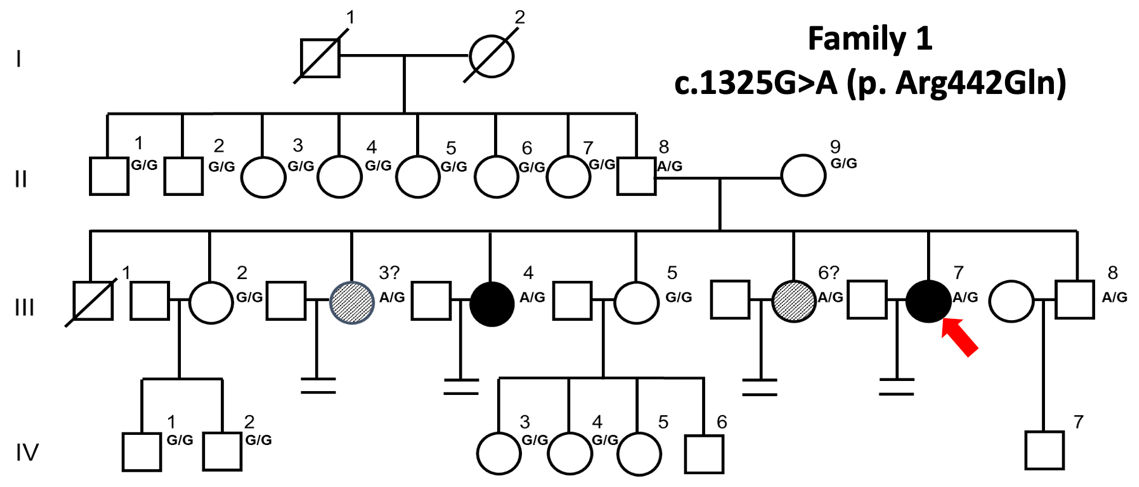
图3 CHEK1基因突变导致的雌性不育家系
基于临床案例,研究人员首先发现了一个表现为受精卵分裂失败的雌性不育家系,并通过全外显子测序分析发现了潜在的致病突变CHEK1 p.R442Q。该家系中不孕症患者存在CHEK1的杂合突变,而其他体细胞及身体功能均正常未受影响。作为DNA损伤检查点激酶,当细胞中发生DNA损伤时,CHEK1激酶活化,阻止细胞周期向下进行并启动修复程序,直到DNA错误修复或细胞凋亡。基于以上生信分析,研究人员克隆了对应的小鼠Chk1突变mRNA,并通过显微注射的手段将其引入小鼠受精卵,突变的Chk1蛋白同样造成了半数以上小鼠受精卵第一次有丝分裂的阻滞。体外纯化的蛋白激酶活性实验确定了此突变体CHEK1激酶活性比野生型CHEK1稍高。升高的CHEK1激酶活性使得第一个有丝分裂检查点阈值过高,在不存在严重DNA损伤的情况下细胞周期依然无法向下进行。
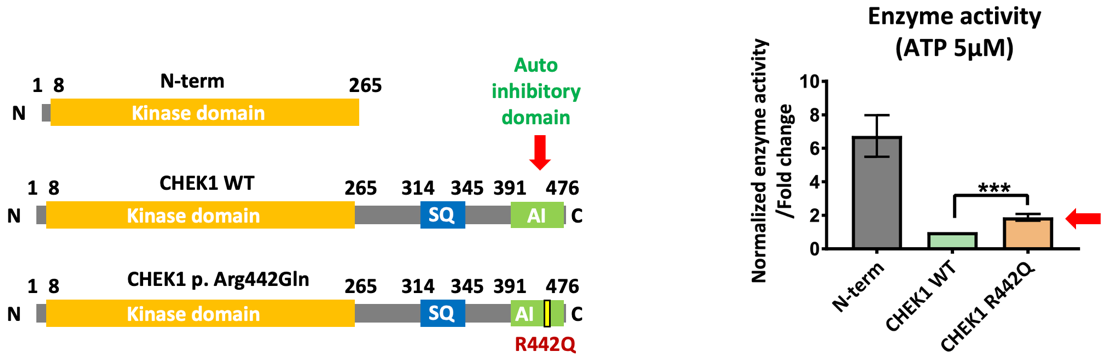
图4 CHEK1激酶结构及酶活。左图显示CHEK1蛋白的酶活结构域及自抑制区,右图显示p.R442Q突变的CHEK1激酶活性上升
为了寻找此突变造成的受精卵分裂障碍的解决方案,研究者进一步利用了CHEK1的化学小分子抑制剂处理了表达突变Chk1蛋白的小鼠的受精卵。与未经CHEK1抑制剂处理的对照组相比,处理后的受精卵正常分裂并进一步发育的比例大大提升,并可以在移植后出生健康的子代。γ-H2AX的荧光染色表明,低剂量的CHEK1抑制剂处理没有造成更多的DNA损伤,且对处理后的胚胎转录组测序表明,CHEK1抑制剂的处理并未造成显著的转录组改变。
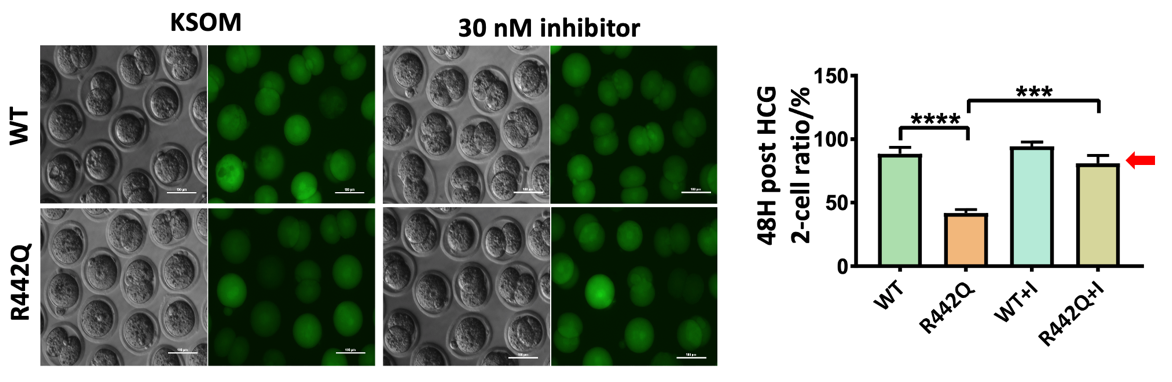
图5 CHEK1抑制剂回复由CHEK1 p.R442Q突变导致的合子卵裂阻滞
该研究揭示了人类早期胚胎第一次有丝分裂对DNA损伤检查点调控极其敏感,并提示人类和小鼠的卵子到受精卵转化过程有种属特异性。该研究发现了早期胚胎第一次有丝分裂对细胞周期调控极其灵敏,并提供了因CHEK1蛋白活性失调造成的不孕症的潜在解决方案。
清华大学医学院那洁副教授,安徽医科大学曹云霞教授、章志国教授及首都医科大学附属北京妇产医院助理研究员李琳博士为该论文的通讯作者。安徽医科大学附属医院陈蓓丽博士、清华大学医学院博士后郭健颖、博士生王婷为本论文共同第一作者。清华大学化学系本科生李倩惠为本研究作出了重要贡献,清华大学医学院李海涛教授指导了CHEK1蛋白纯化和激酶活性检测实验。本研究由国家重点研发计划、国家自然科学基金项目,清华-北大联合生命科学中心、北京市医管中心“青苗计划”、清华大学本科生SRT计划等组织机构提供经费支持。
论文链接:
https://link.springer.com/article/10.1007/s13238-021-00844-9
供稿:医学院
编辑:李华山
审核:吕婷
2021年05月11日 13:32:39
