 , 赵鑫宇1, 陈慧1, 付雨1, 张璐璐1,2
, 赵鑫宇1, 陈慧1, 付雨1, 张璐璐1,2
 , 崔建升1,2
, 崔建升1,21. 河北科技大学环境科学与工程学院, 石家庄 050000;
2. 河北省污染防治生物技术实验室, 石家庄 050000
收稿日期: 2021-04-04; 修回日期: 2021-05-21; 录用日期: 2021-05-21
基金项目: 河北省自然科学基金(No.D2019208152);河北省教育厅重点项目(No.ZD2021046)
作者简介: 剧泽佳(1995—), 男, E-mail: juzejia94@163.com
通讯作者(责任作者): 张璐璐, E-mail: zhanglulu19850703@163.com
摘要:随着社会经济的发展, 大量含有抗生素的废水未经有效处理排放到水环境中, 加剧了城市水环境中抗生素的污染.本研究以石家庄市地表水和地下水为研究对象, 采用超高效液相色谱串联质谱法(HPLC-MS)分析了石家庄水环境中喹诺酮类(Quinolones, QNs)抗生素的空间分布特征, 并采用风险熵值法(RQ)评估了石家庄市水环境中QNs的生态风险和健康风险.结果表明: 1在石家庄市河流和水库中, QNs抗生素的浓度分别为98.43~4398.00 ng·L-1和9.99~49.24 ng·L-1, 恩诺沙星(Enrofloxacin, ENR)和依诺沙星(Enoxacin, ENO)分别是河流和水库中主要的QNs抗生素; 2在石家庄市地下水中, QNs抗生素的浓度为3.45~15.41 ng·L-1; 3相关分析结果表明, 在地表水中氧氟沙星(Ofloxacin, OFL)、诺氟沙星(Norfloxacin, NOR)、恩诺沙星(Enrofloxacin, ENR)、双氟沙星(Difloxacin, DIF)、沙氟沙星(Sarafloxacin, SAR)、恶喹酸(Oxolinic Acid, OXO)和氟甲喹(Flumequine, FLU)与温度(T)和总溶解性固体颗粒物(TDS)呈显著相关(p < 0.01), 而ENO与pH显著相关(p < 0.01);在地下水中吡哌酸(Pipemidic Acid, PIP)和马波沙星(Marbofloxacin, MAR)与T显著相关; 4地表水中QNs与地下水中QNs的相关性不显著, 表明石家庄市地下水中QNs的主要来源不是地表水; 5生态风险结果表明, 石家庄市地表水中QNs总体处于高风险水平, 而地下水QNs整体处于中低风险水平; 6人体健康风险结果表明, 石家庄市水环境中QNs抗生素的健康风险较低.总体来说, 石家庄市水环境中QNs污染在地表水中更为严峻, 而石家庄地表水中QNs浓度最高的区域为汪洋沟.
关键词:城市水环境喹诺酮类抗生素(QNs)空间分布特征生态风险健康风险石家庄
The characteristics of spatial distribution and environmental risk assessment for Quinolones antibiotics in the aquatic environment of Shijiazhuang City
JU Zejia1
 , ZHAO Xinyu1, CHEN Hui1, FU Yu1, ZHANG Lulu1,2
, ZHAO Xinyu1, CHEN Hui1, FU Yu1, ZHANG Lulu1,2
 , CUI Jiansheng1,2
, CUI Jiansheng1,21. Academy of Environmental Science, Hebei University of Science and Technology, Shijiazhuang 050000;
2. Biotechnology Laboratory for Pollution Control in Hebei Province, Shijiazhuang 050000
Received 4 April 2021; received in revised from 21 May 2021; accepted 21 May 2021
Abstract: With the development of society and economy, a large amount of wastewater containing antibiotics was discharged into the urban aquatic environment without effective treatment, which caused the pollution of antibiotics in the urban aquatic environment. The surface water and groundwater in Shijiazhuang city was selected as the research objects, the spatial distribution characteristics of Quinolones (QNs) antibiotics were analyzed by ultra performance liquid chromatography tandem mass spectrometry (HPLC-MS), and the ecological and health risks of QNs in Shijiazhuang aquatic environment were evaluated by risk quotient method (RQ). The results showed that: 1for the rivers and reservoirs, the concentration of QNs ranged from 98.43 to 4398.00 ng·L-1 and from 9.99 to 49.24 ng·L-1, and the main kind of QNs were Enrofloxacin (ENR) and Enoxacin (ENO), respectively; 2for the groundwater, the concentration of QNs ranged from 3.45 to 15.41 ng·L-1; 3through correlation analysis, the results indicated that Ofloxacin (OFL), Norfloxacin (NOR), ENR, Difloxacin (DIF), Sarafloxacin (SAR), Oxolinic Acid (OXO) and Flumequine (FLU) showed significant correlation with T and TDS in surface water, and the correlation was significant between ENO and pH; while in the groundwater, Pipemidic Acid (PIP) and Marbofloxacin (MAR) were significantly correlated with T; 4the correlation of QNs between surface water and groundwater was not significant, which indicated that the main source of QNs in groundwater was not surface water; 5the result of ecological risk indicated that the risk of QNs in surface water was high risk level; while the risk of QNs in groundwater was low risk level; 6the result of health risk showed that the risk of QNs in aquatic environment was low risk level. In general, the pollution level of QNs for surface water was more serious than groundwater in Shijiazhuang, and the most serious polluted area was Wangyang River.
Keywords: urban aquatic environmentQuinolones antibiotics (QNs)the characteristics of spatial distributionecological riskhealth riskShijiazhuang City
1 引言(Introduction)抗生素是指由高等动植物或微生物产生的具有抗病性或抗活性的一类次级代谢产物(王冰等, 2007;陈杖榴等, 2017), 根据其化学结构可以分为喹诺酮类、磺胺类、大环内脂类、四环素类和β-内酰胺类等(刘高燕, 2015).其中, 喹诺酮类抗生素(Quinolones, QNs)具有广谱抗菌、抗菌活性强、交叉耐药性和毒副作用小等特点, 被广泛应用于治疗人类和动物的感染性疾病(Brown et al., 1996;Andriole et al., 2005).据统计, 全球每年抗生素的消耗量在10万t到20万t不等, 且消耗水平还在逐年上升(Chen et al., 2018).我国作为抗生素生产和消费大国, 抗生素的产量和消费量均居世界首位(Zhang et al., 2015).研究发现, 抗生素具有水溶性强及挥发性弱的特点, 制药废水、养殖废水和生活污水中的抗生素可通过一系列途径进入环境中(Mcmanus et al., 2002), 特别是地表水和地下水中.环境中残留的抗生素作为一种新兴污染物已受到人们的广泛关注(Halling-S?rensen et al., 1998), 进入水环境后抗生素可通过吸附、迁移和生物富集等途径在水、沉积物和水生生物中累积, 从而对水生态系统造成潜在风险(Snyder et al., 2004).并且, 抗生素通过饮用水或食物网在人体中积累, 也会对人体健康产生潜在影响(Su et al., 2018).因此, 越来越多的研究开始关注城市水环境中抗生素的污染特征和风险水平.
目前, 在国内外许多城市水环境中都检出了抗生素污染, 如在南京市饮用水源地中检出抗生素的平均浓度为0.56~1995 ng·L-1, 共检出5种大环内酯类、13种磺胺类、3种四环素类、8种喹诺酮类抗生素, 平均浓度为0.30~37.07 ng·L-1, 并发现环丙沙星(Ciprofloxacin, CIP)的检出浓度最高, 为317.60 ng·L-1(李辉等, 2020);而在北京市地下水中抗生素以磺胺类(ND~96.80 ng·L-1)、氟喹诺酮类(ND~39.40 ng·L-1)和四环素类(ND~9.20 ng·L-1)为主, 其中, 氟喹诺酮类检出率高达100%(陈卫平等, 2017).就国外的研究而言, 在北卡罗莱纳山麓乡村的地下水和地表水中检出15种抗生素, 主要以β-内酰胺类、磺胺类、大环内脂类和喹诺酮类为主, 平均浓度为ND~1740 ng·L-1(Austin et al., 2020).由此可见, 喹诺酮类抗生素作为城市水环境中广泛存在的抗生素, 应对其污染特征和风险水平进行准确评估, 尤其是在医药产业发达的城市(如河北石家庄).然而, 目前有关河北典型制药城市水环境中喹诺酮类抗生素的污染特征和风险评价的研究尚未见报道.
石家庄作为河北省重要的医药制造基地, 拥有华北制药、以岭药业、神威药业、石家庄制药等大型制药厂(周长铭, 2018), 尤其在石家庄高新区和经济技术开发区拥有多家大型制药企业, 其产品包括多种抗生素、抗生素中间体及制剂等(徐艳等, 2014).此外, 石家庄市人口众多, 随着社会经济的发展, 抗生素的消费量也显著增多, 制药废水、养殖废水和生活污水中的抗生素未经有效处理而排放到水环境中, 加剧了石家庄市水环境中的抗生素污染(申立娜等, 2019).鉴于此, 本文以石家庄市地表水和地下水为研究对象, 采用野外采样和室内分析相结合的方法, 选取14个地下水样点和15个地表水样点(包括3条典型河流(9个样点)和2个典型水库(6个样点)), 明晰典型喹诺酮类抗生素的空间分布特征, 评估喹诺酮类抗生素的生态风险和健康风险, 以期为石家庄市水环境中抗生素污染的风险管控提供科学依据.
2 材料与方法(Materials and methods)2.1 样品采集及理化参数分析根据石家庄市土地利用类型和现场情况, 选取14个地下水采样点, 于2020年9月采集地下水样品.结合地下水采样点情况, 选取石家庄市3条典型河流及两个典型水库共15个采样点, 于2020年12月采集地表水样品.采样点示意图如图 1所示.
图 1(Fig. 1)
 |
| 图 1 石家庄市采样点示意 Fig. 1Sample sites of Shijiazhuang |
用预先清洗过的5 L低密度聚乙烯容器采集水体样品, 其中, 地下水样品取自采样点附近现有水井, 地表水样品取自河流和水库表层水样.样品放置在保温箱中冷藏保存, 运送至实验室后在0~4 ℃冰箱中保存, 直至分析(朱琳等, 2014).现场使用便携式水质分析仪(HYDROLAB, DS5X)测量水温(T)、pH、溶解氧(Dissolved oxygen, DO)等水质理化参数.
2.2 抗生素分析方法2.2.1 水样前处理和QNs测定取两份水样各1 L过0.45 μm玻璃纤维滤膜除去悬浮颗粒物, 加入0.2 g乙二胺四乙酸二钠(Na2EDTA), 使用1 mol·L-1的硫酸溶液调节pH为3.0, 其中一份加入标准混合溶液(浓度均为100 ng·L-1), 进行回收率实验(崔亚丰等, 2015).InertSep HLB固相萃取柱(500 mg, 6 mL)依次用6 mL甲醇和超纯水活化后, 进行水样固相萃取.固相萃取结束后, 采用超高效液相色谱-三重四极杆质谱(HPLC-MS)测定样品中的QNs.实验所选用的目标抗生素为喹诺酮类抗生素, 标准品均购自Sigma-Aldrich(Steinheim, Germany), 试剂均属于分析纯(纯度>95%).
2.2.2 质量控制采用外标法定量QNs.以甲醇-水(V∶V=1∶1)逐级稀释储备液(1 μg·mL-1)制备0.1、0.5、1.0、5.0、10.0、100.0 ng·mL-1 6个系列标准溶液, 经HPLC-MS分析获得质量浓度与峰面积的标准曲线, 可决系数(R2)均大于或等于0.99.各样品中喹诺酮类抗生素的回收率为72.9%~105.2%.可决系数、检出限(LOQ)及不同抗生素的回收率详见表 1.
表 1(Table 1)
| 表 1 不同QNs的回收率和检出限 Table 1 Recovery and limit of quantification (LOQ) of QNs | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 不同QNs的回收率和检出限 Table 1 Recovery and limit of quantification (LOQ) of QNs
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.3 风险评估2.3.1 生态风险评估采用风险熵值法(RQs)来评估残留在环境中抗生素的生态风险, 计算公式见式(1)~(2).
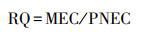 | (1) |
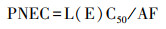 | (2) |
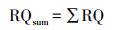 | (3) |
2.3.2 人体健康风险评估基于人体对抗生素的日可接受量ADI, 结合风险熵值的计算模型, 计算石家庄市地下水中QNs对人体健康的风险熵值(RQH), 来评估石家庄市地下水中QNs对人体的健康风险, 计算公式见式(4)~(5).
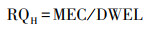 | (4) |
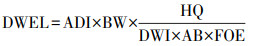 | (5) |
表 2(Table 2)
| 表 2 成人和儿童平均体重及每日饮水量 Table 2 Average body weight and daily water intake for adultsand children | ||||||||||||||||||
表 2 成人和儿童平均体重及每日饮水量 Table 2 Average body weight and daily water intake for adultsand children
| ||||||||||||||||||
按照RQH的不同取值, 划分3个风险水平:RQH>1时, 表明抗生素对人体健康造成的风险处于高风险;当0.1<RQH<1时, 表明抗生素对人体健康造成的风险处于中等风险;当RQH<0.1时, 表明抗生素对人体健康造成的风险处于低等风险.
2.4 数据分析方法水体理化参数及抗生素浓度采用Origin 2018软件制图.利用IBM SPSS Statistical 25软件对各QNs之间的相关性进行分析.通过CANOCO 5版软件进行主成分分析来确定石家庄市地下水及地表水中QNs抗生素与环境因子的相关性.
3 结果与分析(Result and analysis)3.1 石家庄市地表水和地下水主要理化参数空间分布特征石家庄市地表水和地下水中主要理化参数空间分布特征如图 2所示.其中, 地表水的pH为7.74(X1)~9.46(K2);溶解性固体总量(TDS)最大值出现在W1(3.40 g·L-1), 最小值出现在L3(0.20 g·L-1);温度(T)和溶解氧(DO)的均值分别为5.72 ℃和12.68 mg·L-1.地下水水体的温度和溶解氧均值分别为17.75 ℃和6.89 mg·L-1;地下水中pH最大值出现在S8(8.49), 最小值出现在S10(7.44), TDS值为0.30(S13)~1.10 g·L-1(S6).
图 2(Fig. 2)
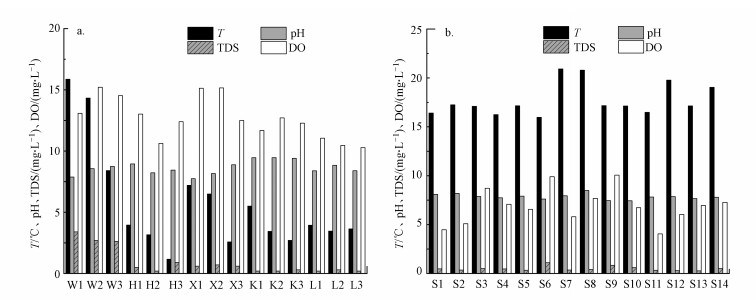 |
| 图 2 石家庄市地表水(a)和地下水(b)的理化参数特征 Fig. 2Characteristics of physical-chemical parameters of surface water (a) and groundwater (b) in Shijiazhuang |
图 3(Fig. 3)
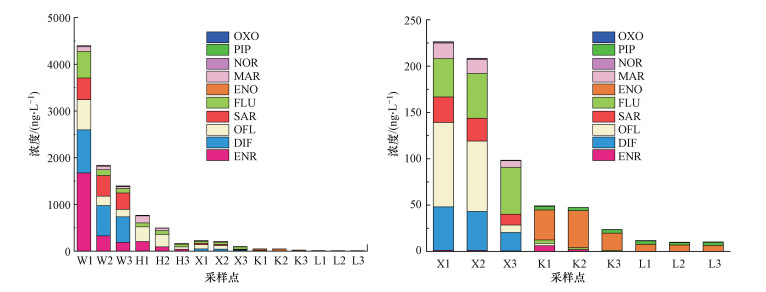 |
| 图 3 石家庄市地表水中QNs在各采样点的浓度分布 Fig. 3The spatial distribution of QNs concentrationin for surface water in Shijiazhuang |
3.2 石家庄市地表水水体中QNs抗生素污染状况及分布特征在石家庄市15个地表水样品中, 共检出8种QNs抗生素(表 3).在9个河流样品中, 除DIF和SAR外, 其余6种抗生素的检出率均为100%, QNs浓度为98.43~4398.00 ng·L-1.就不同QNs浓度而言, 检出浓度呈ENR>DIF>OFL>SAR>FLU>MAR>NOR>OXO的趋势.其中, ENR的检出浓度最高, 达到1675.00 ng·L-1;就QNs所占比例而言, ENR占QNs的26.35%;其次为DIF, 最大浓度达到922.0 ng·L-1, 占QNs总浓度的23.22%.
表 3(Table 3)
| 表 3 石家庄地表水中QNs浓度和检出率 Table 3 The concentrations and detected frequency of QNs for surface water in Shijiazhuang | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 石家庄地表水中QNs浓度和检出率 Table 3 The concentrations and detected frequency of QNs for surface water in Shijiazhuang
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
在6个水库样品中, 共检出6种QNs抗生素.其中, PIP和ENO的检出率均为100%, 其余抗生素的检出率为16.67%~83.33%;水库中QNs浓度为9.99~49.24 ng·L-1.就不同QNs浓度而言, 平均浓度呈ENO>PIP>ENR>FLU>OFL>OXO的趋势.其中, ENO的检出浓度最高, 达到39.95 ng·L-1;就QNs丰度而言, ENO占QNs的69.27%.
就3条典型河流中QNs总浓度而言, 呈现汪洋沟(7633.39 ng·L-1)>滹沱河(1430.33 ng·L-1)>洨河(533.14 ng·L-1)的趋势, 其中, 最大值出现在W1, 浓度为4397.90 ng·L-1, 而最小值出现在X3, 浓度为98.43 ng·L-1.就两个水库中QNs浓度而言, 整体浓度较低, 为9.99~49.23 ng·L-1.其中, 口头水库中QNs总浓度为120.39 ng·L-1, 横山岭水库中QNs总浓度为32.01 ng·L-1.
就3条河流已检出QNs种类而言, 在汪洋沟和洨河均检出了8种QNs, 而在滹沱河只检出了6种QNs.就其空间分布特征而言, QNs抗生素浓度最高的样点集中在汪洋沟(W1、W2和W3), 这3个采样点分别位于汪洋沟的上、中和下游.其中, W1处QNs抗生素浓度最高(4398 ng·L-1).W1所在区域有集中式污水处理厂两座, 分别为石家庄高新技术产业开发区污水处理厂和经济技术开发区污水处理厂, 两个污水处理厂除接纳区域内的生活污水外, 还接纳大量以制药为主的工业废水, 其接纳的废水中工业废水占66%~80%.其中, 高新区华北制药股份公司天翔分公司等21家企业排放的废水和高新区生活污水进入高新区污水处理厂处理后排入汪洋沟, 经济技术开发区的华北制药集团倍达有限公司等46家企业排放的废水和开发区的生活污水进入经济技术开发区污水处理厂处理后排入汪洋沟(刘潇, 2016), 可能导致W1处抗生素浓度偏高;而W2、W3附近村庄较多, 有研究表明该区域QNs抗生素经常被用于畜牧业(Jiang et al., 2014), 此区域抗生素的主要来源可能是养殖废水和居民生活污水.
就2个水库已检出QNs种类而言, 在口头水库已检出6种QNs抗生素, 而在横山岭水库仅检出3种QNs抗生素.就QNs浓度而言, 口头水库QNs浓度高于横山岭水库, 由于口头水库周围村庄较多, QNs抗生素可能会随生活污水排入口头水库中, 造成其QNs浓度更高.
3.3 石家庄市地下水水体中QNs抗生素污染状况及分布特征就石家庄市地下水环境中QNs的检出率和浓度而言, 已检出12种QNs(表 4).其中, OXO和FLU检出率最高(高达100%), 而FLE、OFL、ENO、NOR、CIP、ENR和DIF的检出率均大于50%.在石家庄地下水环境中, QNs浓度为3.45~15.41 ng·L-1;就各种QNs抗生素平均浓度而言, 呈现FLU>NOR>ENR>OXO>FLE>OFL>ENO>DIF>CIP>PIP>SAR>MAR的趋势;其中, FIU的浓度为1.23~2.21 ng·L-1, 占QNs总浓度的17.80%, ENR的检出浓度最高, 为ND~3.44 ng·L-1, 占QNs总浓度的13.36%.
表 4(Table 4)
| 表 4 石家庄市地下水中QNs的浓度与检出率 Table 4 The concentrations and detected frequency for QNs in groundwater of Shijiazhuang | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 石家庄市地下水中QNs的浓度与检出率 Table 4 The concentrations and detected frequency for QNs in groundwater of Shijiazhuang
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
就14个地下水样点的空间分布而言, S1、S2和S11位于石家庄东部, S3、S4和S5位于石家庄北部, S6、S7、S8和S9位于石家庄中部, S10、S12、S13和S14位于石家庄南部.由于石家庄西部地区均为山地, 所以未对石家庄西部地区设置地下水采样点.就石家庄4个区域QNs抗生素浓度的空间分布特征而言, 总体呈现中部(42.67 ng·L-1)>南部(41.51 ng·L-1)>东部(21.16 ng·L-1)>北部(13.07 ng·L-1)的分布特征.这可能与中部地区医院和制药企业较多及人口密集有关, 中部区域地下水可能受到医药废水和生活污水的复合影响, 故中部区域地下水的QNs抗生素浓度最高;而北部地区则由于医院和养殖业较少, 因此, 北部区域地下水中QNs浓度处于较低水平.
就石家庄市地下水环境中QNs的空间分布特征而言, QNs最大值出现在S7, 浓度为15.41 ng·L-1;而最小值出现在S3, 浓度为3.45 ng·L-1(图 4).就各样点的检出频率而言, 最大值出现在S7和S8, 在这两个样点都检出了12种抗生素.其中, S7处QNs浓度较高可能由于该点与滹沱河距离较近, 且该区养殖业密集;而S8位于石家庄市高新区, 该区作为石家庄市制药企业密集区, 可能导致S8处QNs的检出浓度和频率均较高.
图 4(Fig. 4)
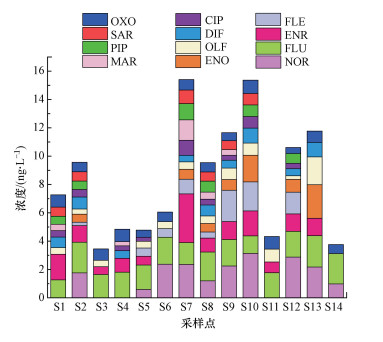 |
| 图 4 石家庄市地下水中各采样点QNs浓度空间分布 Fig. 4The spatial distribution of QNs concentration in groundwater of Shijiazhuang |
就地下水QNs的组成而言, FLU的检出率最高, 其浓度为25.12 ng·L-1;其次为ENR(3.44 ng·L-1, S7)和NOR(3.14 ng·L-1, S10), 因此, 石家庄市地下水中主要的QNs抗生素为FLU、ENR和NOR.
3.4 石家庄市地表水和地下水相关性分析Pearson相关性分析结果表明, 在地表水中, OFL、NOR、ENR、DIF、SAR、OXO和FLU与温度(T)呈显著相关(p < 0.01);PIP和ENO与pH显著相关(p < 0.05, p < 0.01);OFL、NOR、ENR、DIF、SAR、OXO和FLU与TDS显著相关(p < 0.01).而在地下水中, 只有PIP和MAR与温度(T)显著相关(p < 0.05)(图 5).由此可知, 与地下水相比, 地表水环境中QNs受水体理化因子的影响更大.
图 5(Fig. 5)
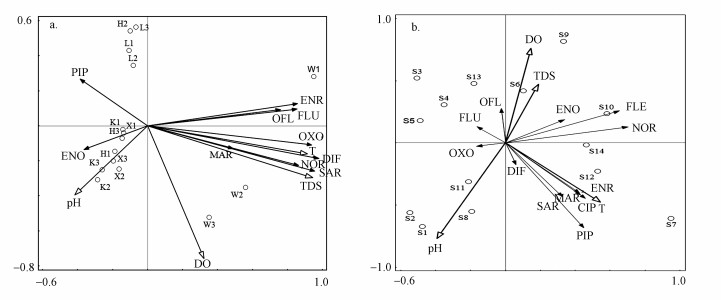 |
| 图 5 石家庄市地表水(a)和地下水(b)中QNs与水体理化参数的相关性分析 Fig. 5The correlation analysis between physical-chemical parameters and QNs concentration in surface water (a) and groundwater (b) in Shijiazhuang |
就地表水中QNs抗生素而言, FLU、ENR和OFL之间呈显著相关(p < 0.01), 说明这3种QNs抗生素具有较高的同源性, 且检出地主要集中在W1点, 该区域制药企业较多, 表明这3种QNs抗生素的主要来源可能是制药废水;而SAR、DIF和NOR之间呈显著相关(p < 0.01), 这3种抗生素主要集中在W2和W3点, 这两点附近村庄较多, 抗生素来源可能是生活污水和养殖废水;其余QNs抗生素相距较远, 其来源差异性较大.
就地下水中QNs抗生素而言, FLE和NOR呈显著相关(p < 0.01), 表明这2种抗生素的来源相同, 主要检出地为S6、S9和S10, 这些区域距离城区较近, 人口密集, 抗生素的主要来源可能是生活污水;而ENR、MAR和CIP之间呈显著相关(p < 0.01), 这3种抗生素主要在S7和S12处检出, 这两个区域附近村庄较多, 抗生素的主要来源可能受生活污水和养殖废水的共同影响;其余抗生素无显著相关性.
3.5 石家庄市地表水和地下水中QNs抗生素浓度及组成特征分析为了进一步辨析地表水是否为地下水中QNs抗生素的主要来源, 本研究对汪洋沟(W1和W2)和滹沱河(H1和H2)采样点及其附近地下水样点中(S8和S11;S5和S7)QNs浓度进行分析.结果表明, 地表水中QNs浓度远高于地下水中QNs浓度, 且地下水中QNs浓度的变化趋势与地表水一致(图 6), 故推测石家庄市地表水中QNs浓度与其附近地下水中QNs浓度存在一定相关性.
图 6(Fig. 6)
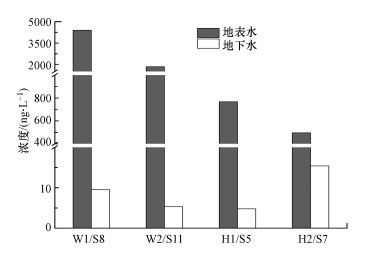 |
| 图 6 地表水与其附近地下水中QNs浓度对比 Fig. 6Comparison of QNs concentrations in surface water and nearby groundwater |
就地表水和地下水中QNs组成而言(图 7), 在汪洋沟中QNs组分主要为ENR和DIF, 而在其附近的地下水中QNs组分主要为FLU;在滹沱河中QNs主要组分为OFL和ENR, 但其周围地下水中QNs以ENR、NOR和FLU为主, 且地下水中QNs的检出种类要比地表水中多.鉴于此, 石家庄市地下水中QNs的种类与地表水中QNs的种类相关性不大.
图 7(Fig. 7)
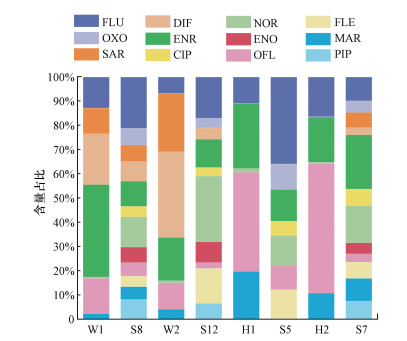 |
| 图 7 地表水与其附近地下水中QNs含量占比 Fig. 7QNs percentage content of surface water and nearby groundwater |
3.6 石家庄市地表水和地下水风险评估3.6.1 生态风险评估单一抗生素并不能体现自然环境中多种抗生素复合污染对生态环境的潜在危害, 因此, 本研究选用联合风险熵值法评估不同样点生态风险.由于不同抗生素对不同物种的敏感性不同, 因此, 通过文献查阅得到了8种QNs抗生素最敏感物种的PNEC值来进行评估(表 5)(Backhaus et al., 2000;Eguchi et al., 2004;Isidori et al., 2005;彭聪等, 2019;申立娜等, 2019).地下水中不同QNs抗生素的生态风险熵值表明(表 6), S7处地下水中ENR的风险值(0.1588)处于中风险水平, 其余各种QNs抗生素的风险值均处于低风险水平.
表 5(Table 5)
| 表 5 不同抗生素对应最敏感生物毒理数据 Table 5 Most sensitive biotoxicological data for different antibiotics | |||||||||||||||||||||||||||||||||||||||||||||
表 5 不同抗生素对应最敏感生物毒理数据 Table 5 Most sensitive biotoxicological data for different antibiotics
| |||||||||||||||||||||||||||||||||||||||||||||
表 6(Table 6)
| 表 6 石家庄市地下水中各种QNs的RQ值 Table 6 The RQ values of different QNs in groundwater of Shijiazhuang | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 6 石家庄市地下水中各种QNs的RQ值 Table 6 The RQ values of different QNs in groundwater of Shijiazhuang
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
就地下水QNs生态风险的空间分布而言, 在S3、S4、S5、S6、S11、S13和S14点的RQsum < 0.1, 说明这些样点地下水中QNs抗生素处于低风险水平;其余样点的RQsum处于0.1~1.0, 说明这些样点地下水中QNs抗生素处于中风险水平, 其中, 最大值出现在S7(0.2758).总体而言, 石家庄市地下水中QNs抗生素的生态风险处于中低风险水平.
运用联合风险熵值法评估石家庄市地表水中5种典型QNs抗生素的生态风险(图 8b).除滹沱河下游(H3)和洨河下游(X3)及口头水库样点外, 其余各点RQsum均大于1, 这表明地表水中QNs抗生素处于高风险水平, 其中, RQsum最大值出现在汪洋沟, 达到65.70(W1).就不同种类QNs抗生素而言(表 7), ENR的生态风险最高, 其RQ值为0.01~34.18, 其次为SAR, 其余抗生素的RQ值均小于1, 生态风险处于中低风险水平.总体而言, 石家庄市地表水中QNs的生态风险处于高风险水平.
图 8(Fig. 8)
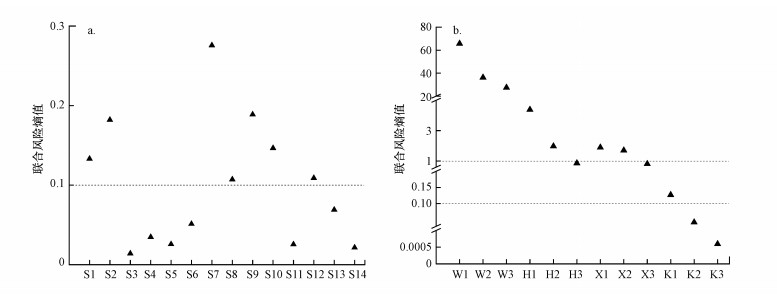 |
| 图 8 石家庄市地下水(a)及地表水(b)各采样点QNs的联合生态风险熵 Fig. 8RQsum of QNs in groundwater(a) and surface water(b) sampling sites in Shijiazhuang |
表 7(Table 7)
| 表 7 石家庄市地表水中不同抗生素的RQ值 Table 7 The RQ values of different QNs in surface water of Shijiazhuang | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 7 石家庄市地表水中不同抗生素的RQ值 Table 7 The RQ values of different QNs in surface water of Shijiazhuang
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.6.2 健康风险评估由于石家庄市水环境中ENR、OFL和SAR的浓度较高, 因此, 选取这3种抗生素进行健康风险评估, 同时选取了CIP和NOR作为对照, 通过文献查阅得到5种QNs的ADI值(表 8)(Hanna et al., 2018;Wang et al., 2018).
表 8(Table 8)
| 表 8 不同抗生素的ADI值 Table 8 ADI with different antibiotics | ||||||||||||
表 8 不同抗生素的ADI值 Table 8 ADI with different antibiotics
| ||||||||||||
选取地下水和地表水样点中检出浓度最高的抗生素来计算石家庄市水环境中QNs对不同人群的健康风险(图 9).结果表明(表 9、10), 地下水和地表水的RQH均小于0.1.虽然当前评估的样点中抗生素风险均处于低风险, 但仍应重视抗生素在生产、使用和排放过程中的问题, 从而降低抗生素对人体造成潜在的健康风险.
图 9(Fig. 9)
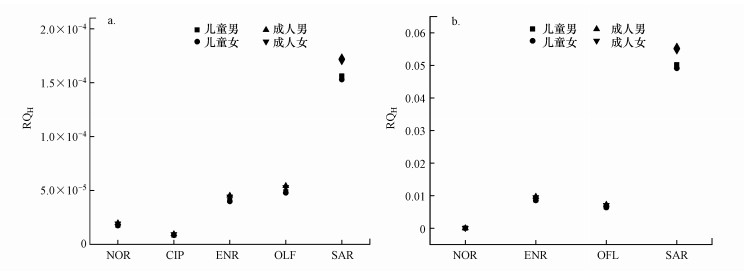 |
| 图 9 地下水(a)和地表水(b)中不同QNs对人体健康的风险评估 Fig. 9Risk assessment of different QNs to human health in groundwater (a) and surface water(b) |
表 9(Table 9)
| 表 9 石家庄市地下水中QNs对不同人群的RQH值 Table 9 The RQH value of QNS in groundwater of Shijiazhuang for different population | ||||||||||||||||||||||||||||||||||
表 9 石家庄市地下水中QNs对不同人群的RQH值 Table 9 The RQH value of QNS in groundwater of Shijiazhuang for different population
| ||||||||||||||||||||||||||||||||||
表 10(Table 10)
| 表 10 石家庄市地表水中QNs对不同人群的RQH值 Table 10 The RQH value of QNS in surface water of Shijiazhuang for different population | |||||||||||||||||||||||||||||
表 10 石家庄市地表水中QNs对不同人群的RQH值 Table 10 The RQH value of QNS in surface water of Shijiazhuang for different population
| |||||||||||||||||||||||||||||
4 讨论(Discussion)就QNs浓度而言, 石家庄市地表水中QNs的赋存情况与国内外河流、湖泊相比处于较高水平, 而地下水中QNs浓度与其它地区相比处于较低水平(表 11).就各种QNs抗生素而言, OFL、NOR和ENR在国内外不同河流、湖泊中均已检出.其中, 石家庄市地表水中OFL浓度与白洋淀(最大浓度428.13 ng·L-1)(申立娜等, 2019)大致相近, 最大浓度为645.66 ng·L-1, OFL浓度略高于巢湖和江汉平原中地表水;而NOR浓度在石家庄市地表水中处于较低水平, 与巢湖(最大浓度34.80 ng·L-1)(唐俊等, 2013)、东江(最大浓度17.31 ng·L-1)(谢全模等, 2020)、白洋淀(最大浓度28.88 ng·L-1)及长江三角洲(最大浓度48.39 ng·L-1)(Cui et al., 2018)的浓度相近, 但低于江汉平原(最大浓度134.20 ng·L-1)(Tong et al., 2014)、塞纳河(最大浓度163.00 ng·L-1)(Tamtam et al., 2008)及昆士兰河(最大浓度1150 ng·L-1)(Watkinson et al., 2009);石家庄市地表水中ENR的浓度处于较高水平, 最大浓度为1674.97 ng·L-1, 远高于巢湖(最大浓度82.70 ng·L-1)和长江三角洲(最大浓度19.33 ng·L-1)等国内外其它河流湖泊;在石家庄市地表水中FLU的最大检出浓度为569.57 ng·L-1, 略低于白洋淀的污染水平(最大浓度963.31 ng·L-1), 但远高于松花江(最大浓度4.21 ng·L-1)和塞纳河(最大浓度32.00 ng·L-1)等流域.
表 11(Table 11)
| 表 11 国内外地表水和地下水中抗生素浓度对比 Table 11 Comparison of antibiotic concentrations in global surface water and groundwater | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 11 国内外地表水和地下水中抗生素浓度对比 Table 11 Comparison of antibiotic concentrations in global surface water and groundwater
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
石家庄市地下水中QNs检出浓度为ND~3.44 ng·L-1, 与韩国南部地区(ND~1.58 ng·L-1)(Lee et al., 2019)处于同一浓度水平, 但低于北京市(ND~39.40 ng·L-1)(陈卫平等, 2017)和江汉平原(ND~47.10 ng·L-1).其中, OFL、NOR、CIP和ENR在北京和江汉平原等多地区的地下水中均已检出.石家庄市地下水中OFL的浓度(最大浓度1.96 ng·L-1)与韩国南部地区地下水(最大浓度0.70 ng·L-1)处于同一污染水平, 略低于江汉平原(最大浓度7.60 ng·L-1);NOR在石家庄市地下水中最大检出浓度为3.14 ng·L-1, 与北京市地下水(最大浓度0.90 ng·L-1)和韩国南部地区地下水(最大浓度1.27 ng·L-1)的污染程度相当, 但远低于江汉平原(最大浓度47.10 ng·L-1);石家庄市地下水中CIP的浓度(最大浓度1.06 ng·L-1)略低于北京市地下水(最大浓度9.20 ng·L-1)和江汉平原地下水(最大浓度5.40 ng·L-1), 与韩国南部地区地下水(最大浓度0.52 ng·L-1)污染水平相当;ENR在石家庄市地下水中的浓度占QNs总浓度的比例较高(13.36%), 其最大浓度为3.44 ng·L-1, 但远低于北京市(最大浓度39.40 ng·L-1)和江汉平原(最大浓度41.80 ng·L-1)地下水中ENR浓度水平.
总体来说, 石家庄市水环境中QNs污染在地表水中更为严峻, 而石家庄地表水中QNs浓度最高的区域为汪洋沟.汪洋沟作为石家庄市高新技术开发区和经济技术开发区的一条主要排污河, 其河水主要来源是各工业企业废水经过污水处理厂处理后达到纳管标准后的综合废水(徐艳, 2014), 导致汪洋沟抗生素浓度偏高.因此, 未来需要进一步加强制药企业废水中有关抗生素和活性药物成分的排放标准.
5 结论(Conclusions)1) 石家庄市地表水中QNs浓度呈显著的空间分布特征, 最大值出现在汪洋沟中.石家庄市地下水中QNs浓度亦出现显著的空间分布特征, QNs浓度呈现中部>南部>东部>北部的趋势.
2) 就地表水中QNs来源而言, FLU、ENR和OFL可能来源于制药废水, 而SAR、DIF和NOR可能来源于养殖废水和生活污水;就地下水中QNs来源而言, FLE和NOR可能来源于生活污水, 而ENR、MAR和CIP的可能来源于养殖污水.
3) 就地表水与地下水中QNs的相关性而言, 地表水与地下水中QNs相关性不显著.
4) 就石家庄市地表水中QNs生态风险而言, 整体处于高风险水平;而地下水中QNs生态风险整体处于中低风险;就人体健康风险而言, 石家庄市水环境中的健康风险处于较低水平.
参考文献
| Andriole V T. 2005. The Quinolones: Past, present, and future[J]. In Clinical Infectious Diseases, 41: S113-S119. DOI:10.1086/428051 |
| Backhaus T, Scholze M, Grimme L H. 2000. The single substance and mixture toxicity of quinolones to the bioluminescent bacterium Vibrio fischeri[J]. Aquatic Toxicology, 49(1/2): 49-61. |
| Brown S A. 1996. Fluoroquinolones in animal health[J]. Journal of Veterinary Pharmacology and Therapeutics, 19: 1-14. DOI:10.1111/j.1365-2885.1996.tb00001.x |
| 陈卫平, 彭程伟, 杨阳, 等. 2017. 北京市地下水中典型抗生素分布特征与潜在风险[J]. 环境科学, 38(12): 5074-5080. |
| Chen Y, Chen H, Zhang L, et al. 2018. Occurrence, distribution, and risk assessment of antibiotics in a subtropical river- reservoir system[J]. Water, 10(2): 104. DOI:10.3390/w10020104 |
| 陈杖榴, 曾振灵. 2017. 兽医药理学[M]. 北京: 中国农业出版社. |
| Cleuvers M. 2003. Aquatic ecotoxicity of pharmaceuticals including the assessment of combination effects[J]. Toxicology Letters, 142(3): 185-194. DOI:10.1016/S0378-4274(03)00068-7 |
| Cleuvers M. 2004. Mixture toxicity of the anti-inflammatory drugs diclofenac, ibuprofen, naproxen, and acetylsalicylic acid[J]. Ecotoxicology and Environmental Safety, 59(3): 309-315. DOI:10.1016/S0147-6513(03)00141-6 |
| Cui C Z, Han Q, Jiang L, et al. 2018. Occurrence, distribution, and seasonal variation of antibiotics in an artificial water source reservoir in the Yangtze River delta, East China[J]. Environmental Science and Pollution Research, 25(20): 19393-19402. DOI:10.1007/s11356-018-2124-x |
| 崔亚丰, 何江涛, 苏思慧, 等. 2015. 某市典型地段地表水及地下水中氟喹诺酮类抗生素分布特征[J]. 环境科学, 36(11): 4060-4067. |
| Eguchi K, Nagase H, Ozawam M, et al. 2004. Evaluation of antimicrobial agents for veterinary use in the eco- toxicity test using microalgae[J]. Chemosphere, 57(11): 1733-1738. DOI:10.1016/j.chemosphere.2004.07.017 |
| Gray A D, Todd D, Hershey A E. 2020. The seasonal distribution and concentration of antibiotics in rural streams and drinking wells in the piedmont of North Carolina[J]. Science of the Total Environment, 710C: 136286. |
| Halling-S?rensen B, Nielsen S N, Lanzky P F, et al. 1998. Occurrence, fate, and effects of pharmaceutical substances in the environment-A review[J]. Chemosphere, 36(2): 357-393. DOI:10.1016/S0045-6535(97)00354-8 |
| Hanna N, Sun P, Sun Q, et al. 2018. Presence of antibiotic residues in various environmental compartments of Shandong province in eastern China: Its potential for resistance development and ecological and human risk[J]. Environment International, 114(May): 131-142. |
| Hatt A L, Bruce L B, Age D S. 2006. Evaluating the vulnerability of surface waters to antibiotic contamination from varying wastewater treatment plant discharges[J]. Environmental Pollution, 142(2): 295-302. DOI:10.1016/j.envpol.2005.10.010 |
| 环境保护部. 2014. 中国人群暴露参数手册(成人卷)[M]. 北京: 中国环境科学出版社. |
| Isidori M, Lavorgna M, Nardelli A, et al. 2005. Toxic and genotoxic evaluation of six antibiotics on non- target organisms[J]. Science of the Total Environment, 346(1/3): 87-98. |
| Jiang Y, Li M, Guo C, et al. 2014. Distribution and ecological risk of antibiotics in a typical effluent-receiving river (Wangyang River) in north China[J]. Chemosphere, 112(Oct.): 267-274. |
| Lee H J, Kim K Y, Hamm S Y, et al. 2019. Occurrence and distribution of pharmaceutical and personal care products, artificial sweeteners, and pesticides in groundwater from an agricultural area in Korea[J]. Science of the Total Environment, 659(Apr.1): 168-176. |
| 李辉, 陈瑀, 封梦娟, 等. 2020. 南京市饮用水源地抗生素污染特征及风险评估[J]. 环境科学学报, 40(4): 1269-1277. |
| 刘高燕. 2015. 抗生素残留对环境影响的调查研究[J]. 化工中间体, 11(1): 13-15. |
| 刘潇. 2014. 汪洋沟入河抗生素废水污染源削减技术集成研究[D]. 石家庄: 河北科技大学 |
| Mcmanus P S, Stockwell V O, Sundin G W, et al. 2002. Antibiotic use in plant agriculture[J]. Annual Review of Phytopathology, 40(1): 443-465. DOI:10.1146/annurev.phyto.40.120301.093927 |
| 彭聪, 巴俊杰, 胡芬, 等. 2019. 广西会仙岩溶湿地典型抗生素污染特征及生态风险评估[J]. 环境科学学报, 39(7): 2207-2217. |
| 申立娜, 张璐璐, 秦珊, 等. 2019. 白洋淀喹诺酮类抗生素污染特征及其与环境因子相关性研究[J]. 环境科学学报, 39(11): 3888-3897. |
| Snyder S A, Leising J, Westerhoff P, et al. 2004. Biological and physical attenuation of endocrine disruptors and pharmaceuticals: implications for water reuse[J]. Groundwater Monitoring & Remediation, 24(2): 108-118. |
| Su H, Liu Y, Pan C, et al. 2018. Persistence of antibiotic resistance genes and bacterial community changes in drinking water treatment system: From drinking water source to tap water[J]. Science of the Total Environment, 616-617: 453-461. DOI:10.1016/j.scitotenv.2017.10.318 |
| Tamtam F, Mercier F, Le Bot B, et al. 2008. Occurrence and fate of antibiotics in the Seine River in various hydrological conditions[J]. Science of the Total Environment, 393(1): 84-95. DOI:10.1016/j.scitotenv.2007.12.009 |
| 唐俊, 陈海燕, 史陶中, 等. 2013. 巢湖喹诺酮及四环素类药物污染现状及来源分析[J]. 安徽农业大学学报, 40(6): 1043-1048. |
| Tong L, Huang S B, Wang Y X, et al. 2014. Occurrence of antibiotics in the aquatic environment of Jianghan Plain, central China[J]. Science of the Total Environment, 497-498: 180-187. DOI:10.1016/j.scitotenv.2014.07.068 |
| 王冰, 孙成, 胡冠九. 2007. 环境中抗生素残留潜在风险及其研究进展[J]. 环境科学与技术, (3): 108-111+121. DOI:10.3969/j.issn.1003-6504.2007.03.040 |
| Wang H X, Yang J Q, Yu X, et al. 2018. Exposure of adults to antibiotics in a Shanghai suburban area and health risk assessment: a biomonitoring- based study[J]. Environmental Science & Technology, 52(23): 13942-13950. |
| Wang W H, Wang H, Zhang W F, et al. 2017. Occurrence, distribution, and risk assessment of antibiotics in the Songhua River in China[J]. Environmental Science and Pollution Research, 24(23): 19282-19292. DOI:10.1007/s11356-017-9471-x |
| Watkinson A J, Murby E J, Kolpin D W, et al. 2009. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water[J]. Science of the Total Environment, 407(8): 2711-2723. DOI:10.1016/j.scitotenv.2008.11.059 |
| 谢全模, 陈云, 万金泉, 等. 2020. 东莞市饮用水源地中抗生素分布特征及风险评价[J]. 环境科学学报, 40(1): 166-178. |
| 徐艳. 2014. 石家庄汪洋沟地区抗生素、抗性细菌和抗性基因污染特征研究[D]. 泰安: 山东农业大学 |
| 徐艳, 张远, 郭昌胜, 等. 2014. 石家庄汪洋沟地区抗生素、抗性细菌和抗性基因污染特征[J]. 农业环境科学学报, 33(6): 1174-1182. |
| Zhang Q Q, Ying G G, Pan C G, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 49(11): 6772-6782. |
| 周长铭. 2018. 探究我国生物制药技术的现状及趋势[J]. 中外企业家, 593(3): 108. |
| 朱琳, 张远, 渠晓东, 等. 2014. 北京清河水体及水生生物体内抗生素污染特征[J]. 环境科学研究, 27(2): 139-146. |
